INTRODUCCION
El pronóstico de las enfermedades hematológicas malignas ha experimentado un importante avance en las últimas décadas, debido sobre todo a los mejores resultados obtenidos con las nuevas combinaciones de quimioterapia y tras el trasplante de médula ósea (TMO), así como a la más eficaz terapia antimicrobiana. Estos hechos han propiciado que muchos de estos pacientes en algún momento de su enfermedad sean tratados en unidades de cuidados intensivos (UCI), lo que hace 20 años era prácticamente implanteable; pero a pesar de todos estos avances, sigue existiendo controversia sobre cuál es el beneficio real que el tratamiento en UCI reporta a estos pacientes tanto a corto como a medio o largo plazo.
Si bien existen algunos factores sobre los que hay cierta unanimidad en cuanto a su mal pronóstico (como la insuficiencia respiratoria aguda con necesidad de ventilación mecánica), no existe un consenso sobre los factores pronósticos en los cuales basarse para dar cabida o no a estos pacientes en nuestras unidades.
El objetivo de este trabajo es conocer los datos epidemiológicos de los enfermos de estas características que ingresan en una UCI, así como determinar los posibles factores pronósticos y la mortalidad a corto y medio plazo.
MATERIAL Y MÉTODOS
Hemos realizado en nuestro servicio de medicina intensiva, unidad polivalente con un total de 42 camas perteneciente a un hospital de tercer nivel (Complejo Hospitalario Carlos Haya de Málaga), un estudio de cohortes prospectivo en el que hemos incluido todos los pacientes con enfermedades hematológicas malignas ingresados en un período comprendido entre noviembre de 1994 y diciembre de 1997, realizándose posteriormente un seguimiento de los mismos hasta marzo de 2000 para determinar su estado vital.
Las variables analizadas fueron edad, sexo, motivo de ingreso, diagnóstico de base, presencia de neutropenia, presencia de enfermedad de injerto contra huésped (EICH), índice APACHE II al ingreso, número de órganos disfuncionantes, necesidad de ventilación mecánica (VM), motivo de la VM, días de VM, necesidad de transfusion, uso de inotrópicos y fármacos vasoactivos, orden de no reanimación cardiopulmonar (no RCP), reingreso (si el paciente era ingresado más de una vez en la unidad, cualquiera que fuese el motivo), estancia en UCI, mortalidad intra-UCI, causa de mortalidad intra-UCI, mortalidad intrahospitalaria y mortalidad al año y a los 2 años del alta de la UCI, así como la supervivencia actual.
Entre los datos clínicos se han considerado: shock, si en ausencia de fármacos vasoactivos la presión arterial (PA) sistólica era menor de 80 mmHg acompañada de oliguria y signos de hipoperfusión que no mejoraron con la administración de volumen, fallo multiorgánico (FMO), considerando la definición de fracaso multiorgánico de Knaus19, e insuficiencia respiratoria aguda (IRA) cuando existía una relación PaO2/FiO2 inferior a 200; se indicó la VM si existía una hipoxia refractaria a la administración de oxígeno en mascarilla, un aumento de PaCO2 superior a 45 mmHg y/o un agotamiento evidente del paciente.
Análisis estadístico
Las variables cuantitativas se expresan en forma de media (desviación estándar) o de mediana (percentil 25-75) si su distribución no es simétrica y las cualitativas se expresan como número de casos (proporción).
Análisis de la mortalidad intra-UCI
El análisis univariante de los datos se ha realizado mediante el test de la t de Student para variables continuas con distribución normal, el test de la U de Mann-Whitney para el resto de las variables cuantitativas y el test de la *2 para las variables cualitativas (o test Exacto de Fisher en los casos indicados) para un nivel de error alfa en todos los tests de 0,05. Posteriormente, hemos realizado un modelo de regresión logística por el método de paso atrás introduciendo en el mismo todas las variables que presentaron una relación significativa para un error alfa de 0,15.
Análisis de supervivencia global desde el momento del primer ingreso
Se realizó un análisis univariante mediante el test de Kaplan-Meyer para construir la curva de supervivencia y test de rangos logarítmicos para valorar el efecto sobre la supervivencia de cada variable. Posteriormente, realizamos un análisis de regresión de Cox mediante el método de paso atrás, incluyendo en el mismo aquellas variables que presentaron una relación en el análisis univariante para una significación mayor de 0,15.
RESULTADOS
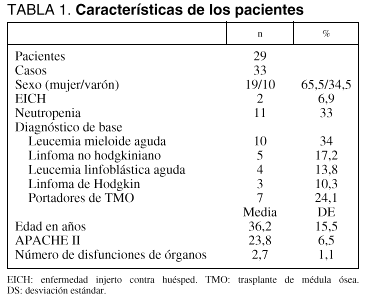
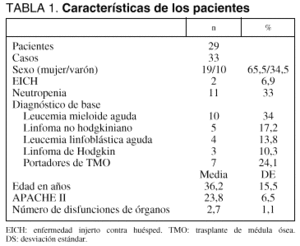
Hemos analizado a 29 pacientes ingresados consecutivamente, admitidos con los siguientes diagnósticos (tabla 1): leucemia mieloide aguda (LMA) 10 pacientes (34%), linfoma no hodgkiniano (LNH) 5 pacientes (17,2%), leucemia linfoblástica aguda (LLA) 4 pacientes (13,8%), linfoma hodgkiniano (LH) 3 pacientes (10,3%), y 7 pacientes (24,1%) eran portadores de un TMO. La enfermedad que motivó dicho trasplante en este grupo de pacientes fue: LLA en 3 casos (42,8%), LNH en 2 (28,5%), LH en uno (14,2%) y LMA en uno (14,2%). La edad media de los pacientes fue 36,2 (15,5) años y 19 (65%) eran mujeres. Dos pacientes (6,9%) habían desarrollado EICH y 11 (33,3%) estaban neutropénicos en el momento de su ingreso en la unidad.
Registramos un total de 33 ingresos (casos) en los 29 pacientes (2 de ellos reingresaron en una ocasión y otro tuvo dos reingresos), siendo éstos los principales motivos de ingreso en la unidad: insuficiencia respiratoria aguda (IRA) en 19 casos (57,6%), shock en 5 (15,2%) y sepsis sin shock inicial en otros 5 (15,2%) (todos los motivos de ingreso se detallan en la tabla 2). Dado que el volumen de ingresos totales en nuestra unidad en este período de 3 años fue de 6.051, la incidencia de ingresos del grupo de pacientes estudiados fue del 0,5%. El APACHE II al ingreso en la UCI fue de 23,8 (6,5) y el número de disfunciones de órganos de 2,7 (1,1). La mediana de estancia en la UCI fue de 10 días (percentiles 25-75: 3,5-21,5 días).
Un total de 19 pacientes (65,5%) fueron ventilados mecánicamente en 21 ingresos (63,3%), durante una mediana de 8 días (1-16,5 días), siendo indicada la ventilación mecánica por IRA en 18 casos (85,7%), postoperatorio en 2 (9,5%) y coma en uno (4,7%). Se prescribieron 23 (45,5) unidades de plasma, 4,7 (10,9) unidades de plaquetas y 5,9 (8) unidades de hematíes por paciente ingresado; en cuanto al consumo de fármacos inotrópicos y vasoactivos, se administró noradrenalina al 18,2%, dopamina al 30,2%, y dobutamina al 33,3% de los ingresos.
En 2 pacientes se realizaron técnicas terapéuticas especiales, en un caso (mujer de 19 años) leucoféresis y en el otro hemofiltración venovenosa continua (mujer de 16 años).
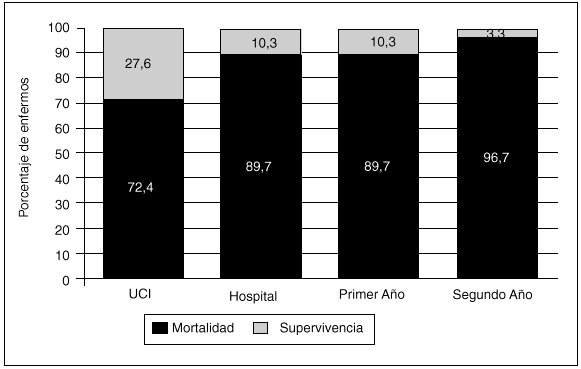
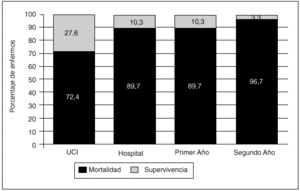
La mortalidad hospitalaria fue de 26 pacientes (89,7%), de los cuales 21 (72,4%) fallecieron en un primer ingreso en la UCI, tres fueron readmitidos posteriormente y fallecieron (uno de ellos en la UCI y los otros dos tras el alta a planta) y dos pacientes fallecieron en el hospital sin llegar a ser readmitidos. Se dio orden de no RCP en 10 casos (30,3%) con una estancia media de 8,9 días cuando dicha orden fue dada. La principal causa de mortalidad intra-UCI fue el fallo multiorgánico (FMO) (en la tabla 3 se describen con detalle las causas de fallecimiento intra-UCI). Los 3 pacientes restantes (10,3%), con una edad media de 25 años, sobrevivían en sus domicilios tras un año de alta de la unidad. Al segundo año tras el alta, sólo un paciente de 45 años (3,3%) sobrevivía (los datos referentes a la mortalidad global se reflejan en la figura 1).
Fig. 1. Mortalidad global de los pacientes hematológicos ingresados en la UCI expresada en forma de porcentaje.
Mortalidad intra-UCI
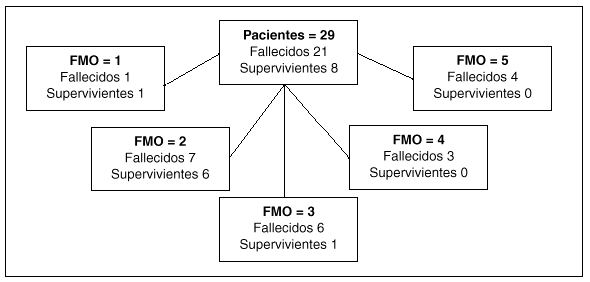
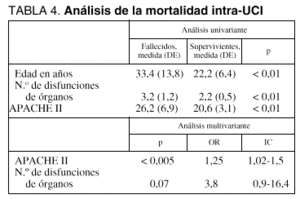
El análisis de la mortalidad intra-UCI demostró una relación significativa en el análisis univariante para las variables de edad, número de órganos con disfunción y APACHE II. Sin embargo, al introducir estas variables en el análisis de regresión logística, sólo el APACHE II y el número de disfunciones de órganos mantenían esta relación (tabla 4). La relación entre disfunciones de órganos y mortalidad intra-UCI se refleja en la figura 2.
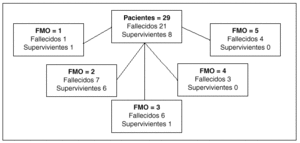
Fig. 2. Mortalidad intra-UCI de los pacientes hematológicos según el número de disfunciones or gánicas19 (FMO).
Supervivencia global de los pacientes
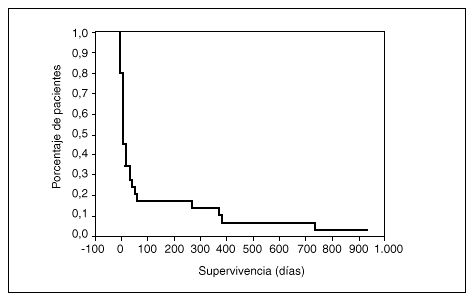
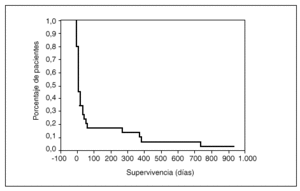
A los 10 días tras el ingreso en la UCI la supervivencia era del 50%, a los 39 días del 25% y a los 61 días del 17%; tras 2 años de seguimiento, la supervivencia era del 3,3% (fig. 3). Ninguna de las variables analizadas ha demostrado relación con la supervivencia a largo plazo de los pacientes y, asimismo, el análisis multivariante no ha detectado variables influyentes para este resultado.
Fig. 3. Curva de supervivencia de los pacientes hematológicos ingresados en UCI.
DISCUSION
Ante todo debemos remarcar que aunque nuestra casuística es muy limitada, es difícil recoger una muestra de enfermos tan amplia, dadas las restricciones que siguen imperando en la mayoría de nuestras unidades respecto al ingreso de estos pacientes.
De todos es sabido que, a pesar del tratamiento de estos pacientes en la UCI, la morbimortalidad sigue siendo elevada1-4. Por ello, la decisión de ingreso en nuestras unidades es controvertida; hasta el momento, no se han podido elaborar unos criterios válidos y consensuados que permitan su estandarización. Si bien se han hecho ciertas aproximaciones en estudios seleccionados5-7, dichos criterios se han visto superados progresivamente por los nuevos avances diagnóstico-terapéuticos.
En cualquier caso, las causas que motivan el ingreso de estos pacientes en nuestras unidades no han variado a lo largo del tiempo y, al igual que en nuestra casuística, la insuficiencia respiratoria aguda3,8-11 sigue siendo la principal causa.
Encontramos una mortalidad en UCI elevada (72,4%), similar a la encontrada en estudios de las mismas características1-3,12, sin variar las causas de las referidas en otras series2,13,14, y se corresponden con aquellas de los enfermos muy graves, dado que tanto el APACHE II, como el número de órganos disfuncionantes (índices de gravedad generales) fueron los únicos parámetros que se correlacionaron con la mortalidad en UCI, al igual que lo referido en la bibliografía2,7,10,15,16, aunque algunos preconizan que el APACHE II diario y no sólo al ingreso es un índice mucho más fiable que un único valor de APACHE II17. Un APACHE II medio de 23,8, como el que presentaban nuestros pacientes se correspondería, aplicando la fórmula de predicción de fallecimiento para grupos de pacientes críticamente enfermos de Knaus et al18, con una mortalidad esperada del 40%, del mismo modo que un índice de FMO de 2,7 se correspondería con una mortalidad del 62%19, datos a tener en cuenta al interpretar estos resultados. Es decir, que si bien los enfermos con índices de gravedad más altos son los que más mortalidad presentan intra-UCI, la mortalidad esperada según las distintas enfermedades es menor que la obtenida realmente, de lo cual podría deducirse que algún otro factor no recogido por estos índices pronósticos al ingreso, está desempeñando un papel fundamental en la mala evolución.
Por otra parte, 10 de estos pacientes (30%) presentaban un síndrome séptico o shock séptico establecido, siendo conocido que la sepsis constituye ya la primera causa de muerte en la UCI en nuestro medio; se estima una mortalidad global del 42% cuando se desarrolla un shock séptico20. Algunos grupos señalan el shock séptico, en este grupo de pacientes, como factor independiente relacionado con la mortalidad3,13. En nuestra casuística no ha sido así, si bien fue la primera causa de mortalidad probable, ya que quedó englobada en el FMO como causa de defunción.
No hubo ningún tipo de correlación entre la mortalidad y cualquier otro de los parámetros estudiados, incluida la VM, hecho tradicionalmente relacionado con la mortalidad en este tipo de enfermos, como se desprende de numerosos estudios4,13,21. La explicación para ello la podríamos encontrar en que de los 11 casos no ventilados, 5 de ellos no lo fueron porque este procedimiento fue desestimado como opción terapéutica dadas las características clínicas, el grado de desarrollo de la enfermedad y el pronóstico estimado a corto plazo.
Éste sigue siendo uno de los puntos clave en el tratamiento de estos pacientes: ¿qué medidas se deben aplicar?, y en el caso de decidir aplicarlas, ¿hasta cuándo se debe continuar con ellas? Las aproximaciones a esta cuestión son múltiples en la bibliografía pero, tal y como sucede en el intento de unificar los criterios de ingreso, no se llega a un consenso en este aspecto, aunque existe cierto acuerdo en que la VM prolongada podría ser el punto de inflexión en cuanto al tratamiento global, tras la constatación de un aumento significativo de la mortalidad en los pacientes sometidos a VM respecto a aquellos que no precisaron ser ventilados2,11,22. Se han preconizado incluso distintos "tiempos máximos razonables" de VM, según diferentes autores, que oscilan en un rango de 3 y 9 días9,23,24. En este sentido, y hasta el momento actual, la guía propuesta por Rubenfeld para el uso de VM después de TMO14 nos parece acertada en su planteamiento y conclusiones, dado que deja una puerta abierta ante la eventual mejoría clínica rápida de enfermos concretos, en los que la prolongación de las medidas instauradas podría estar justificada. A pesar de lo cual, y según sus datos, la expectativa de supervivencia a los 30 días de postextubación y al alta hospitalaria no se modifican.
Tampoco la necesidad de politransfusión ni el uso de agentes inotrópicos y vasoactivos se relacionaron con la mortalidad, hechos que nos hacen reflexionar sobre la utilidad del tratamiento enérgico en estos pacientes (se emplearon agentes inotrópicos y vasoactivos aproximadamente en el 30% de los casos), pero este punto no lo hemos podido corroborar con la bibliografía consultada, a excepción de dos estudios en los que dicho soporte, como en nuestro caso, no reportó ningún tipo de beneficio11,23.
Cabe destacar, en el contexto de las conclusiones a las que se puede llegar en cuanto a reducir o no iniciar ciertos tipos de soporte, la afirmación de Brunet et al13 de que la asociación de VM y hemodiálisis supone una mortalidad del 100% y no deberían aplicarse ambas en el caso de que un enfermo ventilado requiriera técnicas de depuración extra-
rrenal. Sin embargo, entre nuestros pacientes, una mujer de 16 años con disfunción de tres órganos, ventilada, y que fue sometida a hemofiltración venovenosa continua por un fallo renal durante 5 días, fue una de las supervivientes al año, estando libre de enfermedad y realizando una actividad normal en su domicilio durante este tiempo. Posteriormente, falleció en el seguimiento del segundo año, de forma rápida, por recidiva meníngea de su enfermedad.
La orden de no reanimación en algún momento fue dada en 10 casos (30%), con una media de estancia de 9 días cuando dicha decisión fue adoptada, porcentaje menor que el de Denardo et al23 que llegan a dar dicha orden en el 52% de sus pacientes, pero coincidente en el momento en que dicha orden es dada; si bien es cierto que en nuestra serie dejaron de aplicarse medidas inicialmente en 5 casos más, lo que elevaría la cifra total al 45%. Éste es un dato difícil de comparar con los datos de la bibliografía, a excepción del estudio al que hacemos referencia, ya que es muy poco lo publicado al respecto; pero el porcentaje del 30% nos parece que puede ser ajustado al que se aplica a otras enfermedades, asimismo graves, al noveno día de tratamiento intensivo infructuoso.
La mortalidad intrahospitalaria en nuestros resultados fue del 89,7%, dato concordante con el hallado en la bibliografía para enfermos de las mismas características1,3,25,26. Sería interesante resaltar el hecho de que de los 5 pacientes que fallecieron tras el alta inicial de la unidad, uno de ellos reingresó y falleció en la misma, 2 de ellos obtuvieron el alta a planta tras su segundo ingreso y en la creencia de que su recuperación real no era viable, en consenso con los servicios implicados, mientras que la evolución de los otros 2 pacientes en planta fue hacia el deterioro progresivo y no fue planteado su reingreso por el servicio de hematología. Estos resultados nos hacen reflexionar sobre ciertos aspectos y volvemos al inicio. ¿Se benefician estos pacientes de su ingreso en unidades de cuidados intensivos? ¿Hacemos como reza un acertado titular de un artículo de opinión referido a estos casos, "todo lo que se debería haber hecho y no todo lo que se puede hacer"?27. ¿Somos capaces de discernir cuándo el soporte vital es fútil y cuándo la ética nos dicta la conveniencia de terminar con una situación que no está reportando ya beneficios al enfermo?28. Por otra parte, ¿quién debería decidir y en qué momento la orden de no reanimación?29-31. Éstas y otras preguntas con el mismo trasfondo generaron en tiempos pasados, y lo siguen haciendo ahora, grandes polémicas cada vez que un paciente hematológico ingresa en estas unidades32-34.
Probablemente, si el estudio hubiera estado diseñado, como muchos de los publicados hasta el momento, teniendo como objetivo la mortalidad intra-UCI y los factores pronósticos de la misma, deberíamos decir que sí se benefician, ya que 10 pacientes relativamente jóvenes lograron sobrevivir, siendo dados de alta a planta. En este caso, y si pretendiéramos mejorar la supervivencia intra-UCI, deberíamos plantearnos que quizá los criterios de ingreso deberían no estar tan restringidos, permitiendo la entrada de estos pacientes en nuestras unidades antes de que el deterioro hemodinámico y/o respiratorio esté tan avanzado.
El problema lo plantea el seguimiento posterior. Los estudios de seguimiento habitualmente se llevan a cabo en períodos de tiempo más cortos, generalmente de 6 meses, presentando una mortalidad que oscila entre el 82 y el 100%: 82% retenida por Hayes et al y Brunet et al9,13, 97% por Faber-Langedoen et al y Crawford y Petersen26,35 y 100% por Torrecilla, Todd o Peters3-5.
Es posible que la supervivencia de tres pacientes al año en sus domicilios (10%), coincidente con gran parte de los trabajos consultados13,23,25 y teniendo de nuevo en cuenta la juventud de los mismos, podría decantarnos con reservas a contestar que sí se benefician.
Pero, ¿qué pasa a los 2 años? Sólo hemos encontrado un seguimiento prolongado en enfermos similares (no exclusivamente en receptores de TMO) en otro estudio, que demuestra una progresión de la mortalidad muy similar a la nuestra (80% intra-UCI, 93% intrahospitalaria y 100% a los 2 años)1. Con estos resultados, creemos que los criterios de ingreso para estos pacientes en UCI, no deberían estar regidos únicamente ni por la situación de reversibilidad del problema concreto que motiva el ingreso en la unidad, ni por los índices de gravedad (que lo único que nos van a predecir es qué porcentaje de pacientes va a fallecer en la unidad, y que según nuestros datos se ve superado por la mortalidad real alcanzada en este grupo), sino que habría que ir más allá y valorar de forma apropiada, en ese momento, el estado de la enfermedad de base de cada paciente, que en muchos casos va a provocar el fallecimiento en un plazo corto de tiempo.
Nosotros concluimos, en primer lugar, que son necesarios estudios más amplios que deberían ser multicéntricos, a fin de incluir un grupo de pacientes apropiado y obtener conclusiones valorables. En segundo lugar, los índices pronósticos habituales podrían estar sobreestimando las expectativas de supervivencia intra-UCI. Por último, el beneficio real que aportamos a estos pacientes es mínimo, y la carga en cuanto a medios técnicos y humanos muy elevada, obteniéndose supervivencias que quizás no justifiquen este esfuerzo, aunque quizás esta última observación sea, por sí misma, tema suficiente para justificar un nuevo debate.