Evaluar los usos off-label (fuera de ficha técnica [FT]) y unlicensed (medicamentos no autorizados específicamente para niños) en cuidados intensivos neonatales y pediátricos.
MetodologíaSe realizó un estudio transversal en la UCINP (Unidad de Cuidados Intensivos Neonatales y Pediátricos) de un hospital público de tercer nivel de Granada, incluyéndose a todos los niños en los que se indicara al menos un tratamiento farmacológico, mediante reclutamiento consecutivo, y durante un periodo de 5 meses (N=81). Las variables recogidas fueron sociodemográficas, clínicas, y medicación. Todas las prescripciones fueron clasificadas a partir de la información contenida en FT sobre uso en niños.
ResultadosHubo un total de 601 prescripciones, con una media de 7,4±6 medicamentos por niño. Los fármacos más empleados pertenecían a los grupos J (antiinfecciosos), N (sistema nervioso) y C (cardiovascular). Algo más de la mitad de las prescripciones fueron off-label (52%), fundamentalmente por emplear una dosificación distinta de la recomendada en FT (79%), seguida de diferente indicación (13,5%), edad (5%) y vía de administración (2,5%). El uso de medicamentos no específicamente autorizados en niños solo supuso el 5% de las prescripciones.
ConclusionesEl presente estudio aporta datos sobre este tipo de prescripciones en una UCINP española. Pone de manifiesto que el 89% de los niños tiene al menos una prescripción fuera de FT y un 22,3% al menos un uso de fármaco no autorizado para niños. Cifras elevadas, pero justificables dentro del ámbito de unos cuidados intensivos que, además, incluyen neonatos. Pero aunque muchos de los tratamientos estén protocolizados, sería deseable mejorar la evidencia disponible, así como actualizar las FT.
This study aims to assess the prescription profile and license status of drugs used in a neonatal and pediatric intensive care unit (NPICU).
MethodsA prospective observational study was conducted on a dynamic cohort of children admitted to an NPICU (N=81) in a tertiary hospital (Granada, Spain). All prescriptions were classified as off-label or unlicensed based on the summary of product characteristics (SPC).
ResultsOf a total of 601 prescriptions, the patients received a mean of 7.4±6 drugs each. The most commonly prescribed drugs corresponded to classes J (anti-infectious, systemic use) N (nervous system) and C (cardiovascular). A little over one-half of the prescriptions were off-label (52%), usually due to dosages differing from the SPC recommendations (79%), followed by different indications (13.5%), age (5%) and administration route (2.5%). In this NPICU, unlicensed usage represented only 5% of all prescriptions.
ConclusionsThis study contributes data on prescription of this kind in a Spanish NPICU, revealing at least one off-label prescription in 89% of the children and at least one unlicensed use in 22.3%. These are high figures, but are to be expected given the inclusion of newborn infants and the critical care setting. Even though such usage follows clinical protocols, we underscore the dual need to base treatment on the best available evidence, and to upgrade the SPC accordingly.
Se estima que menos del 50% de los medicamentos empleados en niños se han investigado en población pediátrica, de modo que clásicamente se los ha venido tratando a partir de extrapolaciones de fármacos desarrollados para adultos. Sin embargo, sabemos que la mejor garantía disponible para que los tratamientos sean seguros, eficaces y de calidad es la realización de una adecuada investigación clínica. La escasez de ensayos clínicos en niños se ha debido, por un lado, al escaso interés comercial de la industria farmacéutica en esta población especial, y por otro a la dificultad que entraña en sí misma la investigación pediátrica, cuyas barreras han sido fundamentalmente de índole ética y metodológica1. Así, la mayor parte de agentes terapéuticos no han sido ensayados en niños, por lo que el balance beneficio-riesgo de su uso está a menudo sustentado por un limitado nivel de evidencia. Todo esto ha llevado a que en muchas ocasiones la información de calidad sobre las recomendaciones pediátricas sea escasa o esté ausente.
La ficha técnica, aprobada por la Agencia Española del Medicamento y Productos Sanitarios (AEMPS), es el documento oficial que refleja las condiciones de uso autorizadas para el medicamento y que, a partir de los resultados de los ensayos clínicos realizados, sintetiza la información científica esencial destinada a los profesionales sanitarios. Cuando la información sobre la utilización del fármaco en niños es limitada o está ausente, su prescripción se realiza fuera de los términos de su licencia o autorización, entrando en los internacionalmente denominados usos off-label (OL) y unlicensed (UL). Generalmente se entiende por prescripción UL la que se realiza con medicamentos que no han sido aprobados para población pediátrica, y como prescripción OL el uso de medicinas aprobadas para niños pero empleadas en condiciones diferentes a las autorizadas en su ficha técnica, por ejemplo en términos de distinta indicación, dosis, rango de edad o vía de administración. La proporción de fármacos prescritos fuera de los términos de su autorización se ha estudiado en los últimos años, pero con resultados muy dispares2. La mayor parte de estudios son hospitalarios, destacando los realizados en las unidades de cuidados intensivos (UCI) neonatales. Entre los recién nacidos, el número de pacientes que reciben al menos una prescripción de tipo OL o UL es mucho mayor que el de pacientes de cualquier otra sala pediátrica médica o quirúrgica, con proporciones que llegan a situarse entre el 70 y el 97% de los pacientes3.
El uso de estas prescripciones OL o UL no tiene por qué significar que sean incorrectas, solo significa que la evidencia y evaluaciones requeridas por las autoridades sanitarias (AEMPS y la Agencia Europea del Medicamento [EMA]) no están disponibles o no son suficientes y, por lo tanto, no pueden venir reflejadas en la ficha técnica. Sin embargo, se ha demostrado que su empleo puede estar asociado con determinados problemas de seguridad4. De hecho, hay diversos estudios que ya han demostrado que estas prescripciones son un factor de riesgo para desarrollar reacciones adversas a medicamentos (RAM), errores de medicación y la posibilidad de fallo terapéutico5. Se estima que suelen estar involucradas en la producción de entre un 23 y un 60% de RAM en niños6.
Otro problema añadido es la falta de formulaciones pediátricas específicas, lo que favorece la práctica de la formulación magistral para poder adaptar determinados tratamientos a la vía oral. Estas preparaciones también se relacionan con posibles errores de medicación y con incertidumbre sobre la estabilidad de los productos7.
Teniendo en cuenta que en el entorno de los cuidados intensivos la exposición a fármacos es elevada y muy diversa, nos preguntamos sobre la frecuencia de estos tipos de prescripciones en esta área. Además, nos resultan de especial interés medicamentos de uso frecuente como dopamina, midazolam, fentanilo o furosemida, muchos de ellos no investigados específicamente en población pediátrica, pero de los que se dispone de dilatada experiencia de uso. Por otro lado, la mayor parte de los estudios publicados se han realizado en Inglaterra y Holanda6, con datos muy escasos en población española, limitándose estos a 2 áreas bien distintas de los cuidados intensivos como es un estudio en gastroenterología8 y otro sobre prescripciones extrahospitalarias9. Según la actual normativa europea sobre medicamentos pediátricos10, una de las tareas importantes es la de recoger datos sobre el uso de fármacos en los niños en todos los Estados miembros, de cara a evaluar la situación actual y detectar las áreas terapéuticas, donde la necesidad de estudios pediátricos adicionales es más apremiante.
Por tanto, el objetivo de nuestro estudio ha sido determinar el perfil de prescripción y los usos OL (fuera de ficha técnica) y UL (medicamentos no autorizados específicamente en niños) en los cuidados intensivos pediátricos y neonatales.
Pacientes y métodosSe realizó un estudio observacional de tipo transversal de todas las prescripciones realizadas en una cohorte de los niños ingresados en la UCI de un hospital público de tercer nivel en Andalucía (Granada). En esta UCI se distribuía a los pacientes en neonatales (recién nacidos hasta el primer mes de vida) y pediátricos (desde el primer mes de vida hasta los 14 años).
Se recogieron prospectivamente mediante reclutamiento consecutivo, y durante un periodo de 5 meses (julio-noviembre), los datos de aquellos pacientes en los que se hubiese indicado al menos un tratamiento farmacológico. La fuente de información fue la historia clínica y las órdenes médicas. Se recogieron datos sobre edad, peso y motivo de ingreso de los pacientes, así como los referidos al tratamiento farmacológico: indicación, dosis, frecuencia, forma de presentación y vía de administración. Los medicamentos estudiados fueron agrupados según el Anatomical Therapeutic Chemical classification index (índice ATC).
Todas las prescripciones fueron clasificadas como OL o UL en función de la información que sobre su uso pediátrico apareciese contenida en la ficha técnica de los medicamentos. Los criterios empleados han sido los publicados por Turner11, que categorizaba como OL las prescripciones realizadas en distintas dosis, rango de edad, vía de administración o indicaciones, a las reflejadas en la documentación oficial de autorización del fármaco. Y entre las categorías de UL se incluyeron los agentes terapéuticos aún no autorizados, los contraindicados específicamente en niños, la modificación de los preparados y aquellos en los que no constase información alguna sobre su uso pediátrico.
Se realizó un análisis descriptivo utilizando el software SPSS 19.0 (Chicago, Illinois, EE. UU.). Para las comparaciones realizadas entre los 2 grupos de pacientes, en el caso de variable cuantitativa se utilizó, para la comparación de medias, la prueba t de Student; mientras que en el caso de variable dependiente cualitativa, para la comparación de proporciones se empleó el test Ji-cuadrado. El nivel de significación en todos los casos se fijó en p<0,05. Todos los datos personales fueron anonimizados. El estudio ha contado con dictamen favorable del Comité Ético de Investigación.
ResultadosSe incluyó en el estudio a un total de 81 pacientes, de los cuales el 59,3% (n=48) pertenecían a la UCI neonatal (UCIN) y el 40,7% (n=33) a la UCI pediátrica (UCIP). Predominó el sexo masculino (59%), sin diferencias significativas entre ambas unidades. En la UCIP la edad media fue de 4,4±4,7 años (rango: 2 meses-14 años), y entre los recién nacidos la edad gestacional media fue de 34,5±4,2 semanas (rango: 25-41 semanas), con un peso medio de 2.335±949 g (rango: 780-4.750 g). Una tercera parte de los recién nacidos pesó por debajo de 2.500 g, pero solo el 15% presentaron muy bajo peso.
El motivo de ingreso más frecuente en el conjunto de la Unidad fue la prematuridad-bajo peso (22,2%), seguida de problemas infecciosos (21%), enfermedad respiratoria (17,2%) y neurológica (15%).
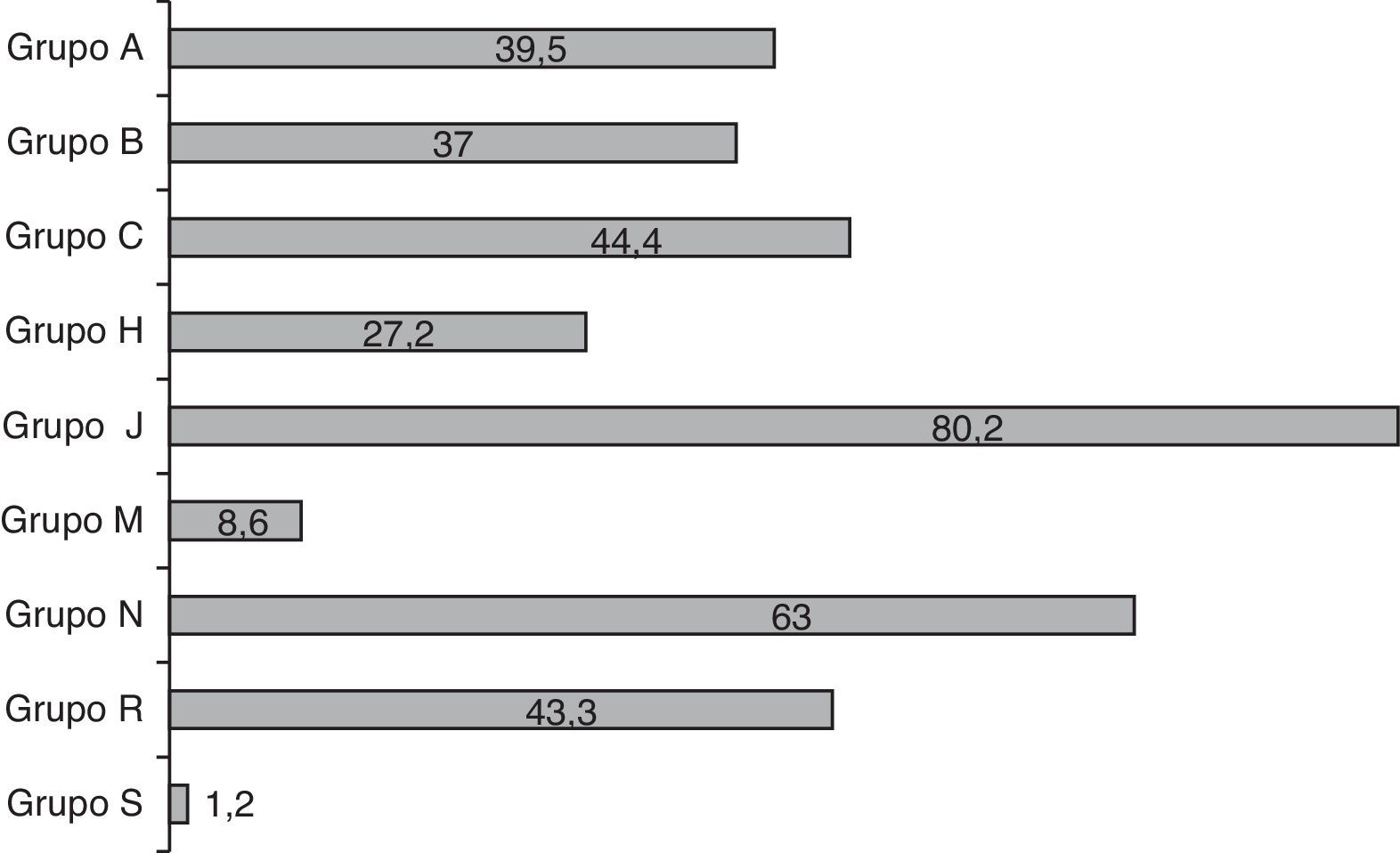
El número medio de fármacos prescritos por paciente fue de 7,4±6 (rango: 1-32; mediana de 6). Los pacientes neonatos recibieron mayor cantidad de fármacos que los pediátricos, aunque la diferencia no alcanzó significación estadística (8,3 vs. 6,1 fármacos, p=0,09). En total, 601 prescripciones con 91 principios activos distintos. En la figura 1 se muestra el perfil de prescripción por grupos terapéuticos según la clasificación ATC. El 80% de los niños recibió al menos un antibiótico, constituyéndose el grupo J (antiinfecciosos de uso sistémico) como el mayoritariamente empleado, seguido de los grupos N (sistema nervioso) y C (cardiovascular). Precisamente en estos 3 grupos se detectaron diferencias entre los pacientes de UCI neonatal y pediátrica, siendo significativamente mayor en los neonatos el uso de antibióticos (92 vs. 64%; p<0,001), de fármacos del sistema nervioso (58 vs. 49%; p<0,05) y de fármacos del grupo C (62,5 vs. 18,2%; p<0,001). El resto de los grupos no presentó diferencias en su distribución. Los 10 medicamentos más frecuentemente administrados en la UCI fueron ampicilina (53% de los pacientes), gentamicina (52%), midazolam (44%), furosemida (34,5%), dopamina (33%), cefotaxima (31%), metamizol (29%), fentanilo (28%), vancomicina (25%) y metilprednisolona (22%).
Distribución del uso de fármacos por grupos terapéuticos ATC (valores en % de niños que reciben algún fármaco del grupo).
Grupos Anatomical, Therapeutic, Chemical classification system (grupos ATC).
A: sistema digestivo y metabolismo; B: sangre y órganos hematopoyéticos; C: sistema cardiovascular; H: preparados hormonales sistémicos; J: antiinfecciosos de uso sistémico; M: sistema musculoesquelético; N: sistema nervioso; R: sistema respiratorio; S: órganos de los sentidos.
Al analizar las 601 prescripciones, se detectó que el 52% fueron de tipo OL, mientras que las de la categoría UL supusieron el 5% (tabla 1). El número de prescripciones OL por paciente pudo oscilar en un rango de entre 0 y 8 (media de 2,39±1,7), y las de tipo UL entre 0 y 4 (media de 0,32±0,6). Hubo una ligera tendencia a un mayor número de prescripciones OL por paciente entre los neonatos frente a los pediátricos (2,5 vs. 1,8; p=0,06). Si nos referimos a la proporción de niños que reciben al menos una prescripción UL, encontramos una tasa del 22,3%, mientras que recibían al menos una prescripción OL el 89% de todos los niños de la muestra. Las escasas diferencias entre cuidados neonatales y pediátricos no alcanzaron significación estadística.
Clasificación de las prescripciones según las condiciones de autorización para niños en ficha técnica (n=601 prescripciones)
| Tipo de Prescripción | Porcentaje (n) | Fármacos involucrados en cada categoría. |
|---|---|---|
| Prescripciones UL | 5 (30) | |
| Categoría UL | ||
| Modificación del preparado | 50 (15) | Vitamina E, ácido fólico, nifedipino, cafeína, gotas oftálmicas vancomicina |
| Contraindicado | 50 (15) | drotrecogina, amiodarona, enoxaparina |
| Prescripciones OL | 52 (313) | |
| Categoría OL | ||
| Diferente dosis | 79 (247) | Gentamicina, amoxicilina-clavulánico, midazolam, cefotaxima, dexametasona, vancomicina, metamizol, alimemazina, fenitoína, desmopresina |
| Diferente indicación | 13,5 (42) | Aminofilina, dexametasona, alimemazina, lidocaína hiperbárica, dextrometorfano |
| Diferente edad | 5 (16) | Budesonida, voriconazol, alimemazina, metamizol, dextrometorfano |
| Diferente vía | 2,5 (8) | Metamizol |
OL: off-label; UL: unlicensed.
Las causas de prescripciones UL se repartieron por igual entre 2 categorías, las modificaciones de las preparaciones y las contraindicaciones en niños. Como ejemplos de las primeras se encontraron las elaboraciones propias de nifedipino, ácido fólico, vitamina E, cafeína y colirio de vancomicina. Entre las contraindicaciones y advertencias por no establecimiento de eficacia y seguridad en niños destacó el uso de drotrecogina, amiodarona y enoxaparina. Por otro lado, entre las prescripciones OL, el principal motivo fue el empleo de una dosis diferente a la recomendada en ficha técnica (79% de los casos OL), seguida de distinta indicación (13,5%), diferente edad (5%) y vía de administración (2,5%) (tabla 1). Las indicaciones no presentes en ficha técnica fueron displasia broncopulmonar para dexametasona, aciduria arginosuccínica para dextrometorfano, cuadros de irritabilidad para alimemazina, el uso de lidocaína hiperbárica como antiarrítmico, y aminofilina como estimulante del centro respiratorio en apnea. Las causas de OL debidas a distinto grupo de edad se refieren principalmente al empleo de fármacos en recién nacidos y en general en menores de 2 años, para los que la seguridad y eficacia no han sido establecidas hasta el momento (por ejemplo budesonida y voriconazol en <2 años). Encontramos algunos fármacos que fueron prescritos bajo condiciones OL de distintas categorías simultáneamente, por ejemplo metamizol (dosis, edad y vía diferentes de las autorizadas), alimemazina (dosis, edad e indicación diferentes) y dextrometorfano (indicación y edad).
DiscusiónEl carácter unicéntrico del trabajo podría limitar la validez externa, sin embargo, aun teniendo presente la variabilidad entre prescriptores y centros, pensamos que estos resultados pueden reflejar adecuadamente el uso de este tipo de fármacos en el ámbito de los cuidados intensivos, en muchas ocasiones protocolizado. Además, con estos datos puede contribuirse, desde una UCI española, al inventario de los patrones actuales de prescripción solicitado desde la Agencia Europea10.
Los estudios publicados sobre este tipo de prescripciones muestran una amplia heterogeneidad en los resultados, consecuencia de las diferencias en la metodología, criterios de clasificación y fuentes de información empleadas, hecho que dificulta la comparación entre ellos. En este proyecto utilizamos la clasificación más ampliamente usada12–17, la originalmente descrita por Turner11. En nuestro estudio, como en la mayor parte de los trabajos más recientes, la fuente de información principal ha sido la ficha técnica (equivalente al o Summary of Products Characteristics [SPC], de la EMA), considerada documento oficial, puesto que sus datos han sido sometidos a una revisión regulatoria, y constituyen para los clínicos un elemento de consulta y de guía de cara a conocer las condiciones autorizadas de prescripción y administración de los medicamentos. Sin embargo, en este punto debe reflexionarse sobre la necesidad de actualización de las fichas técnicas, que en muchos casos van desfasadas con respecto a la generación de nuevos usos basados en estudios de calidad. De hecho, la investigación y el conocimiento en determinadas áreas van cambiando la práctica clínica y, sin embargo, estos cambios no llegan a reflejarse en las fichas técnicas, sobre todo si se trata de fármacos antiguos o de escaso interés comercial.
La exposición a fármacos de los niños de esta UCI fue muy variable, y algo superior (media 7,4 y mediana de 6 fármacos por paciente) a la de otros estudios (mediana de 3 en el estudio de Turquía, 4 en Estonia, y 4,2 en Finlandia)3,18,19. No obstante, teniendo en cuenta que se trata de cuidados críticos, pensamos que es una cifra razonable, y similar a otras en esta área clínica20. El perfil de prescripción es coherente con los motivos de ingreso y con el predominio de neonatos en la UCI, siendo común que el grupo de antibióticos sea el más empleado en estas unidades3,12,18,21. Por otro lado, el hecho de que un 63% de los niños recibiese algún fármaco del grupo N se explica por la necesidad de cubrir sedación y analgesia; encontramos midazolam y fentanilo entre los 10 fármacos más prescritos. En nuestra muestra hubo una significativa mayor proporción del uso de antibióticos, fármacos activos sobre el sistema nervioso y del área cardiovascular en pacientes neonatos que en pediátricos, hecho coherente con los problemas clínicos más frecuentes en los prematuros. También se detectaron ligeras diferencias en el perfil: mientras que los antibióticos más empleados en neonatos fueron ampicilina y gentamicina, en los pediátricos predominó el uso de amoxicilina-clavulánico y cefotaxima, lo cual es lógico teniendo en cuenta el espectro microbiológico que debe cubrirse en cada caso. De forma similar, con respecto al grupo N, la sedación fue más frecuente entre los recién nacidos, mientras que en los niños más mayores el perfil de uso de este grupo estuvo más relacionado con la analgesia y antipirexia (por ejemplo con paracetamol y metamizol).
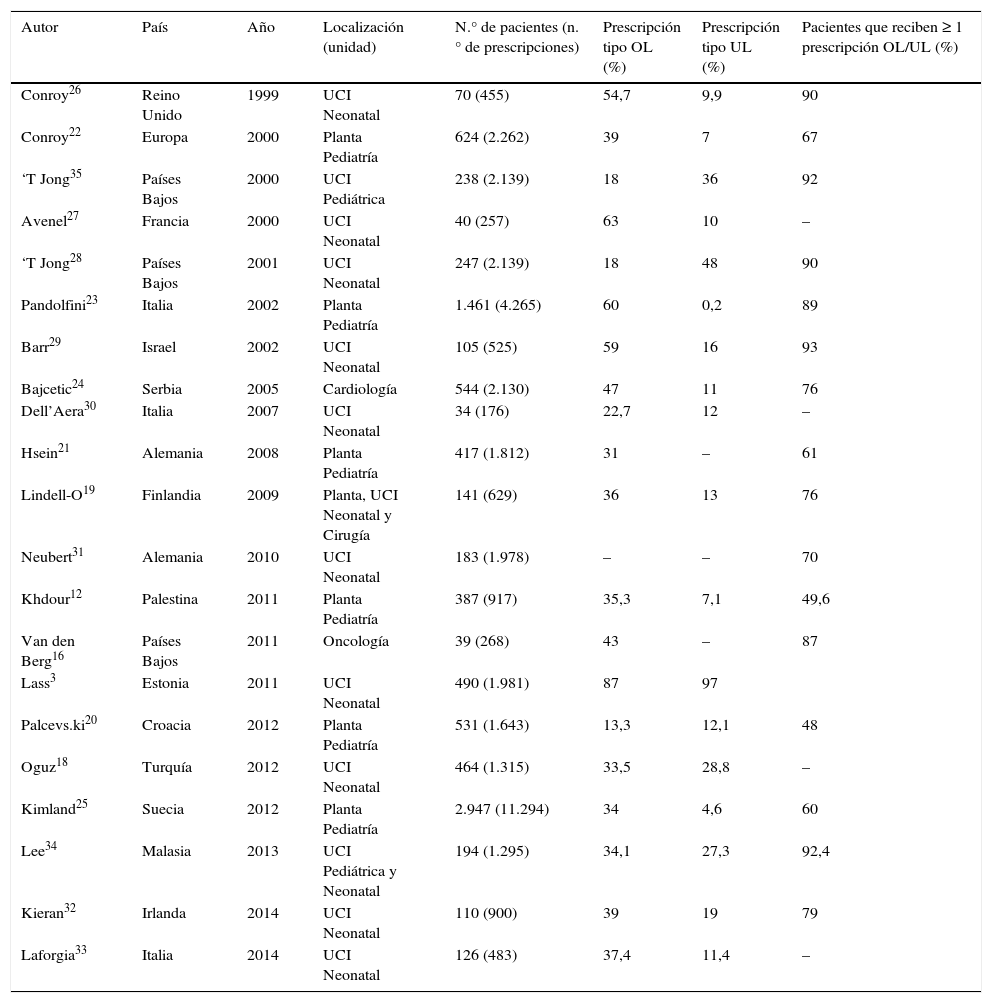
En la tabla 2 se muestra una revisión de los principales estudios realizados a nivel hospitalario. En nuestro caso, algo más de la mitad de las prescripciones fueron OL, cifras algo superiores a las halladas en salas hospitalarias pediátricas8,12,16,19-25 (que rondan cifras de entre 35 y 45%), más cercanas a las de UCIN3,18,26–33 y quizás algo por encima de otras UCIP34,35, lo cual es lógico teniendo en cuenta la importante proporción de neonatos en el presente estudio. Así, no es un hallazgo sorprendente que el 89% de los niños ingresados recibiera alguna prescripción de este tipo. Tal y como se refleja claramente en la tabla 2 las tasas de OL pueden llegar a ser muy diferentes entre los distintos países y estudios. Así, en UCIN encontramos proporciones que oscilan desde el 22,7% detectado en Italia30 hasta el 87% en Estonia3. Estos resultados tan dispares vuelven a reflejar diferencias no solo en la metodología y clasificaciones, sino también en la práctica clínica en sí misma. De acuerdo con Palcevski otra posible fuente de variabilidad puede encontrarse en el tipo de hospital, de forma que serían esperables mayores tasas de estas prescripciones en aquellos en los que se proporcionan cuidados más sofisticados o en los que los pacientes presentan una enfermedad más compleja20.
Resumen de los estudios sobre prescripciones OL/UL en diferentes unidades hospitalarias
| Autor | País | Año | Localización (unidad) | N.° de pacientes (n.° de prescripciones) | Prescripción tipo OL (%) | Prescripción tipo UL (%) | Pacientes que reciben ≥ 1 prescripción OL/UL (%) |
|---|---|---|---|---|---|---|---|
| Conroy26 | Reino Unido | 1999 | UCI Neonatal | 70 (455) | 54,7 | 9,9 | 90 |
| Conroy22 | Europa | 2000 | Planta Pediatría | 624 (2.262) | 39 | 7 | 67 |
| ‘T Jong35 | Países Bajos | 2000 | UCI Pediátrica | 238 (2.139) | 18 | 36 | 92 |
| Avenel27 | Francia | 2000 | UCI Neonatal | 40 (257) | 63 | 10 | – |
| ‘T Jong28 | Países Bajos | 2001 | UCI Neonatal | 247 (2.139) | 18 | 48 | 90 |
| Pandolfini23 | Italia | 2002 | Planta Pediatría | 1.461 (4.265) | 60 | 0,2 | 89 |
| Barr29 | Israel | 2002 | UCI Neonatal | 105 (525) | 59 | 16 | 93 |
| Bajcetic24 | Serbia | 2005 | Cardiología | 544 (2.130) | 47 | 11 | 76 |
| Dell’Aera30 | Italia | 2007 | UCI Neonatal | 34 (176) | 22,7 | 12 | – |
| Hsein21 | Alemania | 2008 | Planta Pediatría | 417 (1.812) | 31 | – | 61 |
| Lindell-O19 | Finlandia | 2009 | Planta, UCI Neonatal y Cirugía | 141 (629) | 36 | 13 | 76 |
| Neubert31 | Alemania | 2010 | UCI Neonatal | 183 (1.978) | – | – | 70 |
| Khdour12 | Palestina | 2011 | Planta Pediatría | 387 (917) | 35,3 | 7,1 | 49,6 |
| Van den Berg16 | Países Bajos | 2011 | Oncología | 39 (268) | 43 | – | 87 |
| Lass3 | Estonia | 2011 | UCI Neonatal | 490 (1.981) | 87 | 97 | |
| Palcevs.ki20 | Croacia | 2012 | Planta Pediatría | 531 (1.643) | 13,3 | 12,1 | 48 |
| Oguz18 | Turquía | 2012 | UCI Neonatal | 464 (1.315) | 33,5 | 28,8 | – |
| Kimland25 | Suecia | 2012 | Planta Pediatría | 2.947 (11.294) | 34 | 4,6 | 60 |
| Lee34 | Malasia | 2013 | UCI Pediátrica y Neonatal | 194 (1.295) | 34,1 | 27,3 | 92,4 |
| Kieran32 | Irlanda | 2014 | UCI Neonatal | 110 (900) | 39 | 19 | 79 |
| Laforgia33 | Italia | 2014 | UCI Neonatal | 126 (483) | 37,4 | 11,4 | – |
–: no se indica; OL: off-label; UCI: Unidad de Cuidados Intensivos; UL: unlicensed.
La principal categoría de OL ha sido el empleo de una dosis o frecuencia diferente de la reflejada en ficha técnica, hallazgo consistente con otros muchos estudios12,14,15,20,21,23. Es reseñable que los fármacos mayoritariamente implicados en los usos OL en la categoría de distinta dosis coincidan con algunos de los más prescritos, entre los que destacan gentamicina, cefotaxima, vancomicina y midazolam. En cuanto a las indicaciones no autorizadas, resulta más interesante en este punto reflexionar sobre el nivel de evidencia que soporta dichos usos. Puede ser controvertido por ejemplo el uso de alimemazine, autorizado como antihistamínico H1 para el tratamiento de la alergia, y usado OL por su acción sedante, o bien el uso de aminofilina como antiapneico en prematuros. Estas situaciones clínicas generan preguntas de investigación relevantes y deberían estimular la realización de estudios independientes que cubrieran estas lagunas de incertidumbre.
Consideramos destacable la escasa frecuencia de usos UL en nuestra muestra, solo un 5% frente a cifras que se mueven habitualmente en un rango de 10-15% de las prescripciones, tanto en UCIN26,27,29,30 como en salas pediátricas19,20,16. Pensamos que la preparación de medicamentos por la farmacia hospitalaria o la modificación de productos autorizados también puede verse influida por las prácticas farmacéuticas de cada país, de hecho, por ejemplo en Holanda existe una amplia tradición a la hora de realizar formulación magistral, con tasas de hasta el 48% de las prescripciones28. En las farmacias hospitalarias españolas también se preparan con frecuencia; sin embargo, en nuestra muestra hubo escasas formulaciones. Esto es debido, probablemente, al estado crítico de gravedad de los pacientes ingresados en esta unidad, de manera que la ruta de administración de elección fue la parenteral. Una vez en cuidados intermedios o en salas generales, con los niños en situación clínica más estable, la necesidad de adaptar soluciones orales puede ser mayor.
Debe recordarse que los usos fuera de ficha técnica no tienen por qué ser inapropiados y que con frecuencia representan la terapia más racional e incluso la mejor basada en la evidencia y en las guías de práctica clínica actuales2. Pero no siempre es así, y además pueden suponer un factor de riesgo de cara a la aparición de RAM, por lo que debe irse garantizando que los niños reciban las medicinas más seguras y más eficaces para una determinada condición. Por eso el Reglamento Europeo n.° 1901/2006 marca como objetivos aumentar el desarrollo de medicamentos pediátricos, asegurar una investigación de calidad y mejorar la información disponible sobre el uso de medicamentos en niños10. Para ello la EMA ha puesto en marcha iniciativas como la creación del Comité Pediátrico, los Planes de Investigación Pediátrica (PIP), la publicación de una lista con los medicamentos que recomienda que sean desarrollados para uso pediátrico, o la European Network of Paediatric Research. Independientemente de la implementación de estas medidas, nos parece recomendable promover estudios de utilización de medicamentos en los niños, difundir el significado de los usos OL-UL y, en aquellos casos en los que estos usos fuera de ficha técnica o no autorizados no estén respaldados por guías de práctica clínica o estudios de calidad, proponer estudios prospectivos que recojan datos de eficacia y seguridad para poder ir proporcionando una mayor evidencia y mejores elementos de juicio a la hora de seleccionar medicamentos. Pensamos que en el área de los cuidados intensivos, por el perfil farmacológico empleado, estos estudios son de un especial interés.
Finalmente hacemos una consideración sobre los aspectos legales del uso de fármacos en condiciones no recogidas en su ficha técnica que, como ya se ha mencionado, es un documento oficial y de carácter legal. Los usos fuera de ficha técnica vienen recogidos desde el año 2009 en el RD sobre Disponibilidad de Medicamentos en Situaciones Especiales36, que facilita administrativamente su empleo cuando vienen respaldados por guías de práctica clínica o algún tipo de evidencia científica, y que clarifica las responsabilidades al respecto. Esta regulación establece que los médicos podrán emplear medicamentos de forma diferente a la amparada por ficha técnica cuando esté justificado, pero reflejando dicho uso en la historia clínica y solicitando el consentimiento, al menos verbal, de los padres. Pero este procedimiento aún no ha sido implementado en la práctica clínica, probablemente por falta de conocimiento y porque se necesite más tiempo para su difusión. De hecho, recientemente se han publicado los resultados de una encuesta a nivel nacional, en la que se pone de manifiesto que el 71,5% de los pediatras que participaron conocían el significado del término OL, que el 61% afirmaba prescribir fármacos con indicaciones fuera de ficha técnica y que un 47% conocía que dicho uso debe quedar reflejado en la ficha técnica. Pero sin embargo, algo menos de la mitad informaba a los padres y solo el 22% lo deja anotado en la historia clínica37.
Centro de realización del estudioUCI Pediátrica del Hospital Universitario San Cecilio de Granada.
Conflicto de interesesLos autores declaramos no tener ningún conflicto de interés.