El fallo respiratorio agudo es la principal causa de hospitalización en pediatría. Las cánulas nasales de alto flujo (CNAF) ofrecen una nueva alternativa, pero sigue existiendo debate en torno a la evidencia e indicaciones. No se ha descrito su comportamiento en gran altitud.
ObjetivoDescribir el uso de CNAF en pacientes pediátricos que ingresan con insuficiencia respiratoria y explorar los factores asociados al fracaso de la terapia.
MetodologíaEstudio de cohortes prospectivo. Pacientes entre un mes y 18 años manejados con CNAF. Se describieron datos demográficos y se evaluó la respuesta al inicio, 1.a, 6.a y 24.a horas. Se determinó el número de fracasos, así como estancia, complicaciones y mortalidad. Se compararon los pacientes con fracaso al tratamiento.
ResultadosIngresaron 539 pacientes. Fueron más frecuentes los lactantes (70,9%) de sexo masculino (58,4%) con afecciones respiratorias como asma y bronquiolitis (61,2%). Se presentaron 53 fracasos (9,8%), 21 en las primeras 24 horas. La mediana de estancia fue de 4 días (RIQ 4), hubo 5 éxitus (0,9%) y 13 eventos adversos –epistaxis– (2,2%). Se observó mejoría de signos vitales y gravedad en el tiempo con diferencias en el grupo que fracasó, pero sin interacciones. El modelo logístico final estimó una relación independiente del fracaso, entre el hospital (OR 2,78; IC95% 1,48-5,21) y la frecuencia respiratoria inicial (OR 1,56; IC95% 1,21-2,01).
ConclusiónLa CNAF es un sistema con buena respuesta clínica, pocas complicaciones y una baja tasa de fracasos. Las diferencias entre las instituciones sugieren una relación subjetiva de la decisión del fracaso.
Acute respiratory failure is the leading cause of hospitalization in pediatrics. High-flow nasal cannulas (HFNCs) offer a new alternative, but the evidence and indications are still debated. The performance of HFNCs at high altitude has not been described to date.
ObjectiveTo describe the use of HFNCs in pediatric patients admitted with respiratory failure and explore the factors associated with treatment failure.
MethodologyA prospective cohort study was carried out in patients between 1 month and 18 years of age managed with HFNCs. The demographic and treatment response data were recorded at baseline and after 1, 6 and 24hours. The number of failures was determined, as well as the length of stay, complications and mortality. Patients with treatment failure were compared with the rest.
ResultsA total of 539 patients were enrolled. Infants (70.9%) of male sex (58.4%) and airway diseases such as asthma and bronchiolitis (61.2%) were more frequent. There were 53 failures (9.8%), with 21 occurring in the first 24hours. The median length of stay was 4 days (IQR 4); there were 5 deaths (0.9%) and 13 adverse events (epistaxis) (2.2%). Improvement was observed in vital signs and severity over time, with differences in the group that failed, but without interactions. The final logistic model established an independent relationship of failure between the hospital (OR 2.78, 95%CI 1.48-5.21) and the initial respiratory rate (OR 1.56, 95%CI 1.21-2.01).
ConclusionsHFNCs afford good clinical response, with few complications and a low failure rate. The differences found between institutions suggest a subjective relationship in the decision of therapy failure.
Las enfermedades respiratorias son el motivo de consulta más frecuente en la práctica pediátrica, generan altas tasas de hospitalización y mortalidad, especialmente en los países en vías de desarrollo1. Las estadísticas de la organización mundial de la salud reportaron que en 2016, la principal causa de mortalidad en niños menores de 5 años fueron las infecciones respiratorias2 y ellas son motivo de ingreso en cerca de un 70% de las causas de ingresos en la unidad de cuidados intensivos pediátricos (UCIP)3. En Colombia en el año 2017, se reportaron 11.286 ingresos a UCIP por infección respiratoria en menores de 5 años lo que representa el 54,5% de todos los ingresos a UCIP, sin importar el grupo etario4.
El tratamiento de estos pacientes consiste en oxigenoterapia con o sin asistencia ventilatoria (invasiva o no invasiva)3. Esto se logra a través de distintas técnicas e interfaces dependiendo de sus requerimientos, y del balance entre riesgo y beneficio1,3. Desde principios de este siglo, a nivel internacional, se inició el uso de equipos capaces de administrar oxígeno a alto flujo acondicionado (humidificado y caliente) a través de cánulas nasales5,6. Las distintas hipótesis por las cuales se sugiere que las cánulas nasales de alto flujo (CNAF) generan asistencia ventilatoria ya han sido revisadas en detalle por otros autores7,8.
Aunque la investigacion aún no termina de definir el papel preciso de este sistema algunas encuestas en pediatría muestran una alta aceptación en la práctica clínica9,10 a pesar de la baja evidencia establecida de su uso11,12. Al parecer hay una percepción clínica de efectividad y facilidad de uso13; además del cambio de paradigma en el uso de sistemas invasivos por aquellos que no lo son, reduciendo el impacto de enfermedades como la bronquiolitis14,15. En los pacientes pediátricos hay estudios que avalan su eficacia (respuesta clínica a la terapia) para soporte inicial16–19, postextubación20 y en distintos tipos de enfermedades que cursan con fallo ventilatorio18,21,22, sin embargo, al compararse con otros dispositivos de soporte ventilatorio no invasivo su eficacia es menor11,16,21.
Bogotá está a 2600 m sobre el nivel del mar (s. n. m.), lo cual tiene implicaciones importantes en la presión de oxígeno disponible. A alturas mayores de 1500 m s. n. m. se produce un estímulo de los centros carotídeos para generar un aumento de la frecuencia respiratoria y del volumen corriente para compensar la caída en la presión de oxígeno inspirado del ambiente23. Estos cambios hacen difícil el diagnóstico24, los umbrales de monitorización25 y la respuesta al manejo de los pacientes en la altura26. Recientemente nuestro grupo publicó la experiencia del uso de CNAF en neonatos encontrando un uso de altas fracciones de oxígeno y pocos signos de gravedad por trabajo respiratorio27. Descripciones de su uso en países de medianos ingresos, con muchas ciudades a moderadas y grandes alturas no han sido descritas.
Algunos estudios describen factores asociados al fracaso de esta terapia basados en variables fisiológicas al ingreso28–30, su respuesta a estas18,30, escalas de gravedad28,31, factores propios de la enfermedad29. Inclusive observa un componente subjetivo en la decisión según el tipo de centro18. Hasta el momento ningún estudio ha buscado estos factores en ciudades a gran altitud.
El presente estudio busca describir el uso de las CNAF en pacientes pediátricos que ingresan en cuidado crítico pediátrico con insuficiencia respiratoria y explorar los factores que predigan el fracaso de esta terapia en dos unidades de Bogotá entre 2013 y 2016.
MetodologíaSe realizó un estudio observacional prospectivo, en pacientes con edades entre un mes y 18 años que ingresaron en las UCIP de la Sociedad de Cirugía de Bogotá Hospital de San José y la Unidad de Cuidados Intermedios (UCIT) en la Clínica Infantil Colsubsidio, de Bogotá. Estas son unidades exclusivas pediátricas ubicadas en hospitales generales universitarios, cuentan con 8/13 camas con un promedio de 300/1000 ingreso al año. Las ratios de atención suelen ser: de enfermería una por cada 6/8 pacientes, de una auxiliar por cada 3 pacientes y de un terapeuta respiratorio por unidad. Son coordinadas por un intensivista pediatra en la jornada de la mañana y pediatras en las noches y festivos. Reciben población médica y quirúrgica, incluyendo pacientes oncológicos en una de las unidades y atienden población principalmente de Bogotá. No cuentan con cirugía cardiovascular, terapia de circulación extracorpórea o trasplante. Las dos unidades usan equipos diseñados de forma exclusiva para realizar terapia de alto flujo adquiridos entre 2012 y 2015, con materiales certificados y desechables. Consta de cánulas diseñadas para entregar flujos elevados (OptiflowTM; 40-70 €), circuitos respiratorios (50-150 €) con calefacción integrada (50-150 €) y humidificador servo controlado (F&P 850™ o myAIRVO™ 2; 2500-3000 €). En ambas unidades contamos con otros sistemas de ventilación no invasiva en equipos convencionales e interfases para distintas edades, aunque de limitada variedad. Se estudiaron todos los pacientes desde noviembre de 2013 a diciembre de 2016 con cuadro clínico compatible con insuficiencia respiratoria por criterio del médico tratante que inició soporte ventilatorio a través de CNAF. En el estudio solo se incluyó el primer momento de soporte con la CNAF, ya que algunos pacientes precisaron más usos durante su estancia hospitalaria. Se excluyeron pacientes que fueran remitidos a otra institución antes de 24 h de su colocación o pacientes en quienes no se rellenó adecuadamente el formulario por parte del médico encargado al inicio del seguimiento. Se recolectó información de cada paciente, al inicio de la terapia y al cabo de la 1.a, 6.a y 24.a h de su uso que incluía: parámetros demográficos como edad peso y sexo, diagnóstico respiratorio definido por su mecanismo fisiopatológico principal (vía aérea pequeña como bronquiolitis y asma, ocupación alveolar como neumonía o edema, vía aérea alta como laringitis obstructiva, y enfermedades neuromusculares como la insuficiencia motora de origen cerebral) y el patrón radiológico de ingreso descrito por el médico tratante que contaba con ayuda de médicos radiólogos en caso de dudas. Se midieron variables fisiológicas como frecuencia respiratoria (FR) y cardiaca (FC), saturación de hemoglobina por pulsoximetría (SpO2), fracción inspirada de oxígeno (FiO2) y su relación (SpO2/FiO2), así mismo se cuantificó la cantidad de flujo administrado por kilogramo de peso. Se midió el grado de gravedad del cuadro con las variables de la escala clínica de asma modificada de Wood (M-WCAS) y la relación entre SpO2/FiO2 y FR o índice Respiratory rate-OXygenation (ROX)32. Además, se agrupó la SpO2/FiO2 en rangos de 100, la escala M-WCAS por categorías de gravedad y se clasificó la FC, FR como anormales si se encontraban por fuera de los percentiles 10, 90 para la edad utilizado los datos publicados por Fleming et al.33. Como medida de bienestar no se utilizó una escala, pero se consideraron las dificultades de la alimentación, y la posibilidad de llorar o hablar según la edad como subrogados indirectos. Se presentan variables continuas en promedios y desviaciones estándar o medianas y rangos intercuartílicos (RIQ) según su distribución y las variables categorías en valores absolutos y proporciones. Se compararon los cambios de las variables en el tiempo utilizando un análisis de medidas repetidas por técnica de modelos mixtos para determinar la varianza de los datos con p menor de 0,05 como significativa. También se midió la mortalidad, estancia en la unidad y la frecuencia de todos los eventos adversos detectados. Se estableció la definición de «caso fracaso», como aquel en el que fue retirada la CNAF y se inició ventilación mecánica invasiva; dividiendo los casos encontrados en tempranos (primeras 24 h de uso) y tardíos (más de 24 h de uso) y se realizó una comparación bivariada por el tipo de fracaso y un análisis multivariado por medio de regresiones logísticas con las variables relevantes o significativas en al análisis bivariado. Toda la información fue verificada y tabulada en una hoja de Excel y procesada por el paquete estadístico Stata 13. Se presentan los datos en tablas para mejorar su comprensión. Este estudio fue presentado y aprobado por los comités de ética en investigacion de cada institución (Comité de Ética en Investigacion con Seres Humanos Sociedad de Cirugía de Bogotá Hospital de San José [IRB#00011307], septiembre 16 de 2013; Clínica Infantil Colsubsidio, abril 4 de 2017 [CEI-36-15]) quienes autorizaron una excepción del consentimiento informado por tratarse de un estudio sin riesgo.
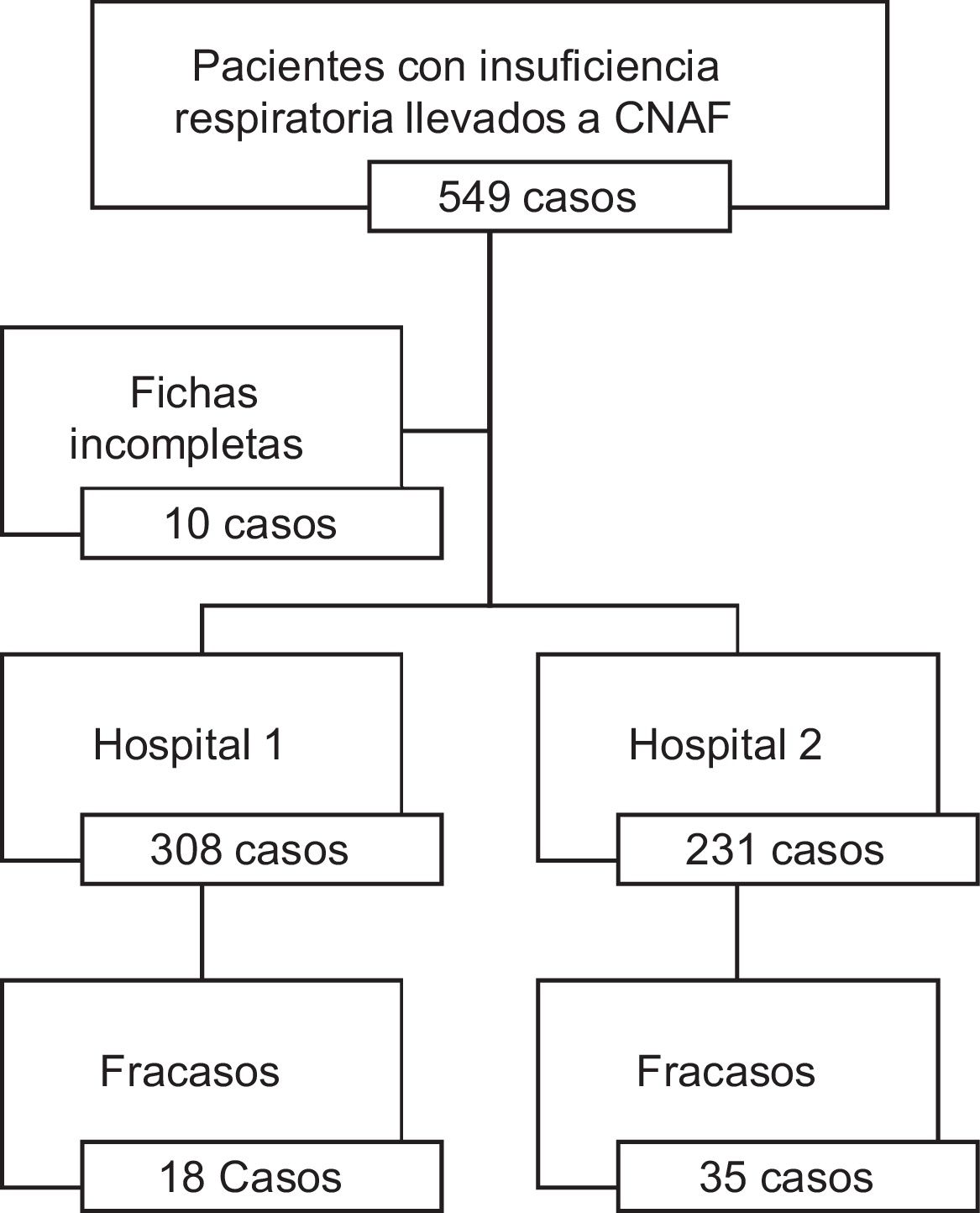
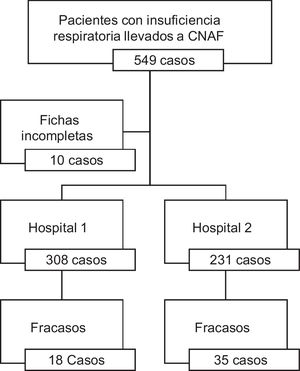
ResultadosIngresaron un total de 549 pacientes de los cuales 10 fueron retirados del estudio por mal diligenciamiento de la ficha de recolección. En total se registraron 308 pacientes en el hospital 1 (57,1%) y 231 al hospital 2 (42,9%) (fig. 1).
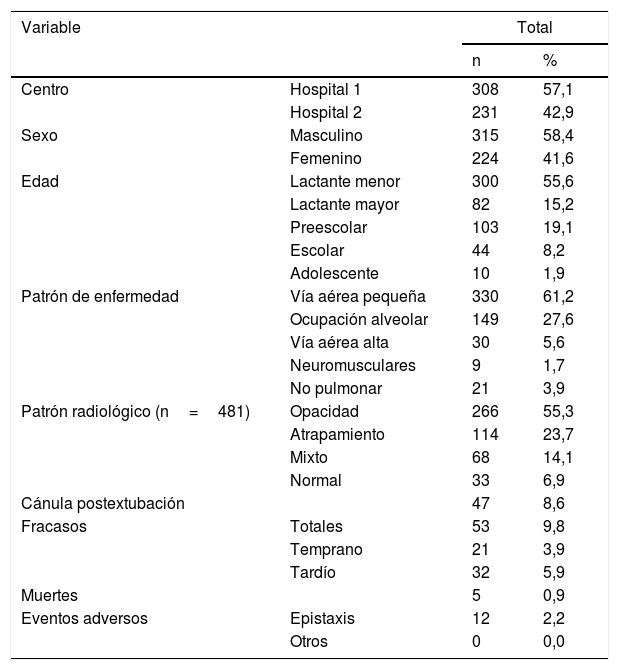
La caracterización clínica demográfica del ingreso global se describe en detalle en la tabla 1. Fueron más frecuentes los lactantes menores que los preescolares y escolares. El diagnóstico más prevalente fue enfermedad de la vía aérea pequeña, seguido de las enfermedades de ocupación alveolar. El patrón radiológico observado con mayor frecuencia fue la presencia de opacidades, seguido de signos de atrapamiento aéreo. La terapia se usó con más frecuencia como esquema primario de soporte que como sistema postextubación. El flujo promedio utilizado fue de 1,3± 0,63ml/kg/min con FiO2 promedio de 0,68± 0,19.
Descripción demográfica, diagnóstica y desenlaces de los pacientes que recibieron soporte con cánula nasal de alto flujo
| Variable | Total | ||
|---|---|---|---|
| n | % | ||
| Centro | Hospital 1 | 308 | 57,1 |
| Hospital 2 | 231 | 42,9 | |
| Sexo | Masculino | 315 | 58,4 |
| Femenino | 224 | 41,6 | |
| Edad | Lactante menor | 300 | 55,6 |
| Lactante mayor | 82 | 15,2 | |
| Preescolar | 103 | 19,1 | |
| Escolar | 44 | 8,2 | |
| Adolescente | 10 | 1,9 | |
| Patrón de enfermedad | Vía aérea pequeña | 330 | 61,2 |
| Ocupación alveolar | 149 | 27,6 | |
| Vía aérea alta | 30 | 5,6 | |
| Neuromusculares | 9 | 1,7 | |
| No pulmonar | 21 | 3,9 | |
| Patrón radiológico (n=481) | Opacidad | 266 | 55,3 |
| Atrapamiento | 114 | 23,7 | |
| Mixto | 68 | 14,1 | |
| Normal | 33 | 6,9 | |
| Cánula postextubación | 47 | 8,6 | |
| Fracasos | Totales | 53 | 9,8 |
| Temprano | 21 | 3,9 | |
| Tardío | 32 | 5,9 | |
| Muertes | 5 | 0,9 | |
| Eventos adversos | Epistaxis | 12 | 2,2 |
| Otros | 0 | 0,0 | |
Adolescente: 13 y 18 años; Escolar: 6 y 12 años; Lactante mayor: 13 y 24 meses; Lactante menor: menores a 12 meses; n: individuos evaluados; Preescolar: 2 y 5 años; %: porcentaje.
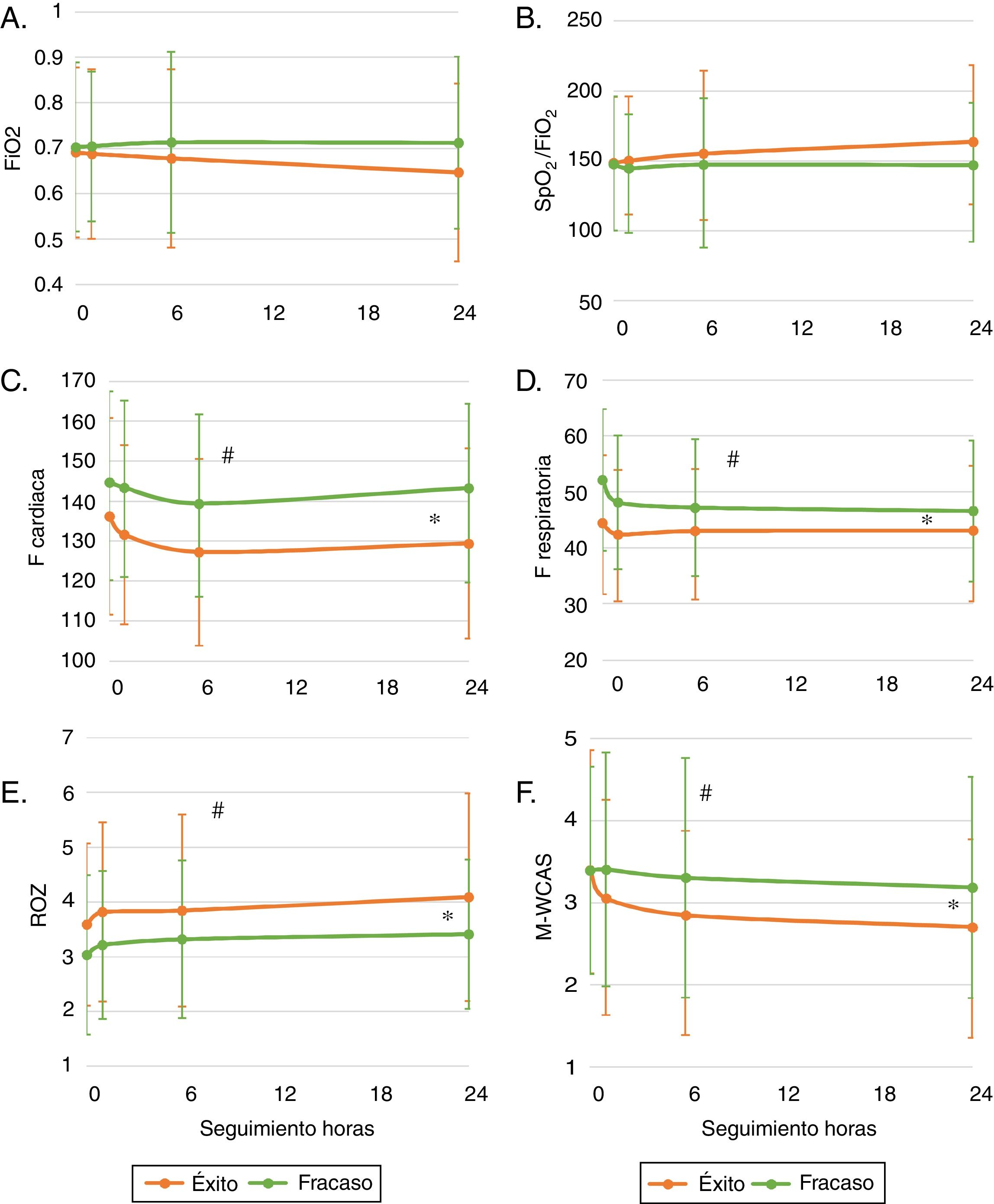
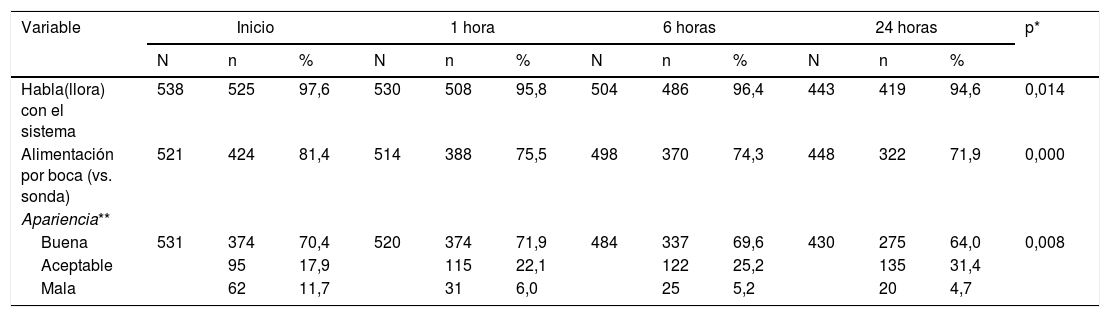
En la tabla 2 y la figura 2 se describe la evolución de las variables de seguimiento. Durante la primera hora se presentaron 2 fracasos de la terapia, 12 más a las 6 h y 7 más para las siguientes 24 h. Se retiró la cánula por epistaxis (11 casos) o por mejoría del paciente (definido como un cambio positivo del estado general) en 16 casos a las 6 h y en 48 casos a las 24 h. En total el 84,23% de los pacientes continuaban utilizando el sistema al concluir las 24 h de seguimiento. La frecuencia cardiaca y respiratoria fueron mejorando de forma significativa con el paso de las h y la relación SpO2/FiO2 fue anormal en la mayoría de los casos con tendencia a mejorar (fig. 2). Se buscó si existía indicadores de mala titulación de FiO2, encontrando un 33,3% de los datos la SpO2 se encontraba mayor de 97%, sin embargo, al analizar en estos grupos la SpO2/FiO2 aún fue baja (SpO2≤97%: mediana 138 riq 66 vs. SpO2>97%: 152 riq 64). Al evaluar la gravedad respiratoria por (M-WCAS) encontramos puntajes en su mayoría leves y moderados que mejoran estadísticamente a lo largo de las h que se mantienen con el uso de CNAF. El índice ROX inició con un puntaje promedio de 3,5± 1,5 y mejoró hasta 4,1± 1,9 con una diferencia estadísticamente significativa, sin embargo, el punto de corte de 4,8 (descrito en la literatura para adultos) se presentó en el 9,43% de los fracasos y en el 16,2% de los demás. Dentro de las medidas de bienestar se observa que más de 95% de los pacientes puede hablar o llorar con el sistema activo. Las dificultades importantes de la alimentación se presentan en rango variable entre el 20-30% y fuero manejadas con alimentación por sonda.
Seguimiento de bienestar durante las 24 horas de seguimiento en pacientes con cánula nasal de alto flujo
| Variable | Inicio | 1 hora | 6 horas | 24 horas | p* | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N | n | % | N | n | % | N | n | % | N | n | % | ||
| Habla(llora) con el sistema | 538 | 525 | 97,6 | 530 | 508 | 95,8 | 504 | 486 | 96,4 | 443 | 419 | 94,6 | 0,014 |
| Alimentación por boca (vs. sonda) | 521 | 424 | 81,4 | 514 | 388 | 75,5 | 498 | 370 | 74,3 | 448 | 322 | 71,9 | 0,000 |
| Apariencia** | |||||||||||||
| Buena | 531 | 374 | 70,4 | 520 | 374 | 71,9 | 484 | 337 | 69,6 | 430 | 275 | 64,0 | 0,008 |
| Aceptable | 95 | 17,9 | 115 | 22,1 | 122 | 25,2 | 135 | 31,4 | |||||
| Mala | 62 | 11,7 | 31 | 6,0 | 25 | 5,2 | 20 | 4,7 | |||||
N: individuos evaluados; n: individuos afectados; %: porcentaje de los evaluados.
Seguimiento de los pacientes en cánula nasal de alto flujo, relación con tiempo. Comparación en relación a fracaso de la terapia. Gráfica que muestra el comportamiento promedio y varianza para cada variable fisiológica por subgrupos de éxito y fracaso total durante las primeras 24 horas de seguimiento. Comparada la variable con el tiempo, el fracaso y la interaccion entre tiempo y fracaso mediante modelos lineales mixtos con efecto aleatorizado (individuo). Se considera de significación estadística una p<0,005, se marca en la figura con [*] las diferencias en categoría fracaso; [#] las difencias en el tiempo; [$] diferencias en la interación. A) Muestra la relación de la fracción inspirada de oxígeno (FiO2). B) Relación de saturación por pulsoximetría (SpO2) y FiO2 (SpO2/FiO2). C) Relación de la frecuencia cárdica (FC). D) Relación de la frecuencia respiratoria (FR). E) Relación de índice ROX (relación entre SpO2/FiO2 sobre FR). F) M-WCAS: Escala Wood de asma clínica modificada.
Se presentaron un total de 53 fracasos (9,8%), de los cuales 21 (3,9%) fueron antes de 24 h (tempranos) mientras que los demás 32 (5,9%) se presentaron después. La estancia mediana en la unidad fue de 4 días (RIQ 4), y se presentaron 5 éxitus, uno de ellos con fracaso temprano, 2 con fracaso tardío y 2 sin fracaso con limitación del esfuerzo terapéutico por su condición de base. Se registraron como efectos adversos 12 epistaxis que ameritaron manejo específico (5 en primera hora, 4 a las 6 h, y 3 a 24 h) y ameritó el retiro de la terapia en 11 casos. Estos eventos sucedieron en una de ellas (0,33%) en un lactante menor, 7 (8,54%) en lactantes mayores, 3 (2,91%) en preescolares, y 1(2,27%) en un escolar.
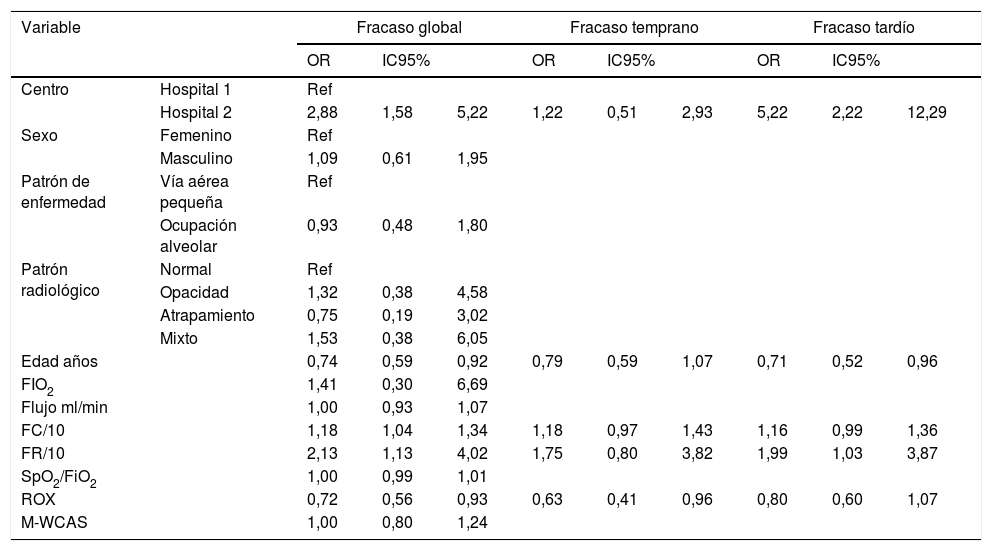
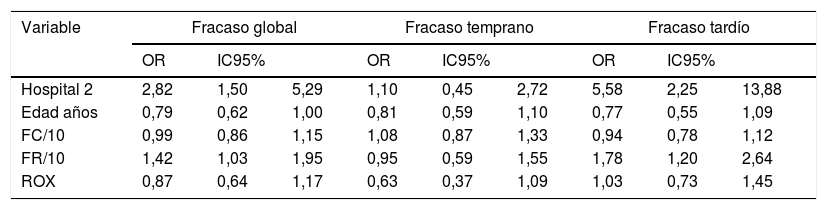
Comparación por tipo de fracasoAl analizar la comparación entre los tipos de fracaso y las variables descritas se encontraron diferencias globales por hospital, menor edad de los pacientes, mayor frecuencia cardiaca y respiratoria, y un valor de puntaje ROX menor (tabla 3). Para estas variables se analizó si esta diferencia se presentaba en los fracasos tempranos o tardíos encontrando que a excepción del índice ROX, los demás factores fueron más relevantes en los fracasos tardíos que en los tempranos. Al hacer la comparación multivariada solo se mantuvo el efecto del hospital y la frecuencia respiratoria para fracaso global y tardío (tabla 4).
Análisis bivariado comparando las variables a estudio con los tipos de fracaso de la terapia en pacientes con cánula nasal de alto flujo
| Variable | Fracaso global | Fracaso temprano | Fracaso tardío | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| OR | IC95% | OR | IC95% | OR | IC95% | |||||
| Centro | Hospital 1 | Ref | ||||||||
| Hospital 2 | 2,88 | 1,58 | 5,22 | 1,22 | 0,51 | 2,93 | 5,22 | 2,22 | 12,29 | |
| Sexo | Femenino | Ref | ||||||||
| Masculino | 1,09 | 0,61 | 1,95 | |||||||
| Patrón de enfermedad | Vía aérea pequeña | Ref | ||||||||
| Ocupación alveolar | 0,93 | 0,48 | 1,80 | |||||||
| Patrón radiológico | Normal | Ref | ||||||||
| Opacidad | 1,32 | 0,38 | 4,58 | |||||||
| Atrapamiento | 0,75 | 0,19 | 3,02 | |||||||
| Mixto | 1,53 | 0,38 | 6,05 | |||||||
| Edad años | 0,74 | 0,59 | 0,92 | 0,79 | 0,59 | 1,07 | 0,71 | 0,52 | 0,96 | |
| FIO2 | 1,41 | 0,30 | 6,69 | |||||||
| Flujo ml/min | 1,00 | 0,93 | 1,07 | |||||||
| FC/10 | 1,18 | 1,04 | 1,34 | 1,18 | 0,97 | 1,43 | 1,16 | 0,99 | 1,36 | |
| FR/10 | 2,13 | 1,13 | 4,02 | 1,75 | 0,80 | 3,82 | 1,99 | 1,03 | 3,87 | |
| SpO2/FiO2 | 1,00 | 0,99 | 1,01 | |||||||
| ROX | 0,72 | 0,56 | 0,93 | 0,63 | 0,41 | 0,96 | 0,80 | 0,60 | 1,07 | |
| M-WCAS | 1,00 | 0,80 | 1,24 | |||||||
Análisis bivariado por método de regresión logística, solo por categorías sí se observó significación en categoría de fracaso global.
FC/10: frecuencia cardiaca agrupada por 10 latidos; FiO2: fracción inspirada de oxígeno; FR/10: frecuencia respiratoria agrupada por 10 respiraciones; IC95%: intervalo de confianza del 95%; M-WCAS: Escala Wood de asma clínica modificada; OR: odds ratio; Ref.: categoría de referencia; ROX: índice de relación entre SpO2/FiO2 sobre FR; SpO2/FiO2: relación pulsoximetría y FiO2.
Modelo multivariado comparando las variables significativas por tipos de fracaso de la terapia en pacientes con cánula nasal de alto flujo
| Variable | Fracaso global | Fracaso temprano | Fracaso tardío | ||||||
|---|---|---|---|---|---|---|---|---|---|
| OR | IC95% | OR | IC95% | OR | IC95% | ||||
| Hospital 2 | 2,82 | 1,50 | 5,29 | 1,10 | 0,45 | 2,72 | 5,58 | 2,25 | 13,88 |
| Edad años | 0,79 | 0,62 | 1,00 | 0,81 | 0,59 | 1,10 | 0,77 | 0,55 | 1,09 |
| FC/10 | 0,99 | 0,86 | 1,15 | 1,08 | 0,87 | 1,33 | 0,94 | 0,78 | 1,12 |
| FR/10 | 1,42 | 1,03 | 1,95 | 0,95 | 0,59 | 1,55 | 1,78 | 1,20 | 2,64 |
| ROX | 0,87 | 0,64 | 1,17 | 0,63 | 0,37 | 1,09 | 1,03 | 0,73 | 1,45 |
Regresión logística multivariada con variables con reporte significativo en el análisis bivariado.
FC/10: frecuencia cardiaca agrupada por 10 latidos; FR/10: frecuencia respiratoria agrupada por 10 respiraciones; IC95%: intervalo de confianza del 95%; OR: odds ratio; ROX: índice de relación entre SpO2/FiO2 sobre FR; SpO2/FiO2: relación pulsoximetría y FiO2.
El estudio muestra el manejo en una corte de pacientes de dos centros ubicados a gran altitud encontrando gran compromiso de la oxigenación y menor gravedad ventilatoria por M-WCAS con respuesta de las variables clínicas y un bajo porcentaje de fallo en las primeras 24 h, aunque con una gran diversidad de pacientes y desenlaces en los centros estudiados.
La composición demográfica por sexo, edad y patologías es similar a la reportada por otras cohortes que vienen utilizando el sistema de CNAF. Por ejemplo, Coletti y su grupo en 2017 publican una cohorte de pacientes seguidos en una unidad pediátrica polivalente con una frecuencia de casos del sexo femenino de 44%, lactantes en el 49% de los casos y la mayoría enfermedades de vía aérea pequeña 65%34. Sin embargo, aún existe gran variabilidad de su uso por edades y patologías lo cual es compatible con las diferencias que se encontraron entre los dos centros analizados y con otras cohortes reportadas en la literatura que también varían con el tiempo35,36.
Los pacientes del presente estudio presentaron un trastorno de oxigenación mucho mayor que el reportado por otros grupos: Oto et al., reportan FiO2 media de 0,39± 0,0826, el estudio TRAMONTANE en bronquiolitis con valores promedio de 0,31± 0,137, y Pilar et al. en pacientes con asma FiO2 con medianas de 0,6% y RIQ 0,4%, o como Er et al. que encontraron en su estudio SpO2/FiO2 de inicio de 160± 57, y fallo del tratamiento con valores de SpO2/FiO2 de 195.
El trabajo respiratorio de estos pacientes fue menos grave que el descrito por Oto et al.38 por la escala M-WCAS (8,8± 2,5) o Pilar21 en asma (mediana 8; RIQ 2) compatibles con compromiso ventilatorio importante, al igual que Er et al. que encontraron en su estudio puntajes de gravedad por mRAID (modified respiratory distress assessment instrument) de 9,3±1,4 donde el compromiso ventilatorio también fue grave22. Otros estudios como TRAMONTANE37 en bronquiolitis (M-WCAS de 4± 1) reportan valores similares a este estudio lo que sugiere más una diferencia de indicación (oxigenación por gran altitud) o por sobreuso (16% de nuestros pacientes fueron retirados de la terapia antes de 24 h) y que podría incurrir en sobrecostos para el sistema de salud (entre 100 y 250 € en consumibles por paciente), preocupaciones previamente discutidas por otros autores39–41.
Estas diferencias en términos de alteraciones de la oxigenación y de la ventilación pueden explicar en parte la baja frecuencia de fallos encontrados en este estudio, realizado a gran altitud (2.640 m s. n. m.) comparado con fallos descritos tan variables como 40%(21) las más altas y 15% a 20% las más bajas22,38 en estudios realizados en países ubicados a baja altitud, que utilizaron FiO2 similares o más bajas, pero con mayores índices de gravedad. Creemos que en los niños que viven a nivel del mar la hipoxemia marcada refleja un gran compromiso de la ventilación, mientras que en la gran altitud es más una manifestación del bajo contenido de oxígeno inspiratorio disponible, de ahí que luzcan más hipoxémicos, pero con menor gravedad de los puntajes de trabajo respiratorio.
La respuesta clínica observada en los signos vitales es similar a la reportada por otros grupos22,38. Sin embargo, los parámetros basales de oxigenación son mucho más bajos comparados con otras series realizadas a menores alturas, lo que hace suponer que, para pacientes en grandes alturas, los puntos de corte de anormalidad deben ser diferentes en términos de riesgo o de la respuesta al uso de las CNAF. Esto deberá ser estudiado y confirmado de forma comparativa con centros ubicados en distintas alturas.
Se evaluó el indicé ROX para probar su capacidad predictiva de respuesta clínica y se encontró que los puntos de corte del estudio original32 no se ajustan a esta cohorte ya que se trata de una población pediátrica con frecuencias respiratorias más altas y por ser una cohorte de altura donde las SpO2/FiO2 en pacientes críticos tienden a ser mucho menores. Sin embargo, sí se observa que el valor cambia con la respuesta clínica por lo que consideramos, que se han de realizar estudios adicionales que puedan dar validez en pediatría y en altura.
En cuanto al nivel de flujo utilizado en soporte, se correlaciona con lo reportado por otros grupos entre 1 y 2ml/kg/min. Recientemente, al menos en lactantes, parece ser claro el flujo a utilizar teniendo en cuenta dos estudios realizados: uno fisiológico42 que busca la respuesta en el trabajo respiratorio en niños menores de 3 años y en el que se encontró que flujos entre 1,5 y 2ml/kg/min producen el mejor efecto sobre el esfuerzo respiratorio determinado por RPR (pressure x rate product) y otro estudio aleatorizado que mostró que no hay diferencias en el grupo que uso flujos de 3ml/kg/min vs. 2ml/kg/min en pacientes con bronquiolitis17.
En la población pediátrica demostrar de forma objetiva la mejoría del bienestar no se haya aún estandarizado en especial en pacientes preverbales que son los principales usuarios, sin embargo, usando escalas como la Comfort modificada, se ha observado mejorías en los puntajes43. En este estudio se encontró que un gran porcentaje de pacientes podía comunicarse, hablar o llorar lo que creemos apoya la hipótesis que los sistemas de CNAF dan mayor bienestar a los pacientes tal como se ha descrito en estudios en adultos44,45. En cuanto a la alimentación muchos continuaron por boca o por sonda en caso de fatiga, que fue un poco mayor al final del seguimiento, pero logrando garantizar una alimentación enteral durante toda la terapia sin eventos adversos reportados. Estos hallazgos son similares a los encontrados en otro estudio, en pacientes con bronquiolitis, que ha estudiado este aspecto de las cánulas y encontraron que se presenta una baja incidencia de efectos adversos (en su mayoría de emesis), sin tener relación con la intensidad del soporte, sino más con la enfermedad, y su aparición predice estancias más prolongadas46.
En la búsqueda de predictores de fracaso solo se evidenció el hospital y la frecuencia respiratoria inicial como predictores independientes. La frecuencia respiratoria inicial es un parámetro reconocido de riesgo de fallo ventilatorio en pediatría1, sin embargo, el papel del hospital sugiere que algunas variables no medidas, en ocasiones subjetivas, determinaron que el médico tratante declarase un fracaso en la terapia.
La fortaleza de este estudio está en ser la primera cohorte de gran tamaño en pediatría que analiza la respuesta clínica en pacientes que son manejados en una ciudad a gran altitud. Su naturaleza multicéntrica y los múltiples diagnósticos respiratorios refuerzan sus hallazgos. Su debilidad está en no disponer de cohortes comparativas a otras altitudes para comparar los resultados y la gran heterogeneidad de enfermedades y edades analizadas en conjunto.
En conclusión, el uso de CNAF en este estudio a grandes altitudes tuvo un comportamiento clínico diferente a lo reportado en estudios a menor altitud: son pacientes con requerimientos de FIO2 mucho mayores y que presentaron mejoría significativa de la oxigenación tras el uso de las CNAF; el compromiso ventilatorio fue menor que lo reportado en estudios a menor altitud lo que debe ser confirmado en otras cohortes que se realicen en diferentes altitudes para tratar de determinar si existe sobreuso y sus respectivos sobrecostos. Los factores asociados a fracaso fueron la frecuencia respiratoria alta inicial y el centro lo que sugiere un componente subjetivo no bien definido en la decisión de escalar a ventilación invasiva. Se requieren más estudios comparativos que permitan definir criterios claros de fracaso y elaborar guías dirigidas a población pediátrica que habite en ciudades ubicadas en gran altitud.
FinanciaciónLa presente investigación ha sido financiada con recursos económicos y personales propios de los autores de la Fundación Universitaria de Ciencias de la Salud, Universidad Nacional de Colombia, Hospital de San José y Clínica infantil Colsubsidio.
Autoría/colaboradoresTodos los autores han contribuido al proyecto para ser incluidos como autores, en particular:
- 1)
La concepción y el diseño del estudio, o la adquisición de datos, o el análisis y la interpretación de los datos.
- 2)
El borrador del artículo o la revisión crítica del contenido intelectual.
- 3)
La aprobación definitiva de la versión que se presenta.
Los autores declaran no tener ningún conflicto de intereses.
A todo el personal del Servicio de Terapia Respiratoria del Hospital de San José y la Clínica Infantil de Colsubsidio que colaboraron en la recolección y diligenciamiento de las fichas.



![Seguimiento de los pacientes en cánula nasal de alto flujo, relación con tiempo. Comparación en relación a fracaso de la terapia. Gráfica que muestra el comportamiento promedio y varianza para cada variable fisiológica por subgrupos de éxito y fracaso total durante las primeras 24 horas de seguimiento. Comparada la variable con el tiempo, el fracaso y la interaccion entre tiempo y fracaso mediante modelos lineales mixtos con efecto aleatorizado (individuo). Se considera de significación estadística una p<0,005, se marca en la figura con [*] las diferencias en categoría fracaso; [#] las difencias en el tiempo; [$] diferencias en la interación. A) Muestra la relación de la fracción inspirada de oxígeno (FiO2). B) Relación de saturación por pulsoximetría (SpO2) y FiO2 (SpO2/FiO2). C) Relación de la frecuencia cárdica (FC). D) Relación de la frecuencia respiratoria (FR). E) Relación de índice ROX (relación entre SpO2/FiO2 sobre FR). F) M-WCAS: Escala Wood de asma clínica modificada. Seguimiento de los pacientes en cánula nasal de alto flujo, relación con tiempo. Comparación en relación a fracaso de la terapia. Gráfica que muestra el comportamiento promedio y varianza para cada variable fisiológica por subgrupos de éxito y fracaso total durante las primeras 24 horas de seguimiento. Comparada la variable con el tiempo, el fracaso y la interaccion entre tiempo y fracaso mediante modelos lineales mixtos con efecto aleatorizado (individuo). Se considera de significación estadística una p<0,005, se marca en la figura con [*] las diferencias en categoría fracaso; [#] las difencias en el tiempo; [$] diferencias en la interación. A) Muestra la relación de la fracción inspirada de oxígeno (FiO2). B) Relación de saturación por pulsoximetría (SpO2) y FiO2 (SpO2/FiO2). C) Relación de la frecuencia cárdica (FC). D) Relación de la frecuencia respiratoria (FR). E) Relación de índice ROX (relación entre SpO2/FiO2 sobre FR). F) M-WCAS: Escala Wood de asma clínica modificada.](https://static.elsevier.es/multimedia/02105691/0000004500000004/v1_202104150922/S0210569119302633/v1_202104150922/es/main.assets/thumbnail/gr2.jpeg?xkr=1dZuESKpnCAWr3yCSGZ24A==)