La hipertensión intracraneal (HIC) influye negativamente en el pronóstico del traumatismo craneoencefálico grave (TCEG). En un 10-15% de los casos la HIC no responde a la terapéutica convencional, considerándose «refractaria» y asociada a una elevada mortalidad1,2. La HIC refractaria carece de terapia validada1. Las opciones incluyen: barbitúricos, hipotermia, hiperventilación profunda o craniectomía descompresiva (CD), ninguna de las cuales ha probado ser eficaz de manera concluyente1,2.
¿Por qué efectuar entonces una CD?
La CD incrementa la capacidad de la cavidad craneal para tolerar aumentos de volumen del parénquima cerebral proporcionales al tamaño de la CD3,4. Según el momento de realización se reconocen 2 tipos: «primaria», durante la evacuación, habitualmente, de un hematoma subdural agudo asociado a hinchazón cerebral; y «secundaria», cuando las medidas tradicionales para el control de la HIC han fallado, pudiendo ser bifrontales o frontotemporoparietooccipitales, uni o bilaterales1,3,4. La CD se considera beneficiosa en el infarto maligno de la arteria cerebral media, mientras que en el TCEG su utilidad es controvertida1,3,4, aunque desciende la presión intracraneal (PIC) e incrementa la presión de perfusión cerebral, el flujo sanguíneo cerebral y la oxigenación cerebral, además de disminuir el esfuerzo terapéutico necesario para controlar la HIC1,3,4.
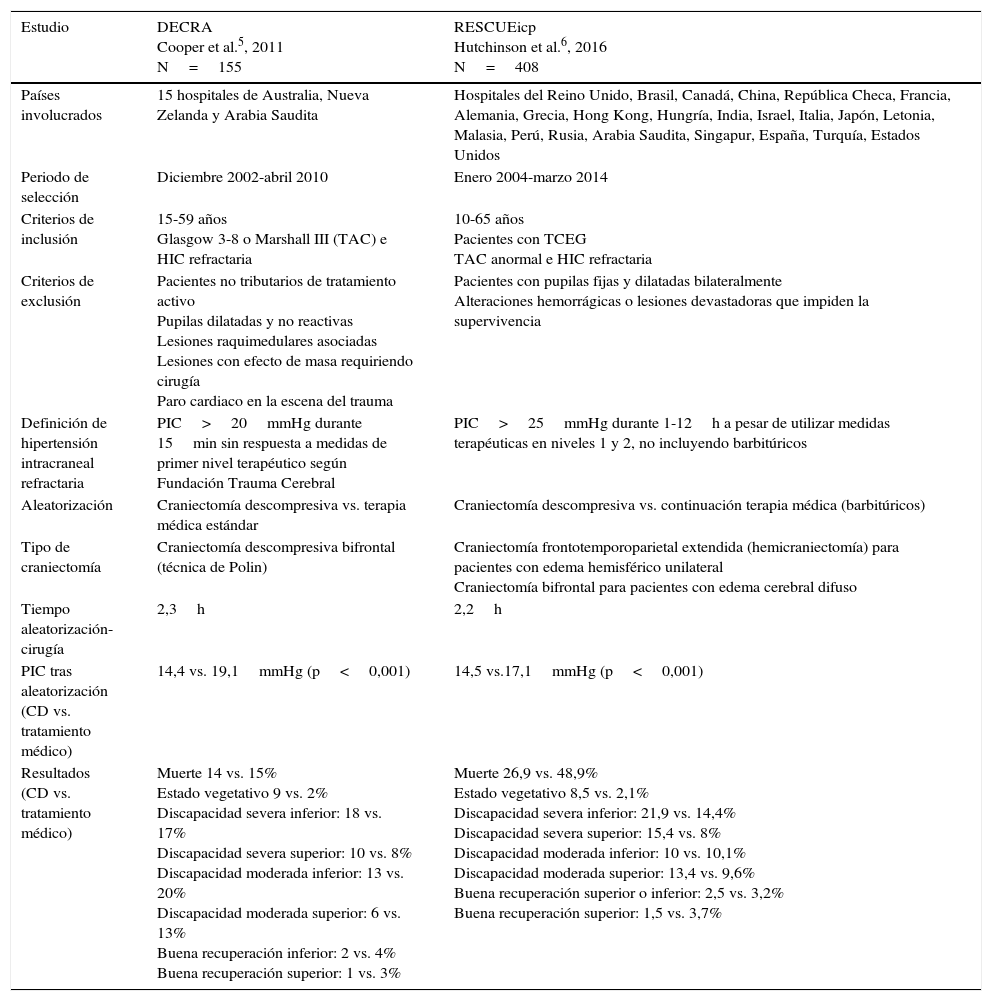
Cochrane no avala la realización rutinaria para disminuir la probabilidad de malos resultados en adultos con TCEG grave e HIC refractaria7. Un metaanálisis posterior evidenció que el 47% de los pacientes tratados con CD alcanzaron resultados favorables a los 6 meses del evento8. Recientemente, 2 estudios –DECRA5 y RESCUEicp6, prospectivos, aleatorizados y controlados, han intentado mejorar la evidencia científica disponible. En la tabla 1 se describen las características de ambos estudios.
Características principales de los estudios analizados
| Estudio | DECRA Cooper et al.5, 2011 N=155 | RESCUEicp Hutchinson et al.6, 2016 N=408 |
|---|---|---|
| Países involucrados | 15 hospitales de Australia, Nueva Zelanda y Arabia Saudita | Hospitales del Reino Unido, Brasil, Canadá, China, República Checa, Francia, Alemania, Grecia, Hong Kong, Hungría, India, Israel, Italia, Japón, Letonia, Malasia, Perú, Rusia, Arabia Saudita, Singapur, España, Turquía, Estados Unidos |
| Periodo de selección | Diciembre 2002-abril 2010 | Enero 2004-marzo 2014 |
| Criterios de inclusión | 15-59 años Glasgow 3-8 o Marshall III (TAC) e HIC refractaria | 10-65 años Pacientes con TCEG TAC anormal e HIC refractaria |
| Criterios de exclusión | Pacientes no tributarios de tratamiento activo Pupilas dilatadas y no reactivas Lesiones raquimedulares asociadas Lesiones con efecto de masa requiriendo cirugía Paro cardiaco en la escena del trauma | Pacientes con pupilas fijas y dilatadas bilateralmente Alteraciones hemorrágicas o lesiones devastadoras que impiden la supervivencia |
| Definición de hipertensión intracraneal refractaria | PIC>20mmHg durante 15min sin respuesta a medidas de primer nivel terapéutico según Fundación Trauma Cerebral | PIC>25mmHg durante 1-12h a pesar de utilizar medidas terapéuticas en niveles 1 y 2, no incluyendo barbitúricos |
| Aleatorización | Craniectomía descompresiva vs. terapia médica estándar | Craniectomía descompresiva vs. continuación terapia médica (barbitúricos) |
| Tipo de craniectomía | Craniectomía descompresiva bifrontal (técnica de Polin) | Craniectomía frontotemporoparietal extendida (hemicraniectomía) para pacientes con edema hemisférico unilateral Craniectomía bifrontal para pacientes con edema cerebral difuso |
| Tiempo aleatorización-cirugía | 2,3h | 2,2h |
| PIC tras aleatorización (CD vs. tratamiento médico) | 14,4 vs. 19,1mmHg (p<0,001) | 14,5 vs.17,1mmHg (p<0,001) |
| Resultados (CD vs. tratamiento médico) | Muerte 14 vs. 15% Estado vegetativo 9 vs. 2% Discapacidad severa inferior: 18 vs. 17% Discapacidad severa superior: 10 vs. 8% Discapacidad moderada inferior: 13 vs. 20% Discapacidad moderada superior: 6 vs. 13% Buena recuperación inferior: 2 vs. 4% Buena recuperación superior: 1 vs. 3% | Muerte 26,9 vs. 48,9% Estado vegetativo 8,5 vs. 2,1% Discapacidad severa inferior: 21,9 vs. 14,4% Discapacidad severa superior: 15,4 vs. 8% Discapacidad moderada inferior: 10 vs. 10,1% Discapacidad moderada superior: 13,4 vs. 9,6% Buena recuperación superior o inferior: 2,5 vs. 3,2% Buena recuperación superior: 1,5 vs. 3,7% |
DECRA evaluó la eficacia de la CD frente a la terapia médica optimizada. Aunque la CD controló la HIC y disminuyó los días de ventilación mecánica y de UCI, no mejoró los resultados5. Sin embargo, este estudio reafirmó la capacidad de la CD para controlar la HIC y disminuir el esfuerzo terapéutico, reflejado en una menor estancia en ventilación mecánica y UCI. Como sombras exponemos que DECRA precisó 8 años para incluir 155 pacientes en 15 centros. La tasa de selección (4,5%) restringe el estudio a una subpoblación seleccionada. Su tamaño poblacional es insuficiente, pues, para detectar una diferencia del 10% entre grupos; hubiera sido necesario analizar 321 pacientes, aleatorizados 1:19. Aunque las características basales de ambos grupos estaban bien balanceadas, la presencia de pupilas arreactivas bilaterales fue mayor en el grupo de CD (27 vs. 12%). Esto es importante, ya que tras ajustar esta variable, no se objetivaron diferencias significativas en los resultados a los 6 meses del trauma. Otra consideración es la definición de HIC (PIC>20mmHg durante más de 15min), ya que la mayoría de los intensivistas o neurocirujanos no consideran efectuar una CD en tal situación. La técnica empleada fue incompleta. Al no seccionarse la hoz del cerebro no se consigue la amplitud necesaria para permitir una expansión cerebral anterior. Por último, la evaluación de los resultados mediante la utilización del GOS-E dicotomizado es controvertida, y según Murray et al., debería tener en cuenta las condiciones clínicas del individuo previas a la aleatorización10.
RESCUEicp evaluó la CD secundaria frente a tratamiento médico continuado con barbitúricos en pacientes con TCEG e HIC refractaria a medidas terapéuticas de niveles i y ii6. A los 6 meses del TCEG la mortalidad fue inferior en el grupo CD, a expensas de mayores tasas de estado vegetativo y discapacidad grave, mientras que el porcentaje de discapacidad moderada y buena recuperación fueron similares en ambos grupos6. El tamaño muestral fue adecuado y las poblaciones, bien balanceadas. El intervalo medio de tiempo entre aleatorización y cirugía fue correcto. Se definió HIC cuando la PIC fue superior a 25mmHg, a pesar de medidas de primer y segundo nivel, durante una a 12h. La PIC fue mejor controlada y la HIC de más corta duración en el grupo de CD (p<0,001).
Como objeciones, presenta una tasa de inclusión del 20,36%, tras 10 años de selección. Hay una ausencia de datos de PIC previos a la aleatorización. La terapéutica médica se instauró «a discreción del equipo médico tratante», de forma heterogénea, sin un protocolo uniforme. No se aportan datos del nivel de intensidad terapéutica previo a la aleatorización y el protocolo terapéutico fue modificado durante el ensayo clínico. Algunas cuestiones, no suficientemente clarificadas, pueden haber confundido los resultados; por citar un ejemplo, el manejo de la presión de perfusión cerebral. En el protocolo se recomienda mantener cifras de presión de perfusión cerebral>60mmHg en contra de las guías vigentes. El 63% de los pacientes fueron sometidos a descompresión bifrontal, sin embargo, los resultados finales no están discriminados de acuerdo con la técnica empleada. La CD bifrontal tiene implicaciones diferentes a la CD hemisférica desde el punto de vista mecánico en el tejido cerebral. Por otro lado, el 37% de los individuos del grupo médico fueron entrecruzados al grupo CD. No se aclara ni cuándo, ni el motivo ni la técnica empleada.
Se utilizó el GOS-E dicotomizado para la evaluación de los resultados. A pesar de lo complejo del análisis estadístico, si observamos la del estudio RESCUEicp, al discriminarse el GOS-E a los 12 meses en el grupo de favorables de manera tradicional, en los pacientes incluidos en las categorías «moderada discapacidad superior e inferior» y «buena recuperación superior e inferior» se aprecia una clara tendencia del grupo quirúrgico (32 vs. 28,5%) a obtener mejores resultados.
Estos estudios muestran que la CD controla la HIC, sin beneficio sobre los resultados finales. El TCEG es una entidad dinámica y heterogénea, donde el control de la PIC es importante pero no suficiente para mejorar los resultados. Las conclusiones de estos estudios no son aplicables a la CD primaria o hemicraniectomía, procedimientos efectuados frecuentemente en países con un gran número de TCEG y recursos limitados de neuromonitorización. Quedan pendientes interrogantes y controversias. Actualmente, está en curso el Rescue-ASDH trial4, que investiga la efectividad de la CD primaria en pacientes con hematoma subdural agudo. Teniendo en cuenta la evidencia disponible, la CD bifrontal secundaria no debe considerarse un tratamiento útil en la HIC refractaria. Con respecto a la CD hemisférica uni o bilateral, no hay datos concluyentes, pero, a nuestro juicio, podría considerarse una opción en casos seleccionados (lesiones difusas tipo iii o iv).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.