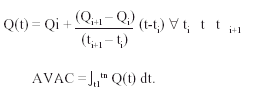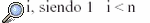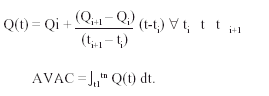INTRODUCCIÓN
Los recursos que pueden dedicarse a la asistencia sanitaria son necesariamente limitados. Este hecho plantea diferentes problemas éticos que afectan a la planificación de la distribución y del tipo de servicios sanitarios, así como a su gestión eficiente1,2. Las unidades de cuidados intensivos son las áreas de hospitalización que resultan más consumidoras de recursos. Una estancia en UCI es unas 6,2 veces monetariamente más cara que una estancia en las áreas de hospitalización convencional3. A dichos costes hay que añadir los de oportunidad, y el concepto coste-oportunidad es fácil de comprender para los intensivistas. Cada vez que ingresamos o rechazamos a un paciente lo hacemos tratando de obtener la mayor eficiencia de los recursos estructurales puestos bajo nuestra responsabilidad. Simplificando, dichos recursos serían las camas de las que disponemos en cada momento. Al coste del tratamiento de cada paciente que ingresamos hay que añadir el coste de las consecuencias de no haber ingresado a otro paciente. La efectividad de las UCI ha sido medida tradicionalmente en forma de índices de mortalidad o supervivencia. Sin embargo, teniendo en cuenta la limitación de los recursos que se puede destinar a la asistencia sanitaria, la efectividad de una opción terapéutica tan costosa debería medirse con mayor rigor. Aplicando la metodología de análisis del coste-efectividad se ha tratado de comparar diferentes opciones asistenciales midiendo la efectividad como la ganancia de años de vida ajustados por calidad de vida (AVAC o QALY), asociada a cada una de ellas y relacionándola con los diferentes costes de cada alternativa4,5.
El análisis que hemos realizado tiene un diseño longitudinal, que consiste básicamente en el seguimiento prospectivo de una cohorte de pacientes y está desarrollado desde una perspectiva social. El objetivo principal es valorar el coste adicional de cada AVAC conseguido mediante el empleo de la ventilación mecánica prolongada, administrada a través de tubo endotraqueal y asociada con el resto de medidas características del tratamiento intensivo y de soporte vital de pacientes en situación crítica.
MÉTODOS
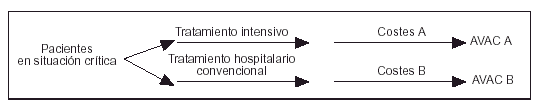
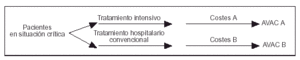
La metodología seguida en este análisis de coste- efectividad está basada en los principios que desarrolló A. Williams4 y en las recomendaciones publicadas por el U.S Panel on Cost Effectiveness in Health and Medicine5. Hemos utilizado un modelo de decisión en árbol de Markov, buscando evaluar las dos estrategias básicas de tratamiento en la cohorte de pacientes estudiada (ramas A y B; fig. 1)6. La rama A incluye el tratamiento con ingreso en la UCI y los datos fueron obtenidos mediante el seguimiento prospectivo de la evolución real de los pacientes. Dicha información incluía los costes medidos en euros y la utilidad medida en AVAC. La rama B es virtual e incluiría el tratamiento hospitalario de los mismos pacientes pero sin ingreso en la UCI. La supuesta evolución (supervivencia o fallecimiento) de los pacientes en esta rama se obtuvo en función de las tasas de mortalidad que se deducían de la opinión de cinco expertos. Dichos expertos fueron consultados sobre cuál habría sido a su juicio la evolución final de cada paciente en el caso de que no hubiese sido ingresado en la UCI. Los expertos dieron su opinión a la vista de los siguientes datos de cada paciente: edad, sexo, anamnesis, exploración física, exploraciones complementarias, diagnósticos médicos (principal y secundarios), APACHE II y MPM IIo. En los análisis de coste-efectividad se recomienda el método basado en la opinión de expertos para valorar opciones terapéuticas no habituales o no admitidas social o éticamente5.
Figura 1. Diagrama de decisión de Markov aplicado en el estudio.
El valor de la razón coste-efectividad marginal (RCEM) se determinó mediante la siguiente fórmula, donde Costes A: costes de la opción A (tratamiento intensivo); Costes B: costes de la opción B (tratamiento hospitalario convencional); AVAC A: años de vida ajustados a la calidad producidos mediante la opción A; AVAC B: años de vida ajustados a la calidad producidos mediante la opción B:
Pacientes
Se incluyó a todos los pacientes que entre el 1 de junio de 1996 y el 31 de mayo de 1998 fueron ingresados en la Unidad de Cuidados Intensivos del Hospital Severo Ochoa y que durante más de 72 h consecutivas necesitaron: a) ventilación mecánica a través de tubo endotraqueal; b) FiO2 igual o superior a 0,40, y c) PEEP igual o superior a 5 cmH2O. Los pacientes incluidos podían proceder del servicio de urgencias, de otras unidades de hospitalización, de quirófano o bien venir de otros hospitales. La evolución de los pacientes que sobrevivieron al episodio de hospitalización inicial fue seguida durante 4 años. Se registraron los valores de las variables que se muestran en la tabla 1.
Costes
Rama A. Se determinó el coste del episodio de hospitalización que dio lugar a la inclusión de cada paciente en el estudio. Para ello se utilizó el sistema de contabilidad analítica y asignación de GRD con que cuenta el Hospital Severo Ochoa7. El citado sistema de contabilidad analítica es de tipo full costing y recibió la denominación genérica de SIGNO inicialmente y, en una versión posterior más avanzada, GECLIF. El agrupador de GRD utilizado fue el denominado All Patient DRG 14.11 3M®. Además se determinaron los costes de la asistencia sanitaria que necesitaron los supervivientes durante los cuatro años de seguimiento. En estos costes se incluyeron los costes de rehabilitación, consultas externas de especialistas, visitas a servicios de urgencia, reingresos hospitalarios (con o sin ingreso en UCI), atención primaria, así como los de farmacia y material sanitario. Salvo los costes de farmacia y material sanitario, el resto de los costes de la atención sanitaria realizada durante los cuatro años de seguimiento fue facilitado por los servicios de control de gestión y admisión del hospital8. La dirección del área de atención primaria nos facilitó sus costes de personal desagregados por consulta médica programada, a demanda o de enfermería. Las consultas efectuadas, así como los costes de farmacia y material sanitario, fueron obtenidos revisando las historias clínicas de atención primaria de los pacientes supervivientes. En ellas aparece el tratamiento farmacológico y el material sanitario prescritos a cada paciente, con las fechas de inicio y suspensión. Consultando el Vademecum Internacional y los correspondientes catálogos de material sanitario se valoraron los costes en cada caso9. Por último, se calcularon los costes futuros de la atención sanitaria a cada superviviente tras el período de seguimiento de cuatro años, asumiendo que los costes del último año de seguimiento se prolongarían durante todos los años de esperanza de vida del paciente.
Rama B. Los costes del episodio de hospitalización inicial se determinaron mediante GRD 7. Los restantes costes de atención sanitaria a los supervivientes se determinaron considerándolos como una fracción relacionada con la tasa de mortalidad.
Todos los costes fueron calculados inicialmente en pesetas constantes de 1996. Posteriormente se expresaron en euros al cambio 166,386 pesetas por euro.
Utilidad
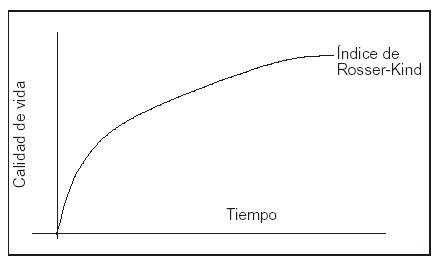
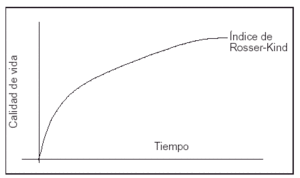
El cálculo de los AVAC obtenidos en cada rama del análisis se basó en la expectativa de vida y en la calidad de vida de los supervivientes. La expectativa de vida se dedujo, una vez finalizado el seguimiento, de los datos del Instituto Nacional de Estadística para población española de iguales edad y sexo10. Los datos de calidad de vida fueron obtenidos directamente mediante la escala de Rosser11-13. Los AVAC se obtuvieron calculando la superficie comprendida entre la función índice de Rosser y el eje temporal (fig. 2). La aproximación de la función índice de Rosser se realizó a partir de las medidas de muestreo obtenidas durante el período de seguimiento por medio de la interpolación lineal entre cada par consecutivo de muestras disponibles. Para el período [t1...tn] se han obtenido los valores de índice de Rosser [Q1...Qn].
Figura 2. Los AVAC se calcularon midiendo la superficie comprendida entre la función Índice de Rosser-Kind y el eje de abscisas (tiempo).
se define
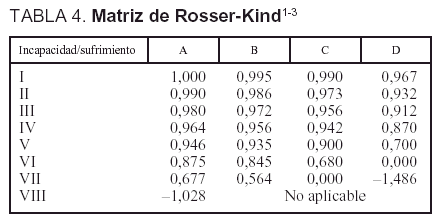
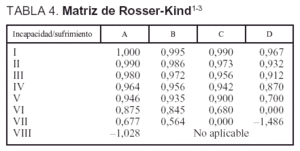
Los instrumentos utilizados para medir la calidad de vida y determinar el índice de Rosser fueron: a) el cuestionario que aparece en la tabla 2; b) la escala de Rosser (tabla 3), y c) la matriz de Rosser-Kind (tabla 4).
Para estimar los costes y AVAC futuros se aplicó un descuento anual del 3%.
Análisis de sensibilidad
Para verificar la consistencia de los resultados aplicamos un análisis de sensibilidad utilizando la tasa de mortalidad definida por cada uno de los cinco expertos para la rama B del análisis.
Metodología completa
Los autores ponen a disposición de aquellos lectores interesados una descripción detallada de la metodología empleada en este análisis de coste-efectividad.
RESULTADOS
Los datos se expresan en media y desviación estándar (DE).
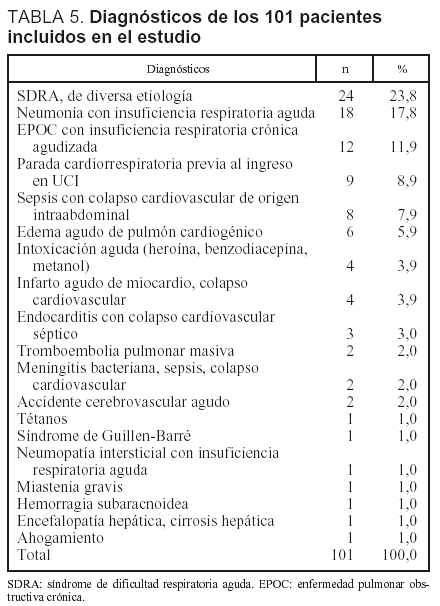
Pacientes. Se incluyó a 101 pacientes que reunían los criterios de selección especificados (67,3% varones y 32,7% mujeres). La edad media era de 57,5 años (DE ± 17 años). La gravedad medida mediante el APACHE II fue de 23,8 puntos (7,9). La probabilidad de muerte durante el período de hospitalización, medida mediante el MPM Io.· fue del 53%. La calidad de vida previa, de 0,9520 (0,0897). Los pacientes necesitaron ventilación mecánica durante una media de 16,1 días (intervalo, 3-155). Durante la hospitalización fallecieron 52 pacientes (51,5%). El promedio de estancia en la UCI fue de 21,3 días (3-155) y el de estancia en el hospital, de 60,2 días (3-524). Los diagnósticos se muestran en la tabla 5.
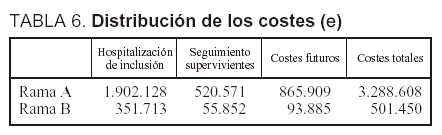
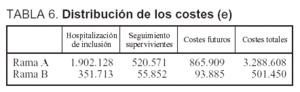
Costes. Los costes totales ascendieron a 3.288.608 A. El promedio por paciente fue de 32.560 (30.777). La distribución de dichos costes se muestra en la tabla 6. Los costes totales de la rama B del análisis ascendieron a 501.450 A.
Efectividad (utilidad)
Rama A. De los 49 pacientes que fueron dados de alta del hospital con vida, 13 fallecieron durante el seguimiento. De ellos, 4 fallecieron durante el primer año, 3 durante el segundo, 4 durante el tercero y 2 durante el cuarto año de seguimiento. La supervivencia verificada fue de 166,2 años y la supervivencia estimada de 964,5 años, por lo que la supervivencia total ascendió a 1.130,7 años. En el momento del alta del hospital los 49 pacientes presentaban un índice de Rosser-Kind promedio de 0,6095 (0,5348). Al mes dicho valor ascendía a 0,6909 (0,5380). Tres meses después del alta el promedio de calidad de vida era de 0,7510 (0,5997). A los seis meses habían fallecido dos de los 49 pacientes y los restantes presentaban un promedio de calidad de vida de 0,8455 (0,4269). Nueve meses después del alta del hospital seguían sobreviviendo 47 pacientes con un índice de Rosser-Kind de 0,7825 (0,5919). Al año del alta habían fallecido otros 2 pacientes y los 45 restantes tenían como promedio de calidad de vida un índice de 0,8901 (0,3235). En el control efectuado dos años después del alta, se comprobó el fallecimiento de tres pacientes más. La calidad de vida de los 42 supervivientes era de 0,8971 (0,3334). Tres años después del alta habían fallecido otros 4 pacientes más. A los 38 supervivientes pudo administrárseles el cuestionario para evaluar su calidad de vida. Dichos pacientes presentaban en ese momento un promedio de calidad de vida de 0,8997 (0,3365). Por último, a los 4 años del alta habían fallecido otros 2 pacientes más y, de los 36 supervivientes, pudo evaluarse la calidad de vida de 28. Estos pacientes tenían un promedio de índice de Rosser-Kind de 0,9944 (0,0088). Durante el seguimiento efectivo del grupo de supervivientes se obtuvieron 143,8 AVAC. Aplicando un 3% de descuento anual a los valores de calidad de vida obtenidos en el último control efectuado, se obtendrían a partir de dicho momento otros 515,8 AVAC. Por tanto, la utilidad total de la rama A del presente estudio asciende a 659,6 AVAC.
Rama B. La tasa de mortalidad promedio asignada fue de 89,2%, lo que significa que habrían sobrevivido 10,9 pacientes (7,3 hombres y 3,6 mujeres). La esperanza de vida de los varones supervivientes sería de 21,4 años y la de las mujeres 30,7 años. Presumiendo una mortalidad durante los primeros 4 años tras el alta hospitalaria idéntica a la del grupo tratado en UCI (rama A), se obtienen 122,9 años de supervivencia para los hombres y 99,4 años para las mujeres. El total de supervivencia sería por tanto de 222,3 años. Se presume un valor promedio de calidad de vida idéntico al de los pacientes supervivientes de la rama A. Los AVAC que se habrían obtenido serían 43,8 durante el período de seguimiento y 113,8 adicionales en el futuro. La utilidad total en la rama B asciende por lo tanto a 157,6 AVAC.
Coste-efectividad marginal (rama A/rama B)
Cada AVAC adicionalmente conseguido mediante el tratamiento intensivo de los pacientes supone un coste marginal de 5.552 A. Según el análisis de sensibilidad realizado modificando las tasas de mortalidad asignada a la rama B del estudio, el coste marginal de cada AVAC oscilaría entre 9.463 A, si la mortalidad fuese del 75%, y 4.526 A, si fuese del 97%.
DISCUSIÓN
La idea inicial tras la obtención de los resultados anteriormente mencionados fue tratar de conocer hasta qué punto nuestra cohorte de pacientes era representativa de los enfermos más característicos de la medicina intensiva. Para ello hicimos varias comparaciones. Primeramente comparamos las características generales de los 101 pacientes incluidos en nuestro estudio con las de 13.152 pacientes tratados en cuidados intensivos en 11 países, incluida España14. El promedio de edad de nuestros pacientes es similar [57,5 (17,0) años] al de la base de datos internacional [57,2 (18,5) años]. También la distribución por sexo es muy similar (67,3% varones y 32,7% mujeres frente a 59,6% varones y 40,4% mujeres). En comparación con la serie en la que Knaus et al basaron el APACHE II15, un grupo de 5.815 pacientes ingresados en UCI con una puntuación de gravedad media de 13,8 puntos y una mortalidad del 12%, nuestros pacientes estaban más graves (23,8 puntos) y tuvieron una mortalidad más elevada (51,5%). Abizanda16 describe que 645 pacientes ingresados consecutivamente en una UCI tenían una puntuación APACHE II de 15,7. Brown y Sullivan17, en 265 pacientes ingresados en UCI hallan un APACHE II de 18,6. En nuestro país y más recientemente, Bravo Pérez18 recoge a un grupo de 711 pacientes politraumatizados ingresados en UCI. La puntuación promedio de gravedad de los citados pacientes resultó de 47,8 puntos SAPS II19 que equivaldrían a 17,3 puntos APACHE II20. Respecto al pronóstico, el MPM IIo de los 101 pacientes del estudio era de 0,53, lo que supone una mortalidad previsible del 53%. La mortalidad hospitalaria que tuvo realmente el grupo de pacientes estudiado fue del 51,1%. El trabajo en el que Lemeshow et al describen el MPM II21 se basa en una cohorte de 19.124 pacientes tratados en 137 UCI de 12 países. La cohorte no incluía a pacientes menores de 18 años, grandes quemados, diagnosticados de cardiopatía isquémica ni postoperados de cirugía cardíaca. El MPM IIo fue de 0,22 y la mortalidad observada del 20,8%. Por otra parte, Rapoport et al22 encuentran en una base de datos de 4.090 pacientes tratados en unidades de cuidados intensivos de 27 hospitales distintos un MPM IIo promedio de 0,21. En España, Rué et al23 en un estudio en el que incluyeron a 1.263 pacientes atendidos en las UCI de 17 hospitales encontraron un MPM IIo promedio de 0,24 y una mortalidad observada del 27%.
Los diagnósticos de los pacientes pueden ser considerados típicos de una casuística como la estudiada, en la que el elemento común es la presencia de insuficiencia respiratoria grave24. El diagnóstico más frecuente fue el síndrome de disnea (23,8%). Dicho diagnóstico junto a los de neumonía (17,8%) y enfermedad pulmonar obstructiva crónica (11,9%) sumaban un total de 54 casos. En comparación con otras series publicadas14, la nuestra llama la atención por la ausencia de pacientes politraumatizados. Dicha ausencia no es completa porque dos de los pacientes diagnosticados de síndrome de disnea aguda eran en realidad pacientes politraumatizados que habían presentado dicha complicación. No obstante la presencia de politraumatizados continúa siendo muy baja en nuestra serie. El Hospital Severo Ochoa no cuenta con servicio de neurocirugía y además se encuentra muy próximo a un importante centro traumatológico (el Hospital 12 de Octubre). Por dichos motivos la mayoría de los pacientes politraumatizados es derivada directamente a ese centro.
De las anteriores comparaciones deducimos que, salvo en la escasa presencia de politraumatizados, el grupo de pacientes estudiados puede ser considerado típico de UCI en cuanto a edad y sexo, de mayor gravedad y de peor pronóstico sin duda a causa de los criterios de inclusión utilizados. Dichos criterios nos han permitido seleccionar a pacientes muy graves y con mal pronóstico que requirieron un tratamiento intensivo prolongado y presentaron una elevada mortalidad. Podríamos suponer que los pacientes incluidos en nuestro análisis son representativos de aquellos cuyo tratamiento constituye el núcleo principal y paradigmático de la actividad de la medicina intensiva.
Aunque no existen demasiados estudios de costes relativos a las UCI, se sabe que los cuidados intensivos consumen entre el 15 y el 20% de los costes hospitalarios en los Estados Unidos25,26. En España se han realizado diferentes estimaciones sobre el coste que representa la atención en unidades de cuidados intensivos27-29. Los resultados de dichas estimaciones oscilan entre el 2,4 y el 4% del gasto sanitario, y en el 8,5% del gasto hospitalario. Según otras estimaciones, en España los costes de los cuidados intensivos suponen entre el 5 y el 6% de los costes hospitalarios3. En Europa los costes en cuidados intensivos en relación con el gasto sanitario total alcanzan el 2,5% en Holanda30 y el 1% en el Reino Unido31, donde la proporción del coste de los cuidados intensivos sobre el coste hospitalario alcanza un 3%32. En Canadá los costes del tratamiento en cuidados intensivos son entre 6 y 7 veces más elevados que en las salas generales33.
Durante 1996 la UCI del Hospital Severo Ochoa atendió a 513 pacientes con un promedio de estancia de 5,6 días. Los costes medios por estancia fueron de unos 1.026 A y los costes medios por paciente, de unos 5.782 A. Los 101 pacientes de nuestro estudio supusieron aproximadamente el 10% del total de los pacientes atendidos y el coste promedio de su tratamiento ascendió a unos 9.000 A (excluidos los costes incurridos por su atención fuera de la UCI: planta, quirófanos, urgencias, etc.). De los anteriores datos se deduce que el paciente promedio del grupo seleccionado para el presente estudio fue un 56% más caro de tratar. Se confirma, pues, que además de ser un grupo de pacientes caracterizado por la gravedad y el mal pronóstico, también lo fue por el gran consumo de recursos que requirió su atención en relación con el resto de los pacientes tratados durante el mismo período en la UCI.
Ridley et al34 publicaron en 1994 un análisis de coste-efectividad de la medicina intensiva cuyos objetivos coinciden básicamente con los del nuestro. Según el citado trabajo, la razón coste-efectividad por cada AVAC ganado mediante el tratamiento en cuidados intensivos ascendió a 7.500 libras esterlinas de 1989 (unos 9.000 A de 1996), significativamente superior a nuestros resultados. Los autores calcularon el coste del tratamiento en la UCI y supusieron que era el 40% del coste hospitalario total, método por el cual no es difícil que se produzca una sobrestimación. Por otra parte solamente calculan el coste por AVAC de los pacientes supervivientes al año, y no introducen los costes del tratamiento de los fallecidos. A diferencia de nuestros pacientes, la mayoría de los 90 pacientes estudiados por Ridley, el 36% concretamente, eran enfermos que ingresaban en la UCI exclusivamente para observación postoperatoria, de hecho la gravedad medida mediante el APACHE II de los 90 pacientes era relativamente baja (11,8 puntos frente a 23,8 en nuestro grupo). A pesar de la menor gravedad, la mortalidad al año del alta era del 37,8%, frente al 55,4% de nuestros pacientes. Estos datos parecen indicar que el grupo de pacientes de Ridley era muy heterogéneo, integrado por una mayoría de pacientes de poca gravedad que ingresaban en la UCI sólo para observación y una minoría de pacientes muy graves en los que se producía una elevada mortalidad. El coste-efectividad del tratamiento de ambos subgrupos de pacientes resultaría elevado. El primero por incurrir en altos costes sin necesidad y el segundo por la baja efectividad conseguida.
Kerridge et al35 publicaron en 1995 otro análisis de coste-efectividad de la medicina intensiva que presenta también similitudes con el nuestro. No obstante, tal y como reconocen los autores, tanto la determinación de los costes como el cálculo de los AVAC presentan en dicho análisis limitaciones muy importantes. Sus resultados, referidos a 1985, reflejan unos costes por AVAC que oscilaron entre 297 y 2.323 dólares australianos (entre 140 y 1.100 A), dependiendo de la patología principal de los pacientes. La metodología empleada para la determinación de los costes los podría haber infravalorado significativamente.
El análisis de coste-efectividad más parecido al presente es el que Hamel et al36 publicaron en diciembre de 2000, con un grupo de 963 pacientes que recibieron ventilación mecánica y cuidados intensivos durante al menos 48 h consecutivas. A diferencia de nuestro estudio, utilizaron como rama no intervencionista del análisis un grupo de 42 pacientes con características similares a los de la rama intervencionista, a los cuales no se aplicó ventilación mecánica ni otras medidas especiales de soporte por rechazo debidamente informado, tan sólo tratamiento paliativo. Los 42 pacientes presentaron una mortalidad similar a la predicha por los expertos para la rama B de nuestro trabajo. Los cálculos de la utilidad y de los costes son similares a los que hemos realizado nosotros, salvo en el aspecto de la duración del seguimiento, que en su caso fue solamente de un año. Los pacientes con bajo riesgo de mortalidad (supervivencia prevista > 70% en el plazo de 2 meses) presentaron una razón coste-efectividad de 29.000 dólares por AVAC ganado (unos 30.500 A). Los pacientes de riesgo intermedio (supervivencia entre el 51 y el 70%), una razón coste-efectividad de 44.000 dólares por AVAC ganado (unos 46.300 A). Por último, los pacientes con riesgo alto (supervivencia igual o inferior al 50%), un coste-efectividad de 110.000 dólares por AVAC ganado (unos 116.000 A). Concluyen, coincidiendo con nosotros, que sus resultados contradicen a aquellos que afirman que los cuidados intensivos son prohibitivamente costosos. En las tres cuartas partes de los 963 pacientes tratados el coste-efectividad de la ventilación mecánica y los cuidados intensivos se comparaba favorablemente con el de otras actuaciones terapéuticas comúnmente aceptadas. Sin embargo, reconocen que el tratamiento intensivo de los pacientes con peor pronóstico resulta menos coste-efectivo. Globalmente la razón coste-efectividad hallada por Hamel et al es bastante más cara que la nuestra, lo que se explicaría por los mayores costes de la asistencia sanitaria en los EE.UU.
Es obvio que los resultados de los análisis de coste-efectividad han de relacionarse con los niveles de evidencia existentes sobre cada técnica terapéutica o estrategia de atención a una determinada patología. El uso de ventilación mecánica y tratamiento intensivo en pacientes con insuficiencia respiratoria grave o fallo multiorgánico presenta un nivel de evidencia I en cuanto a su eficacia (US Preventive Services Task Force37). En 1993 el Advisory Group in Health Technology Assessment definió cuatro categorías de técnicas terapéuticas o estrategias de atención en función a su coste-efectividad38. De esa forma los tratamientos con un coste por AVAC inferior a los 5.000 A se situarían en la categoría A; los que tuviesen un coste por AVAC entre 5.000 A y 50.000 A, en la categoría B, y los de coste por AVAC superior a los 50.000 A en la categoría C. Además hay que considerar aquellas técnicas o programas asistenciales que, como las vacunaciones infantiles, ahorran costes. Éstas tendrían siempre el máximo nivel de prioridad. Los tratamientos situados en la categoría A tendrían alta prioridad, los de la categoría B, prioridad intermedia, y los de la categoría C, baja prioridad (eficaces pero caros). Según la anterior clasificación, una sociedad o sistema sanitario debería completar las medidas asistenciales de manera ordenada en función de su prioridad. Por lo tanto en un país en el que la población no tuviese acceso a las medidas de máxima prioridad no deberían desarrollarse prestaciones de prioridad alta o intermedia, como sería el caso de la medicina intensiva.
De nuestros resultados se desprende que, en nuestro medio, la ventilación mecánica y el tratamiento intensivo de pacientes en situación crítica tiene un coste por AVAC ganado de entre 5.552 A y 6.634 A, en función de la tasa de descuento anual aplicada. Dicha razón coste-efectividad situaría a la medicina intensiva entre las opciones terapéuticas de prioridad intermedia, en una posición cercana a la frontera de la alta prioridad.