Al abordar las limitaciones planteadas por Rodríguez et al.1 en su reciente estudio publicado en MEDICINA INTENSIVA se destaca que, debido a las particularidades de la base de datos desarrollada durante la pandemia, no se incluyeron registros sobre aspectos relevantes de la mecánica pulmonar que podrían estar vinculados con los resultados clínicos de los pacientes. Coincidimos con los autores que dichas características de mecánica pulmonar en pacientes sometidos a ventilación mecánica pueden variar significativamente en función de la presencia o ausencia de obesidad2,3.
Ciertamente, la ventilación protectora se fundamenta en la administración de un volumen corriente ajustado al peso corporal ideal (a partir de ahora IBW, del inglés ideal body weight) como parte esencial de su enfoque. Sin embargo, la estimación del IBW presenta desafíos significativos: al origen anglosajón de las fórmulas empleadas, consistentes con una antigua regla que se desarrolló a partir de tablas de altura y peso, existe por ejemplo una falta de consideración de la edad del paciente, lo que puede conducir a inexactitudes al aplicarse en poblaciones distintas a las utilizadas en su formulación4.
Con el objetivo de ofrecer una perspectiva más completa en este sentido y bajo la hipótesis de que en pacientes obesos sometidos a ventilación mecánica los parámetros de carga de energía variarán considerablemente entre individuos, en contraste con pacientes no obesos, y que esta variabilidad estará estrechamente relacionada con el grado de hipoxemia experimentado, presentamos nuestros datos de mecánica pulmonar en pacientes con C-ARDS, categorizados según grado de hipoxemia y obesidad.
Es un estudio de cohortes retrospectivo, observacional y analítico de todos los casos hospitalizados por infección por SARS-CoV-2 con ingreso en la UCI entre marzo de 2020 y marzo de 2022. Los datos se obtuvieron del registro de la cohorte de pacientes COVID-19 de un servicio de medicina intensiva en un hospital de tercer nivel, previa aprobación del Comité de Ética en Investigación local y la obtención (escrita y/o telefónica) del consentimiento informado de los pacientes/representantes legales.
En el período analizado ingresaron un total de 911 pacientes en la UCI con enfermedad por SARS-CoV-2. Después de eliminar los pacientes menores de 18años, aquellos que se encontraban ventilados en modalidad controlada por presión y los que presentaban registros defectuosos o incompletos, el análisis de los datos se efectuó sobre un total de 253 pacientes.
Los pacientes se categorizaron en hipoxémicos severos o no hipoxémicos severos en función del valor de la relación entre la presión arterial de oxígeno y la fracción inspirada de oxígeno (P/F) en el momento de ingreso en la UCI. Valores de P/F <150mmHg fueron catalogados como hipoxémicos severos, y valores ≥150mmHg, como no hipoxémicos severos. En función del índice de masa corporal (IMC), los pacientes fueron categorizados al ingreso en la UCI como paciente obeso si presentaba un IMC ≥30kg/m2 o como no obeso si el IMC era <30kg/m25. Para su análisis, los pacientes se distribuyeron en cuatro grupos: grupo1, pacientes sin hipoxemia severa ni obesidad; grupo2, pacientes con hipoxemia severa sin obesidad; grupo3, pacientes sin hipoxemia severa con obesidad, y grupo4, pacientes con hipoxemia severa y obesidad.
Dentro del cálculo de las variables bioenergéticas se definió mechanical power (MP) según la formula simplificada de Gattinoni, driving power como: VT×f×[(Pplateau −PEEP)/2], y dynamic power como: VT×f×[(Pplateau +PEEP)/2]3,6-8.
Se realizaron comparaciones de porcentajes entre grupos utilizando ANOVA y variables continuas mediante la prueba de Kruskal Wallis. Se utilizó un análisis de regresión logística multivariado para explorar la asociación de las variables con el resultado primario: mortalidad a 28días, para cada factor de riesgo considerado en tres modelos diferentes: modelo MP, modelo driving power y modelo dynamicpower. Para interpretar los resultados en un escenario clínico válido se incluyeron como covariables las características que, mostrando diferencias significativas en el análisis bivariante o tendencia (p<0,2), no evidenciasen problemas de muticolinealidad (valorado con un factor de inflación de la varianza [FIV] menor de3). Los modelos analizados se presentan como odds ratio (OR) con su intervalo de confianza del 95% (IC95%).
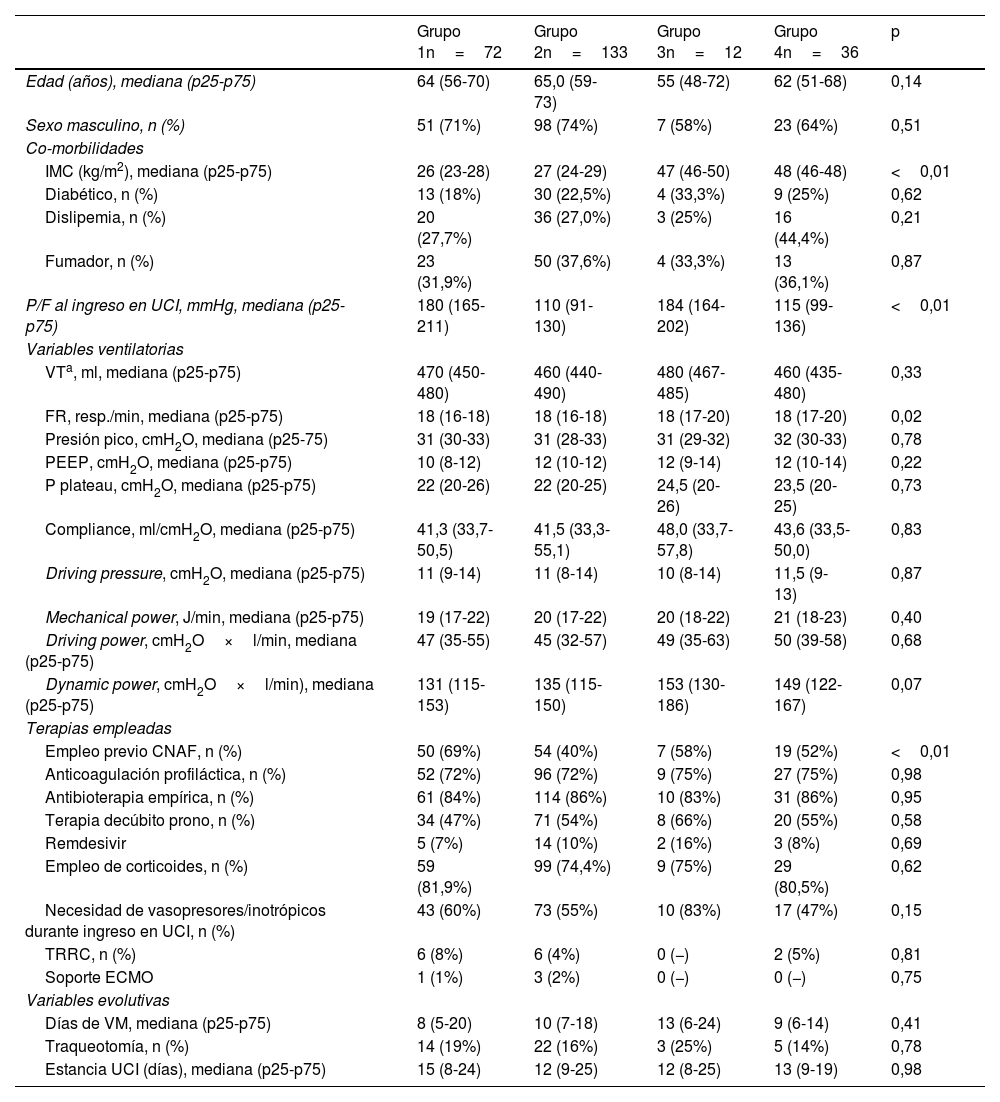
El grupo4 (pacientes con hipoxia severa y obesidad) presentó los valores medios más altos de MP: 20,96J/min. No se encontraron diferencias significativas en el análisis entre grupos. El valor medio de drivingpower más elevado se evidenció en el grupo4 (pacientes con hipoxia severa y obesidad) 49,91cmH2O×l/min, y el valor medio más elevado de dynamicpower se comprobó en el grupo3 (pacientes sin hipoxemia severa con obesidad): 153,13 (129,75-185,95) cmH2O×l/min (tabla 1). La dynamicpower presentó diferencias significativas entre los grupos de pacientes atendiendo a la presencia de la variable obesidad en la categorización del grupo.
Características clínico-epidemiológicas y datos de la ventilación mecánica
| Grupo 1n=72 | Grupo 2n=133 | Grupo 3n=12 | Grupo 4n=36 | p | |
|---|---|---|---|---|---|
| Edad (años), mediana (p25-p75) | 64 (56-70) | 65,0 (59-73) | 55 (48-72) | 62 (51-68) | 0,14 |
| Sexo masculino, n (%) | 51 (71%) | 98 (74%) | 7 (58%) | 23 (64%) | 0,51 |
| Co-morbilidades | |||||
| IMC (kg/m2), mediana (p25-p75) | 26 (23-28) | 27 (24-29) | 47 (46-50) | 48 (46-48) | <0,01 |
| Diabético, n (%) | 13 (18%) | 30 (22,5%) | 4 (33,3%) | 9 (25%) | 0,62 |
| Dislipemia, n (%) | 20 (27,7%) | 36 (27,0%) | 3 (25%) | 16 (44,4%) | 0,21 |
| Fumador, n (%) | 23 (31,9%) | 50 (37,6%) | 4 (33,3%) | 13 (36,1%) | 0,87 |
| P/F al ingreso en UCI, mmHg, mediana (p25-p75) | 180 (165-211) | 110 (91-130) | 184 (164-202) | 115 (99-136) | <0,01 |
| Variables ventilatorias | |||||
| VTa, ml, mediana (p25-p75) | 470 (450-480) | 460 (440-490) | 480 (467-485) | 460 (435-480) | 0,33 |
| FR, resp./min, mediana (p25-p75) | 18 (16-18) | 18 (16-18) | 18 (17-20) | 18 (17-20) | 0,02 |
| Presión pico, cmH2O, mediana (p25-75) | 31 (30-33) | 31 (28-33) | 31 (29-32) | 32 (30-33) | 0,78 |
| PEEP, cmH2O, mediana (p25-p75) | 10 (8-12) | 12 (10-12) | 12 (9-14) | 12 (10-14) | 0,22 |
| P plateau, cmH2O, mediana (p25-p75) | 22 (20-26) | 22 (20-25) | 24,5 (20-26) | 23,5 (20-25) | 0,73 |
| Compliance, ml/cmH2O, mediana (p25-p75) | 41,3 (33,7-50,5) | 41,5 (33,3-55,1) | 48,0 (33,7-57,8) | 43,6 (33,5-50,0) | 0,83 |
| Driving pressure, cmH2O, mediana (p25-p75) | 11 (9-14) | 11 (8-14) | 10 (8-14) | 11,5 (9-13) | 0,87 |
| Mechanical power, J/min, mediana (p25-p75) | 19 (17-22) | 20 (17-22) | 20 (18-22) | 21 (18-23) | 0,40 |
| Driving power, cmH2O×l/min, mediana (p25-p75) | 47 (35-55) | 45 (32-57) | 49 (35-63) | 50 (39-58) | 0,68 |
| Dynamic power, cmH2O×l/min), mediana (p25-p75) | 131 (115-153) | 135 (115-150) | 153 (130-186) | 149 (122-167) | 0,07 |
| Terapias empleadas | |||||
| Empleo previo CNAF, n (%) | 50 (69%) | 54 (40%) | 7 (58%) | 19 (52%) | <0,01 |
| Anticoagulación profiláctica, n (%) | 52 (72%) | 96 (72%) | 9 (75%) | 27 (75%) | 0,98 |
| Antibioterapia empírica, n (%) | 61 (84%) | 114 (86%) | 10 (83%) | 31 (86%) | 0,95 |
| Terapia decúbito prono, n (%) | 34 (47%) | 71 (54%) | 8 (66%) | 20 (55%) | 0,58 |
| Remdesivir | 5 (7%) | 14 (10%) | 2 (16%) | 3 (8%) | 0,69 |
| Empleo de corticoides, n (%) | 59 (81,9%) | 99 (74,4%) | 9 (75%) | 29 (80,5%) | 0,62 |
| Necesidad de vasopresores/inotrópicos durante ingreso en UCI, n (%) | 43 (60%) | 73 (55%) | 10 (83%) | 17 (47%) | 0,15 |
| TRRC, n (%) | 6 (8%) | 6 (4%) | 0 (−) | 2 (5%) | 0,81 |
| Soporte ECMO | 1 (1%) | 3 (2%) | 0 (−) | 0 (−) | 0,75 |
| Variables evolutivas | |||||
| Días de VM, mediana (p25-p75) | 8 (5-20) | 10 (7-18) | 13 (6-24) | 9 (6-14) | 0,41 |
| Traqueotomía, n (%) | 14 (19%) | 22 (16%) | 3 (25%) | 5 (14%) | 0,78 |
| Estancia UCI (días), mediana (p25-p75) | 15 (8-24) | 12 (9-25) | 12 (8-25) | 13 (9-19) | 0,98 |
VT: volumen tidal ajustado al peso ideal (6-8ml/kg).
CNAF: oxigenoterapia de alto flujo; ECMO: oxigenación por membrana extracorpórea; FR: frecuencia respiratoria; Grupo1: pacientes no obesos y no hipoxémicos; Grupo2: pacientes hipoxémicos y no obesos; Grupo3: pacientes obesos y no hipoxémicos; Grupo4: pacientes obesos e hipoxémicos; IMC: índice de masa corporal; PEEP: presión positiva al final de la espiración; P/F: relación entre la presión arterial de oxígeno y la fracción inspirada de oxígeno; TRRC: terapias de reemplazo renal continuo; VT: volumen tidal.
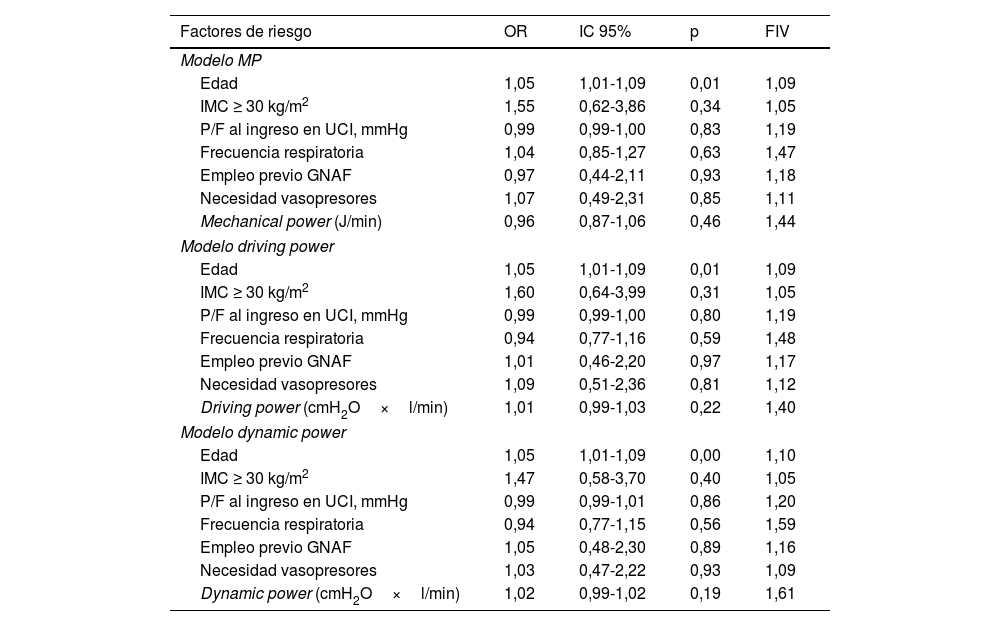
En el análisis de regresión logística (tabla 2), en los tres modelos ajustados solo la edad se mostró como un predictor independiente de la mortalidad con significación estadística. En cuanto al índice de masa corporal (IMC) mayor o igual a 30kg/m2, aunque mostró una asociación positiva con la mortalidad, no alcanzó significación estadística en ninguno de los tres modelos ajustados. Otros factores, como el P/F al ingreso en la UCI, la frecuencia respiratoria, el empleo previo de GNAF y la necesidad de vasopresores, no mostraron asociación significativa con la mortalidad en ninguno de los modelos.
Factores de riesgo relacionados con la mortalidad a 28 días mediante análisis de regresión logística multivariable
| Factores de riesgo | OR | IC 95% | p | FIV |
|---|---|---|---|---|
| Modelo MP | ||||
| Edad | 1,05 | 1,01-1,09 | 0,01 | 1,09 |
| IMC ≥ 30 kg/m2 | 1,55 | 0,62-3,86 | 0,34 | 1,05 |
| P/F al ingreso en UCI, mmHg | 0,99 | 0,99-1,00 | 0,83 | 1,19 |
| Frecuencia respiratoria | 1,04 | 0,85-1,27 | 0,63 | 1,47 |
| Empleo previo GNAF | 0,97 | 0,44-2,11 | 0,93 | 1,18 |
| Necesidad vasopresores | 1,07 | 0,49-2,31 | 0,85 | 1,11 |
| Mechanical power (J/min) | 0,96 | 0,87-1,06 | 0,46 | 1,44 |
| Modelo driving power | ||||
| Edad | 1,05 | 1,01-1,09 | 0,01 | 1,09 |
| IMC ≥ 30 kg/m2 | 1,60 | 0,64-3,99 | 0,31 | 1,05 |
| P/F al ingreso en UCI, mmHg | 0,99 | 0,99-1,00 | 0,80 | 1,19 |
| Frecuencia respiratoria | 0,94 | 0,77-1,16 | 0,59 | 1,48 |
| Empleo previo GNAF | 1,01 | 0,46-2,20 | 0,97 | 1,17 |
| Necesidad vasopresores | 1,09 | 0,51-2,36 | 0,81 | 1,12 |
| Driving power (cmH2O×l/min) | 1,01 | 0,99-1,03 | 0,22 | 1,40 |
| Modelo dynamic power | ||||
| Edad | 1,05 | 1,01-1,09 | 0,00 | 1,10 |
| IMC ≥ 30 kg/m2 | 1,47 | 0,58-3,70 | 0,40 | 1,05 |
| P/F al ingreso en UCI, mmHg | 0,99 | 0,99-1,01 | 0,86 | 1,20 |
| Frecuencia respiratoria | 0,94 | 0,77-1,15 | 0,56 | 1,59 |
| Empleo previo GNAF | 1,05 | 0,48-2,30 | 0,89 | 1,16 |
| Necesidad vasopresores | 1,03 | 0,47-2,22 | 0,93 | 1,09 |
| Dynamic power (cmH2O×l/min) | 1,02 | 0,99-1,02 | 0,19 | 1,61 |
IMC: índice de masa corporal; P/F: ratio entre la presión parcial de oxígeno arterial y la fracción inspiratoria de oxígeno suministrada.
Datos presentados como odds ratio (OR) con su intervalo de confianza del 95% (IC95%). El valor de p ha sido calculado mediante análisis de regresión logística. El diagnóstico de multicolinealidad se muestra con el factor de inflación de la varianza (FIV).
Nuestro análisis evidencia que la parametrización de la ventilación mecánica de los pacientes obesos durante la pandemia por SARS-CoV-2 conllevó una dynamicpower más alta que la del resto de pacientes, sin que este hallazgo condicionase un aumento del MP o un efecto sobre la mortalidad a 28días en la UCI.
En este contexto, diferentes estudios han demostrado que la distensibilidad total del sistema respiratorio disminuye en pacientes obesos por disminución de la distensibilidad de la pared torácica, permaneciendo la distensibilidad pulmonar sin cambios9. Los pacientes obesos pudieron requerir valores de PEEP más altos durante la ventilación mecánica para conseguir contrarrestar la carga de peso que se impone sobre la misma. Esta situación condiciona que se precise mayor carga energética: dinamicpower. Hay diferentes trabajos publicados sobre valores de PEEP utilizados en este tipo de pacientes, que describen la necesidad de un promedio de valores de PEEP entre 11 y 18cmH2O para conseguir un reclutamiento total del tejido pulmonar colapsado8.
Nuestro análisis ha sido incapaz de detectar una asociación estadística entre las variables de carga de energía y la mortalidad a los 28días en esta cohorte de pacientes. A pesar de la relevancia teórica de estas variables y su potencial impacto en los resultados clínicos, nuestro estudio podría carecer del poder suficiente para detectar dicha capacidad sobre la mortalidad a corto plazo.
La confirmación de estos hallazgos plantearía interrogantes sobre la utilidad clínica de estas medidas de carga de energía en la predicción de resultados en pacientes con obesidad graves. Es posible que otros factores, como la gravedad de la enfermedad subyacente, la respuesta al tratamiento y las comorbilidades, tengan un impacto más significativo en la mortalidad que las medidas de carga de energía en sí mismas.
En consecuencia, estos hallazgos destacan la necesidad de una investigación adicional para comprender mejor la relación entre la carga de energía en la ventilación mecánica y los resultados clínicos, así como para identificar biomarcadores y variables clínicas más predictivas de la mortalidad en pacientes críticamente enfermos10.
Nuestros resultados en pacientes con síndrome de distrés respiratorio agudo (SDRA) plantean interrogantes sobre su extrapolación a la población con SDRA «típico», especialmente en aquellos con neumonía bacteriana y enfermedad intraabdominal. La comprensión de la patogénesis viral exclusiva del SARS-CoV-2 subyace en la diferenciación fisiológica entre el SDRA-C y el SDRA no relacionado con COVID-19. Las respuestas proinflamatorias, íntimamente vinculadas con la lesión del endotelio vascular pulmonar y la inmunotrombosis, presentan discrepancias significativas entre ambos tipos de SDRA11.
Contribución de los autoresTodos los autores firmantes cumplen los requisitos de autoría.
Alejandro González-Castro: ideación, elaboración y redacción del manuscrito.
Elena Cuenca Fito: recogida de datos.
Yhivian Peñasco: elaboración, corrección.
Carmen Huertas: depuración de la base de datos.
Aurio Fajardo: corrección.
Conflicto de interesesTodos los autores firmantes han declarado la no existencia de conflictos de intereses.