029 NIVEL DE HOMOCISTEÍNA PLASMÁTICA COMO FACTOR DE RIESGO DE INFARTO AGUDO DE MIOCARDIO EN PACIENTES JÓVENES. ESTUDIO CASOS CONTROL
C. Culebras, J. Díaz, J. Fuentes, G. O´Shanahan, L. Santana, y V. Nieto
Servicio de Cardiología. Hospital Universitario Insular de Gran Canaria. Las Palmas de Gran Canaria.
Planteamiento: Estudios retrospectivos y prospectivos han demostrado que el nivel plasmático de homocisteína (HCY) es un factor de riesgo cardiovascular independiente de los factores de riesgo clásicos.
Objetivo: Demostrar un mayor nivel de HCY en los pacientes jóvenes (< 49 años) que sufren infarto de miocardio (IAM).
Material y método: Durante 24 meses hemos recogido muestras de plasma en pacientes jóvenes con IAM. Estudiamos 142 pacientes: 72 con infarto crónico (> 6 meses) y 72 con IAM. Analizamos niveles de HCY, folatos y vitamina B12 en los dos grupos.
Análisis estadístico: Test no paramétrico de Kolmogerov para comprobar la normalidad. T-Student para muestras numéricas independientes. Chi2 para variables cualitativas.
Resultados: No se aprecia diferencia estadísticamente significativa en relación con el folato sérico, folato eritrocitario o con vitamina B12. Si se apreció diferencia estadísticamente significativa (P < 0,05) respecto a HCY (12,3514,34 de niveles medios). En las variables cualitativas había diferencias estadísticamente significativas respecto al tabaquismo (mayor incidencia en agudos) y en cuanto a la dislipemia (mayor incidencia en crónicos).
Conclusiones: El nivel de HCY está claramente elevado en la fase aguda del infarto.
Esto nos puede llevar a pensar que la HCY no es solo un factor de riesgo aterogénico, sino además un factor de riesgo procoagulante. Esto ocurre aún con niveles moderadamente elevados de HCY.
030 VALORACIÓN POR CITOMETRÍA DE FLUJO DE LA EXPRESIÓN DE LA P-SELECTINA EN EL SÍNDROME CORONARIO AGUDO TRATADO CON TIROFIBAN
F. Pérez, M.P. Fuset, E. Peris, M. Ruano y S. Gómez-Biedma*
Servicio de Medicina Intensiva. *Departamento de Biopatología Clínica. Hospital La Fe. Valencia.
Introducción: La P-selectina (CD62) es un receptor que se expresa en la superficie plaquetar cuando la plaqueta se activa. Su expresión se puede determinar por citometría de flujo. Proponemos valorar el estado de activación plaquetaria en los pacientes con Síndrome Coronario Agudo (SCA) sin elevación del ST y su variación tras la administración de tirofiban.
Métodos: Estudiamos 26 pacientes con SCA. Todos fueron tratados con AAS, heparina no fraccionada (HNF) y tirofiban. Se extrajeron muestras basales, a las 24 horas y a la semana de iniciado el tratamiento. Se valoró la expresión (%) basal de CD62 y la capacidad de activación de las plaquetas con diferentes agonistas (ADP, ácido araquidónico, U 46619, colágeno y trombina) una vez iniciada la pauta. Se comparó con un grupo de 30 sujetos sanos. Se evaluaron las diferencias por análisis de la varianza (ANOVA). Se consideró diferencia significativa si p < 0,05.
Resultados: La % CD62+ basal es significativamente mayor en los pacientes que en el grupo control: 4,3 ± 3,8% vs 2,7 ± 1.7%, p < 0,05. A las 24 h se reduce de forma significativa (2,2 ± 1,5%, p < 0,01) y a los 7 días vuelve a la situación basal (3,9 ± 2,2%, ns). Sólo la capacidad de activación por ADP y trombina se reduce de forma significativa a las 24 horas tras administrar tirofiban (ADP: 25,8 ± 12,9% vs 35, ± 14.8%, p < 0,05 y trombina: 32,5 ± 29,8% vs 81,3 ± 25,3%, p < 0,001).
Conclusión: Los enfermos con SCA presentan un aumento de expresión de CD62. El tratamiento con tirofiban inhibe ese aumento y reduce la respuesta activadora plaquetar de la trombina y del ADP y no del ácido araquidónico y de U 46619 por el empleo concomitante de AAS.
031 ACCIÓN ANTICOAGULANTE DE LAS HEPARINAS EN EL SÍNDROME CORONARIO AGUDO: VALORACIÓN DE LA DISFUNCIÓN ENDOTELIAL
M.P. Fuset, F. Pérez, E. Peris, M. Ruano y V. Martínez-Sales*
Servicio de Medicina Intensiva. *Centro de Investigación. Hospital La Fe. Valencia.
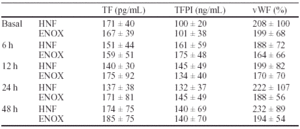
Objetivo: Nos proponemos valorar en el Síndrome Coronario Agudo (SCA) si tiene una diferente acción la enoxaparina (ENOX) sobre la heparina no fraccionada (HNF) en el inhibidor del factor tisular (TFPI) o una atenuación de la disfunción endotelial valorada por los niveles en plasma del factor de von Willebrand (vWF).
Métodos: Estudiamos 24 pacientes con SCA. Once se trataron con HNF 5000 UI en bolo y 18 UI/Kg/h y 13 con ENOX sc 1 mg/Kg/12 h. Se determinaron el factor tisular (TF), TFPI y vWF basalmente y a las 6, 12, 24 y 48 horas de iniciado el tratamiento. Las diferencias se evaluaron por análisis de la varianza (ANOVA). Se consideró significativo un valor de p < 0,05.
Resultados:
Conclusión: Tanto la HNF como la ENOX producen una elevación de TFPI y del vWF en el SCA.
032 PREDISPOSICIÓN GENÉTICA AL SÍNDROME DE BAJO GASTO CARDÍACO TRAS LA REVASCULARIZACIÓN MIOCÁRDICA CON CIRCULACIÓN EXTRACORPÓREA
F. Martínez Sagasti, D. Prieto Merino*, J.L. Iribarren Sarrías, E. Salido Ruiz y A. Torres Ramírez
Servicio de Medicina Intensiva y Unidad de Investigación. Hospital Universitario de Canarias. La Laguna (Tenerife). *Departamento de Ciencias Sanitarias-Universidad de Alcalá (Madrid).
Objetivo: Estudiar el efecto de poseer polimorfismos genéticos concretos del factor de necrosis tumoral beta (TNF-β) y del antagonista del receptor de la interleucina 1 (IL-1Ra) en la aparición de Síndrome de Bajo Gasto cardíaco (BG), no debido a infarto de miocardio, tras la revascularización miocárdica (RM) con circulación extracorpórea (CEC).
Métodos: Analizamos los polimorfismos comunes intrón 1 del gen del TNF-β e intrón 2 del gen del IL-1Ra en pacientes consecutivos, no seleccionados, sometidos a cirugía cardíaca bajo CEC para RM y su relación con el BG postoperatorio. Se definió el BG cuando, con temperatura rectal > 35,5 ºC y frecuencia cardíaca 60-120 ppm, el paciente tenía IC < 2,2 L/min/m2 sin mejoría tras aporte de volumen si PCP < 18 mmHg, precisando drogas inotropas.
Resultados: Estudiamos 112 pacientes isquémicos (H84/M28). Desarrollaron BG 20 (17,8%). Los pacientes con algún alelo G del TNF-β tuvieron BG el 26% vs el 9,4% los homocigotos AA (p 0,028). Desarrollaron BG el 45% de los pacientes con IL-1Ra homocigotos A2 vs el 15% con otros alelos (p 0,026). En el análisis multivariante se confirma un mayor riesgo de BG para quienes tienen algún alelo G del TNF-β (OR 3,44; IC 95%: 1,09-10,75) o son homocigotos A2/A2 para el IL-1Ra (OR 4,39; IC 95% 1,1-17,6).
Conclusiones: Existe una susceptibilidad genética, individual, a presentar BG tras la RM mediante CEC. Poseer el alelo G del TNF-βo la homocigosis A2 del IL-Ra aumenta el riesgo de su aparición.
033 POLIMORFISMO GENÉTICO VALINA34LEUCINA DEL FACTOR XIII EN EL IAM < 45 AÑOS.
F. López, J. Pineda, V. Roldán, J. Canovas y J. Caturla
Servicio de Medicina Intensiva. Hospital General Universitario de Alicante. Alicante.
El polimorfismo guanina/tiamina en el exon 2 del gen de la subunidad A del factor XIII que origina una sustitución de valina por leucina (val34leu) se asocia a un incremento en la actividad del factor XIII, lo cual lleva a una mayor resistencia del coágulo a la lisis. Paradójicamente, se ha asociado con un efecto protector frente a procesos trombóticos, siendo su comportamiento en pacientes con IAM tratados con fibrinolíticos controvertido.
Objetivos: Analizar la influencia del polimorfismo val34leu en los pacientes con IAM prematuro (< 45 a.). Estudiar su influencia sobre la eficacia del tratamiento trombolítico en el IAM con elevación de segmento ST.
Método: Análisis genético de 585 sujetos caucasianos representativos de la población mediterránea (Grupo control A) y 180 pacientes que sufren primer IAM prematuro y que sobreviven al mismo (Grupo B). Se analizan en ambos grupos los factores de riesgo cardiovascular. En el Grupo B se realiza arteriografía coronaria en los 7 días del episodio agudo, analizándose el efecto del tratamiento trombolítico.
Resultados: La prevalencia del alelo leu34val fue similar en ambos grupos, en cambio la de homocigotos leucina/leucina fue mayor en el Grupo B que en el A (7,2% vs 3,8%) (p = 0,01). Los IAM prematuros mas jóvenes < 35 a. presentan una prevalencia de genotipo leu/leu de 17,7 % vs 3,8 % (p = 0,007). Se atribuye un papel independiente del genotipo val34leu como factor de riesgo para sufrir IAM prematuro. En la coronariografía no se encuentra asociación entre el número de vasos afectados y la presencia de polimorfismo. Existe una asociación significativa entre la eficacia de la trombólisis y el polimorfismo val34leu. Siendo esta menor en los pacientes con dicho alelo. Los pacientes en los que se realizó angioplastia primaria muestran mejor evolución inicial.
Conclusiones:1) El alelo leucina 34 del factor XIII en la población mediterránea se asocia a un incremento de riesgo trombótico, por el mayor poder de estabilización del coagulo de fibrina al factor XIII. 2) En los paciente con este genotipo la eficacia del tratamiento trombolítico es menor (p = 0,005). 3) Los pacientes del Grupo B con el genotipo leu/leu se benefician mas de la ACTP primaria que de la trombólisis.
034 GENOTIPOS DE TROMBOFILIA Y RIESGO DE EPISODIO CORONARIO AGUDO
J.I. Corchero, O. Gavin, R. Cornudella, E. Civeira y M.T. Calvo
UCI. H. Real y Provincial Nuestra Señora de Gracia. Zaragoza.
Introducción: El síndrome coronario agudo constituye una de las primeras patologías en las UCI, dada la importancia real del problema y la incidencia sobre población cada vez más joven, se están estudiando nuevos factores determinantes de aparición del infarto además de los ya conocidos; entre estos factores cobran importancia relativa los estudios de trombofilia plasmática así como las mutaciones más frecuentes de trombofilia.
Método: Estudio prospectivo de 95 pacientes jóvenes (27-50) afectos de episodio coronario agudo en los que se determinó trombofilia sérica que incluía: prot. C y C antigénica, prot. S y S antigénica, AT III, RPCA y LAC y estudio de mutaciones de trombofilia: Factor V Leiden, C677T,G (20210)A. Grupo control de 50 pacientes donantes de Banco de sangre.
Resultados: El 100% de los pacientes estudiados presentaban algún factor de riesgo arterial siendo el tabaquismo el de mayor incidencia con un 80%. El 17,8% de los pacientes presentaba alguna alteración de la trombofilia sérica siendo el déficit de AT III el de mayor incidencia con un 52,9%. Las mutaciones de trombofilia estudiados presentaban escasa incidencia con un 6,3% distribuyéndose de la siguiente manera: C677T M/M 3 pacientes, C677T M/N + FV Leiden 2 pacientes, G(20210)A 1 paciente.
Conclusiones: Realizado un test de contraste de hipótesis concluimos que no hay razones estadísticamente significativas (p 0,184) que nos hagan pensar en la existencia de relación entre riesgo de padecer episodio coronario agudo y la presencia de mutaciones de trombofilia. Al realizar un tratamiento estadístico de riesgo de padecer episodio coronario agudo en pacientes portadores de déficit de AT III nuestros resultados arrojan un mayor riesgo de padecer IAM en personas con déficit de AT III (OR 37,04%)
Por lo tanto concluimos que no está recomendado el realizar estudio genético de las mutaciones de trombofilia en pacientes jóvenes con IAM; por el contrario sería altamente recomendable el realizar estudio de trombofilia sérica en todos ellos con fines profilácticos y terapéuticos.