En los enfermos con sepsis grave y una baja probabilidad de muerte el tratamiento con drotrecogina alfa activada se asocia con un aumento del riesgo (1,7%) de sangrado grave, sin ninguna mejoría en la supervivencia.
In patients with severe sepsis and low risk of death treatment with drotrecogin alfa (activated) is associated with an increase (1.7%) of severe bleeding and without any beneficial effect in 28 day survival.
Artículo: Abraham E, Laterre PF, Garg R, Levy H, Talwar D, Trzaskoma BL, et al. Administration of Drotrecogin Alfa (Activated) in Early Stage Severe Sepsis (ADDRESS) Study Group. Drotrecogin alfa (activated) for adults with severe sepsis and a low risk of death. N Engl J Med. 2005;353:1332-41.
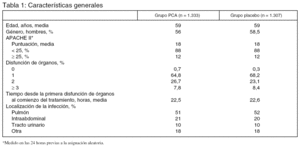
Antecedentes: tras un ensayo clínico en fase III1 el uso de la proteína C activada (PCA) fue autorizado por la U.S. Food and Drug Administration para el tratamiento de los enfermos con sepsis grave y APACHE II a la inclusión ≥ 25, exigiendo la realización de un nuevo ensayo clínico en la población con sepsis grave y APACHE II < 25.
La European Agency for the Evaluation of Medicinal Products aprobó el uso de PCA con la indicación de enfermos con sepsis grave y fracaso multiorgánico.
Objetivo:: estimar el efecto de la PCA sobre la mortalidad a los 28 días y su seguridad en los enfermos con sepsis grave y baja probabilidad de muerte.
Diseño: ensayo clínico aleatorizado.
Lugar: 516 centros hospitalarios en 34 países.
Período de estudio: de septiembre 2002 a febrero 2004.
Pacientes (tabla 1):
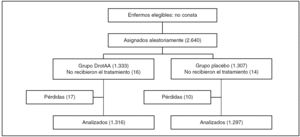
Figura 1
Criterios de Inclusión: se incluyeron los enfermos que tenían sepsis grave definida como sepsis con infección sospechada o conocida y disfunción ≤ 1 órgano.
Criterios de exclusión:1. Riesgo de sangrado aumentado; 2. Esperanza de vida ≤ 28 días; 3. Decisión de no realizar tratamiento agresivo; 4. El empleo de PCA estaba indicado o contraindicado según las normas de cada país participante; 5. Tiempo desde el comienzo de la disfunción de órganos hasta el comienzo del tratamiento superior a 48 horas.
Intervenciones que se comparan:
Grupo PCA: 24 µg/kg/hora durante 96 horas.
Grupo placebo: placebo (solución salina 0,9%)
Otros aspectos del tratamiento se dejaron a la decisión de los médicos que trataron a los enfermos.
Asignación aleatoria: sí. Oculta. Estratificada por centros y por tratamiento previo, o no, con dosis profilácticas de heparina.
Enmascaramiento: sí.
Desenlaces principales: mortalidad a los 28 días.
Análisis por intención de tratar: sí.
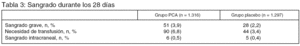
Resultados principales (tablas 2 y 3): la muestra calculada fue 11.444 enfermos.
Tras un análisis intermedio de 1.500 enfermos se interrumpió el reclutamiento de enfermos por ausencia de eficacia y aumento de sangrado en el grupo tratado con PCA.
En el análisis de subgrupos previamente definidos se encontró:
1. En el subgrupo de enfermos con cirugía reciente (≤ 30 días antes de la inclusión en el estudio) y disfunción de 1 órgano la administración de PCA se asoció a un incremento de la mortalidad a los 28 días del 14,1% al 20,7% (p = 0,03) y del sangrado 6,1% a 10,9% (p = 0,03).
2. En el subgrupo de enfermos con APACHE II ≥ 25 la administración de PCA se asoció a un incremento de la mortalidad a los 28 días del 24,7% al 29,5%.
3. En el subgrupo de enfermos con > 1 disfunción de órganos la administración de PCA se asoció a una reducción no significativa de la mortalidad a los 28 días del 21,9% al 20,7%.
Información sobre costes: no consta.
Financiación del estudio: el estudio fue financiado por Ely Lilly.
Conflicto de intereses: se describen apropiadamente.
*Esta sección está financiada con la ayuda ISCIII-FIS 02/8115.
Conclusiones de los autores: los resultados indican que la PCA no debe usarse en los enfermos con sepsis grave y con probabilidad baja de muerte.
Conclusiones de los revisores: este ensayo clínico proporciona dos conclusiones: 1. la PCA no mejora la supervivencia en los enfermos con sepsis grave y baja probabilidad de muerte y aumenta el riesgo de sangrado grave; 2. en los pacientes con cirugía en los 30 días previos y baja probabilidad de muerte la PCA puede aumentar la mortalidad. Esta última conclusión ha provocado una alerta en la FDA2. El incremento en el riesgo de sangrado grave encontrado en este ensayo clínico es congruente con la observación de que el uso de PCA en la práctica clínica3, en la población en la que se ha autorizado el uso de PCA es superior al encontrado en el ensayo clínico PROWESS: 6,5% frente a 3,5%. El hallazgo en este ensayo clínico de la ausencia de efecto de la PCA en la población con APACHE II > 25 o con fracaso > 1 órgano plantea la duda sobre la eficacia actual de ese fármaco en el tratamiento de los enfermos con sepsis grave para los que su uso ha sido autorizado. Esta duda también se refuerza por los hallazgos de un ensayo clínico realizado en la población infantil con sepsis grave que ha sido interrumpido tras constatar la ausencia de efecto sobre la mortalidad (mortalidad a los 28 días: grupo placebo, 18%; grupo PCA, 17%) y el aumento del sangrado intracerebral4. Estos dos hechos -la inconsistencia del efecto sobre la mortalidad de la PCA en los ensayos clínicos y el incremento del riesgo de sangrado- ha llevado a sugerir la necesidad de un nuevo ensayo clínico que permita definir la población en la que el uso de PCA pueda ser potencialmente beneficioso5.