INTRODUCCIÓN
El síndrome de distrés respiratorio agudo (SDRA) fue descrito por primera vez por Ashbaugh et al1. Estos autores reportaron un síndrome caracterizado por taquipnea aguda, hipoxemia y disminución de la compliance pulmonar secundario a diversos daños como infección pulmonar o traumatismo. Desde esta descripción original, el SDRA se ha convertido en una entidad de importancia significativa para los intensivistas debido a su incidencia y su alta mortalidad.
DIAGNÓSTICO
Los criterios específicos para el diagnóstico del SDRA han cambiado desde la descripción inicial. Como mencionamos previamente, los primeros investigadores que acuñaron el término «síndrome de distrés respiratorio del adulto» fueron Asbaugh et al en 19671. Ellos identificaron a 12 pacientes con fracaso respiratorio agudo que tenían similares hallazgos clínicos y patológicos: a) disnea; b) taquipnea; c) cianosis refractaria a la oxigenoterapia; d) disminución de la compliance pulmonar; e) infiltrados alveolares difusos en la radiografía de tórax, y f) no había antecedentes de enfermedad pulmonar previa. Hay que reconocer que esta enfermedad no aparece por primera vez en los años sesenta y, de hecho, descripciones similares se encuentran durante la epidemia de gripe de 1918. La importancia de la descripción realizada por Asbaugh et al estriba en el hecho de que su hallazgo fue paralelo a la generalización de las Unidades de Cuidados Intensivos (UCI) y al tratamiento de la insuficiencia respiratoria aguda con presión positiva. En los siguientes 10-20 años no se produce ningún avance en la definición de SDRA, considerándose que esta entidad no precisaba una definición específica. Garber et al2 en una revisión sistemática acerca de la incidencia y factores de riesgo del SDRA encuentran que en el 51% de los 83 artículos identificados no se indica ninguna definición específica.
En 1988, Murray et al3 publicaron el primer intento para crear una definición uniforme de SDRA: el Lung Injury Score. Este score tiene cuatro componentes (radiografía de tórax, hipoxemia, presión positiva al final de la espiración [PEEP] y compliance pulmonar) cada uno de los cuales puntúa entre 0-4. La puntuación final se calcula sumando el valor de cada componente y dividiendo entre el número de componentes que se ha utilizado. Los autores consideraron que un Lung Injury Score > 2,5 definía el SDRA.
En 1992 se reunió una Conferencia de Consenso Americano-Europea sobre SDRA para tratar de clarificar y uniformar la definición de daño pulmonar agudo y SDRA4. La definición, publicada en 1994, consiste en la presencia de cuatro criterios: a) comienzo agudo; b) relación PaO2/FIO2 ≤ 200 (independientemente del nivel de PEEP aplicada); c) infiltrados bilaterales en la radiografía de tórax, y d) presión de oclusión de la arteria pulmonar ≤ 18 mmHg o ausencia de signos clínicos de hipertensión de aurícula izquierda. En esta Conferencia de Consenso, además de establecer una definición de SDRA, se definió una entidad clínica denominada daño pulmonar agudo. El daño pulmonar agudo es un proceso que engloba al SDRA (podemos considerar a este último una forma grave de daño pulmonar agudo) que se define de forma idéntica a éste, pero con una diferencia en el criterio de oxigenación que en el daño pulmonar agudo es una relación PaO2/FIO2 ≤ 300 (independiente del nivel de PEEP). En resumen, el daño pulmonar agudo y el SDRA se definieron como entidades que representan diferentes niveles de gravedad de la misma entidad, con la única diferencia de un punto de corte, elegido arbitrariamente, para la oxigenación.
Un aspecto importante de una definición es la fiabilidad de la misma tanto cuando se utiliza en la práctica clínica diaria como cuando se emplea como criterio de inclusión en ensayos clínicos. Se ha evaluado la fiabilidad de alguno de los componentes individuales de la definición de la Conferencia de Consenso. El criterio radiológico, infiltrados bilaterales en la radiografía frontal de tórax, ha sido examinado en dos estudios5,6. En el primero5, 21 expertos revisaron las radiografías de 28 pacientes con hipoxemia (PaO2/FIO2 ≤ 300). Estos autores mostraron un acuerdo moderado cuando se les preguntó a los expertos si la radiografía de tórax cumplía los criterios de la Conferencia de Consenso con un índice de kappa de 0,55 (intervalo de confianza 95%: 0,52 a 0,57). El segundo estudio, de Meade et al6, reportó unas conclusiones similares. Estos autores examinaron la fiabilidad interobservador en el diagnóstico de infiltrados bilaterales en las radiografías de tórax de un grupo de pacientes con SDRA o con factores de riesgo para dicho síndrome. Las radiografías fueron examinadas por intensivistas y un radiólogo. En este estudio se encuentra un acuerdo moderado con un índice de kappa de 0,40 a 0,56.
También ha sido evaluado el criterio de oxigenación, pero enfocado sobre el efecto que la variabilidad de la relación PaO2/FIO2 en un paciente tiene sobre la validez. Gowda et al7 realizan un modelo para estimar la estabilidad y fiabilidad de la relación PaO2/FIO2. En este estudio encuentran que la relación PaO2/FIO2 en pacientes con shunt moderado (< 30%) varía significativamente cuando se modifica la FIO2. En ambos extremos de FIO2, la relación PaO2/FIO2 fue mayor que con niveles intermedios de FIO2. Los pacientes con una fracción shunt grande (> 30%) tuvieron una relación PaO2/FIO2 mayor con FIO2 bajas y disminuye progresivamente con FIO2 > 0,5. Recientemente, Ferguson et al8 han publicado otro trabajo evaluando la estabilidad de la relación PaO2/FIO2 en 41 enfermos con SDRA. En este estudio los pacientes, con una relación PaO2/FIO2 al inicio ≤ 200, fueron ventilados con una FIO2 de 1,0 y una PEEP de 10 cmH2O. En 24 pacientes se observó que la relación PaO2/FIO2 se incrementó a los 30 minutos a niveles mayores de 200. Estos estudios sugieren que en muchas situaciones la relación PaO2/FIO2 puede que no sea exacta, ya que puede ser modificada por el simple hecho de ajustar la fracción inspirada de oxígeno y/o los parámetros respiratorios.
Otro método para valorar la validez de una definición es comparar a los pacientes diagnosticados de SDRA mediante la nueva definición con aquellos identificados por definiciones preexistentes. Esta metodología ha sido evaluada en dos estudios. Moss et al9 compararon las nuevas definiciones aparecidas en el momento del diseño del estudio (Lung Injury Score y Conferencia de Consenso Americano-Europea) con una definición previamente utilizada con criterios más estrictos que incluye insuficiencia respiratoria aguda que requiere ventilación mecánica, infiltrados pulmonares, una disminución documentada de la compliance torácica, y una relación entre la presión arterial y la presión alveolar de oxígeno menor de 0,25. Estos autores encontraron que la definición de la Conferencia de Consenso tenía una sensibilidad del 100% y una especificidad del 96% cuando se comparó con la definición histórica. Otro estudio10 comparó la definición de la Conferencia Americano-Europea con el Lung Injury Score. Se incluyeron 118 pacientes con factores de riesgo para SDRA. La incidencia de SDRA fue de un 55% utilizando la definición de la Conferencia de Consenso y 62% usando la clasificación de Murray (p = 0,07). El porcentaje de acuerdo bruto fue de un 73% y el índice de kappa de 0,46.
Es difícil establecer conclusiones de estos estudios porque no hay seguridad sobre cuál de las definiciones es la correcta en los casos de desacuerdo. Un modo de determinar la exactitud diagnóstica de las definiciones clínicas de SDRA sería compararlas con un gold standard previamente descrito. Recientemente han sido publicados dos trabajos que establecen la fiabilidad de las definiciones de SDRA utilizando como gold standard el hallazgo de daño pulmonar agudo en el examen posmortem de los pulmones11.
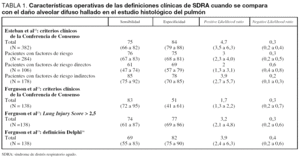
Esteban et al12 encontraron que la exactitud de la definición de la Conferencia de Consenso fue moderada. En todos los pacientes incluidos (N = 382), la sensibilidad de los criterios de la Conferencia de Consenso fue 75% (intervalo de confianza para el 95%: 66 a 82) y la especificidad fue 84% (intervalo de confianza para el 95%: 79 a 88). Cuando se analizaron los pacientes con factores de riesgo para SDRA (N = 284) la especificidad disminuyó a 75% (intervalo de confianza para el 95%: 68 a 81) con una sensibilidad similar. La definición fue más exacta en pacientes con factores de riesgo extrapulmonar que en pacientes con factores de riesgo pulmonar: sensibilidad 61% frente a 85% (p = 0,009), mientras que la especificidad fue numéricamente mayor pero no diferente estadísticamente (69% frente a 78%; p = 0,25) (tabla 1).
Ferguson et al13 compararon los hallazgos de la autopsia con tres definiciones diferentes: criterios de la Conferencia de Consenso, Lung Injury Score y una nueva definición creada por el método Delphi14. De las tres definiciones, la primera fue la más sensible, aunque sin alcanzar significación estadística, y la Lung Injury Score y la definición de Delphi fueron más específicas (tabla 1).
Las conclusiones de ambos estudios son que los criterios clínicos no pueden identificar a todos los pacientes con SDRA y podría indicar la necesidad de desarrollar nuevas herramientas que mejoren la fiabilidad y exactitud diagnóstica. Sin embargo, siendo conscientes de las limitaciones de la definición de la Conferencia de Consenso probablemente siga siendo útil en la práctica clínica diaria, ya que estos pacientes se beneficiarían de tratamientos como la ventilación con volúmenes bajos la cual ha sido evaluada en enfermos que cumpliendo los criterios clínicos de la conferencia de consenso podían o no tener daño alveolar difuso15,16.
ETIOLOGÍA
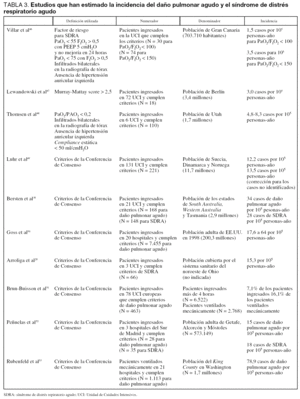
Identificar los factores de riesgo de desarrollar daño pulmonar agudo o SDRA podría ser particularmente importante para utilizar tratamientos que puedan prevenir la progresión del daño pulmonar en poblaciones de alto riesgo. La mayoría de las causas que producen daño pulmonar agudo son conocidas desde las primeras descripciones de esta entidad17-28 (tabla 2).
Varios estudios recientes han evaluado, a partir de una cohorte de pacientes que cumplen criterios clínicos de SDRA, las causas de este síndrome29-31. Los tres estudios coinciden en que la causa más frecuente de SDRA fue la neumonía y la segunda la sepsis de origen no pulmonar. Una limitación de esta conclusión es la dificultad para diferenciar entre neumonía y SDRA, lo cual podría sobreestimar el diagnóstico de SDRA en enfermos con patología pulmonar12,13.
En los últimos años se han descrito nuevos factores de riesgo asociados al desarrollo de SDRA. Aunque el daño pulmonar agudo relacionado con las transfusiones de hemoderivados (TRALI) fue descrito por primera vez en una serie larga de pacientes en 1985 por Popovsky y Moore20, en los últimos años ha habido un aumento en la incidencia de esta entidad y se ha profundizado en el conocimiento de su fisiopatología21,22. Esta reacción postransfusional es la tercera en frecuencia tras la imcompatibilidad ABO y la hepatitis22. En 2004 se definió como criterio diagnóstico del daño pulmonar agudo relacionado con la transfusión de hemoderivados la aparición de criterios clínicos de daño pulmonar agudo en las primeras 6 horas tras la misma32. En un reciente estudio23 para evaluar la incidencia de esta complicación se encontró que los factores asociados al TRALI fueron la trombocitopenia (odds ratio 5,9) y la transfusión de plasma fresco congelado (odds ratio 3,2).
Otro grupo de enfermos que tiene un mayor riesgo para el desarrollo de SDRA son los que han recibido un trasplante. Shorr et al33 observaron que en un grupo de 42.190 pacientes con trasplante renal un 0,2% desarrollaron SDRA, estimándose una incidencia de 51/100.000 habitantes/año que sería superior a la incidencia de la población general. Los factores de riesgo asociados con el desarrollo de SDRA en estos pacientes fueron el rechazo (odds ratio, 3.85; intervalo de confianza al 95%, 1,36-10,87) y el uso de globulina antilinfocitaria (odds ratio 2,70; intervalo de confianza al 95%, 1,33-5,52). Además de estos dos factores, la inmunosupresión requerida para un trasplante predispone de forma individual a la aparición de dos causas frecuentes de SDRA: neumonía y sepsis.
El último factor descrito es la infección por el virus del síndrome respiratorio agudo severo (SARS). Lew et al34 analizaron una serie de 199 adultos tratados en un hospital de Singapur con SARS, 46 de los cuales requirieron ingreso en UCI y un 23% cumplían criterios de daño pulmonar agudo.
Varios estudios experimentales35 han demostrado que la ventilación mecánica puede producir una lesión pulmonar aguda (ventilator induced lung injury, VILI). La evidencia de que en pacientes sin lesión pulmonar previa, que requieren ventilación mecánica, se puede desarrollar daño pulmonar agudo ha sido descrita en dos recientes estudios observacionales. Gajic et al25 observaron en una cohorte de 332 pacientes sin lesión pulmonar que el 24% de ellos desarrollan daño pulmonar agudo en los primeros 5 días de la ventilación mecánica. Los factores asociados fueron el uso de volúmenes tidal altos (odds ratio 1,3 por cada mililitro mayor de 6 ml/kg de peso ideal), la transfusión de hemoderivados (odds ratio 3,0), la acidemia (pH < 7,35; odds ratio 2,0) y antecedentes de enfermedad pulmonar restrictiva (odds ratio 3,6). Este hallazgo ha sido recientemente confirmado en un estudio multicéntrico26 en el que se observó una incidencia de un 6% de daño pulmonar agudo en una población de 3.261 pacientes sin criterios de SDRA al inicio de la ventilación mecánica. En el análisis de regresión logística ajustado se encontró que los parámetros ventilatorios al inicio se asociaron con el desarrollo de SDRA: volumen tidal alto (odds ratio 2,6 para un volumen tidal > 700 ml), presión pico mayor de 30 cmH2O (odds ratio 1,6) y una PEEP > 5 cmH2O (odds ratio 1,7).
Actualmente hay evidencias que sugieren que hay factores genéticos que se podrían asociar con una mayor susceptibilidad para desarrollar daño pulmonar. En los últimos años varios estudios han descrito polimorfismos genéticos relacionados con la producción de surfactante, la respuesta inflamatoria, vías endocrinas (como la enzima conversora de la angiotensina) y receptores (como los receptores toll-like y el CD14)36. El desarrollo del SDRA ha sido puesto en relación con alteraciones en la composición del surfactante pulmonar. Este último contiene 4 proteínas mayores, de las cuales la proteína A (SP-A) desempeña un papel de defensa a nivel pulmonar y la B (SP-B) es crucial para mantener la integridad estructural de las células tipo II; ambas contribuyen a disminuir la tensión superficial aire-líquido, evitando así el colapso pulmonar. En el SDRA se ha demostrado una disminución de la cantidad de estas proteínas en el lavado broncoalveolar y una menor capacidad para disminuir la tensión superficial. En los últimos años se ha postulado que la variación de los nucleótidos C/T en la posición 1580 en el exón 4 del gen que codifica la proteína SP-B resultaría en una alteración funcional de dicha proteína37-39. Otra proteína que desempeña un papel importante en la patogénesis del SDRA, a través de sus efectos sobre el tono y la permeabilidad pulmonar vascular, la supervivencia de las células epiteliales y la activación de los fibroblastos, es la enzima conversora de la angiotensina. La deleción de un fragmento de 287 pb (alelo D) en el gen que codifica esta enzima sería la responsable de una mayor actividad. Marshall et al40 estudiaron el genotipo de 96 pacientes blancos que cumplían los criterios de la Conferencia de Consenso, comparándolos con otros 3 gupos de pacientes (88 pacientes ventilados mecánicamente sin SDRA, 174 pacientes sometidos a by-pass aortocoronario y 1.906 individuos de una población general). La frecuencia del genotipo DD fue mayor en pacientes con SDRA comparado con el grupo ventilado sin SDRA (p = 0,00008), grupo by-pass (p = 0,0009) y grupo población general (p = 0,00004). El factor de necrosis tumoral alfa (TNF-α) es una de las citocinas principales de la cascada inflamatoria, y uno de los mediadores centrales en la sepsis y el daño pulmonar agudo. El gen que codifica este factor de necrosis tumoral se encuentra localizado en el cromosoma 6 en la región conocida como complejo mayor de histocompatibilidad. Un polimorfismo en la región promotora del gen ha sido asociado con un incremento en la síntesis del mismo y una mayor mortalidad en pacientes con procesos infecciosos41. Gong et al42, sin embargo, demostraron, en un estudio de 441 casos y 212 controles ingresados en la UCI por sepsis, traumatismo, aspiración o transfusiones múltiples, que los alelos -308A y TNF-B1 de los genes del TNF no se asociaban con una mayor predisposición para desarrollar SDRA. Estos alelos se asociaban con una mayor mortalidad en el SDRA, pero su asociación con la susceptibilidad para padecer dicho síndrome dependía del origen del daño que predisponía al mismo. Otro polimorfismo asociado con el SDRA es el del gen del factor de crecimiento endotelial vascular (VEGF). El papel que desempeña en el pulmón normal es incierto, pero hay estudios clínicos que sugieren que tiene un papel importante en la resolución del daño pulmonar. En estadios precoces del SDRA, los niveles de VEGF están aumentados en plasma y reducidos en pulmón, normalizándose sus valores cuando se recupera el daño pulmonar. Unos niveles plasmáticos bajos de VEGF se han asociado con la presencia del alelo T en el polimorfismo +936 CT. Medford et al43 estudian el genotipo para el polimorfismo VEGF + 936 en una cohorte de 137 personas sanas, 117 pacientes con SDRA y 103 pacientes con factores de riesgo para daño pulmonar agudo, y encuentran que la frecuencia de los genotipos CT y TT estaban aumentadas en los pacientes con SDRA en comparación con los sujetos sanos (odds ratio 2,01; intervalo de confianza para el 95% 1,13 a 3,58, p = 0,02) y con los pacientes «a riesgo» (odds ratio 2,05; intervalo de confianza para el 95% 1,02 a 2,20; p = 0,03). Por último, en estudios clínicos y de experimentación de daño pulmonar agudo se ha detectado un aumento en la expresión del factor estimulador de colonias de células pre-B (pre-B-cell colony-enhancing factor; PBEF). Ye et al44 han estudiado dos cambios en un único par de bases (single-nucleotide polymorphisms, SNP) en un grupo de enfermos con daño pulmonar agudo secundario a sepsis, un grupo de pacientes con sepsis grave y un grupo de sujetos sanos. Los portadores del haplotipo GC en las bases T-1001G y C-1543T tuvieron mayor incidencia de daño pulmonar agudo (riesgo relativo 7,7; intervalo de confianza para el 95%: 3,01 a 19,75; p < 0,001).
INCIDENCIA
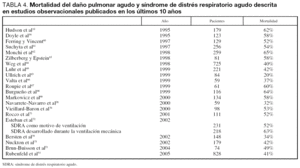
La primera estimación realizada por un panel de expertos fue de 70 casos por 100.000 habitantes45. Varios estudios posteriores29,30,46-53 han estimado la incidencia entre 1,5 y 80 casos por 100,000 habitantes-año (tabla 3). Aproximadamente, entre un 18% y un 25% de los casos cumplen criterios de oxigenación para daño pulmonar agudo pero no para SDRA. La variación en los resultados entre los estudios son debidos a diferencias en la metodología utilizada para calcular la incidencia como son diferencias en el denominador, tipo de hospital, criterios de ingreso en las UCI y criterios diagnósticos de SDRA.
PRONÓSTICO
Mortalidad
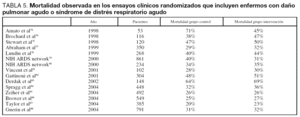
Existe controversia acerca de si la mortalidad del SDRA ha disminuido a lo largo del tiempo. Suchyta et al54 fueron los primeros en reportar que los pacientes que cumplían criterios para ser incluidos en un estudio de oxigenación extracorpórea tenían en 1970 una mortalidad del 90% y esta mortalidad descendió al 50% en los años noventa. Milberg et al55 analizan la mortalidad de 918 pacientes que cumplen criterios de SDRA ingresados en la UCI desde 1983 a 1993. La tasa de mortalidad a principios de los años ochenta se situó alrededor de un 60%, y se observa un descenso de la mortalidad a finales de dicha década hasta una mortalidad en 1993 de 36%. La disminución más significativa de la mortalidad se produjo en los enfermos con SDRA secundario a sepsis (de 67% en 1990 a 40% en 1993). Abel et al56 observaron una disminución de la mortalidad de 60% a 30% cuando compararon el período 1990-1993 con el 1993-1996. Recientemente, Stapleton et al57 compararon la mortalidad de los enfermos en el mismo hospital, utilizando la misma metodología y en 4 años diferentes (1982, 1990, 1994 y 1998) y encuentran una reducción de la mortalidad desde un 67% en 1982 hasta un 37% en 1998. A diferencia de Milberg et al55 estos autores describen que la disminución en la mortalidad de los enfermos con SDRA secundario a sepsis fue menos significativa que en el resto de etiologías. Por el contrario, Krafft et al58 en un análisis de 101 artículos publicados entre 1967 y 1994, incluyendo a 3.264 pacientes con SDRA, encuentran una tasa media de mortalidad de 53% ± 22% sin cambios significativos a lo largo del tiempo: en los 22 estudios publicados en 1994 tuvieron una mortalidad media de 51% ± 19%.
La mortalidad observada en los estudios publicados desde 1995 está entre un 20% y un 71% dependiendo del case-mix incluido en el estudio19,30,49,51,53,59-88. Es interesante la observación de que la mortalidad reportada en ensayos clínicos randomizados es inferior a la descrita en estudios observacionales (tablas 4 y 5). Probablemente, la principal razón para explicar estas diferencias es la selección de enfermos que se realiza para su inclusión en los ensayos clínicos. Suchyta et al89 observaron una mortalidad significativamente mayor en los enfermos que no fueron recogidos en tres ensayos clínicos de la ARDS network en comparación con los enfermos incluidos (44% frente a 34%).
Factores asociados a la mortalidad
Múltiples factores han sido relacionados con la mortalidad de los enfermos con daño pulmonar agudo o SDRA (tabla 6), siendo el fracaso multiorgánico la causa más frecuente de muerte.
El fracaso respiratorio per se ha sido reportado como causa de muerte en un 9%-27% de los enfermos con SDRA12,28,29,57,59,60,68,92. El papel de la hipoxemia como factor pronóstico es un aspecto discutido en la literatura. Luhr et al48 observaron una mortalidad de 41% en pacientes con insuficiencia respiratoria aguda, un 42% en pacientes con daño pulmonar agudo y un 41% en pacientes con SDRA. Estos datos confirman el hallazgo de los mismos autores en un estudio previo93 donde no encontraron relación entre la mortalidad y la gravedad de la hipoxemia. Roupie et al67 hallan una mayor mortalidad en los enfermos con una relación PaO2/FIO2 < 200, pero los índices de oxigenación no fueron parámetros asociados a la mortalidad. Por el contrario, otros autores han observado una relación directa entre el nivel del deterioro de la oxigenación y la mortalidad28-31,94. Maunder et al94 describen una mortalidad de 84% en los enfermos que al tercer día del diagnóstico del SDRA tienen una relación PaO2/FIO2 < 150 frente a una mortalidad del 30% en los enfermos con relación PaO2/FIO2 > 250. Esta observación ha sido confirmada en dos estudios más recientes28,31 donde encuentran que la relación PaO2/FIO2 en el tercer día después del diagnóstico del SDRA se asocia independientemente con la mortalidad. Bersten et al30 describen que los enfermos con daño pulmonar agudo que fallecen tuvieron una relación PaO2/FIO2 menor que los supervivientes (153 ± 80 frente a 186 ± 73; p < 0,001) y que la mortalidad de los enfermos con criterios de SDRA fue mayor que la de los enfermos con daño pulmonar agudo. En un análisis secundario de los enfermos con SDRA incluidos en un estudio internacional de ventilación mecánica72 encontramos que uno de los factores asociados con la mortalidad fue la necesidad de fracciones inspiradas de oxígeno altas (odds ratio para cada 0,1 de incremento de la FIO2: 1,8; intervalo de confianza para el 95%: 1,5 a 2,1; p < 0,001) pero no la relación PaO2/FIO291.
Dos estudios62,73 reportan la relación entre variables de mecánica pulmonar y la mortalidad. Monchi et al62 encuentran que uno de los factores asociados a la mortalidad fue el índice de oxigenación definido como presión media en la vía aérea × FIO2 × 100/PaO2 (odds ratio 1.05 por punto; intervalo de confianza al 95%: 1,02 a 1,09). Nuckton et al73 describen que los enfermos que fallecen tienen una fracción de espacio muerto mayor que los enfermos que sobreviven (0,63 ± 0,10 frente a 0,54 ± 0,09, p < 0,001). La fracción de espacio muerto fue un factor asociado, de forma independiente, con la mortalidad (odds ratio para cada incremento de 0,05: 1,45; intervalo de confianza para el 95%: 1,15 a 1,83; p = 0,002). Otro factor asociado con la mortalidad fue la compliance respiratoria cuasiestática (odds ratio para cada disminución de 1 ml/cmH2O: 1,06; intervalo de confianza para el 95%: 1,01 a 1,10; p = 0,01).
Un aspecto menos descrito es la relación entre el momento de aparición del SDRA y la mortalidad. En un estudio no publicado, citado por Vincent et al95, los autores encuentran datos que sugieren que en enfermos con daño pulmonar agudo puede haber diferencias en el pronóstico que dependerían del momento de aparición del fracaso respiratorio. En este sentido, Esteban et al72 describen que los enfermos cuyo motivo principal de ventilación mecánica fue SDRA tuvieron un menor riesgo de mortalidad (odds ratio 1,44; intervalo de confianza al 95%: 1,03 a 2,01) que los enfermos que desarrollan SDRA durante la ventilación mecánica (odds ratio 1,66; intervalo de confianza al 95%: 1,15 a 2,38). Esta primera aproximación fue confirmada recientemente por Ferguson et al91, que encuentran que el desarrollo de SDRA como complicación durante la ventilación mecánica fue una variable asociada con la mortalidad (odds ratio: 2,09; intervalo de confianza al 95%: 1,25 a 3,49).
Calidad de vida
Los pacientes que sobreviven presentan secuelas que afectan a la calidad de vida relacionada con la salud, a la función respiratoria actividad física, y a la función cognitiva y emocional.
Para determinar si la pérdida de calidad de vida relacionada con la salud en los enfermos con SDRA es secundaria al síndrome por sí mismo o a otros aspectos relacionados con el proceso causante del SDRA, Davidson et al96 realizaron un estudio de casos apareados incluyendo a 73 pacientes con SDRA y 73 pacientes con factores de riesgo para el mismo. El estado de salud de los enfermos fue evaluado mediante escalas genéricas de salud (Medical Outcomes Study 36-Item Short Form Health Survey, Standard Form; SF-36) y escalas específicas que evalúan la función pulmonar (St George's Respiratory Questionnaire; SGRQ). Los enfermos con SDRA mostraron una reducción significativa en ambas escalas y las mayores limitaciones se observaron en los apartados correspondientes a la capacidad física y pulmonar. Otros autores97-99, utilizando estas escalas u otras como la de Calidad de Bienestar (QWB), también describen un deterioro en la calidad de vida de los enfermos supervivientes a los 6 y a los 12 meses del alta del hospital.
Se han descrito alteraciones en las pruebas de función pulmonar como disminución del volumen espirado máximo en el primer segundo (VEMS)99,100 que se pueden mantener durante el primer año tras el alta99, disminución en la capacidad vital forzada99 y en la capacidad de difusión del monóxido de carbono (DLCO)98,101,102. Estas alteraciones en las pruebas respiratorias se han considerado el motivo principal del deterioro observado en la escala de calidad de vida98,99.
La actividad física estimada por el SF-36 aumentó, en 109 pacientes supervivientes, desde 0 puntos a los 3 meses a 25 puntos a los 12 meses, siendo la puntuación en la población normal de 84 puntos102. Este deterioro físico se confirma en el mismo estudio, y en el de Schelling et al100, mediante la prueba de 6 minutos de marcha. La distancia recorrida en 6 minutos aumentó desde 281 metros a los 3 meses hasta 422 metros a los 12 meses, valores inferiores a lo predicho102 y equiparable a lo observado en la población con patología respiratoria crónica100.
En lo referente a las secuelas neuropsicológicas, los estudios103,104 que han evaluado este aspecto han encontrado que un significativo porcentaje de los enfermos supervivientes presentan a su salida del Hospital y a largo plazo un deterioro en la función cognitiva. Hopkins et al103 describen que un 46% de pacientes supervivientes tienen, al año del alta del Hospital, al menos una de estas alteraciones: problemas de memoria, dificultad para la concentración y/o la atención y disminución en la velocidad de procesamiento mental. Los mismos autores evaluaron las secuelas neuropsicológicas a los 2 años y encuentran que en un 47% de los enfermos persisten esas secuelas, fundamentalmente ansiedad y depresión104. Estas alteraciones psíquicas se han relacionado con el desarrollo de un síndrome de estrés postraumático105,106.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses