Resucitación del paciente con sepsis y shock séptico
Más datosLa reanimación con fluidos y vasopresores es, junto con la terapia antimicrobiana y el control del foco de infección, un elemento fundamental del tratamiento de la sepsis y el shock séptico.
Actualmente no existe un protocolo aceptado en el que basar la reanimación de estos pacientes y la Surviving Sepsis Campaign propone medidas controvertidas y sin suficiente respaldo de la evidencia como para establecer recomendaciones en firme.
Proponemos una estrategia de reanimación adaptada a la situación de cada paciente: en el paciente en el que se sospecha una sepsis comunitaria consideramos que la administración precoz de 30ml/kg de cristaloides es eficaz y segura; en el paciente con sepsis nosocomial debemos realizar una evaluación más profunda antes de iniciar una reanimación agresiva. En pacientes que no responden a la resucitación inicial es necesario incrementar la monitorización y, en función del perfil hemodinámico, administrar más fluidos, un segundo vasopresor o inotropos.
Fluid and vasopressor resuscitation is, along with antimicrobial therapy and control of the focus of infection, a basic issue of the treatment of sepsis and septic shock.
There is currently no accepted protocol that we can follow for the resuscitation of these patients and the Surviving Sepsis Campaign proposes controversial measures and without sufficient evidence support to establish firm recommendations.
We propose a resuscitation strategy adapted to the situation of each patient: in the patient in whom community sepsis is suspected, we consider that the early administration of 30mL/kg of crystalloids is effective and safe; in the patient with nosocomial sepsis, we must carry out a more in-depth evaluation before initiating aggressive resuscitation. In patients who do not respond to initial resuscitation, it is necessary to increase monitoring level and, depending on the hemodynamic profile, administer more fluids, a second vasopressor or inotropes.
La reanimación con fluidos y vasopresores es, junto con la terapia antimicrobiana y el control del foco de infección, un elemento fundamental del tratamiento de la sepsis y el shock séptico.
A principios de siglo, Rivers et al.1 publicaron un ensayo clínico que comparaba la reanimación de pacientes con sepsis (sepsis grave en aquel momento) y shock séptico mediante un protocolo guiado por objetivos con el tratamiento estándar. Dicho protocolo, que incluía la administración de fluidos, vasopresores, agentes inotrópicos y transfusión de concentrados de hematíes, reducía la mortalidad de pacientes con hipotensión o hipoperfusión inducida por sepsis (lactato ≥ 4 mmol/l). A pesar de la controversia, este protocolo (conocido como early goal-directed therapy [EGDT] o protocolo de Rivers) fue el recomendado en las primeras ediciones de las guías de la Surviving Sepsis Campaign (SSC)2-4. Sin embargo, la publicación más reciente de 3 grandes ensayos clínicos, que incluyeron a más de 4.000 pacientes con shock séptico comparando EGDT con tratamiento estándar, demostró que aplicar un protocolo rígido no obtenía mejores resultados e, incluso, podría relacionarse con un mayor consumo de recursos hospitalarios5-9. Consecuentemente, en las últimas ediciones de la SSC no se recomienda seguir EGDT (ni ningún otro protocolo específico) para la reanimación del paciente con sepsis10,11.
El beneficio de las medidas propuestas por la SSC en lugar de EGDT también es controvertido y no se ha demostrado en ensayos clínicos, solo en estudios observacionales y, casi siempre, en combinación con otras intervenciones12,13, pero, a pesar de esta controversia y de la ausencia de evidencia científica suficiente para establecer recomendaciones firmes, la adherencia a las recomendaciones de la SSC es elevada14.
Nuestro objetivo es revisar la evidencia disponible y proponer una estrategia de reanimación del paciente con sepsis y shock séptico.
Criterios de activación de un protocolo de reanimaciónEn los últimos años hemos asistido a un intenso debate acerca de la recomendación de iniciar tratamiento antimicrobiano dentro de la primera hora de sospecha de sepsis10,15, que han llevado incluso a sociedades, como Infectious Diseases Society of America (IDSA) a no respaldar las guías de la SSC16,17. Uno de los argumentos en contra es la alta frecuencia de casos en los que la sospecha inicial de sepsis no se confirma con posterioridad, incluso en pacientes que ingresan en ls UCI con el diagnóstico de shock séptico18,19. Estos pacientes estarían recibiendo varias dosis de antibióticos de amplio espectro, sin ningún beneficio clínico, pero con los consiguientes efectos secundarios, toxicidades y consumo de recursos.
Del mismo modo, son bien conocidos los efectos perjudiciales de la sobrecarga de fluidos20; teniendo en cuenta, además, que entre las entidades no infecciosas que pueden simular una sepsis aparecen enfermedades como el infarto agudo de miocardio, la embolia pulmonar o la insuficiencia cardíaca18, situaciones en las que incluso el aporte de pequeñas cantidades de fluidos puede ser perjudicial, esto cobra especial relevancia.
A pesar de contar ya con 3definiciones de sepsis21-23, la «sospecha de infección», imprescindible para iniciar un tratamiento precoz, sigue basándose en criterios subjetivos. Pero, incluso en esta situación, en la que debemos combinar la urgencia de iniciar un tratamiento (fluidos, antibióticos, etc.) con la incertidumbre del diagnóstico, la realidad es que solo en el 18% de los pacientes etiquetados de sepsis en el Servicio de Urgencias18 y en el 13% de los pacientes que ingresan en UCI con el mismo diagnóstico19 se descarta por completo (de forma retrospectiva) la existencia de una infección. Un escenario más complejo es la detección de la sepsis en el paciente crítico, situación en la que ni la fiebre, de etiología infecciosa solo en el 50% de los casos24, ni la presencia de SRIS han demostrado una sensibilidad o especificidad suficiente25,26; para mayor dificultad, la interpretación de las alteraciones hemodinámicas será también más compleja, debido a la influencia de múltiples factores (complicaciones no infecciosas, fármacos, parámetros del ventilador, etc.).
La «hipoperfusión tisular inducida por sepsis (HTIS)» es el criterio empleado por la SSC para el inicio de la reanimación del paciente con sospecha de sepsis. Si bien en las primeras ediciones de las guías este concepto consistía en la presencia de hipotensión arterial persistente tras la administración inicial de fluidos o la presencia de un lactato ≥ 4 mmol/l, en 2016 este concepto fue equiparado al de sepsis, ya que se indica que «la HTIS puede manifestarse como disfunción orgánica o descenso de la presión arterial (PA) y aumento del lactato sérico» (tabla 1). Ante la detección o la sospecha de HTIS se establece la recomendación de iniciar la reanimación de forma inmediata; sin embargo, no existe evidencia que respalde dicha recomendación (graduada como mejor práctica) y este punto es uno de los considerados prioritarios a investigar en los próximos años27,28. En los ensayos clínicos que evaluaron diferentes protocolos de reanimación, su activación se estableció en función de las cifras de PA o lactato (tabla 2). Por otro lado, un grupo de expertos de la European Society of Intensive Care Medicine (ESICM) recomienda combinar parámetros de exploración física (alteraciones cutáneas, del nivel de consciencia y oliguria) con el análisis de la frecuencia cardíaca, la PA y los niveles de lactato para el diagnóstico de disfunción circulatoria aguda y como activación de la resucitación; además, recomiendan dirigir la resucitación a la normalización de dichas variables, pero con especial prudencia en lo que respecta a la diuresis, ya que estará influida por múltiples factores (no únicamente hemodinámicos) y por presentar una respuesta, en no pocas ocasiones, más lenta29.
Definiciones hipoperfusión inducida por sepsis
| Edición SSC | Definición |
|---|---|
| SSC 20042 | Hipotensión arterial o acidosis láctica |
| SSC 20083 | Hipotensión arterial persistente tras carga de fluidos inicial o lactato ≥ 4 mmol/l |
| SSC 20124 | Hipotensión arterial persistente tras carga de fluidos inicial o lactato ≥ 4 mmol/l |
| SSC 201610 | Disfunción órgano±hipotensión arterial y aumento de lactato |
| SSC 202111 | No definida, remite a SSC 2016 |
Resumen de los principales ensayos clínicos de reanimación de la sepsis
| Estudio | Definición sepsis empleada | Ámbito | Criterios activación protocolo | Intervenciones | Principales resultados |
|---|---|---|---|---|---|
| Rivers et al.1 | Sospecha de infección+SRIS | Urgencias | PAA ≤ 90 tras 20-30 ml/kg en 30 minolactato ≥ 4 mmol/l | EGDT vs. tratamiento estándar | Mortalidad hospitalaria:EGDT 30,5%; control: 46,5%, p=0,009 |
| PROCESS6 | Sospecha de infección+SRIS | Urgencias | PAS ≤ 90 (o necesidad de vasopresores) tras ≥ 20 ml/kg o 1.000 mla en 30 minolactato ≥ 4 mmol/l | EGDT vs. tratamiento estándar vs. tratamiento habitual | Mortalidad 60 días:EGDT: 21,0%Estándar: 18,2%Habitual: 18,9%p=0,83 |
| PROMISE7 | Sospecha de infección+SRIS | Urgencias | PAS <90 o PAM <65 tras 1.000ml en 60 minolactato ≥ 4 mmol/l | EGDT vs. tratamiento habitual | Mortalidad 90 días:EGDT: 29,5%Habitual: 29,2%p=0,90 |
| ARISE5 | Sospecha de infección+SRIS | Urgencias | PAS <90 o PAM <65 tras 1.000ml en 60 minolactato ≥ 4 mmol/l | EGDT vs. tratamiento habitual | Mortalidad 90 días:EGDT: 18,6%Habitual: 18,8%p=0,90 |
| ANDROMEDA-SHOCK43 | Infección sospechada/confirmada | Urgencias, 71% | Lactato ≥ 2 mmol/l y necesidad de vasopresores para TAM ≥ 65mmHg tras ≥ 20 ml/kg en 60 min | Resucitación guiada por lactato vs. relleno capilar | Mortalidad 28 días:Lactato: 43,4%Relleno capilar: 34,9%p=0,06 |
PAM: presión arterial media; PAS: presión arterial sistólica; SRIS: síndrome de respuesta inflamatoria sistémica.
Leisman et al., en una cohorte de pacientes con sepsis (definida por la sospecha de infección y presencia de criterios de SRIS) e hipotensión arterial, encontraron que el inicio precoz de la fluidoterapia (en las 2primeras horas, administración de 30ml/kg) se relacionaba con una mayor tasa de resolución de la hipotensión arterial (sin necesidad de vasopresores), y con un mejor pronóstico (menor necesidad de ingreso en UCI y de ventilación mecánica y menor mortalidad hospitalaria); observaron también que la resolución de la hipotensión fue más frecuente en pacientes atendidos en el Servicio de Urgencias (el 68,5% de estos pacientes normalizaron su PA únicamente con la carga de fluidos), en comparación con aquellos pacientes que desarrollan una sepsis durante su estancia hospitalaria. Los pacientes con insuficiencia cardíaca, hipotermia, inmunodepresión, hiperlactemia y coagulopatía tienen menores probabilidades de resolver la hipotensión arterial solo con fluidos; sin embargo, estos criterios clínicos no son suficientes para seleccionar o descartar pacientes subsidiarios de recibir sueroterapia intensiva30,31.
Por otro lado, en pacientes que ingresan en el hospital con el diagnóstico de sepsis se ha observado que una fluidoterapia inicial restrictiva, aplicada de forma indiscriminada, no conlleva una menor incidencia de insuficiencia respiratoria, ni siquiera en aquellos con comorbilidades como cirrosis, enfermedad renal terminal o insuficiencia cardíaca32,33.
La situación es diferente en el paciente ingresado en la UCI. Solo un 50-70% de los pacientes tratados mediante ventilación mecánica se pueden clasificar como respondedores a fluidos (definido como incremento del gasto cardíaco [GC] con relación a la administración de una carga de fluidos, sin tener en cuenta la relevancia clínica de dicho incremento)34,35.
La combinación de alta frecuencia de concordancia entre la sospecha de sepsis y el diagnóstico final, la alta tasa de respuesta a fluidos y la ausencia de efectos secundarios hacen que, ante la sospecha de sepsis y HTIS en el paciente en Urgencias, esté justificado el inicio de una resucitación intensiva. Por el contrario, la mayor dificultad en el diagnóstico y la menor respuesta a fluidos nos obligará a analizar en profundidad y con mayor prudencia cada situación en el caso del paciente ingresado en la UCI36.
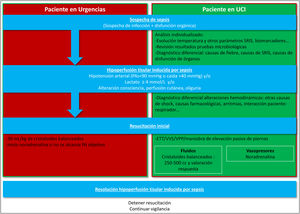
Resucitación inicial (fig. 1)Sepsis adquirida en la comunidadComo hemos comentado, el primer paso en la resucitación del paciente con sospecha de sepsis en el Servicio de Urgencias, y de acuerdo con las recomendaciones de las guías y los bundles de la SSC11,15, será la administración de una carga de fluidos de 30ml/kg de peso ideal, que se debe iniciar en la primera hora tras el diagnóstico y completar en las primeras 3 h. A pesar de que la evidencia es de baja calidad, es una intervención segura y que se asocia con una respuesta clínica favorable en un alto porcentaje de pacientes. Respecto al tipo de fluidos, los resultados del ensayo clínico SMART y el análisis de su subgrupo de pacientes con sepsis (en los que la resucitación con cristaloides balanceados redujo la mortalidad) hacen que se prefieran las soluciones balanceadas sobre el suero salino 0,9%37,38 y así lo refleja la SSC11; sin embargo, un ensayo clínico más reciente no encuentra beneficios en cuanto a reducción de mortalidad o de fracaso renal en los pacientes resucitados con un cristaloide balanceado, ni en la población crítica en general, ni en el paciente con sepsis (subgrupo con más de 2000 pacientes)39 y lo mismo ocurre en el estudio de Zampieri et al.40 con un número similar de pacientes con sepsis. Estos nuevos y contradictorios datos se han incluido (con otros 12 ensayos clínicos) en un metaanálisis que concluye que es altamente probable que los cristaloides balanceados reduzcan la mortalidad en el paciente crítico, en comparación con el suero salino 0,9%41. A pesar de la controversia, consideramos que los cristaloides balanceados ofrecen ventajas sobre el salino 0,9% (entre ellas una menor aparición de acidosis metabólica hiperclorémica y una posible reducción de la mortalidad), por lo que deben ser el fluido de elección, reservándose el salino 0,9% para aquellas situaciones donde no se encuentren disponibles y siempre monitorizando la cloremia y el pH36.
El objetivo de la resucitación debe ser resolver la HTIS o la disfunción circulatoria aguda, esto es: normalización de la PA, del lactato y de las alteraciones cutáneas (relleno capilar) y neurológicas secundarias a dicha hipoperfusión29,42,43.
Si la fluidoterapia inicial alcanza estos objetivos, el paciente no necesitará mayor resucitación, aunque se debe mantener una monitorización mínima de su evolución.
Si, por el contrario, no se alcanzan los objetivos terapéuticos, debemos continuar la reanimación. Existe unanimidad en que la noradrenalina es el vasopresor inicial de elección en el paciente con sepsis que no alcanza una PA media ≥ 65mmHg, pero no respecto al mejor momento para iniciarla (durante la administración de la fluidoterapia inicial o tras finalizarla)14,15. Disponemos, sin embargo, de datos que indican que el inicio precoz de vasopresores es beneficioso (reducción de mortalidad, menor retraso en alcanzar la PA objetivo, menor necesidad de fluidos), por lo que se recomienda no retrasar su inicio44-46, ni siquiera en ausencia de un catéter venoso central47.
Tras la fluidoterapia inicial, asociada o no a vasopresores, es posible que continuar la administración de fluidos sea beneficioso para algunos pacientes. Pasamos de la primera fase, de rescate, a una segunda fase, de optimización48 y nos encontramos ante la dicotomía que supone la administración liberal de fluidos, con la consiguiente sobrecarga hídrica, asociada a un peor pronóstico49 o la fluidoterapia restrictiva, cuya aplicación indiscriminada tampoco ha demostrado mejorar la supervivencia50. Por lo tanto, en esta fase de optimización, la decisión de continuar administrando fluidos o tomar otras medidas debe basarse en parámetros objetivos51 y para ello será necesario incrementar el nivel de monitorización del paciente, mediante, al menos, la realización de un ecocardiograma y la inserción de un catéter arterial y de un catéter venoso en la vena cava superior29,42,52.
Sepsis adquirida en el paciente críticoParadójicamente, la detección de la sepsis y de la hipoperfusión tisular o disfunción circulatoria secundaria puede ser más compleja en el paciente crítico. A pesar de disponer de gran cantidad de información (monitorización de constantes, datos analíticos, etc.), tanto los parámetros inflamatorios como hemodinámicos del paciente crítico se ven influidos por múltiples factores. Esta heterogeneidad dificulta el establecimiento de recomendaciones generales, siendo necesario, en todo paciente, revisar e integrar toda la información disponible para realizar una aproximación al diagnóstico de sepsis y de hipoperfusión secundaria.
En el mismo sentido, la respuesta a la fluidoterapia en el paciente crítico es muy variable y los principales ensayos clínicos de resucitación, en los que se basa la recomendación de administrar 30ml/kg de cristaloides, fueron realizados en pacientes con sepsis de origen comunitario resucitados en el Servicio de Urgencias1,5-7. Por estos motivos, no se debe iniciar la resucitación con grandes cantidades de fluidos sin una evaluación objetiva de la precarga-dependencia del paciente53,54. En aquellos pacientes con variables dinámicas o respuesta a la maniobra de elevación pasiva de piernas que predigan respuesta favorable a fluidos, la administración de cargas de 250-500 cc y la evaluación de la respuesta es una opción55; en caso contrario, debemos priorizar el inicio de vasopresores, siendo la noradrenalina el de primera elección56-58.
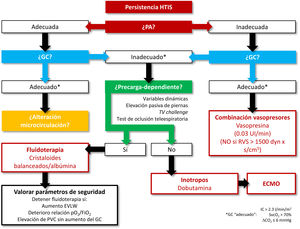
Resucitación del shock refractario (fig. 2)El shock séptico refractario, que tiene lugar en un 6-15% de las sepsis59, no está bien definido. Conceptualmente, sería la situación de HTIS a pesar de una reanimación adecuada con fluidoterapia y vasopresores, pero no hay consenso en cuanto a la dosis de fluidos y fármacos vasoactivos necesaria para definir un shock como refractario, variando desde 0,25 hasta 4μg/kg/min de noradrenalina (o dosis equivalentes de otra fármaco), siendo lo más habitual considerar una dosis superior a 0,6-1μg/kg/min60-64.
Reanimación shock refractario.
EVLW: agua extravascular pulmonar (extravascular lung water); GC: gasto cardíaco; HTIS: hipoperfusión tisular inducida por sepsis; IC: índice cardíaco; PA: presión arterial; PVC: presión venosa central; RVS: resistencias vasculares sistémicas; SvcO2: saturación venosa central de O2; TV: tidal volume; ?ΔCO2: diferencia veno-arterial de CO2.
Aquellos pacientes en los que la administración de fluidoterapia (30ml/kg de cristaloides balanceados) y un vasopresor (noradrenalina) a dosis bajas no resuelva la HTIS necesitarán un grado mayor de monitorización para establecer el perfil hemodinámico del paciente65; lo mismo ocurre en aquellas situaciones clínicas que compliquen el tratamiento, como la insuficiencia respiratoria aguda secundaria a síndrome de distrés respiratorio agudo (SDRA) o la disfunción miocárdica. En estos casos, será necesaria la monitorización continua del GC, de variables dinámicas de respuesta a volumen y la medición de parámetros de seguridad como el agua pulmonar extravascular (extravascular lung water [EVLW]) o el índice de permeabilidad vascular pulmonar [IPVP]). En general, se prefiere el empleo de dispositivos menos invasivos, como los basados en la termodilución transpulmonar (especialmente en situación de SDRA, dado que nos proporciona el valor del EVLW) frente al catéter de arteria pulmonar (reservado para pacientes con hipertensión pulmonar y fracaso de ventrículo derecho)42,52,66,67.
La ecografía proporciona información para identificar el tipo de shock, monitorizar la respuesta al tratamiento instaurado y valorar eventuales complicaciones. No existen dudas acerca de su valor, pero debemos de tener en cuenta que es una herramienta de evaluación puntual y no continua.
Llegado este punto, para continuar la reanimación debemos identificar qué factores están provocando la persistencia de la HTIS: vasodilatación excesiva, disfunción miocárdica, alteración de la microcirculación/disfunción mitocondrial o la combinación de algunos de ellos. Así, el enfoque terapéutico debe ser orientado a la situación identificada68.
Vasodilatación excesivaEn aquellos casos en que no se alcanza una adecuada PA media a pesar de la perfusión de noradrenalina a 0,25-0,5μg/kg/min, las últimas guías de la SSC sugieren asociar vasopresina11 ya que facilita alcanzar la PA media objetivo, mejorando además la perfusión gastrointestinal69 con menor riesgo de fibrilación auricular70 y reduciendo las necesidades de noradrenalina. Conociendo el mecanismo de acción de la vasopresina, podemos recomendarla en pacientes en los que predomine la vasodilatación a pesar de la perfusión de noradrenalina, es decir, en situaciones sin disfunción miocárdica y con resistencias vasculares sistémicas que no estén ya por encima de los niveles normales (< 1.500dyn×s/cm5). A pesar de que en alguno de los ensayos clínicos se emplean dosis de hasta 0,06 UI/min, se recomienda no superar los 0,03 UI/min, como se recoge en su ficha técnica, debido al riesgo de isquemia cardíaca, digital o esplácnica71-73.
En caso de persistencia de hipoperfusión secundaria a un exceso de vasodilatación a pesar de noradrenalina y vasopresina, la SSC sugiere la administración de adrenalina11, que podría ser especialmente útil en los casos de disfunción miocárdica asociada y otra opción a valorar, no disponible actualmente en España, es la angiotensina ii74.
Bajo GCSi bien es complejo determinar qué cifra de GC es baja, o inapropiadamente baja, existen algunos parámetros que nos pueden ayudar. Uno de ellos es la diferencia venoarterial de CO2 (delta de pCO2 o ΔCO2): valores superiores a 6mmHg indican que el GC es insuficiente, por lo que podemos utilizarlo como trigger de medidas dirigidas a aumentarlo75,76.
Para incrementar el GC disponemos de 2estrategias terapéuticas: aporte de fluidos o inicio de fármacos con efecto inotrópico positivo. La elección la basaremos en la integración de parámetros de respuesta a fluidos (variables dinámicas o respuesta a la elevación pasiva de piernas)77,78, de parámetros de seguridad (presión venosa central, EVLW, IPVP, etc.) y en el posible impacto negativo de la sobrecarga de fluidos79,80.
En caso de que el paciente no presente datos de precarga-dependencia y consideremos que el GC es bajo o inadecuadamente bajo (la disfunción miocárdica inducida por sepsis se define por la presencia de bajo GC y presiones de llenado elevadas), asociaremos una perfusión de dobutamina. Además de la asociación de noradrenalina y dobutamina, la SSC sugiere el empleo de adrenalina, considerando ambas pautas equivalentes11,81. En caso de no respuesta o ante la aparición de eventos adversos, el inotropo debe retirarse. En los últimos años, se ha analizado el posible papel del levosimendán; sin embargo, no se han podido documentar beneficios de su empleo en la sepsis82-84.
Si el paciente es precarga-dependiente, sabemos que su GC aumentará con alta probabilidad con la administración de fluidos, sin embargo, debemos ser conscientes de que esta respuesta puede ser insuficiente79 o transitoria, lo que reducirá su eficacia clínica85; por este motivo, es necesario evaluar también el riesgo asociado a la fluidoterapia, especialmente en pacientes con SDRA.
La decisión de continuar con la fluidoterapia debe estar basada en parámetros de precarga-dependencia o respuesta a fluidos: respuesta a elevación pasiva de piernas o variables dinámicas (variación de la presión de pulso [VPP] o del volumen sistólico [VVS])77,78,86. Debemos ser conscientes de que estas últimas no son válidas en pacientes con impulso respiratorio o arritmias cardíacas y son menos sensibles en pacientes ventilados con bajo volumen corriente; sin embargo, en los últimos años se han propuesto algunos procedimientos para superar estas limitaciones, como el tidal volume challenge y del test de oclusión teleespiratoria. El primero de ellos identifica a los pacientes precarga-dependientes en función de los cambios en VPP o VVS al incrementar el volumen corriente de 6 a 8ml/kg durante 1 min87. El test de oclusión teleespiratoria consiste en realizar una pausa de 15 s al final de espiración y valorar la repercusión en el GC88.
Si bien los fluidos de elección en la resucitación inicial son los cristaloides balanceados, en este momento podríamos combinarlos con la administración de albúmina, que ha demostrado, en los subgrupos de pacientes con shock séptico de 2ensayos clínicos, mejorar la supervivencia89,90; sin embargo, no podemos establecer una recomendación firme respecto a la dosis o el momento de inicio89,90.
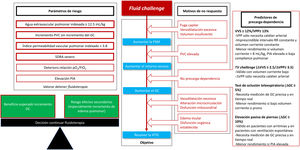
Otra opción razonable para detectar pacientes precarga-dependientes es el fluid challenge (FC) (fig. 3). Consiste en administrar 4ml/kg de cristaloides en 5-10 min y evaluar la respuesta hemodinámica91-93. Aunque el objetivo de la resucitación es corregir la HTIS, debemos observar, en primer lugar, si ha aumentado el GC, considerándose precarga-dependiente a aquel paciente en el que se produzca un aumento del GC superior al 10%92. En caso de que el GC no aumente, es posible que el volumen administrado haya sido insuficiente (el paciente continuaría siendo precarga-dependiente y las presiones de llenado no habrían aumentado), en cuyo caso se podría administrar un nuevo FC. Otra opción podría ser el aumento de dosis de vasopresores (o su inicio si no los está recibiendo) debido a la venoconstricción que producen, estresando el volumen acumulado en el sistema venoso y aumentando la presión sistémica media (determinante, junto con la presión venosa central, del retorno venoso: retorno venoso=presión sistémica media – presión venosa central)94.
Fluid challenge.
GC: gasto cardíaco; HTIS: hipoperfusión tisular inducida por sepsis; PIA: presión intraabdominal; PSM: presión sistémica media; PVC: presión venosa central; SDRA: síndrome de distrés respiratorio agudo; TV: tidal volume; VPP: variación presión de pulso; VVS: variación de volumen sistólico.
En caso de que la fluidoterapia provoque un aumento de las presiones de llenado sin aumento del GC95, o se produzca un aumento de EVLW96,97 o un deterioro de la relación pO2/FiO2 deberíamos detener la fluidoterapia y valorar la necesidad de infundir dobutamina. En pacientes con SDRA grave e IPVP elevado debemos ser conscientes de que la respuesta hemodinámica será transitoria y, probablemente, empeore la función pulmonar, por lo que la decisión de administrar un FC se tomará sopesando el posible beneficio del incremento del GC en contraposición con el riesgo del deterioro de la situación respiratoria80.
Alteración de la microcirculación/disfunción mitocondrialAun en el caso de que logremos aumentar el GC (mediante inotropos, fluidos o ambos) y la PA media (bien al aumentar el GC, bien con la infusión de uno o más vasopresores), existe la posibilidad de que persista la HTIS. En este caso, podemos suponer que se ha perdido la coherencia entre la macrocirculación (que habríamos optimizado) y la microcirculación98. A día de hoy, a pesar de que existen diferentes sistemas de monitorización de la microcirculación, ninguno de ellos es de empleo habitual en la práctica clínica99, por lo que, si no disponemos de ninguno de estos dispositivos, el diagnóstico será de exclusión. Por otro lado, ninguno de los tratamientos ensayados (vasodilatadores, anticoagulantes, prostaglandinas, óxido nítrico y otros) ha demostrado beneficio100,101. Otra opción sería la presencia de disfunción mitocondrial secundaria a la sepsis, encontrándonos en una situación similar a la anterior, en la que no disponemos de opciones de monitorización ni de tratamiento con eficacia mínimamente contrastada.
Debemos mencionar que los perfiles mencionados y los esquemas terapéuticos propuestos no son excluyentes entre sí y que, tanto los tratamientos administrados específicamente como parte de la reanimación como el resto de los tratamientos de la sepsis, pueden provocar que la situación hemodinámica del paciente varíe, haciendo necesario que tanto la monitorización como el tratamiento sean dinámicos y evolutivos. Debemos evaluar la persistencia de HTIS y detener la resucitación si se han alcanzado los objetivos e identificar la situación real del paciente antes de cada intervención.
Soporte extracorpóreoEl empleo de la extracorporeal membrane oxygenation (ECMO), en su modalidad veno-arterial (VA), ha mostrado resultados desesperanzadores en el shock séptico, con tasas de mortalidad superiores al 80%102. Sin embargo, analizando la literatura se encuentran resultados tremendamente dispares, con diferencias en la supervivencia extremadamente variables103. Cuando la ECMO se emplea en pacientes con función cardíaca preservada y shock de perfil fundamentalmente distributivo, la supervivencia es muy escasa104-106; es más, en un modelo animal de shock vasodilatador, el empleo de ECMO-VA no solo no aportó beneficios sobre el tratamiento convencional, si no que agravó el perfil hemodinámico de los animales, quienes requirieron progresivamente mayores dosis de vasopresores y fluidos107. Por el contrario, en aquella subpoblación de pacientes con disfunción miocárdica inducida por la sepsis, el ECMO-VA mejora la supervivencia al compararlo con el tratamiento médico aislado108, por lo que, teniendo en cuenta además su carácter reversible, la disfunción miocárdica refractaria a tratamiento médico sería la posible indicación de la ECMO en la sepsis, siempre en centros con experiencia en esta técnica67.
Tratamiento coadyuvanteDebido al riesgo de insuficiencia suprarrenal (total o relativa)109, en pacientes que necesiten vasopresores (noradrenalina ≥ 0,25μg/kg/min, durante al menos 4h) se recomienda asociar corticoides (200mg/día de hidrocortisona, repartidas en varias dosis o en perfusión continua11,72,110-112 durante 7 días o hasta que los vasopresores no sean necesarios, lo que suceda primero113).
Con relación a la resucitación metabólica, la SSC realiza una sugerencia contraria al uso de vitamina C en el paciente séptico11: los prometedores resultados iniciales de Marik et al.114 no se han confirmado en los ensayos clínicos aleatorizados desarrollados con posterioridad115-119. El empleo de vitamina C, corticoides y tiamina no ha demostrado reducir la mortalidad, ni la estancia media ni los días de ventilación mecánica ni la incidencia de fallo renal, aunque en un reciente metaanálisis sí se observa una reducción en la puntuación SOFA en el día 3 postaleatorización120. Si a este hallazgo unimos sus bases fisiopatológicas121, puede existir una subpoblación de pacientes en los que esta suplementación pueda resultar beneficiosa: la vitamina C es un importante antioxidante y desempeña un papel insustituible como cofactor en múltiples reacciones enzimáticas mitocondriales122, consumiéndose de forma rápida en las etapas iniciales de la sepsis. Con respecto a la tiamina, se presenta una situación parecida: en aquellos pacientes deficitarios de la misma es posible que su empleo sea beneficioso y disminuya la mortalidad123.
Otra posibilidad, no evaluada hasta ahora, es que la resucitación metabólica sea beneficiosa en aquellos pacientes en los que persista la HTIS a pesar de haberse restaurado/normalizado la PA y el GC; podemos inferir que el motivo será, o bien una alteración significativa de la microcirculación o bien una disfunción mitocondrial. En ambas situaciones, desde un punto de vista fisiopatológico, la resucitación metabólica podría ser de utilidad124.
DesresucitaciónEn los últimos años se ha comenzado a prestar atención a la eliminación de fluidos mediante la administración de diuréticos o técnicas de reemplazo renal, una vez que el paciente se ha estabilizado o, incluso, mientras está recibiendo soporte con vasopresores. Esta estrategia se combina habitualmente con una fluidoterapia restrictiva, generalmente guiada por parámetros de precarga-dependencia. Un metaanálisis publicado en 2016 observó una relación entre esta estrategia y un mayor número de días libres de ventilación mecánica y menor estancia en la UCI en el paciente crítico, pero la mayoría de los estudios no intentaban siquiera concretar el momento de inicio de este proceso50. Más recientemente se ha publicado un ensayo clínico que ha relacionado esta estrategia con una mayor mortalidad en el subgrupo de pacientes con sepsis125, por lo que debemos ser cuidadosos a la hora de adoptar esta estrategia.
La desresucitación es uno de los muchos aspectos sobre los que es necesaria más y mejor evidencia (tabla 3).
Reanimación en la sepsis. Preguntas (actualmente) sin respuesta
| Apartado | Aspectos a aclarar |
|---|---|
| HTIS | ¿Cuál es la mejor definición? |
| ¿Cuáles son los criterios de activación de un protocolo de reanimación? | |
| ¿Cuáles son los objetivos terapéuticos de un protocolo de reanimación? | |
| Tipo de fluidos | ¿Queda algún lugar para el suero salino 0,9%? |
| ¿Existen diferencias entre los distintos tipos de cristaloides balanceados? | |
| ¿En qué momento debemos iniciar la administración de albúmina? | |
| ¿Cuál es la dosis y concentración óptima y cómo podemos guiar la administración de albúmina? | |
| Dosis de fluidos | ¿Son 30 ml/kg la mejor dosis para la reanimación inicial de todos los pacientes? |
| ¿Qué hacer en un paciente precarga-dependiente, pero con parámetros de riesgo (como, por ejemplo, EVLW elevado) y sin criterios de SDRA grave? | |
| Vasopresores | ¿Debe ser la noradrenalina siempre el primer vasopresor? |
| ¿En qué momento debemos iniciar la administración de un segundo vasopresor? | |
| ¿Tenemos alternativas a la vasopresina como segundo vasopresor? | |
| ¿Mejora la administración de vitamina C la respuesta a vasopresores adrenérgicos? | |
| Inotropos | ¿En qué momento debemos iniciarlos? |
| ¿Existe alguna situación en la que la dobutamina no sea la mejor opción | |
| Monitorización | ¿En qué momento debemos pasar de una monitorización básica a una monitorización avanzada (semiinvasiva o invasiva)? |
| ¿Qué parámetros debemos monitorizar como guía de tratamiento en cada momento? | |
| Disfunción mitocondrial | ¿Cómo podemos diagnosticarla? |
| ¿De qué opciones terapéuticas disponemos? | |
| Alteraciones de la microcirculación | ¿Cómo podemos monitorizarla? |
| ¿De qué opciones terapéuticas disponemos? | |
| Resucitación metabólica | ¿Existe algún subgrupo de pacientes en el que sea beneficiosa? |
| Desresucitación | ¿Es una estrategia segura? |
| ¿Cuál es el mejor momento para iniciarla? | |
| ¿Cómo hacerlo?, ¿diuréticos, técnicas de reemplazo renal? |
Los autores declaran no tener conflicto de intereses.
Nota al suplementoEste artículo forma parte del suplemento «Resucitación del paciente con sepsis y shock séptico», que cuenta con el patrocinio de AOP HEALTH IBERIA.