Evaluar la utilización y efectividad de la estrategia invasiva de rutina (EIR) en pacientes con síndrome coronario agudo sin elevación de ST con disfunción renal en el mundo real.
MétodosEstudio de cohortes retrospectivo basado en el registro ARIAM-SEMICYUC (años 2011-2014). Se consideró que había disfunción renal cuando el GFR (Cockroft-Gault) era menor de 60ml/min (disfunción moderada) o de 30ml/min (disfunción grave). Se excluyeron los pacientes en los que la coronariografía precoz (<72h) se debió a shock cardiogénico o isquemia recurrente. El desenlace primario fue la mortalidad hospitalaria. El control del confounding se realizó mediante un análisis de propensión.
ResultadosSe analizan 4.279 pacientes, de los cuales un 26% tenía disfunción renal moderada y un 5% disfunción grave. Los pacientes con disfunción renal presentaron una mayor gravedad y comorbilidad, una mayor mortalidad hospitalaria (8,6 frente a 1,8%) y una menor utilización de la EIR (40 frente a 52%). Las OR ajustadas mediante emparejamiento para pacientes sin/con disfunción renal fueron de 0,38 (intervalo de confianza al 95% [IC95%] de 0,17 a 0,81) y 0,52 (IC95% de 0,32 a 0,87), respectivamente (p de interacción 0,4779). El impacto de la EIR (diferencia de riesgos ajustada) fue mayor en el grupo con disfunción renal (−5,1%, IC95% entre −8,1 y −2,1, frente a −1,6%, IC95% entre −2,6 y −0,6, p de interacción=0,0335). Tampoco se detectó interacción significativa respecto a los demás enlaces considerados (mortalidad en UCI o a los 30 días, riesgo combinado de muerte o infarto, fracaso renal agudo o hemorragias moderadas/graves).
ConclusionesLos resultados evidencian que la efectividad de la EIR es similar en pacientes con función renal normal o reducida y alertan sobre una infrautilización de esta estrategia en estos últimos.
To evaluate the use and effectiveness of a routine invasive strategy (RIS) in patients with acute coronary syndrome without persistent ST-segment elevation with renal dysfunction in the real world scenario.
MethodsA retrospective cohort study based on the ARIAM-SEMICYUC Registry (2011-2014) was carried out. Renal dysfunction was defined as GFR (Cockroft-Gault)<60ml/min (moderate dysfunction) or<30ml/min (severe dysfunction). Patients in which early angiography (<72h) was performed due to cardiogenic shock or recurrent myocardial ischemia were excluded. The primary endpoint was hospital mortality. Confounding factors were controlled using propensity score analysis.
ResultsA total of 4,279 patients were analyzed, of which 26% had moderate renal dysfunction and 5% severe dysfunction. Patients with renal dysfunction had greater severity and comorbidity, higher hospital mortality (8.6 vs. 1.8%), and lesser use of the RIS (40 vs. 52%). The adjusted OR for mortality in patients without/with renal dysfunction were 0.38 (95% confidence interval [95%CI] 0.17 to 0.81) and 0.52 (95%CI 0.32 to 0.87), respectively (interaction P-value=.4779). The impact (adjusted risk difference) of RIS was higher in the group with renal dysfunction (−5.1%, 95%CI −8.1 to −2.1 vs. −1.6%, 95%CI −2.6 to −0.6; interaction P-value=.0335). No significant interaction was detected for the other endpoints considered (ICU mortality, 30-day mortality, myocardial infarction, acute renal failure or moderate/severe bleeding).
ConclusionsThe results suggest that the effectiveness of IRS is similar in patients with normal or abnormal renal function, and alert to the under-utilization of this strategy in such patients.
Los pacientes con síndrome coronario agudo sin elevación persistente del segmento ST (SCASEST) con disfunción renal crónica constituyen un subgrupo de pacientes con una alta letalidad y un elevado riesgo de eventos cardiacos adversos1–8. Aunque las principales guías clínicas favorecen el uso de la estrategia invasiva en pacientes de riesgo moderado-alto9,10, la literatura científica muestra de forma consistente una menor utilización de las técnicas invasivas en los pacientes con SCASEST y disfunción renal11–14.
Este desfase entre las recomendaciones de las guías y la práctica clínica habitual podría estar relacionado con la incertidumbre existente sobre la relación beneficio-riesgo de la estrategia invasiva precoz en pacientes con insuficiencia renal crónica. En efecto, un metaanálisis de ensayos aleatorizados de estrategia invasiva de rutina (EIR) frente a una estrategia conservadora realizado en el subgrupo de enfermos con un filtrado glomerular estimado por el método de Cockroft-Gault (GFR) menor de 60ml/min solo pudo demostrar una tendencia no significativa a una reducción de la mortalidad15. El problema de imprecisión fue mayor en el subgrupo de pacientes con disfunción renal grave. A estas limitaciones hay que añadir el riesgo de sesgo de los estudios individuales (con una alta tasa de crossover) y el momento de realización de estos, en una época en que muchos de los antitrombóticos y de las tecnologías intervencionistas no estaban disponibles, por lo que estos resultados se podrían considerar como «evidencia indirecta»16. Por su parte, es bien sabido que los estudios observacionales1,3,6,8,13,17,18 están lastrados por el confounding de indicación. Aunque algunos estudios afrontan este problema mediante un análisis de propensión, en muchos casos adolecen de una comunicación poco transparente de la metodología utilizada.
El objetivo de este estudio es evaluar, mediante datos de un registro hospitalario de síndrome coronario agudo, la frecuencia de utilización y el impacto de la EIR frente a la estrategia conservadora inicial en pacientes con SCASEST en función del grado de disfunción renal.
MétodosPacientesEl estudio está basado en datos del Registro ARIAM-SEMICYUC19, un registro voluntario de pacientes consecutivos ingresados en unidades coronarias o de cuidados intensivos españolas con diagnóstico de síndrome coronario agudo mayores de 18 años, con menos de 48h desde el comienzo de los síntomas, y seguidos hasta el alta hospitalaria y (opcionalmente) hasta los 30 días desde el comienzo de los síntomas. La recogida de datos se realiza mediante cortes transversales anuales de 3 meses de duración. Adicionalmente, los centros que lo desean pueden introducir sus propios datos a lo largo de todo el año (registro continuo). Durante el periodo de estudio participaron 76 centros, en su mayoría procedentes de hospitales de mediano tamaño (Anexo disponible en la versión online), que incluyeron una media de 49 pacientes por centro. El estudio cumple con la legislación española sobre protección de datos y realización de estudios observacionales, y ha sido eximido por un comité ético de la obtención de consentimiento informado de los pacientes.
En el presente estudio se analizan los pacientes incluidos en el registro ARIAM-SEMICYUC entre enero de 2011 y septiembre de 2014 con diagnóstico de SCASEST. Se excluyeron los pacientes que ingresaron con shock cardiogénico (en los que se recomienda la estrategia invasiva urgente9) y los pacientes en los que se realizó una coronariografía urgente por shock o dolor recurrente en las 72h siguientes al primer contacto sanitario.
MedicionesLos pacientes se consideraron como expuestos si se les realizó coronariografía dentro de las primeras 72h, y como no expuestos en caso contrario. De acuerdo con los puntos de corte preestablecidos, los pacientes se subclasificaron en 3 grupos de función renal: normal (filtrado glomerular estimado por el método de Cockroft-Gault20 [GFR]≥60ml/min), disfunción moderada (GFR entre 30 y 59ml/min) o disfunción grave (GFR<30ml/min).
El desenlace primario fue la mortalidad hospitalaria. Se consideraron como desenlaces secundarios la mortalidad en UCI y a los 30 días, la aparición de infarto o reinfarto, la hemorragia moderada-grave (con criterios del estudio GUSTO21) y la aparición de fracaso renal agudo (definido como un aumento de la creatinina 1,5 veces sobre el valor basal o diuresis menor de 0,5ml/kg durante 6h).
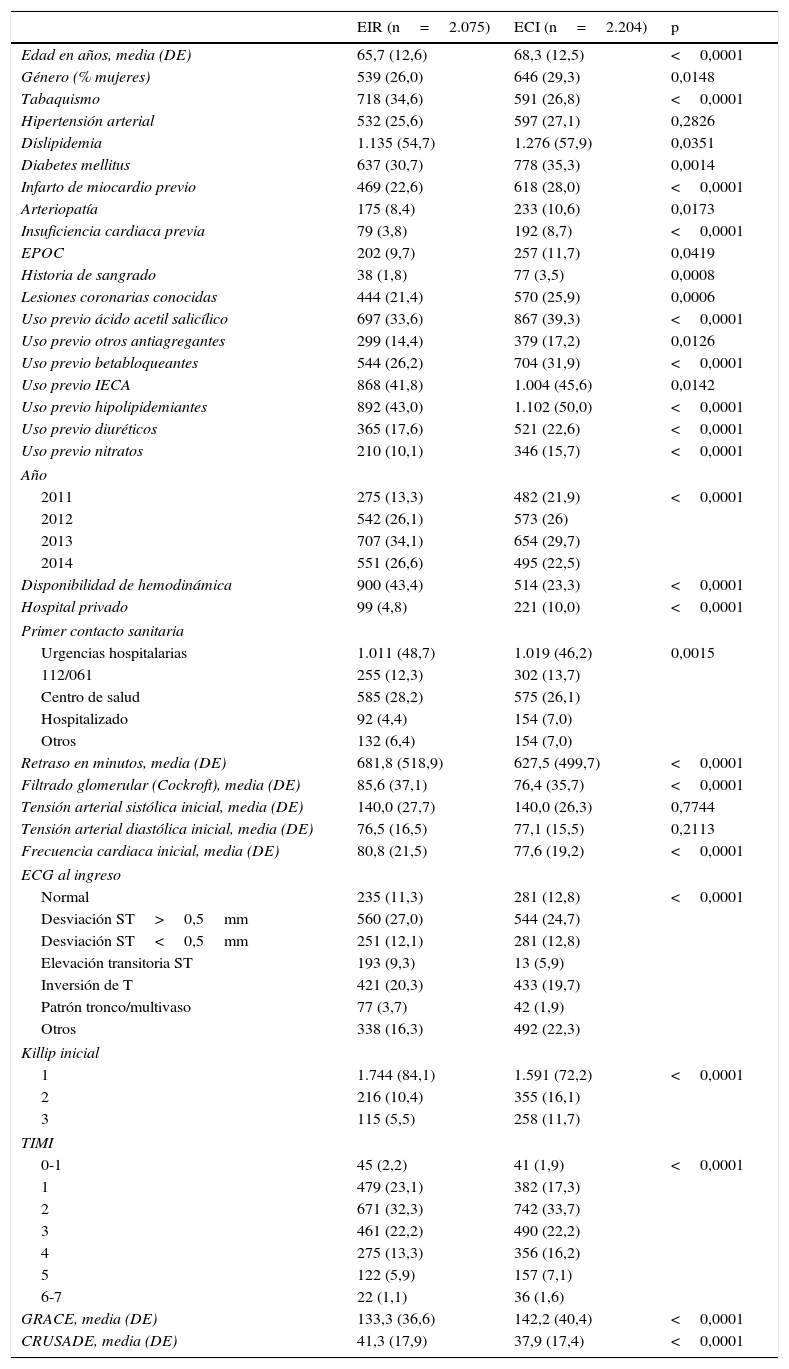
Se consideraron como posibles variables de confusión diversos datos demográficos (edad, sexo), asistenciales (forma de acceso, transporte y retrasos en el acceso al centro, disponibilidad de cateterismo cardiaco22), factores de riesgo coronario, enfermedad cardiovascular previa, tratamientos previos (farmacológicos y coronarios) y situación clínica basal (presión arterial, frecuencia cardiaca, ECG inicial, Killip inicial23, puntuación TIMI24, GRACE25 y CRUSADE26) (tablas 1 y 2).
Características basales de los pacientes
| EIR (n=2.075) | ECI (n=2.204) | p | |
|---|---|---|---|
| Edad en años, media (DE) | 65,7 (12,6) | 68,3 (12,5) | <0,0001 |
| Género (% mujeres) | 539 (26,0) | 646 (29,3) | 0,0148 |
| Tabaquismo | 718 (34,6) | 591 (26,8) | <0,0001 |
| Hipertensión arterial | 532 (25,6) | 597 (27,1) | 0,2826 |
| Dislipidemia | 1.135 (54,7) | 1.276 (57,9) | 0,0351 |
| Diabetes mellitus | 637 (30,7) | 778 (35,3) | 0,0014 |
| Infarto de miocardio previo | 469 (22,6) | 618 (28,0) | <0,0001 |
| Arteriopatía | 175 (8,4) | 233 (10,6) | 0,0173 |
| Insuficiencia cardiaca previa | 79 (3,8) | 192 (8,7) | <0,0001 |
| EPOC | 202 (9,7) | 257 (11,7) | 0,0419 |
| Historia de sangrado | 38 (1,8) | 77 (3,5) | 0,0008 |
| Lesiones coronarias conocidas | 444 (21,4) | 570 (25,9) | 0,0006 |
| Uso previo ácido acetil salicílico | 697 (33,6) | 867 (39,3) | <0,0001 |
| Uso previo otros antiagregantes | 299 (14,4) | 379 (17,2) | 0,0126 |
| Uso previo betabloqueantes | 544 (26,2) | 704 (31,9) | <0,0001 |
| Uso previo IECA | 868 (41,8) | 1.004 (45,6) | 0,0142 |
| Uso previo hipolipidemiantes | 892 (43,0) | 1.102 (50,0) | <0,0001 |
| Uso previo diuréticos | 365 (17,6) | 521 (22,6) | <0,0001 |
| Uso previo nitratos | 210 (10,1) | 346 (15,7) | <0,0001 |
| Año | |||
| 2011 | 275 (13,3) | 482 (21,9) | <0,0001 |
| 2012 | 542 (26,1) | 573 (26) | |
| 2013 | 707 (34,1) | 654 (29,7) | |
| 2014 | 551 (26,6) | 495 (22,5) | |
| Disponibilidad de hemodinámica | 900 (43,4) | 514 (23,3) | <0,0001 |
| Hospital privado | 99 (4,8) | 221 (10,0) | <0,0001 |
| Primer contacto sanitaria | |||
| Urgencias hospitalarias | 1.011 (48,7) | 1.019 (46,2) | 0,0015 |
| 112/061 | 255 (12,3) | 302 (13,7) | |
| Centro de salud | 585 (28,2) | 575 (26,1) | |
| Hospitalizado | 92 (4,4) | 154 (7,0) | |
| Otros | 132 (6,4) | 154 (7,0) | |
| Retraso en minutos, media (DE) | 681,8 (518,9) | 627,5 (499,7) | <0,0001 |
| Filtrado glomerular (Cockroft), media (DE) | 85,6 (37,1) | 76,4 (35,7) | <0,0001 |
| Tensión arterial sistólica inicial, media (DE) | 140,0 (27,7) | 140,0 (26,3) | 0,7744 |
| Tensión arterial diastólica inicial, media (DE) | 76,5 (16,5) | 77,1 (15,5) | 0,2113 |
| Frecuencia cardiaca inicial, media (DE) | 80,8 (21,5) | 77,6 (19,2) | <0,0001 |
| ECG al ingreso | |||
| Normal | 235 (11,3) | 281 (12,8) | <0,0001 |
| Desviación ST>0,5mm | 560 (27,0) | 544 (24,7) | |
| Desviación ST<0,5mm | 251 (12,1) | 281 (12,8) | |
| Elevación transitoria ST | 193 (9,3) | 13 (5,9) | |
| Inversión de T | 421 (20,3) | 433 (19,7) | |
| Patrón tronco/multivaso | 77 (3,7) | 42 (1,9) | |
| Otros | 338 (16,3) | 492 (22,3) | |
| Killip inicial | |||
| 1 | 1.744 (84,1) | 1.591 (72,2) | <0,0001 |
| 2 | 216 (10,4) | 355 (16,1) | |
| 3 | 115 (5,5) | 258 (11,7) | |
| TIMI | |||
| 0-1 | 45 (2,2) | 41 (1,9) | <0,0001 |
| 1 | 479 (23,1) | 382 (17,3) | |
| 2 | 671 (32,3) | 742 (33,7) | |
| 3 | 461 (22,2) | 490 (22,2) | |
| 4 | 275 (13,3) | 356 (16,2) | |
| 5 | 122 (5,9) | 157 (7,1) | |
| 6-7 | 22 (1,1) | 36 (1,6) | |
| GRACE, media (DE) | 133,3 (36,6) | 142,2 (40,4) | <0,0001 |
| CRUSADE, media (DE) | 41,3 (17,9) | 37,9 (17,4) | <0,0001 |
DE: desviación estándar; ECG: electrocardiograma; ECI: estrategia conservadora inicial; EIR: estrategia invasiva de rutina; EPOC: enfermedad pulmonar obstructiva crónica; IECA: inhibidor de la enzima conversiva de la angiotensina.
Los valores se expresan como n (porcentaje) excepto donde se indica.
Diferencias estandarizadas en las cohortes originales y en las cohortes emparejadas
| GFR<60ml/min | GFR≥60ml/min | |||
|---|---|---|---|---|
| Variable | Cohortes originales | Cohortes emparejadas | Cohortes originales | Cohortes emparejadas |
| Edad | 2,139 | 1,274 | 17,638 | 12,827 |
| Género | 8,126 | 5,786 | 5,226 | 7,504 |
| Hipertensión arterial | 4,191 | 1,643 | 6,772 | 4,171 |
| Dislipidemia | 9,472 | 2,46 | 4,201 | 2,628 |
| Diabetes | 7,478 | 0,811 | 5,563 | 2,15 |
| Infarto previo | 5,424 | 0 | 10,867 | 4,04 |
| Arteriopatía | 8,186 | 0,586 | 3,237 | 2,808 |
| Insuficiencia cardiaca | 24,099 | 5,715 | 13,52 | 6,18 |
| EPOC | 9,862 | 2,308 | 3,918 | 5,979 |
| Historia de sangrado | 10,13 | 5,173 | 7,095 | 2,079 |
| Lesiones coronarias conocidas | 5,34 | 0,872 | 9,443 | 3,069 |
| Uso previo ácido acetil salicílico | 8,732 | 1,216 | 8,556 | 2,244 |
| Uso previo otros antiagregantes | 0,935 | 2,838 | 5,231 | 1,605 |
| Uso previo nitratos | 11,359 | 5,086 | 16,322 | 7,572 |
| Uso previo betabloqueantes | 8,463 | 5,003 | 11,572 | 6,059 |
| Uso previo IECA | 0,159 | 1,612 | 6,341 | 4,339 |
| Uso previo hipolipidemiante | 13,194 | 7,267 | 9,909 | 4,636 |
| Uso previo diuréticos | 9,039 | 4,248 | 11,529 | 5,668 |
| Año | 3,989 | 4,359 | 17,928 | 16,368 |
| Disponibilidad de hemodinámica | 43,997 | 26,012 | 38,535 | 46,102 |
| Hospital privado | 26,862 | 0 | 7,116 | 8,313 |
| Primer contacto | 7,724 | 3,395 | 5,893 | 7,54 |
| Retraso | 9,565 | 5,323 | 10,715 | 9,646 |
| Filtración glomerular | 13,758 | 4,142 | 13,684 | 10,497 |
| Tensión arterial sistólica | 4,662 | 3,733 | 4,284 | 5,174 |
| Tensión arterial diastólica | 2,913 | 3,732 | 1,769 | 0,721 |
| Frecuencia cardiaca | 14,498 | 3,646 | 12,124 | 7,873 |
| ECG inicial normal | 6,195 | 4,736 | 2,445 | 0,262 |
| Desviación ST>0,5mm | 0,613 | 2,179 | 10,508 | 11,492 |
| Desviación ST<0,5mm | 3,6 | 3,463 | 6,308 | 4,423 |
| Elevación transitoria de ST | 6,45 | 2,37 | 14,365 | 15,87 |
| Inversión de T | 4,331 | 7,197 | 1,972 | 5,014 |
| Patrón tronco/multivaso | 11,192 | 7,244 | 9,818 | 11,682 |
| Killip | 31,888 | 12,878 | 15,435 | 6,466 |
| TIMI | 5,677 | 1,357 | 10,07 | 3,407 |
| GRACE | 20,393 | 8,443 | 10,825 | 2,992 |
| CRUSADE | 26,452 | 9,784 | 6,788 | 0,435 |
ECG: electrocardiograma; EPOC: enfermedad pulmonar obstructiva crónica; GFR: tasa de filtración glomerular; IECA: inhibidor de la enzima conversiva de la angiotensina.
La efectividad de la EIR se examinó mediante la estimación de la odds ratio (OR) –efecto relativo– y la diferencia de riesgos (DR) −efecto absoluto−, con sus correspondientes intervalos de confianza al 95% (IC95%).
El control del confounding por indicación se realizó a través de un análisis de propensión27,28 mediante los paquetes estadísticos nonrandom de R29 y StatsDirect30. Para ello, se creó una puntuación de propensión a la realización de EIR que incluía 33 variables disponibles en el momento del ingreso del paciente (tabla S4 del material suplementario disponible en la versión online). El efecto ajustado (OR) de la EIR sobre los diferentes desenlaces se analizó mediante análisis estratificado en 5 quintiles de la puntuación de propensión y análisis de cohortes emparejadas. El efecto absoluto (DR) se estimó a partir de los resultados del análisis estratificado por quintiles de propensión, ponderado por el método de Greenland y Robins31.
Este procedimiento analítico se realizó de forma separada para los pacientes con disfunción renal moderada-grave (GFR<60ml/min) y los de función renal normal (GFR≥60ml/min). Las diferencias de efecto (crudas y ajustadas) entre estos 2 estratos se contrastaron mediante un test de interacción basado en el estadístico Q de Cochran.
Adicionalmente, se hizo un análisis de subgrupos post-hoc para las variables GRACE (>140 frente a≤140), género (mujeres frente a hombres) y disponibilidad de hemodinámica (posibilidad o no de realización de cateterismo cardiaco en el centro).
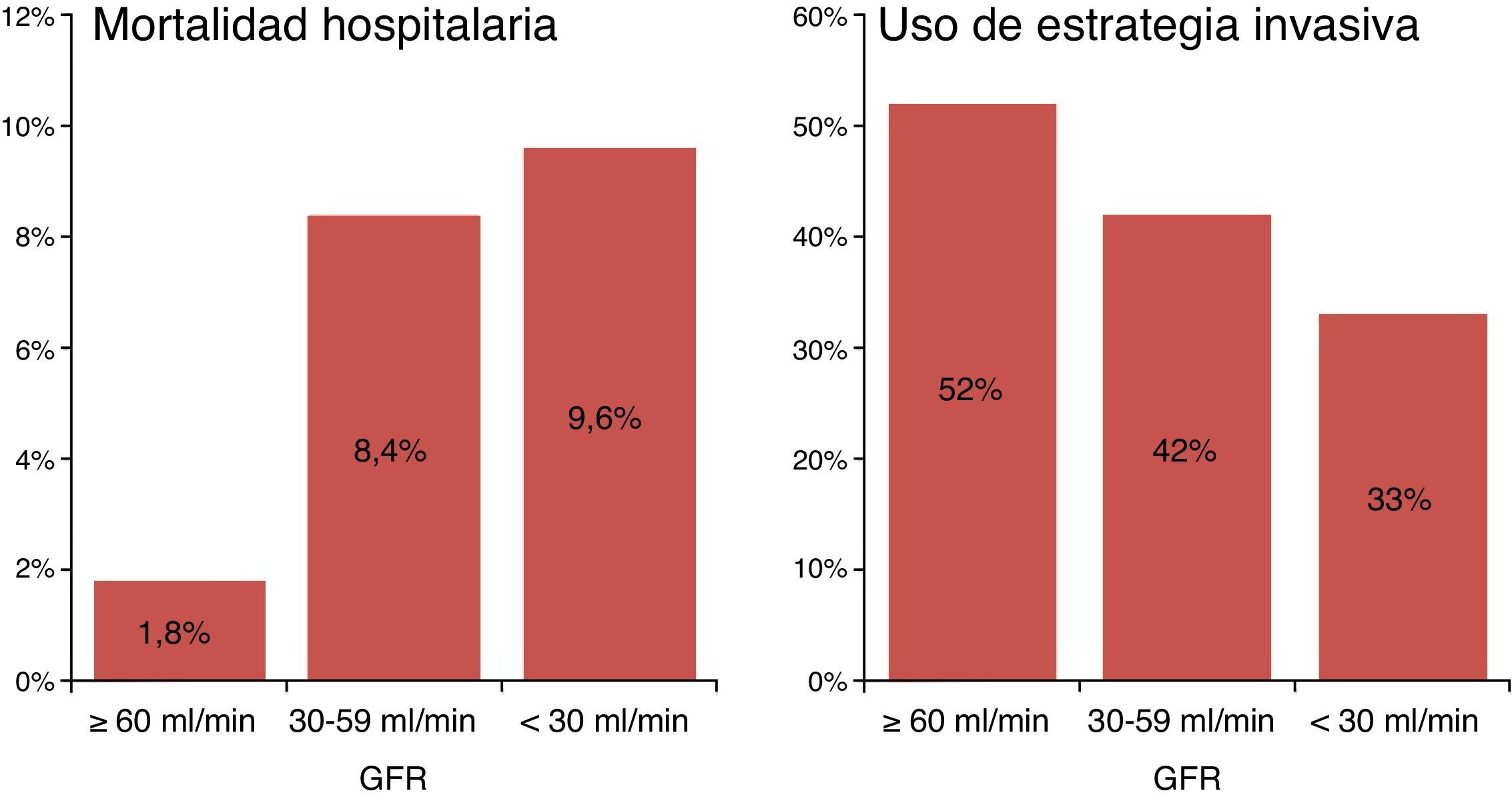
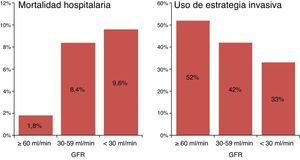
ResultadosSe consideraron para su inclusión en el estudio 4.363 pacientes, 84 de los cuales se excluyeron por isquemia recurrente o shock cardiogénico. De los 4.279 pacientes analizados, un 69% tenía función renal normal o ligeramente deprimida, un 26% tenía disfunción renal moderada, y un 5%, disfunción grave. La mortalidad hospitalaria observada fue del 1,8, el 8,4 y el 9,6%, respectivamente (p<0,0001) (fig. 1).
La mortalidad hospitalaria no se pudo determinar en 287 (9,8%) pacientes con función renal normal y en 130 (9,7%) pacientes con disfunción renal. Las características demográficas, de comorbilidad y de gravedad inicial de las pérdidas en el seguimiento no difirieron apreciablemente de las de los pacientes con seguimiento completo (tabla S3 del material suplementario disponible en la versión online).
El porcentaje de pacientes tratados con EIR en los subgrupos de función renal normal, disfunción moderada y disfunción grave fue del 52, 42 y 33%, respectivamente (p<0,0001) (fig. 1).
Las características basales de los pacientes tratados de forma invasiva o conservadora fueron muy diferentes (tabla 1). El grupo tratado de forma conservadora se caracterizó por tratarse de enfermos ingresados preferentemente en hospitales sin disponibilidad de hemodinámica, de mayor edad, con peor función renal, mayor prevalencia de diabetes y cardiopatía isquémica conocida, menor prevalencia de ECG de alto riesgo y mayor gravedad inicial medida por Killip, TIMI o GRACE.
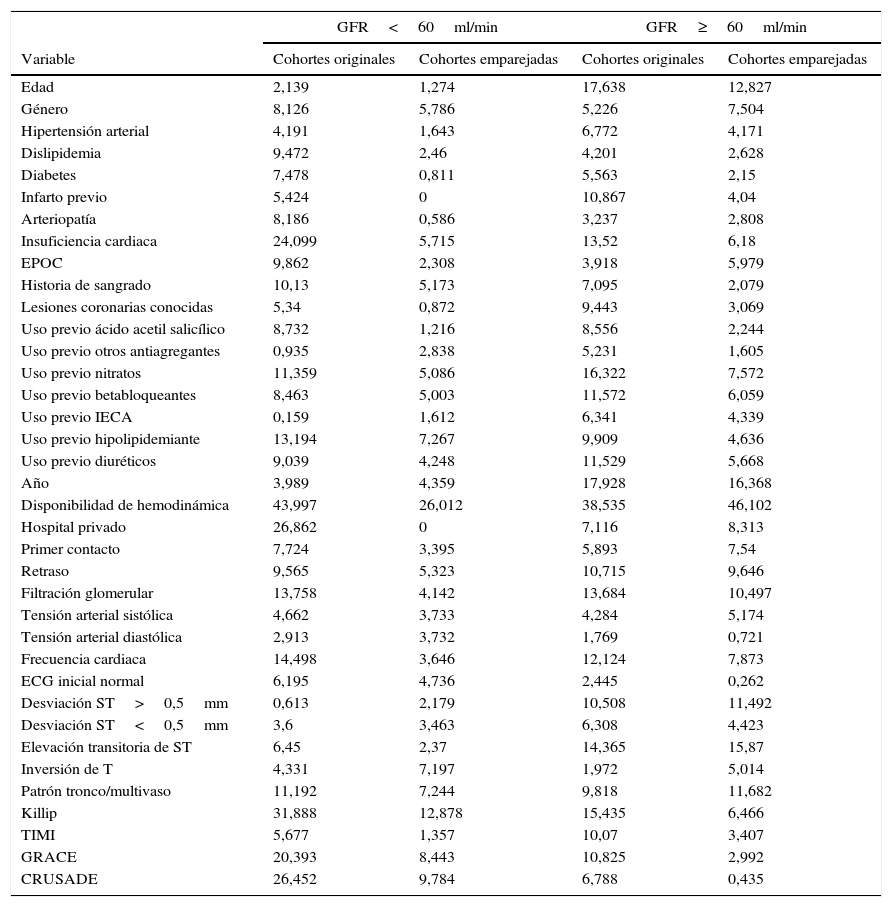
Las cohortes emparejadas por la puntuación de propensión estuvieron constituidas por 1.144 parejas con función renal normal y 499 parejas con disfunción renal. La distribución de las puntuaciones de propensión en los grupos intervencionista y conservador mostró un adecuado solapamiento (figura S1 del material suplementario disponible en la versión online). El análisis de propensión emparejado consiguió homogeneizar en gran medida ambas poblaciones (tabla S2 del material suplementario disponible en la versión online), si bien persistieron diferencias estandarizadas superiores a 10 en algunas variables de escaso significado pronóstico tanto en el subgrupo con disfunción renal como en el de función renal normal.
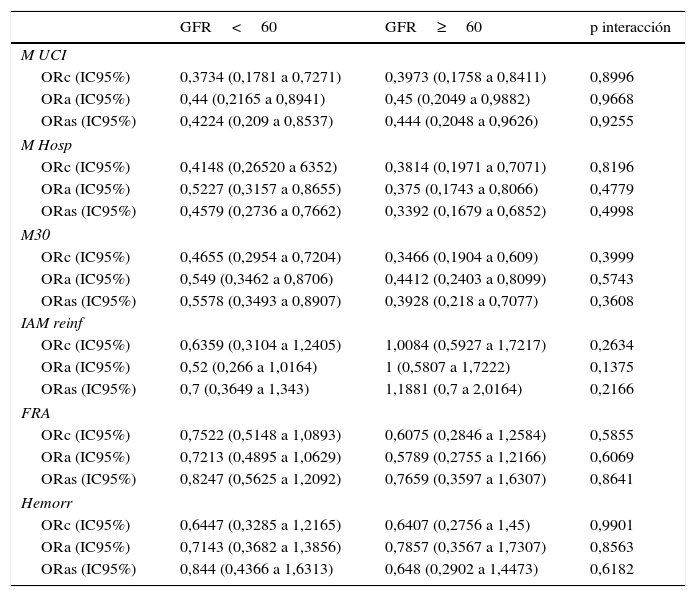
Respecto al endpoint primario, el efecto de la EIR fue similar en pacientes con disfunción moderada-grave (OR ajustada 0,52; IC95% de 0,32 a 0,87) o función renal normal (OR ajustada 0,38; IC95% de 0,17 a 0,81) (p test de interacción 0,4779). Tampoco se encontró interacción entre la EIR y el nivel de función renal cuando se estratificó en 3 grupos (p de interacción 0,76) (figura S3 del material suplementario disponible en la versión online).
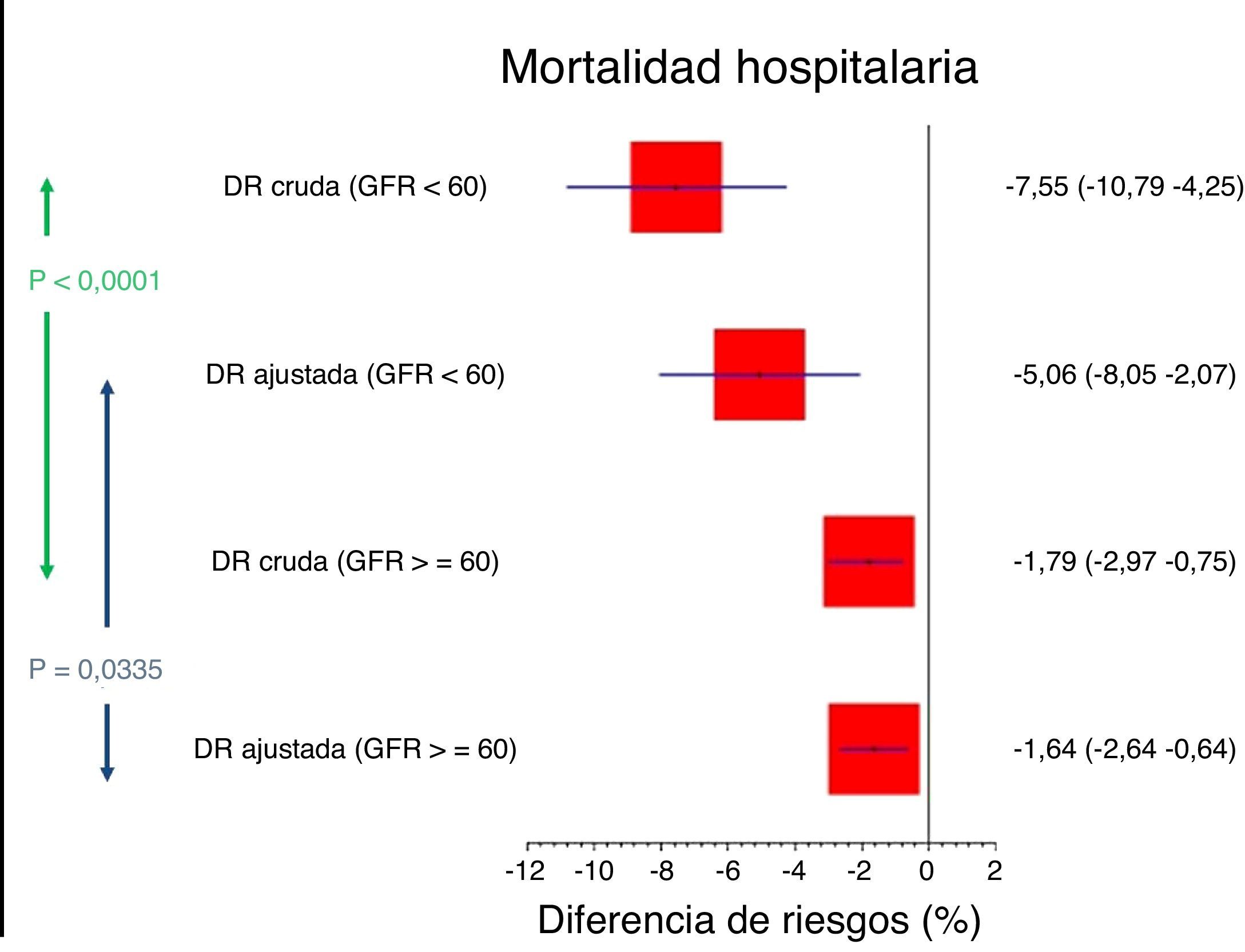
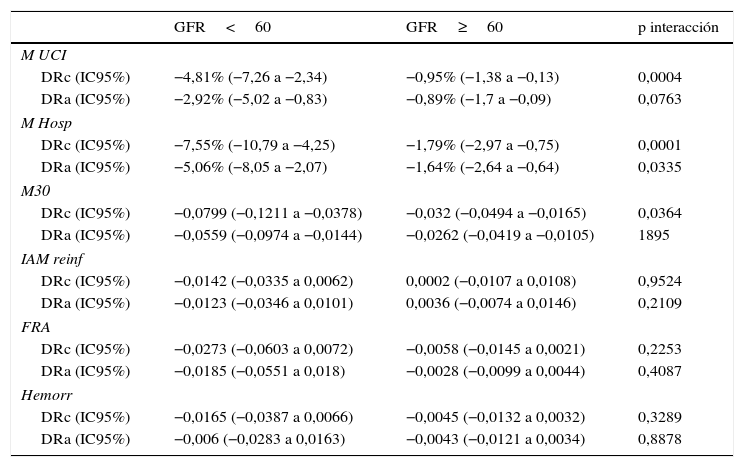
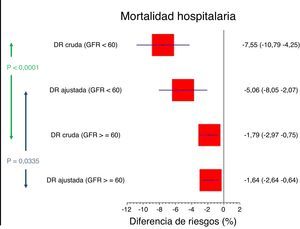
Dado el diferente riesgo basal, la diferencia de riesgos fue mayor en el grupo de pacientes con disfunción renal (DR −5,1%; IC95% de −8,1 a −2,1) que en el grupo con función renal conservada (DR −1,6%; IC95% de −2,6 a −0,6) (p test de interacción 0,0335) (tablas 3 y 4; fig. 2).
Efectividad de la estrategia invasiva de rutina (odds ratios brutas y ajustadas)
| GFR<60 | GFR≥60 | p interacción | |
|---|---|---|---|
| M UCI | |||
| ORc (IC95%) | 0,3734 (0,1781 a 0,7271) | 0,3973 (0,1758 a 0,8411) | 0,8996 |
| ORa (IC95%) | 0,44 (0,2165 a 0,8941) | 0,45 (0,2049 a 0,9882) | 0,9668 |
| ORas (IC95%) | 0,4224 (0,209 a 0,8537) | 0,444 (0,2048 a 0,9626) | 0,9255 |
| M Hosp | |||
| ORc (IC95%) | 0,4148 (0,26520 a 6352) | 0,3814 (0,1971 a 0,7071) | 0,8196 |
| ORa (IC95%) | 0,5227 (0,3157 a 0,8655) | 0,375 (0,1743 a 0,8066) | 0,4779 |
| ORas (IC95%) | 0,4579 (0,2736 a 0,7662) | 0,3392 (0,1679 a 0,6852) | 0,4998 |
| M30 | |||
| ORc (IC95%) | 0,4655 (0,2954 a 0,7204) | 0,3466 (0,1904 a 0,609) | 0,3999 |
| ORa (IC95%) | 0,549 (0,3462 a 0,8706) | 0,4412 (0,2403 a 0,8099) | 0,5743 |
| ORas (IC95%) | 0,5578 (0,3493 a 0,8907) | 0,3928 (0,218 a 0,7077) | 0,3608 |
| IAM reinf | |||
| ORc (IC95%) | 0,6359 (0,3104 a 1,2405) | 1,0084 (0,5927 a 1,7217) | 0,2634 |
| ORa (IC95%) | 0,52 (0,266 a 1,0164) | 1 (0,5807 a 1,7222) | 0,1375 |
| ORas (IC95%) | 0,7 (0,3649 a 1,343) | 1,1881 (0,7 a 2,0164) | 0,2166 |
| FRA | |||
| ORc (IC95%) | 0,7522 (0,5148 a 1,0893) | 0,6075 (0,2846 a 1,2584) | 0,5855 |
| ORa (IC95%) | 0,7213 (0,4895 a 1,0629) | 0,5789 (0,2755 a 1,2166) | 0,6069 |
| ORas (IC95%) | 0,8247 (0,5625 a 1,2092) | 0,7659 (0,3597 a 1,6307) | 0,8641 |
| Hemorr | |||
| ORc (IC95%) | 0,6447 (0,3285 a 1,2165) | 0,6407 (0,2756 a 1,45) | 0,9901 |
| ORa (IC95%) | 0,7143 (0,3682 a 1,3856) | 0,7857 (0,3567 a 1,7307) | 0,8563 |
| ORas (IC95%) | 0,844 (0,4366 a 1,6313) | 0,648 (0,2902 a 1,4473) | 0,6182 |
GFR: tasa de filtración glomerular; FRA: fallo renal agudo; Hemorr: hemorragias moderadas-graves; IAM reinf: infarto o reinfarto; IC95%: intervalo de confianza al 95%; M Hosp: mortalidad hospitalaria; M UCI: mortalidad en la Unidad Coronaria; M30: mortalidad a los 30 días; ORa: odds ratio ajustada por emparejamiento; ORas: odds ratio ajustada por estratificación.
Impacto de la estrategia invasiva de rutina (diferencias de riesgo brutas y ajustadas)
| GFR<60 | GFR≥60 | p interacción | |
|---|---|---|---|
| M UCI | |||
| DRc (IC95%) | −4,81% (−7,26 a −2,34) | −0,95% (−1,38 a −0,13) | 0,0004 |
| DRa (IC95%) | −2,92% (−5,02 a −0,83) | −0,89% (−1,7 a −0,09) | 0,0763 |
| M Hosp | |||
| DRc (IC95%) | −7,55% (−10,79 a −4,25) | −1,79% (−2,97 a −0,75) | 0,0001 |
| DRa (IC95%) | −5,06% (−8,05 a −2,07) | −1,64% (−2,64 a −0,64) | 0,0335 |
| M30 | |||
| DRc (IC95%) | −0,0799 (−0,1211 a −0,0378) | −0,032 (−0,0494 a −0,0165) | 0,0364 |
| DRa (IC95%) | −0,0559 (−0,0974 a −0,0144) | −0,0262 (−0,0419 a −0,0105) | 1895 |
| IAM reinf | |||
| DRc (IC95%) | −0,0142 (−0,0335 a 0,0062) | 0,0002 (−0,0107 a 0,0108) | 0,9524 |
| DRa (IC95%) | −0,0123 (−0,0346 a 0,0101) | 0,0036 (−0,0074 a 0,0146) | 0,2109 |
| FRA | |||
| DRc (IC95%) | −0,0273 (−0,0603 a 0,0072) | −0,0058 (−0,0145 a 0,0021) | 0,2253 |
| DRa (IC95%) | −0,0185 (−0,0551 a 0,018) | −0,0028 (−0,0099 a 0,0044) | 0,4087 |
| Hemorr | |||
| DRc (IC95%) | −0,0165 (−0,0387 a 0,0066) | −0,0045 (−0,0132 a 0,0032) | 0,3289 |
| DRa (IC95%) | −0,006 (−0,0283 a 0,0163) | −0,0043 (−0,0121 a 0,0034) | 0,8878 |
GFR: tasa de filtración glomerular; DRa: diferencias de riesgo ajustadas; DRc: diferencias de riesgo crudas; FRA: fallo renal agudo; Hemorr: hemorragias moderadas-graves; IAM reinf: infarto o reinfarto; IC95%: intervalo de confianza al 95%; M Hosp: mortalidad hospitalaria; M UCI: mortalidad en la Unidad Coronaria; M30: mortalidad a los 30 días.
Respecto a los desenlaces secundarios, la EIR se asoció a una reducción de la mortalidad en UCI y a los 30 días, sin una reducción significativa del riesgo de infarto/reinfarto, fracaso renal agudo o hemorragia moderada-grave. El efecto para estos 5 desenlaces fue similar (p de interacción no significativa) para los pacientes con y sin disfunción renal (tabla 3).
El análisis de subgrupos mostró que, dentro del estrato de pacientes con puntuación GRACE>140, la EIR reducía la mortalidad hospitalaria tanto en pacientes con disfunción renal como en aquellos con función renal normal. En los pacientes con puntuación GRACE≤140 la EIR no redujo de forma significativa la mortalidad hospitalaria. La p del test de interacción, sin embargo, no fue estadísticamente significativa. La efectividad de la EIR en pacientes con función renal normal fue mayor en los centros que no disponían de unidad de hemodinámica que en aquellos que disponían de ella (p de interacción 0,0133). No hubo evidencia de interacción entre el uso de la EIR y el género, tanto en pacientes con función renal normal como en pacientes con función renal alterada (tabla S5 del material suplementario disponible en la versión online).
DiscusiónNuestros resultados confirman la persistente baja utilización de la EIR en pacientes con SCASEST y disfunción renal y evidencian que esta estrategia se asocia a una reducción relativa de la mortalidad hospitalaria y a los 30 días en estos pacientes, comparable a la de los enfermos con función renal normal5,6,8,15,32. En términos absolutos, en cambio, la reducción de la mortalidad a corto plazo en pacientes con insuficiencia renal es mayor que en aquellos con función renal normal: tratando al mismo número de pacientes, el número de muertes evitadas por la EIR es mayor en el grupo de enfermos con disfunción renal que en el grupo con función renal normal.
Por otro lado, no se ha detectado una asociación entre el uso de EIR y la incidencia de infarto, fallo renal o hemorragias moderadas-graves en pacientes con disfunción renal. La ausencia de un efecto detectable sobre el riesgo de infarto es consistente con la mayoría de los estudios, que encuentran un aumento inicial del riesgo de infarto que solo se ve compensado por una reducción del riesgo de reinfarto a medio-largo plazo. Por su parte, los resultados negativos respecto al riesgo de hemorragias y fallo renal podrían deberse tanto a una falta de potencia del estudio como a la mejora de las prácticas preventivas en este campo (por ejemplo, la generalización del acceso radial o la prevención de la nefropatía por contraste).
Cabe preguntarse por las razones de la menor utilización de la EIR en pacientes con disfunción renal. Posiblemente el temor a provocar una nefropatía por contraste y un deterioro adicional de la función renal podría disuadir a los clínicos del uso de la EIR en estos pacientes. Sin embargo, el impacto de la administración de contrastes yodados sobre desenlaces importantes (como la muerte o la necesidad de diálisis) no está bien establecido33 y el cuerpo de evidencia disponible muestra una relación beneficio-daño favorable al empleo de la EIR en pacientes con insuficiencia renal9,10.
Desde una perspectiva más amplia, la infrautilización de la EIR en estos pacientes se podría considerar como una manifestación peculiar de una tendencia de los clínicos a evitar el uso de procedimientos invasivos en pacientes de alto riesgo11,12,14,17. En el caso que nos ocupa, la mayor utilización de la EIR se concentra en el subgrupo de pacientes con función renal normal y puntuación GRACE<140, precisamente el grupo que menos se beneficia del tratamiento. El papel que pueden jugar las dificultades de traslado a la sala de cateterismo y la limitación de los tratamientos de soporte vital de los pacientes más graves requeriría estudios más detallados.
El estudio tiene limitaciones, entre las que destaca su diseño observacional. Aunque el análisis de propensión ha conseguido una distribución uniforme de las principales covariables entre el grupo experimental y el grupo control, no se puede descartar la existencia de confounding residual debido a variables de confusión no incluidas en el registro. Este confounding residual podría explicar las diferencias entre las OR estimadas por los estudios observacionales y las estimadas a partir de ensayos aleatorizados, claramente más favorables en los primeros. Una explicación alternativa podría ser la alta prevalencia de crossover en los estudios aleatorizados (pacientes del grupo control que se someten a intervención coronaria percutánea), que contribuiría a subestimar el beneficio de la EIR. En cualquier caso, el objetivo del presente estudio no era tanto la estimación puntual del efecto de la EIR como la exploración de la posible heterogeneidad de efectos en función del grado de deterioro renal.
Una segunda limitación de nuestro estudio son las pérdidas en el seguimiento y la falta de resultados a medio-largo plazo. La credibilidad de nuestros resultados se ve reforzada por la ausencia de diferencias sistemáticas entre los pacientes perdidos y los incluidos, así como por la consistencia de nuestros resultados con los de otros estudios. Sin embargo, la existencia de un sesgo de selección no puede descartarse por completo.
Finalmente, aunque no se ha detectado un efecto de subgrupo en los pacientes con disfunción renal grave, en este grupo solo se registraron 16 eventos, por lo que nuestro estudio adolece de un problema de imprecisión en la estimación del efecto en pacientes con disfunción renal grave34.
Concluimos que los resultados evidencian que la efectividad de la EIR es similar en pacientes con función renal normal o reducida y alertan sobre una infrautilización de esta estrategia en estos últimos.
FinanciaciónSEMICYUC.
Conflicto de interesesNinguno.