Identificar los factores clínico-radiológicos que se asocian a evolución precoz a muerte encefálica (ME), definida esta como la ocurrida en ≤24 horas.
DiseñoEstudio de cohortes retrospectivo desde 2015 hasta 2017, ambos incluidos.
ÁmbitoServicio de Medicina Intensiva (SMI) de adultos.
Pacientes y métodoAnálisis de variables clínico-epidemiológicas y de la TC craneal de ingreso en pacientes con evolución a ME.
ResultadosSe analizaron 166 ME, 86 varones, edad media 62,7 años, 42,8% hemorragia intracerebral, 18,7% HSA, 17,5% TCE, 7,8% ictus isquémico, 9% anoxia y 4,2% otras causas; 50% HTA, 34% dislipemia, 33% tabaquismo, 21% antiagregación, 19% enolismo. El 15% anticoagulación, 15% diabetes. El GCS fue tres en el 68,8% en ME precoz frente 38,2% en ME >24 h (p 0,0001); 85 hematoma supratentorial (90,9 mL en ME precoz vs. 82,7 mL ME tardía, p 0,54); 12 hematoma infratentorial. Desplazamiento medio de línea media 10,7 mm en ME precoz vs. 7,8 mm en ME tardía (p 0,045); 91 pacientes ventriculomegalia y 38 trasudado periependimario (p 0,021). Borramiento completo de cisternas basales 36 en ME precoz frente a 24 en ME tardía (p 0,005), borramiento de surcos (p 0,013), pérdida de diferenciación córtico-subcortical (p 0,0001) y ausencia de cisterna supraselar (p 0,005). La medición de la vaina del nervio óptico no mostró diferencias significativas entre los dos grupos.
ConclusionesSe asoció con ME ≤24 horas el GCS <5, el desplazamiento de línea media, la pérdida de diferenciación córtico-subcortical, el borramiento de surcos, el borramiento completo de cisternas basales, de la cisterna supraselar y la presencia de trasudado periependimario.
To identify clinical and radiological factors associated to early evolution to brain death (BD), defined as occurring within the first 24 hours.
DesignA retrospective cohort study was made covering the period 2015-2017.
SettingAn adult Intensive Care Unit (ICU).
Patients/MethodsEpidemiological, clinical and imaging (CT scan) parameters upon admission to the ICU in patients evolving to BD.
ResultsA total of 166 patients with BD (86 males, mean age 62.7 years) were analyzed. Primary cause: intracerebral hemorrhage 42.8%, subarachnoid hemorrhage 18.7%, traumatic brain injury 17.5%, anoxia 9%, stroke 7.8%, other causes 4.2%. Epidemiological data: arterial hypertension 50%, dyslipidemia 34%, smoking 33%, antiplatelet medication 21%, alcoholism 19%, anticoagulant therapy 15%, diabetes 15%. The Glasgow Coma Score (GCS) upon admission was 3 in 68.8% of the cases in early BD versus in 38.2% of the cases in BD occurring after 24 h (p = 0.0001). Eighty-five patients presented supratentorial hematomas with a volume of 90.9 ml in early BD versus 82.7 ml in BD >24 h (p = 0.54). The mean midline shift was 10.7 mm in early BD versus 7.8 mm in BD >24 h (p = 0.045). Ninety-one patients presented ventriculomegaly and 38 additionally ependymal transudation (p = 0.021). Thirty-six patients with early BD versus 24 with BD >24 h presented complete effacement of basal cisterns (p = 0.005), sulcular effacement (p = 0.013), loss of cortico-subcortical differentiation (p = 0.0001) and effacement of the suprasellar cistern (p = 0.005). The optic nerve sheath measurements showed no significant differences between groups.
ConclusionsEarly BD (>24 h) was associated to GCS < 5, midline shift, effacement of the basal cisterns, cerebral sulci and suprasellar cistern, and ependymal transudation.
Los pacientes con hipertensión endocraneal evolucionan a muerte encefálica (ME) cuando la presión intracraneal (PIC) supera a la tensión arterial sistólica, dando lugar a la parada circulatoria cerebral1-5, siendo la etiología más frecuente en España la hemorragia intracerebral (HIC), seguida del traumatismo craneoencefálico (TCE) y la hemorragia subaracnoidea (HSA)3. Los donantes que fallecen en muerte encefálica continúan siendo la fuente principal de órganos para trasplante6, pero en los últimos años se ha detectado una disminución de los pacientes fallecidos por criterios neurológicos7, lo que representa un problema universal al reducir el número de órganos disponibles para trasplante. En España la ME supone el 2,3% de las muertes hospitalarias y el 12,4% de los fallecimientos en Unidad de Cuidados Intensivos (UCI)8, en nuestro entorno, un estudio europeo confirma que el 7,8%, de los pacientes ingresados en una UCI fallecen en situación de ME9.
Sabemos que la mayoría de los pacientes con graves lesiones cerebrales que evolucionan a ME, lo hacen en las primeras 72 horas3, pero identificar al ingreso que pacientes son los que van a evolucionar a ME y cuándo no es fácil. Las lesiones cerebrales tienen diferente etiología, un comportamiento fisiopatológico diferente y gran complejidad clínica. Varios estudios han identificado signos clínicos y radiológicos predictivos10-15 de evolución a ME, pero en la práctica clínica, no existe una herramienta que permita predecirlo con un alto grado de certeza. Identificar al ingreso qué factores están asociados a la ME precoz, puede ser de gran ayuda para el manejo terapéutico del paciente y la toma de decisiones, tales como la limitación del tratamiento de soporte vital (LTSV) o la identificación de potenciales donantes de órganos16.
El objetivo del presente estudio fue establecer la existencia de diferencias entre los elementos clínicos y radiológicos que se presentan en pacientes que evolucionan a ME precoz definida esta como la ocurrida en las primeras 24 horas, en comparación con aquellos que fallecían por ME transcurridas 24 horas.
Pacientes, material y métodosÁmbito
UCI polivalente de adultos en hospital universitario de tercer nivel.
Pacientes
Pacientes hospitalizados en UCI con evolución a ME desde el 1 de enero del 2015 hasta el 31 de Diciembre del 2017. Estudio retrospectivo.
Recopilación de datos
Se elaboró un formulario estandarizado para la recogida de variables epidemiológicas, clínicas, y radiológicas. Igualmente se recogieron datos de los tratamientos realizados, tales como barbitúricos, utilización de bloqueantes neuromusculares, terapia osmótica etc. Las escalas de gravedad utilizadas fueron la E. Glasgow (GCS) para el TCE y la HIC (en pacientes intubados y sedados se consideró el GCS registrado por la UVI móvil o el obtenido en el servicio de Urgencias del Hospital), Hunt y Hess para la HSA y el NIHSS (National Institutes of Health Stroke Scale) para el ictus isquémico. Cuando el paciente estaba intubado o en coma y no se podía aplicar el NIHSS se sustituyó por el GCS. Las variables radiológicas estudiadas en la TC craneal de ingreso fueron: volumen del hematoma medido por el método AxBxC/2 y añadiendo el área de edema circundante, medición en mm del espesor máximo de las lesiones extraaxiales, borramiento difuso de surcos, pérdida de la diferenciación córtico-subcortical, colapso ventricular, presencia o ausencia de cisterna supraselar, borramiento parcial/ completo de cisternas basales, medición del diámetro de la vaina del nervio óptico a 3 y 10 mm del globo ocular, presencia de hidrocefalia y trasudado periependimario. La interpretación de las imágenes fue realizada por un neurorradiólogo. Se definió ME precoz aquella que ocurría durante las primeras 24 horas de ingreso y ME tardía la que ocurría más allá de las primeras 24 horas.
Análisis estadístico
Los datos fueron analizados mediante el programa SPSS 20.0 para Windows® (SPSS Inc., Chicago, Illinois). Análisis comparativo mediante pruebas de Student-Welch, Mann-Whitney y X2 de variables clínicas y radiológicas. El análisis univariante y multivariante se realizaron mediante regresión logística. El nivel de significación estadística se fijó en una p <0,05.
ResultadosDurante los años 2015-2017 ambos incluidos, ingresaron en la UCI 3.834 pacientes con una edad media de 60,3 ± 15,8 años y con un APACHE II de 18,0 ± 7,9. La estancia media fue de 7 ± 12,5 días. De los pacientes ingresados, fallecieron 724 (mortalidad 18,8%) y de estos, 166 lo hicieron en ME de los cuales 144 fueron donantes de órganos y tejidos. La ME representó el 22,9% de los exitus de la UCI y el 3,4% de los exitus hospitalarios.
Variables clínicas
De los 166 casos de ME, 86 eran varones (51,8%) y 80 (48,2%) mujeres, con una edad media de 62,75 años. Etiología de la ME: 71 (42,8%) hemorragia intracerebral, 31 (18,7%) HSA, 29 (17,5%) TCE, 13 (7,8%) ictus isquémico, 15 (9%) anoxia y 7 (4,2%) otras causas. En sus antecedentes clínicos el 50% de los pacientes tenían HTA, 34% dislipemia, 33% tabaquismo, 21% estaban antiagregados, 19% enolismo, 15% anticoagulantes orales, 15% diabetes y 11% fibrilación auricular. Ninguna de estas variables mostró relación estadísticamente significativa con la aparición de ME ≤24 horas. Tampoco se encontraron diferencias significativas en relación con la edad, el sexo o el diagnóstico de los pacientes.
Con respecto a las escalas de gravedad, la mediana del GCS fue de 3 puntos, existiendo diferencias estadísticamente significativas en la distribución de la puntuación del GCS entre ambos grupos (p 0,0001). El GCS fue de 3 puntos en el 68,8% de pacientes en ME precoz frente al 38,2% en ME tardía. Por rangos, el GCS 4-5 fue el 24,7% en ME precoz vs. 27% en ME tardía, GCS 6-9 fue el 5,2% en ME precoz versus 23,6% en ME tardía y GCS 10-15 1,3% en ME precoz versus 11,1% en ME tardía. El GCS <5 se asoció con ME precoz (OR 2,9, p 0,002). En los 31 pacientes con HSA existen diferencias significativas en la puntuación de la escala Hunt y Hess entre ME precoz y tardía (p 0,026). El Hunt y Hess fue de 5 puntos en el 93,8% en ME precoz, frente al 66,7% de los pacientes que evolucionaron a ME tardíamente. En el grupo de ME tardía, el 26,6% puntuaron entre 3-4 y el 6,7% entre 1-2. De los 11 pacientes con ictus isquémico la media del NIHSS fue de 24 puntos.
Se monitorizó la presión intracraneal en 39 pacientes (23,5%), 11 con catéter Camino® y 28 mediante catéter intraventricular. La mayoría de los casos monitorizados (89,7%) corresponden a pacientes con evolución tardía a ME. La media de PIC máxima en el grupo de ME tardía fue de 60,4 mmHg vs. 63,7 en ME precoz. (p 0,8).
Tratamiento
De los pacientes con HSA aneurismática se realizó tratamiento endovascular en 18 (15 en el grupo que hizo ME tardía y tres en el de ME precoz). En los ictus isquémicos a siete pacientes se les practicó trombectomía mecánica (seis en el grupo de ME tardía y uno en el grupo de ME precoz). Tratamiento para la hipertensión intracraneal: 69 pacientes (41,6%) recibieron terapia osmótica (OR 0,28, p 0,0001), 44 pacientes (26%) fueron tratados con bloqueantes neuromusculares (OR 0,24, p 0,0001), cinco pacientes recibieron tratamiento con barbitúricos (3%) (p 0,62) y a 11 pacientes se les realizó cirugía descompresiva (6,6% del total) de los cuales 10 hicieron ME tardía y 1 ≤24 h, (OR 0,1, p 0,033). En 10 pacientes se realizó también evacuación quirúrgica de lesión ocupante de espacio. Todos los pacientes que recibieron algún tipo de tratamiento antihipertensión endocraneal, excepto los que recibieron barbitúricos, presentaban una relación estadísticamente significativa con evolución a ME tardía.
Variables radiológicasVolumen del hematoma: 85 pacientes tenían un hematoma de localización supratentorial con un volumen medio de 86,5 mL, IC 0,95 [73,3-99,7]. 12 pacientes tenían hematoma infratentorial con un volumen medio de 23,8 mL, IC 0,95 [11,0-36,6]. No se encontró diferencia significativa en cuanto al volumen del hematoma supratentorial (90,9 mL en ME precoz vs. 82,7 mL en ME tardía, p 0,54), ni en cuanto al volumen del hematoma infratentorial (26,2 mL en ME precoz vs. 23,0 mL en ME tardía, p 0,83).
Lesion extraaxial: no se constató ningún paciente con hematoma epidural. En la serie 33 pacientes presentaban hematoma subdural (16 en el grupo de ME >24 horas y 17 en el grupo de ME <24 horas). El espesor máximo medio medido en mm en el primer grupo fue de 9,59 y en el segundo grupo de 16,23 con una p de 0,053.
Desplazamiento de línea media: 10,7 mm en ME precoz vs. 7,8 mm en ME tardía con diferencia significativa (p 0,045). Por cada aumento de 1 mm en el desplazamiento de la línea media, aumenta el riesgo de ME precoz 1,06 veces (p 0,047).
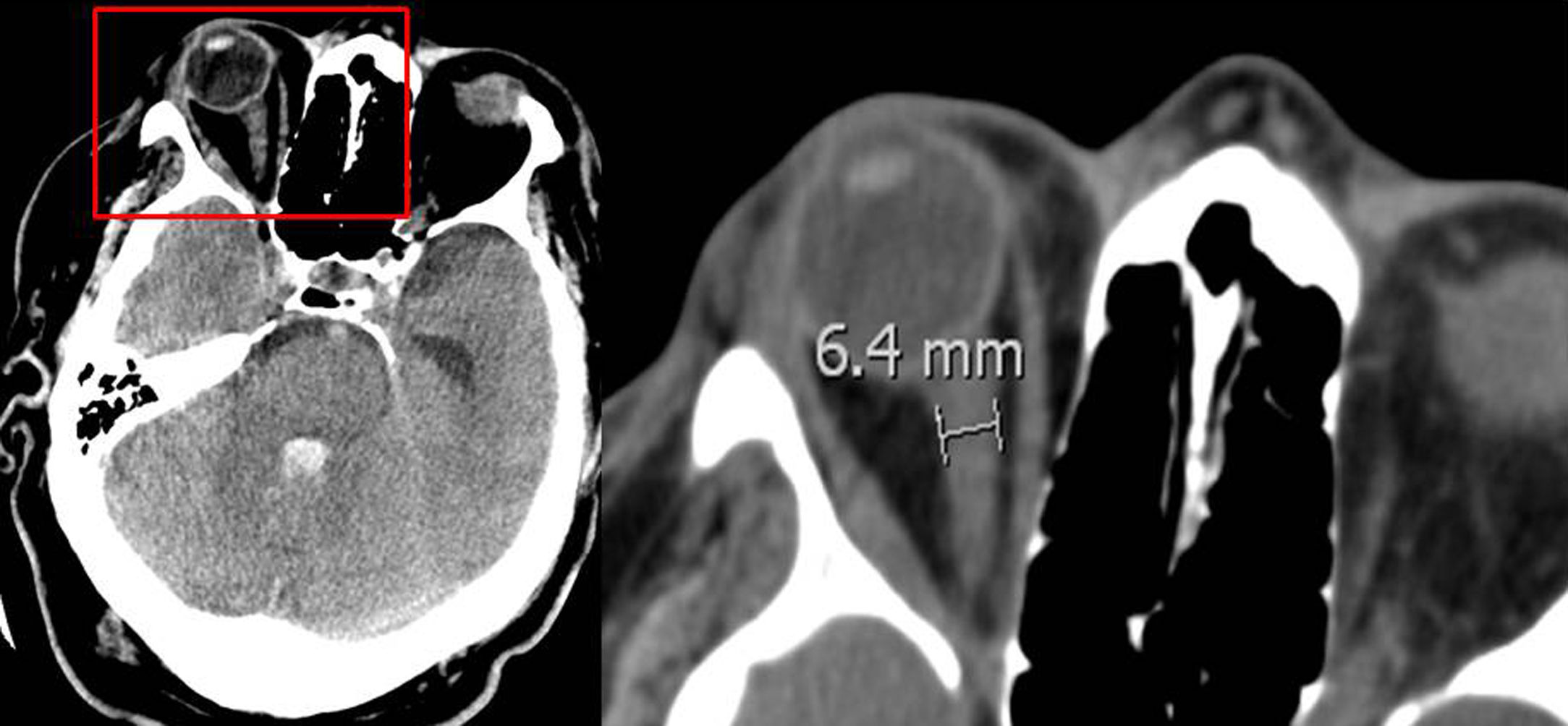
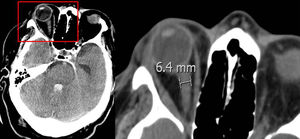
Vaina del nervio óptico: se midió el diámetro a 3 y 10 mm del globo ocular (fig. 1), los resultados se muestran en la tabla 1. No se encontró diferencia significativa entre el diámetro de la vaina del nervio óptico y la ME precoz.
Diámetro de la vaina del nervio óptico medido en mm
| TC de ingreso | ME ≥24 horas | ME >24 horas | p |
|---|---|---|---|
| Ojo izquierdo medido a:3 mm del globo ocular10 mm del globo ocularOjo derecho medido a:3 mm del globo ocular10 mm del globo ocularMedia:3 mm10 mm | 5,54,45,44,35,44,3 | 5,74,45,54,35,54,4 | 0,230,700,600,820,600,86 |
Hidrocefalia: 91 pacientes tenían ventriculomegalia y en 38 se acompañaba de trasudado periependimario relacionándose significativamente la presencia de trasudado con una evolución a ME precoz (OR 2,74, p 0,021).
El borramiento completo de las cisternas basales (36 pacientes en el grupo de ME precoz vs. 24 en ME tardía) OR 2,55 y p 0,005, el borramiento de los surcos (OR 2,28, p 0,013), la pérdida de diferenciación córtico-subcortical (OR 3,96, p 0,0001) y la ausencia de cisterna supraselar (OR 2,55 p 0,005) se relacionan significativamente con una evolución a ME precoz. El borramiento parcial de las cisternas basales no se asocia a ME precoz (tabla 2).
Signos de herniación cerebral y edema cerebral en la TC craneal
| TC ingreso | ME >24 horasn 85 | ME ≤24 horasn 71 | p |
|---|---|---|---|
| Signos de herniación cerebral | |||
| Borramiento parcial de cisternas basales | 57 | 52 | 0,4 |
| Borramiento completo de cisternas basales | 24 | 36 | 0,005 |
| Tumefacción/edema cerebral difuso | |||
| Borramiento difuso de surcos | 38 | 46 | 0,013 |
| Pérdida de la diferenciación córtico-subcortical | 12 | 28 | 0,0001 |
| Colapso ventricular | 15 | 15 | 0,68 |
| Cisterna supraselar ausente | 41 | 48 | 0,015 |
Al realizar un análisis multivariante la evolución a ME precoz se asoció con la pérdida de diferenciación córtico-subcortical OR 2,81 (p 0,041) y el GCS <5 con una OR 2,13 (p = 0,05). El aumento de 1 punto en la GCS disminuye la probabilidad de ME precoz 1,4 veces con p 0,013.
DiscusiónLas escalas de gravedad neurológicas ayudan a estimar la probabilidad de muerte o pronóstico funcional, pero sin alcanzar un alto grado de certeza17-20, por lo que las investigaciones se orientan a buscar factores asociados con evolución a ME que permitan optimizar la toma de decisiones clínicas al ingreso. Algunos autores han establecido el concepto de «ME inminente», definido como pacientes con lesión cerebral catastrófica, Glasgow 3, ausencia de tres o más reflejos de tronco y ventilación mecánica21,22, pero esta entidad es una situación clínica muy evolucionada y no es útil en la práctica clínica. Humbertjean et al.12 describen seis factores determinantes en la evolución a ME: puntuación en la escala de Glasgow ≤6 antes de la sedación, volumen del hematoma >65 mL, signos de herniación en la TC, hidrocefalia, tensión arterial sistólica inicial >150 mmHg y antecedentes de consumo excesivo de alcohol, con los que tratan de identificar en las primeras 24 horas los pacientes con alta probabilidad de evolucionar a ME. Otros estudios encuentran que los factores determinantes de mala evolución son la edad avanzada, baja puntuación en la escala de Glasgow o elevada en el NIHSS, localización infratentorial, hipertensión arterial, anticoagulación y/o coagulopatía, hemorragia ventricular e hidrocefalia13,23. En nuestro estudio no hemos encontrado ninguna relación estadísticamente significativa con los antecedentes clínicos de los pacientes ni tampoco con la edad, el sexo o el diagnóstico. Concordante con lo descrito en la literatura, sí encontramos que la escala de Glasgow al ingreso es un buen predictor. En nuestro caso el GCS fue de 3 puntos en el 68,8% de pacientes en ME precoz frente al 38,2% en ME tardía (p 0,0001) y el GCS <5 se asociaba claramente con ME precoz. Por otra parte, los pacientes que reciben tratamiento para la hipertensión intracraneal con terapia osmótica, bloqueantes neuromusculares y cirugía descompresiva, presentaban, como era de esperar, una ME tardía.
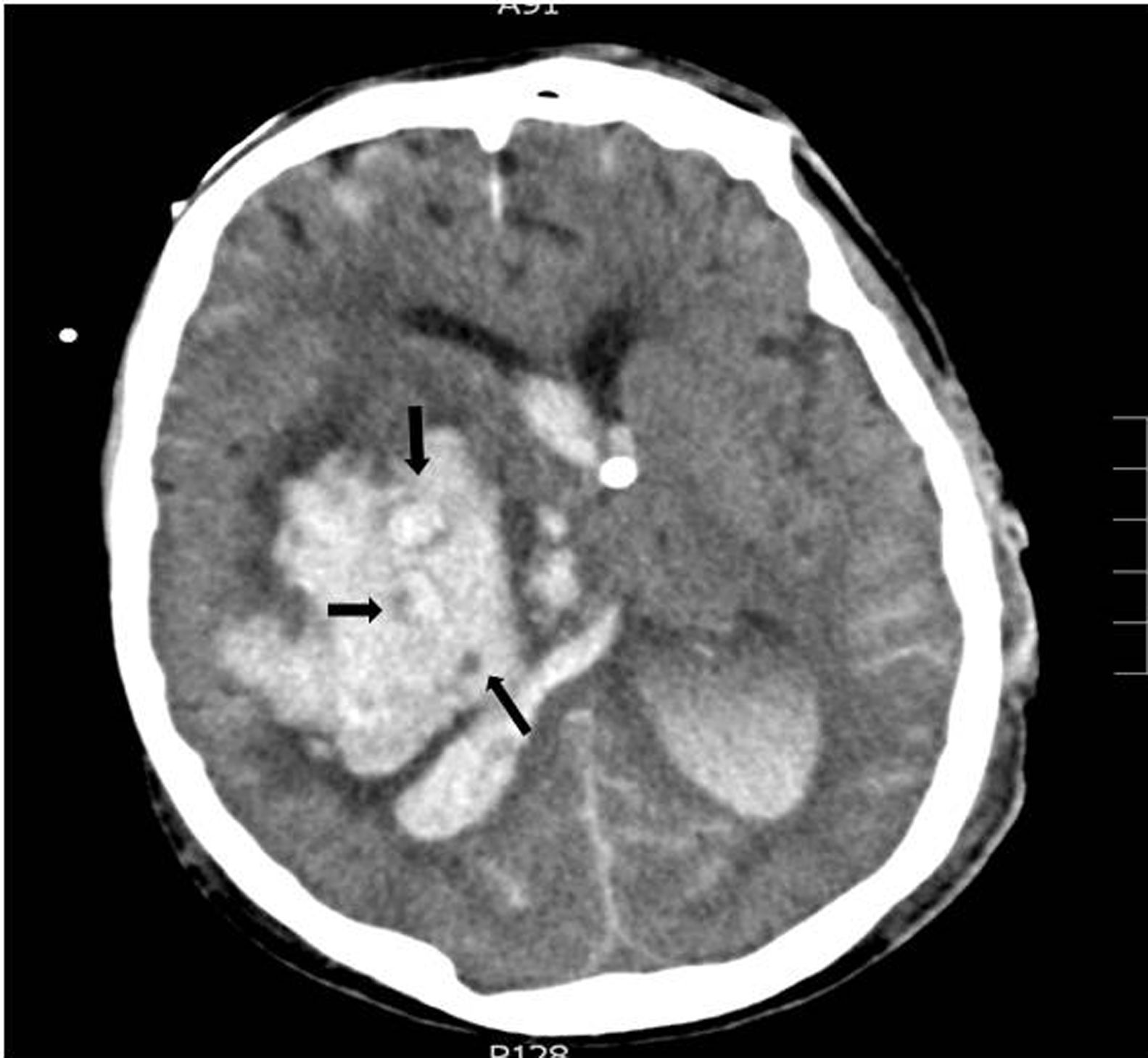
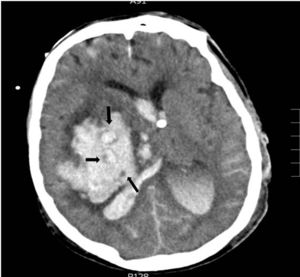
Con respecto a las variables radiológicas, tradicionalmente sabemos que la presencia de signos de hipertensión endocraneal en la TC es un indicador de gravedad, siendo el volumen de la lesión uno de los factores determinantes de mal pronóstico14,24; en el caso de las hemorragias, diversos estudios correlacionan el volumen del hematoma con la mortalidad a corto y largo plazo11,15,18,26-30 (tabla 3). La presencia de sangre intraventricular y su volumen, la localización infratentorial de la hemorragia, o la desviación de línea media, son también otros factores determinantes de mal pronóstico13,26,28,31,32. En pacientes con hemorragia intracerebral, la ausencia de reflejo corneal junto con el «signo del remolino» en la TC (fig. 2), que indica sangrado activo en el interior del hematoma, se han asociado a evolución de ME10 por una mayor probabilidad de expansión del hematoma, al igual que la presencia de spot sign en el angio-TC que también indica hemorragia activa33. En nuestra serie todos los pacientes fallecieron en situación de ME y presentaban signos de hipertensión endocraneal en la TC; los signos radiológicos que en nuestro estudio se asocian de forma significativa con una evolución a ME en las primeras 24 horas son el desplazamiento de línea media, la presencia de hidrocefalia activa, el borramiento completo de las cisternas basales, el borramiento de los surcos, la pérdida de diferenciación córtico-subcortical y la ausencia de cisterna supraselar.
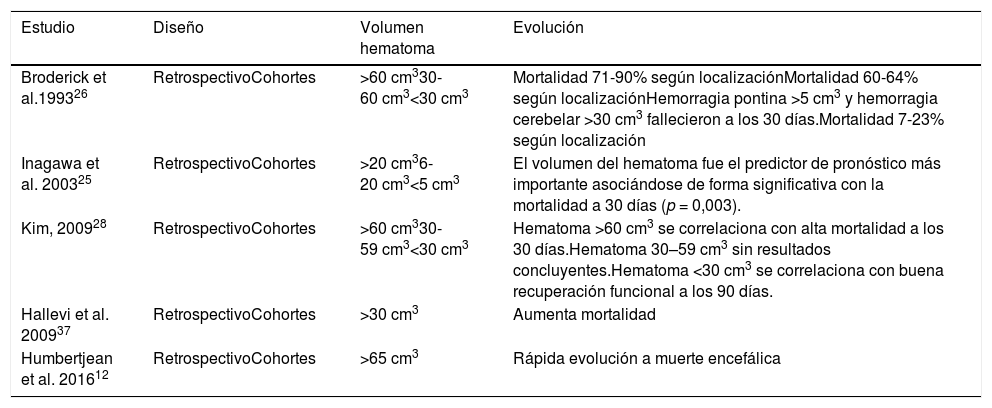
Volumen del hematoma y evolución de los pacientes en diferentes estudios
| Estudio | Diseño | Volumen hematoma | Evolución |
|---|---|---|---|
| Broderick et al.199326 | RetrospectivoCohortes | >60 cm330-60 cm3<30 cm3 | Mortalidad 71-90% según localizaciónMortalidad 60-64% según localizaciónHemorragia pontina >5 cm3 y hemorragia cerebelar >30 cm3 fallecieron a los 30 días.Mortalidad 7-23% según localización |
| Inagawa et al. 200325 | RetrospectivoCohortes | >20 cm36-20 cm3<5 cm3 | El volumen del hematoma fue el predictor de pronóstico más importante asociándose de forma significativa con la mortalidad a 30 días (p = 0,003). |
| Kim, 200928 | RetrospectivoCohortes | >60 cm330-59 cm3<30 cm3 | Hematoma >60 cm3 se correlaciona con alta mortalidad a los 30 días.Hematoma 30–59 cm3 sin resultados concluyentes.Hematoma <30 cm3 se correlaciona con buena recuperación funcional a los 90 días. |
| Hallevi et al. 200937 | RetrospectivoCohortes | >30 cm3 | Aumenta mortalidad |
| Humbertjean et al. 201612 | RetrospectivoCohortes | >65 cm3 | Rápida evolución a muerte encefálica |
Hemorragia en ganglios basales derechos con vertido ventricular y desplazamiento de línea media. En el interior del hematoma se observa el «signo del remolino», las flechas indican áreas con diferentes densidades; las pequeñas áreas hipodensas se corresponden con focos de sangrado activo por arteriolas y vénulas
La vaina del nervio óptico acumula líquido cefalorraquídeo y aumenta su diámetro en la hipertensión intracraneal. Aunque en la literatura no existe unanimidad en el lugar de la medición ni el diámetro necesario para considerar hipertensión endocraneal, algunos autores encuentran que un diámetro >5-6 mm se acompaña de un PIC >20 mmHg34,35. Nosotros medimos la vaina del nervio óptico a 3 y 10 mm del globo ocular sin encontrar una relación significativa con la evolución precoz a ME; en la medición de la vaina del nervio óptico realizada a 3 mm del globo ocular, la media encontrada del diámetro fue >5 mm en los dos grupos de pacientes (ME precoz y tardía). Algunas de las limitaciones de este estudio son su análisis retrospectivo, que analiza exclusivamente pacientes que evolucionan a ME y ser realizado en un solo centro.
La escasez de órganos para trasplante es un problema universal que ha obligado a implementar estrategias dirigidas a incrementar la donación. La ventilación electiva no-terapéutica (VENT) en terminología anglosajona, denominado en España: Cuidados Intensivos Orientados a la Donación (CIOD), promociona el ingreso en UCI de pacientes con lesiones catastróficas cerebrales, sin opciones terapéuticas, para facilitar la donación11,16,36, pero una de las dificultades de los CIOD es predecir con un alto grado de certeza qué pacientes van a evolucionar a ME y en qué plazo de tiempo. En este sentido, nuestro estudio, a pesar de sus limitaciones, tiene el interés de aportar algunos de los factores pronósticos más precoces, facilitando al médico intensivista la difícil toma de decisiones al ingreso en UCI en cuanto a LTSV o mantenimiento como donante potencial de órganos en ME.
Autoría/colaboracionesDolores Escudero diseñó el estudio y escribió el manuscrito.
Iván Astola participó en el diseño del trabajo, el análisis estadístico y la elaboración y corrección del manuscrito.
Ángela Meilán y Débora Vizcaino recogieron los datos radiológicos, analizaron las imágenes de la TC craneal y revisaron el manuscrito.
Salvador Balboa, Blanca Leoz, Cecilia del Busto, Brígida Quindós, Lorena Forcelledo, Lorena Martín, Estefanía Salgado, y Lucía Viña realizaron la recogida de datos y participaron en la corrección del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónLos autores no han recibido ningún tipo de financiación.