Evaluar el grado de adherencia a las recomendaciones sobre el tratamiento antivírico y su impacto en la mortalidad de pacientes críticos afectados por gripe A (H1N1)pdm09.
DiseñoAnálisis secundario de estudio prospectivo.
ÁmbitoMedicina intensiva (UCI).
PacientesPacientes con gripe A (H1N1)pdm09 en el periodo pandémico 2009 y pospandémico 2010-11.
VariablesLa adherencia a las recomendaciones se clasificó en: total (AT), parcial dosis (PD), parcial tiempo (PT) y no adherencia (NA). La neumonía vírica, obesidad y ventilación mecánica fueron considerados criterios de gravedad para el uso de dosificaciones elevadas de antivírico (CG). Análisis mediante «chi» cuadrado y t-test. Supervivencia mediante regresión de Cox.
ResultadosSe incluyeron 1.058 pacientes, 661(62,5%) en pandemia y 397 (37,5%) en pospandemia. La AT global del estudio fue del 41,6% (el 43,9% y el 38%, respectivamente; p=0,07). Los pacientes con criterios de gravedad no fueron diferentes en ambos periodos (un 68,5% y un 62,8%; p=0,06). En estos pacientes la AT fue del 54,7% durante el 2009 y del 36,4% en pospandemia (p<0,01). La NA (19,7% vs. 11,3%; p<0,05) y la PT (20,8% vs. 9,9%; p<0,01) fueron más frecuentes durante la pospandemia. La mortalidad fue mayor en la pospandemia (30% vs. 21,8%; p<0,001). El APACHE II(HR=1,09) y la enfermedad hematológica (HR=2,2) se asociaron a mortalidad y la adherencia (HR=0,47) fue un factor protector.
ConclusionesSe evidencia un bajo grado de adherencia al tratamiento en ambos periodos. La adherencia al tratamiento antivírico se asocia con menor mortalidad y debería ser recomendada en pacientes críticos afectados por gripe A (H1N1)pdm09.
To determine the degree of antiviral treatment recommendations adherence and its impact to critical ill patients affected by influenza A(H1N1)pdm09 mortality.
DesignSecondary analysis of prospective study.
SettingIntensive care (UCI).
PatientsPatients with influenza A(H1N1)pdm09 in the 2009 pandemic and 2010-11 post-Pandemic periods.
VariablesAdherence to recommendations was classified as: Total (AT); partial in doses (PD); partial in time (PT), and non-adherence (NA). Viral pneumonia, obesity and mechanical ventilation were considered severity criteria for the administration of high antiviral dose. The analysis was performed using t-test or «chi» square. Survival analysis was performed and adjusted by Cox regression analysis.
ResultsA total of 1,058 patients, 661 (62.5%) included in the pandemic and 397 (37.5%) in post-pandemic period respectively. Global adherence was achieved in 41.6% (43.9% and 38.0%; P=.07 respectively). Severity criteria were similar in both periods (68.5% vs. 62.8%; P=.06). The AT was 54.7% in pandemic and 36.4% in post-pandemic period respectively (P<.01). The NA (19.7% vs. 11.3%; P<.05) and PT (20.8% vs. 9.9%, P<.01) was more frequent in the post-pandemic period. The mortality rate was higher in the post-pandemic period (30% vs. 21.8%, P<.001). APACHE II (HR=1.09) and hematologic disease (HR=2.2) were associated with a higher mortality and adherence (HR=0.47) was a protective factor.
ConclusionsA low degree of adherence to the antiviral treatment was observed in both periods. Adherence to antiviral treatment recommendations was associated with lower mortality rates and should be recommended in critically ill patients with suspected influenza A(H1N1)pdm09.
Ante la pandemia de gripe A (H1N1) en los inicios de 2009, las autoridades sanitarias planificaron estrategias de comunicación, la toma de decisiones éticas, el aprovisionamiento de antivíricos y la mejora de la capacidad del sistema sanitario, para hacer frente a la adecuada atención de un gran número de pacientes. En este sentido se establecieron un conjunto de directrices y estrategias que agrupaban la evidencia disponible hasta ese momento e iban encaminadas a optimizar la terapia antivírica. En España, con el objetivo de garantizar una asistencia adecuada y homogénea a los pacientes adultos afectados por el virus A (H1N1)pdm09 con formas graves de la enfermedad1,2, se diseñó desde el Ministerio de Salud un protocolo de actuación3 basado en las recomendaciones emitidas por la OMS4,5. Sin embargo, dicho documento se estableció sobre los datos de eficacia de los inhibidores de la neuraminidasa obtenidos a partir de estudios realizados en pacientes con cuadros leves o moderados. Por lo tanto, el verdadero impacto del tratamiento antivírico en pacientes críticos era difícil de valorar, debido a la falta de estudios aleatorizados en este grupo especial de pacientes.
Durante el periodo pandémico, distintas organizaciones sanitarias4–7 coincidieron en que era necesario administrar tratamiento antivírico con oseltamivir, de forma precoz, a todas las personas que requirieran hospitalización, que tuvieran una enfermedad progresiva grave o que desarrollaran complicaciones. Esta estrategia debía aplicarse con independencia del estado de salud previo o de los antecedentes de vacunación. En este contexto, la dosis recomendada de oseltamivir para adultos fue de 75mg 2 veces al día por vía oral. Por otra parte, se consideró que determinados colectivos de pacientes podrían requerir una dosis superior (300mg/día)6,8,9 por una posible disminución en la absorción intestinal del medicamento y/o un incremento en el volumen de distribución cuando requieren ventilación mecánica y/o presentan obesidad. La duración del tratamiento antivírico en pacientes con enfermedad leve o moderada se limitó a 5 días (tiempo de eliminación del virus)7–9, mientras que en los pacientes críticos, en los que el periodo de eliminación del virus podía prolongarse de forma significativa6,8,9, se aconsejó un tratamiento más prolongado (10 días).
El grado de adherencia global a las guías clínicas es muy variable pero generalmente bajo10–12. Las guías de tratamiento antivírico durante la pandemia 2009 y el periodo pospandémico 2010-11 fueron aplicadas según decisiones de cada comunidad autónoma, de cada centro de salud y de cada prescriptor individual, por lo cual nuestra hipótesis es que existe una diferencia considerable entre la recomendación de tratamiento realizado por las autoridades sanitarias y su implementación en la práctica clínica. A pesar del elevado número de publicaciones sobre pacientes con gripe A (H1N1)pdm09, el grado de adherencia a las guías de tratamiento antivírico durante la pandemia de gripe A no se conoce. Por lo cual, nuestro objetivo fue evaluar el grado de adherencia a las recomendaciones de tratamiento antivírico en los pacientes críticos afectados de gripe A en 2 periodos, pandémico y pospandémico, así como la asociación entre la adherencia, los factores de riesgo y la mortalidad.
Material y métodoAnálisis secundario de un estudio prospectivo, observacional y multicéntrico.
Población de estudioLa población de estudio comprendió 2 cohortes de pacientes adultos, todos ellos casos confirmados de gripe A (H1N1)pdm09 e ingresados en 148 unidades de críticos (UCI) españolas. No se incluyeron otros tipos de virus responsables de gripe (H3N2 ni B) ya que la circulación del virus A (H1N1)pdm09 fue predominante durante los periodos de estudio.
Criterios de inclusión y exclusiónSe incluyeron todos los pacientes con clínica compatible con gripe que presentaron fiebre (>38°C), síntomas respiratorios compatibles con tos, dolor de garganta, mialgia o enfermedad de tipo gripal, insuficiencia respiratoria aguda con confirmación microbiológica de la infección por gripe A (H1N1)pdm09. Se excluyeron los menores de 15 años y aquellos pacientes con clínica compatible con síndrome gripal pero sin confirmación microbiológica de gripe A (H1N1)pdm09.
Se analizaron 2 periodos: 1) una cohorte de pacientes ingresados entre las semanas epidemiológicas 23-52 del año 2009 correspondientes con la pandemia y 2) una cohorte de pacientes durante el periodo pospandémico que registró los casos diagnosticados entre las semanas epidemiológicas 50 -52 del 2010 y las semanas 1-9 del 2011.
Recogida de datosLos datos se obtuvieron a partir de un registro voluntario creado por la Sociedad Española de Medicina Intensiva (SEMICYUC). El estudio fue aprobado por el Comité Ético del hospital coordinador del proyecto (IRB NEUMAGRIP/11809). La identidad de los pacientes permaneció en el anonimato y la obtención del consentimiento informado fue considerada innecesaria debido a la naturaleza observacional del estudio y a la urgencia sanitaria.
Los datos fueron comunicados por el médico responsable de cada centro participante mediante un formulario de registro voluntario. La confirmación de la infección por el virus A (H1N1)pdm09 se realizó por medio de la PCR en tiempo real en muestras de frotis nasofaríngeos o secreciones traqueales en cada institución o de manera centralizada en un laboratorio de referencia, cuando los recursos locales no estaban disponibles. Los criterios de admisión en la UCI y las decisiones de tratamiento para todos los pacientes, incluyendo la necesidad de intubación y el tipo de tratamiento antibiótico o antivírico administrado, se realizaron a discreción del médico responsable.
El shock séptico y la puntuación de disfunción multiorgánica (SOFA score) fueron definidos siguiendo los criterios del Colegio Americano de Médicos del Tórax y la Sociedad de Medicina de Cuidados Críticos13,14. Se consideró neumonía vírica primaria cuando los pacientes presentaban dificultad respiratoria aguda y opacidades alveolares en 2 o más lóbulos con cultivos respiratorios y hemocultivos negativos durante la fase aguda de la infección por virus de la influenza12. La coinfección respiratoria adquirida en la comunidad fue definida como cualquier infección bacteriana o fúngica diagnosticada dentro de los 2 primeros días de hospitalización14. Las infecciones que ocurrieron después de las 48h se consideraron nosocomiales.
La enfermedad hematológica fue definida como aquella que se presentaba en pacientes con leucemia linfoblástica aguda, leucemia aguda mieloblástica, leucemia linfocítica crónica, leucemia mieloide crónica, linfoma de Hodgkin, linfoma no Hodgkin, mieloma, o enfermedad injerto contra huésped12.
Los pacientes obesos fueron definidos como aquellos con un índice de masa corporal>30kg/m215.
Los pacientes que habían recibido previamente una vacuna contra el virus A (H1N1)pdm09 monovalente o la vacuna polivalente para la gripe estacional 2010-2011 se consideraron «vacunados». La insuficiencia renal aguda y sus grados de disfunción se diagnosticaron según los criterios Acute Kidney injury (AKI)16.
En cuanto al tratamiento antivírico, se consideró como tratamiento «precoz» cuando el tiempo desde el inicio de la sintomatología hasta el comienzo del tratamiento antivírico fue≤48h 3.
Se consideró pacientes con «criterios de gravedad» a aquellos que presentaron una combinación de neumonía, obesidad (índice de masa corporal >30kg/m2) y/o presencia de ventilación mecánica invasiva siguiendo las recomendaciones sobre el tratamiento antivírico emitidas por la SEMICYUC, las cuales recogían que este grupo de pacientes podía beneficiarse de la administración de oseltamivir a dosis altas (150mg/12h) y con duraciones de tratamiento superiores a 10 días, argumentando la existencia de mayor volumen de distribución. Para el resto de los pacientes, es decir «sin criterios de gravedad», se recomendaron dosis y duraciones estándares (75mg/12h<10días)3.
La variable «adherencia» a las recomendaciones de tratamiento antivírico se estableció mediante la combinación de las variables «criterios de gravedad» y la duración y dosificación del tratamiento antivírico prescrito para cada paciente. De esta forma se establecieron 4 grados de adherencia tal como se observa en la tabla 1. También se estudió la adherencia como una variable dicotómica en la que se consideró «adherencia total» a aquellos pacientes que habían recibido el tratamiento recomendado tanto en dosis como en duración de tratamiento y «no adherencia» al resto.
Clasificación de los grados de adherencia a los protocolos de tratamiento antivírico
| Variable adherencia | Definición |
|---|---|
| Adherencia total | Dosis de 150mg/12h y duración≥10díasaDosis de 75mg/12h y duración<10díasb |
| Adherencia parcial en dosis | Dosis de 150mg/12h pero duración<10díasaDosis de 75mg/12h pero duración≥10díasb |
| Adherencia parcial en duración | Dosis de 75mg/12h y duración≥10díasaDosis de 150mg/12h y duración<10díasb |
| No adherencia | Dosis de 75mg/12h y duración de<10díasaDosis de 150mg/12h y duración≥10díasb |
Las variables categóricas se expresaron como valores (porcentaje) y las variables continuas como media±desviación estándar o medianas con el 25 al 75 o intercuartil gama. Para las características demográficas y clínicas de los pacientes, las diferencias entre grupos se evaluaron mediante la prueba de «chi» cuadrado o prueba exacta de Fisher para las variables categóricas y t-test o U de Mann-Whitney para las variables continuas cuando fue apropiado. El impacto de las diferentes variables sobre la mortalidad se estudió mediante regresión de Cox17,18. Con el fin de evitar asociaciones espurias, la elección de la variables a introducir se decidió mediante el criterio estadístico en aquellas variables con significación en el análisis univariado (p<0,1) o por un sentido clínico potencial con el resultado.
Para evaluar la posibilidad de un impacto diferenciado de las variables explicativas en los resultados para cada periodo, las interacciones entre las variables explicativas y periodos fueron utilizados en los modelos. Los resultados se presentan como hazard ratio (HR), el 95% intervalos de confianza del 95% (IC 95%).
Finalmente un análisis post-hoc fue realizado excluyendo a aquellos pacientes que fallecieron precozmente, antes de poder cumplir con los objetivos de la adherencia, y de esta forma poder solo analizar específicamente la adherencia a las recomendaciones en pacientes que habían cumplido con el tratamiento indicado a modo de un análisis «per-protocol».
Un valor de p<0,05 fue considerado significativo. Los datos fueron analizados utilizando SPSS 16.0 para Windows (SPSS, Chicago, IL, EE. UU.)
ResultadosSe incluyeron en el presente análisis un total de 1.058 pacientes ingresados en UCI con infección confirmada de gripe A (H1N1)pdm09, 661 pacientes (62,5%) correspondían a pacientes infectados durante la pandemia del año 2009 y 397 (37,5%) pacientes al periodo 2010-11 (pospandemia). Las variables relacionadas con el tratamiento antivírico evaluadas para cada periodo se presentan en la tabla 2. Los pacientes del periodo pospandémico presentaron un mayor nivel de gravedad y disfunción orgánica así como mayor frecuencia de shock, insuficiencia renal, necesidad de ventilación mecánica y diálisis. También se observó un mayor retraso en el diagnóstico, en el ingreso a UCI y al hospital. En lo que respecta al tratamiento, en el periodo pospandémico se observó un mayor retraso en el inicio del tratamiento antivírico (un día) y una menor indicación de tratamiento empírico precoz, así como un menor uso en general de altas dosis y duraciones más cortas en el tratamiento antivírico.
Comparación de diferentes variables que definen el tratamiento antivírico entre ambos periodos
| Variable | Pandemia 2009n=661 | Pandemia 2010-11n=397 | p |
|---|---|---|---|
| Gravedad, media (DE) | |||
| APACHE II | 13,9 (7,2) | 16,2 (7,7) | <0,001 |
| SOFA | 5,7 (3,6) | 6,2 (4,0) | 0,03 |
| Manifestaciones clínicas, n (%) | |||
| Neumonía vírica primaria | 546 (69,5) | 267 (67,3) | 0,4 |
| EPOC reagudizada | 36 (5,5) | 24 (6,1) | 0,8 |
| Coinfección bacteriana | 99 (15,2) | 76 (19,2) | 0,1 |
| Variables asistenciales, media (DE) | |||
| Estancia media en UCI | 13,53 (14,34) | 13,88 (13,82) | 0,69 |
| Estancia media en hospitalización | 20,8 (17,83) | 20,01 (16,97) | 0,47 |
| Días desde inicio síntomas hasta ingreso hospitalario | 4,28 (2,7) | 4,92 (3,4) | 0,02 |
| Días desde la hospitalización hasta ingreso en UCI | 1,86 (2,1) | 2,37 (3,8) | 0,016 |
| Días de hospitalización hasta el diagnóstico | 2,32 (2,1) | 6,69 (3,9) | <0,001 |
| Indicadores de evolución, n (%) | |||
| Shock séptico | 295 (45,5) | 224 (56,4) | 0,001 |
| Ventilación mecánica | 471 (71,3) | 326 (82,1) | <0,001 |
| Ventilación mecánica invasiva | 404 (61,2) | 269 (66,8) | 0,02 |
| Posición en decúbito prono | 95 (14,7) | 82 (20,7) | 0,01 |
| Insuficiencia renal aguda | 136 (21,7) | 112 (39,3) | 0,005 |
| Diálisis | 20 (3,1) | 29 (7,3) | 0,002 |
| Mortalidad en las UCI | 144 (21,8) | 119 (30) | 0,003 |
| Tratamiento | |||
| Tratamiento con oseltamivir, n (%) | 643 (99,1) | 383 (96,7) | 0,008 |
| Tratamiento con zanamivir, n (%) | 4 (0,69) | 25 (6,3) | <0,001 |
| Tratamiento antivírico empírico, n (%) | 463 (72,9) | 274 (71) | 0,517 |
| Días inicio síntomas-administración de antivírico, media (DE) | 4,7 (2,9) | 5,7 (3,6) | <0,001 |
| Tratamiento antivírico precoz (<48h), n (%) | 153 (23,9) | 61 (15,8) | 0,002 |
| Uso de altas dosis del fármaco antivírico, n (%) | 453 (72,9) | 212 (55,4) | <0,001 |
| Duración del tratamiento antivírico, media (DE) | 9,6 (4,26) | 8,88 (3,8) | 0,005 |
| Adherencia al protocolo de tratamiento, n (%) | 267 (43,9) | 145 (38) | 0,075 |
La adherencia total global del estudio fue del 41,6% y superior para el periodo pandémico (43,9%) respecto del periodo 2010-11 (38%), aunque estas diferencias no fueron estadísticamente significativas (p=0,07).
Al efectuar el análisis del grado de adherencia según las 2 categorías de pacientes establecidas en los protocolos (presencia o ausencia de los criterios de gravedad) se observó que el porcentaje de pacientes con «criterios de gravedad» que debían recibir dosificaciones altas fue superior durante el periodo pospandémico (68,5%) respecto del pandémico (62,8%) pero sin alcanzar significación estadística (p=0,06). En la tabla 3 se puede observar los diferentes grados de adherencia según la presencia o no de criterios de gravedad en ambos periodos considerados. La «adherencia total» fue del 54,7% para el 2009 y descendió significativamente hasta el 36,4% durante el 2010-11. Por otra parte, la no adherencia y la adherencia parcial en duración fueron más frecuentes en el periodo pospandémico. A diferencia de lo observado en los pacientes con criterios de gravedad, aquellos que no los presentaban tuvieron un mayor grado de «adherencia total» durante el periodo pospandémico.
Grados de adherencia en cada periodo para pacientes con y sin criterios de gravedad
| Pacientes con criterios de gravedad: dosificación elevada | |||
|---|---|---|---|
| Grados de adherencia: n (%) | Pandemia 2009n=380 | Periodo 2010-11n=264 | p |
| Adherencia total | 208 (54,7) | 96 (36,4) | <0,001 |
| Adherencia parcial en dosis | 84 (22,1) | 61 (23,1) | 0,774 |
| Adherencia parcial en duración | 47 (11,3) | 52 (19,7) | 0,014 |
| No adherencia | 41 (9,9) | 55 (20,8) | 0,007 |
| Pacientes sin criterios: dosificación estándar | |||
|---|---|---|---|
| Grados de adherencia: n (%) | Pandemia 2009n=228 | Periodo 2010-11n=118 | P |
| Adherencia total | 59 (25,9) | 49 (41,5) | 0,003 |
| Adherencia parcial en dosis | 18 (7,9) | 15(12,7) | 0,177 |
| Adherencia parcial en duración | 89 (39) | 32 (27,1) | 0,032 |
| No adherencia | 62 (27,2) | 22 (18.6) | 0,08 |
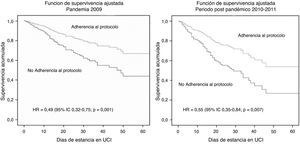
La mortalidad fue significativamente mayor (p=0,001) en los pacientes del periodo pospandémico 2010-11 (n=119; 30%) respecto del periodo pandémico (n=144; 21,8%), lo cual se asoció a un mayor nivel de gravedad valorado por el APACHE II (16,2 [7,7] vs. 13,9 [7,2]; p<0,001) y a un mayor compromiso orgánico (SOFA al ingreso 6,2 [4,0] vs. 5,7 [3,6]; p=0,03) para dicho periodo. En la tabla 4 se observan las variables asociadas con la mortalidad en ambos periodos considerados. Al incluir aquellas variables con significación estadística en el análisis multivariado, se observó que el APACHE II, la enfermedad hematológica y la adherencia al tratamiento fueron las variables asociadas de forma independiente con la mortalidad (tabla 5). Por otra parte, el tratamiento antivírico precoz solo se evidenció asociado a supervivencia en el periodo pandémico, mientras que el VIH lo fue en el brote estacional (tabla 5). El análisis de supervivencia ajustada evidenció que la adherencia a los protocolos de tratamiento antivírico establecidos mejoró la supervivencia tanto al considerar la población global (HR=0,57; IC 95%: 0,431-0,77; p<0,001) como al diferenciar ambos periodos (fig. 1).
Características demográficas y clínicas de supervivientes y fallecidos en los 2 periodos
| Variables | Periodo pandémico (n=661) | Periodo pospandémico (n=396) | ||||
|---|---|---|---|---|---|---|
| Viven(n=517) | Fallecen(n=144) | p | Viven(n=277) | Fallecen(n=119) | p | |
| Nivel de gravedad | ||||||
| SOFA | 4,9 (3) | 8,5(4,3) | <0,001 | 5,2 (3,59) | 8,6 (4) | <0,001 |
| APACHE II | 12,5 (6,1) | 19,5 (8,4) | <0,001 | 14,1 (6,3) | 21 (8,4) | <0,001 |
| Factores demográficos | ||||||
| Edad, media (DE) | 43,8 (14) | 48 (16,4) | 0,057 | 49,5 (14,4) | 51,9 (14,1) | 0,113 |
| Sexo masculino | 287 (55,9) | 91 (63,3) | 0,209 | 184 (66,2) | 85 (71,4) | 0,590 |
| Comorbilidades | ||||||
| >1 morbilidad | 353 (69,6) | 154 (79,4) | 0,051 | 205 (73,7) | 94 (79) | 0,316 |
| EPOC | 87 (16,8) | 21 (14,6) | 0,467 | 52 (21,3) | 26 (24,8) | 0,203 |
| Asma | 69 (13,6) | 12 (8,5) | 0,829 | 27 (9,7) | 6 (5) | 0,4 |
| Insuficiencia cardíaca | 31 (6,1) | 16 (11,3) | 0,034 | 26 (9,4) | 13 (11,8) | 0,189 |
| Insuficiencia renal crónica | 19 (3,7) | 14 (9,9) | 0,010 | 19 (6,8) | 13 (10,9) | 0,45 |
| Diabetes mellitus | 62 (12,2) | 20 (14,2) | 0,555 | 48 (17,3) | 16 (13,4) | 0,946 |
| Obesidad | 180 (35,5) | 58 (41,1) | 0,713 | 107 (38,5) | 31 (26,1) | 0,017 |
| Enfermedad autoinmune | 13 (2,5) | 8 (1,8) | 0,09 | 7 (2,9) | 7 (6,7) | 0,153 |
| Enfermedad hematológica | 19 (3,7) | 21 (14,9) | <0,001 | 15 (5,4) | 28 (23,5) | <0,001 |
| Enfermedad neuromuscular | 18 (3,5) | 6 (4,2) | 0,783 | 2 (0,8) | 2 (1,9) | 0,632 |
| VIH | 9 (1,8) | 4 (2,8) | 0,165 | 2 (0,7) | 12 (10,1) | <0,001 |
| Embarazo | 24(4,6) | 7 (4,8) | 0,896 | 11 (4) | 2 (1,7) | 0,233 |
| Presentación clínica | ||||||
| Neumonía vírica | 359 (70,1) | 97 (67,4) | 0,178 | 186 (66,9) | 81 (68,1) | 0,844 |
| EPOC exacerbación | 31 (6,1) | 5 (3,5) | 0,427 | 22 (7,9) | 2 (1,7) | 0,217 |
| Coinfección bacteriana respiratoria | 70 (13,6) | 29 (20,9) | 0,056 | 45 (16,2) | 31,2 (6,1) | 0,119 |
| Complicaciones | ||||||
| Shock séptico | 190 (37,4) | 105 (74,5) | <0,001 | 127 (45,7) | 97 (91,5) | 0,001 |
| Fallo multiorgánico | 283 (55,5) | 125 (88) | <0,001 | 133 (47,89 | 100 (84) | 0,001 |
| Insuficiencia renal aguda | 74(15) | 38 (27,1) | <0,001 | 49 (17,6) | 64 (53,8) | <0,001 |
| Terapia de remplazo renal continuo | 74 (15) | 62 (45,9) | <0,001 | 9 (3,2) | 20 (16,8) | <0,001 |
| Ventilación mecánica no invasiva | 125 (24,2) | 38 (27) | 0,373 | 105 (38,5) | 37 (31,1) | 0,766 |
| Ventilación mecánica invasiva | 266 (51,6) | 138 (95,8) | <0,001 | 156 (57,1) | 113 (95) | <0,001 |
| Fallo renal | 74 (15) | 62 (45,9) | <0,001 | 51 (18,3) | 61 (51,2) | <0,001 |
| Posición en decúbito prono | 52 (10,2) | 43 (30,7) | 0,002 | 33 (11,9) | 49 (41,2)49 | <0,001 |
| Tratamiento | ||||||
| Tratamiento con oseltamivir | 506 (99,6) | 137 (97,2) | <0,001 | 68 (96,8) | 115 (96,6) | 0,322 |
| Tratamiento con zanamivir | 2 (0,4) | 2 (1,4) | 0,475 | 16 (5,8) | 9 (7,6) | 0,973 |
| Tratamiento antivírico empírico | 371 (74,3) | 92 (67,6) | 0,207 | 196 (72,6) | 78 (67,2) | 0,07 |
| Días hasta inicio del tratamiento antivírico | 4,6 (2,7) | 5,3 (3,6) | 0,085 | 5,4 (3,1) | 6,5 (4,4) | 0,033 |
| Tratamiento antivírico precoz (≤48h) | 129(25,6) | 24 (17,8) | 0,361 | 49 (18,1) | 12 (10,3) | 0,263 |
| Pacientes con criterios de gravedad | 284 (54,9) | 131 (91) | <0,001 | 160 (57,6) | 112 (94,1) | <0,001 |
| Uso de dosificaciones elevadas | 221 (45,4) | 49 (40,5) | 0,113 | 88 (33) | 30 (26,1) | 0,001 |
| Uso de dosis altas (150mg/12h) | 350 (70,9) | 103 (81,1) | 0,204 | 148 (55,2) | 64 (55,7) | 0,147 |
| Uso de más de 10 días de tratamiento | 276 (56,4) | 59 (48) | <0,001 | 138 (51,7) | 47 (40,9) | <0,001 |
| Duración del tratamiento antivírico | 9,79 (3,98 | 8,88 (5,17) | <0,001 | 9,34 (3,36) | 7,8 (4,5) | <0,001 |
| Adherencia total al tratamiento | 218 (44,8) | 49 (40,5) | 0,002 | 113 (42,3) | 32 (27,8) | <0,001 |
| Vacunación | -- | -- | -- | 16 (5,8) | 6 (5) | 0,883 |
EPOC: enfermedad pulmonar obstructiva crónica; UCI: unidad de cuidados intensivos; VIH: virus de inmunodeficiencia humana.
Variables que lograron significación estadística asociadas a la mortalidad (regresión de Cox) para cada uno de los periodos considerados
| Periodo pandémico | Periodo pospandémico | |||||
|---|---|---|---|---|---|---|
| Variables | HR | IC 95% | P | HR | IC 95% | p |
| APACHE II score (por punto) | 1,09 | 1,06-1,12 | 0,001 | 1,07 | 1,05-1,09 | 0,001 |
| Enfermedad hematológica | 2,20 | 1,26-3,85 | 0,005 | 2,27 | 1,39-3,70 | 0,001 |
| Adherencia al tratamiento | 0,47 | 0,32-0,75 | 0,001 | 0,55 | 0,35-0,80 | 0,007 |
| Tratamiento precoz (<48h) | 0,56 | 0,32-0,97 | 0,03 | 0,83 | 0,35-1,83 | 0,07 |
| Serología positiva VIH | 2,73 | 0,96-7,72 | 0,058 | 3,20 | 1,63-6,30 | 0,001 |
En el análisis post-hoc, se identificaron solo 23 pacientes (2,2%) que fallecieron antes de completar el tratamiento indicado por el médico tratante, por lo cual fueron excluidos. La población final para este análisis fue de 1.035 pacientes. Doce de los pacientes (1,2%) correspondieron al periodo pandémico y 11 (1,0%) al pospandémico. La adherencia global fue similar (42,6%) a la observada para la población total, sin diferencias estadísticas entre los periodos estudiados. En esta población, la adherencia a las recomendaciones (HR=0,62; IC 95%: 0,43-0,96) y el tratamiento antivírico precoz (HR=0,64; IC 95%: 0,43-0,95) fueron las únicas variables asociadas de forma independiente con una menor mortalidad en el análisis multivariado.
DiscusiónEl principal hallazgo del presente estudio fue evidenciar una baja adherencia global a las recomendaciones de tratamiento de la gripe A en el periodo 2009-2011, lo cual se hizo más evidente para el periodo pospandémico. La adherencia a las recomendaciones de tratamiento fue baja, aun entre los pacientes considerados de alto riesgo. En este subgrupo de pacientes, en tan solo uno de cada 2 se siguió el protocolo de actuación durante la pandemia y esta situación fue aún peor en el periodo pospandémico, en el cual únicamente en 4 de cada 10 pacientes se cumplieron dichas recomendaciones. Otro hallazgo de gran interés fue observar que la adherencia a las recomendaciones de tratamiento se asoció con una reducción del 50% en la mortalidad cuando se consideró la población en forma global, diferenciando ambos periodos o al excluir a los pacientes con mortalidad precoz.
Nuestros resultados están en concordancia con los observados en otros estudios destinados a valorar el cumplimiento del tratamiento en otras poblaciones11,12. Seale et al.19 publicaron el grado de adherencia al protocolo de tratamiento con antivíricos desarrollado por la Agencia de Protección de la Salud (HPA) del Reino Unido para la población pediátrica en UCI. Las recomendaciones de la HPA instaban al inicio del tratamiento antivírico de forma precoz (dentro de las 48h del inicio de los síntomas) en este subgrupo de pacientes. Los autores evaluaron a un total de 36 niños, 9 tratados antes de la publicación de la guía y el resto tras su instauración. La prescripción de oseltamivir al ingreso en UCI se incrementó significativamente desde un 11% (1/9) hasta un 50% (9/18) (OR=8). Como se puede observar, a pesar de esta mejoría en el cumplimiento, finalmente solo uno de cada 2 niños fueron tratados según las recomendaciones. Por otra parte, Fietjé et al.20 al analizar el grado de prescripción de oseltamivir en Holanda durante la pandemia, observaron un incremento del 100% respecto al 2008. El objetivo del trabajo fue evaluar si la dispensación de oseltamivir se ajustaba a la prescripción de acuerdo con las guías nacionales para la pandemia. Además se analizó el uso de este fármaco por parte de los pacientes mediante un cuestionario. Se contactó con un total de 630 pacientes y 361 (57,3%) completaron dicho cuestionario. Un 37% (n=111) de los pacientes recibió oseltamivir sin que existiera ningún criterio que justificara dicha prescripción. Respecto a la adherencia por parte del paciente, los resultados mostraron una adherencia elevada ya que un 97,4% de los pacientes inició el tratamiento prescrito y un 90,8% cumplió con la duración de tratamiento establecida. Sin embargo, Hersh et al.21 evaluaron el grado de adherencia a las directrices de tratamiento emitidas por los Centers for Diseases Control and Prevention (CDC), respecto a la prescripción de los antivíricos durante la pandemia de gripe A (H1N1) 2009 en EE. UU. La frecuencia de prescripción no fue diferente durante el periodo de la gripe A (H1N1)pdm09 (58%) en comparación con años anteriores (59%). Durante la pandemia se prescribió antivíricos solo al 47% de los pacientes menores de 2 años y al 68% de los pacientes mayores de 65 años. Estos resultados muestran una infrautilización del tratamiento antivírico en estos grupos de riesgo con posibilidad de complicaciones que se pueden prevenir, lo que sugiere oportunidades de mejora para la implantación de las directrices de salud pública en la práctica clínica.
Nuestros resultados sugieren que la adherencia a los protocolos de tratamiento es una variable relacionada de forma independiente con la mortalidad. Se observó una reducción cercana al 50% en general y al considerar los diferentes periodos, lo cual se encuentra en concordancia con datos de la literatura22,23. El no cumplimiento de las guías de tratamiento en la neumonía comunitaria grave se relaciona con aumento de la morbimortalidad, así como con el incremento de la estancia hospitalaria y del coste sanitario24–26. Sin embargo, pocos estudios han evaluado el impacto del cumplimiento de las recomendaciones de tratamiento antivírico sobre la mortalidad en pacientes críticos de UCI durante la pandemia de 2009 y en el periodo pospandémico 2010-11. Dichas recomendaciones se basaron en la experiencia acumulada con la gripe estacional (1970-2008), donde el tratamiento precoz con inhibidores de la neuraminidasa podía reducir la gravedad y la duración del cuadro, así como el riesgo de complicaciones27,28. Sin embargo, a diferencia de la gripe estacional (H1N1 no pandémico o H3N2), el virus A (H1N1)pdm09 presenta un comportamiento diferente, no solo porque afecta a personas más jóvenes, sino por su capacidad para producir una lesión rápida y grave pulmonar, con desarrollo de síndrome de distrés respiratorio agudo y muerte por insuficiencia respiratoria refractaria. En este contexto especial, se hace difícil trasladar el impacto del tratamiento antivírico desde estudios en los que los pacientes incluidos tienen una afectación leve o moderada por otro tipo de virus A. Por ello, existe controversia sobre el impacto del tratamiento antivírico en la infección por virus A (H1N1)pdm09, ya que no se cuenta con un estudio controlado y randomizado en pacientes críticos que haya demostrado fehacientemente su utilidad. Una revisión29 sobre 11 estudios publicados, evidenció (aunque con importantes limitaciones metodológicas) que las complicaciones de la gripe A (H1N1)pdm09 se reducen por el uso de antivíricos, tanto en pacientes de bajo como de elevado riesgo. Por su parte Jain et al.30 observaron que la única variable asociada de forma independiente con la mortalidad fue la administración de oseltamivir dentro de las primeras 48h, mientras que Domínguez-Cherit et al.31 refirieron una mayor supervivencia (OR=7,4) en pacientes que recibieron antivíricos. En 2011 se publicaron 3 estudios retrospectivos32–34 con resultados en esta misma dirección. Sin embargo, y a pesar de que diversas publicaciones de la Cochrane Library27,28,35 no muestran beneficio en la profilaxis y/o tratamiento de la gripe estacional con oseltamivir, los estudios considerados en dichas revisiones no incluyen a pacientes críticos. Por otro lado, estos datos son contrarios a lo observado en el estudio multicéntrico español GETGAG22, en el cual se evidenció una disminución en la mortalidad de los pacientes con tratamiento antivírico precoz. En el mismo sentido, un reciente estudio internacional sobre la efectividad del uso de tratamiento antivírico durante el periodo pandémico, que incluyó a más de 29.000 pacientes, observó una disminución del riesgo de mortalidad en los pacientes que recibieron tratamiento con antivíricos23.
El presente estudio tiene una serie de limitaciones que deben ser comentadas, a pesar de lo cual, sus hallazgos son relevantes y de gran interés. La principal limitación se relaciona con el análisis de la adherencia, que considera solamente la adhesión a las recomendaciones de tratamiento en relación con los factores de riesgo reconocidos. Si bien nuestros resultados muestran una reducción en el riesgo de muerte cuando se siguen las recomendaciones de tratamiento de la gripe A (H1N1)pdm09, el tipo de análisis realizado no permite obtener una relación causa efecto, ya que otras variables no controladas (factores de confusión)podrían influir en los resultados. En este sentido, es posible que aquellos pacientes en los que se siguieron las recomendaciones de tratamiento también recibieran una asistencia médica más adecuada y el efecto sobre la mortalidad no solo responda a la administración del antivírico. Sin embargo, el objetivo del estudio fue evaluar la adherencia a las recomendaciones de tratamiento en general, considerando los factores de gravedad conocidos. Además, después de ajustar el modelo por el riesgo, mediante análisis multivariado y excluir a aquellos pacientes con mortalidad precoz en un análisis post-hoc, la adherencia a las recomendaciones de tratamiento continuó siendo un factor asociado de forma independiente con la mortalidad.
En segundo lugar, el conjunto de datos incluido en este estudio es representativo de la prescripción y uso de antivíricos en UCI de España, pero estos resultados no pueden ser extrapolados a otras UCI, ni a otro tipo de pacientes. Finalmente, cabe mencionar que pueden haber existido factores sociales, económicos o sanitarios no controlados que pueden haber contribuido a la falta de adherencia a las recomendaciones de tratamiento, como ha sido reconocido en un reciente editorial36, pero estas variables, por las características del estudio, no han podido ser analizadas. Por lo cual, nuestros resultados deben ser interpretados con cautela considerando las limitaciones de su diseño
En conclusión, los resultados del presente estudio muestran un bajo nivel de adherencia al tratamiento antivírico en pacientes críticos y una estrecha asociación de esta situación con la mortalidad. La adherencia fue aún menor en el periodo pospandémico, en el cual se registró una mayor mortalidad respecto del periodo pandémico. La puesta en marcha de programas educativos y de difusión, destinados a aumentar la adherencia a las recomendaciones de tratamiento, deberían ser considerados antes de cada temporada invernal.
Conflicto de interesesLos autores no tienen conflictos de intereses que declarar.
El estudio fue avalado por la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC). La SEMICYUC no ha tenido ninguna influencia en el diseño del estudio, en la recolección, análisis o interpretación de los datos, en la redacción del manuscrito ni en la decisión de enviar el mismo a publicar. El contenido del manuscrito es responsabilidad de los autores y no representa de forma necesaria la visión oficial de SEMICYUC.
Al GTEIS/SEMICYUC por el apoyo en este proyecto.
Andalucía: Pedro Cobo (Hospital Punta de Europa, Algeciras); Javier Martins (Hospital Santa Ana Motril, Granada); Cecilia Carbayo (Hospital Torrecárdenas, Almería);Emilio Robles-Musso, Antonio Cárdenas, Javier Fierro (Hospital del Poniente, Almería); Ocaña Fernández (Hospital Huercal–Overa, Almería); Rafael Sierra (Hospital Puerta del Mar, Cádiz); M. Jesús Huertos (Hospital Puerto Real, Cádiz); Juan Carlos Pozo, R. Guerrero (Hospital Reina Sofía, Córdoba); Enrique Márquez (Hospital Infanta Elena, Huelva); Manuel Rodríguez-Carvajal (Hospital Juan Ramón Jiménez, Huelva); Antonio Jareño (Hospital del SAS de Jerez, Jerez de la Frontera); José Pomares, José Luis Ballesteros (Hospital Universitario San Cecilio, Granada); Yolanda Fernández, Francisco Lobato, José F. Prieto, José Albofedo-Sánchez (Hospital Costa del Sol, Marbella); Pilar Martínez (Hospital Virgen de la Victoria, Málaga); Miguel Ángel Díaz Castellanos (Hospital Santa Ana de Motril, Granada); Guillermo Sevilla (Clínica Sagrado Corazón, Sevilla); José Garnacho-Montero, Rafael Hinojosa, Esteban Fernández (Hospital Virgen del Rocío, Sevilla); Ana Loza, Cristóbal León (Hospital Universitario Nuestra Señora de Valme, Sevilla); Ángel Arenzana (Hospital Virgen de la Macarena, Sevilla), Dolores Ocaña (Hospital de la Inmaculada, Sevilla); Inés Navarrete (Hospital Virgen de las Nieves, Granada).
Aragón: Manuel Luis Avellanas, Arantxa Lander, S. Garrido Ramírez de Arellano, M.I. Marquina Lacueva (Hospital San Jorge, Huesca); Pilar Luque (Hospital Lozano Blesa, Zaragoza); Ignacio González (Hospital Miquel Servet, Zaragoza); Jose M. Montón (Hospital Obispo Polanco, Teruel); Jose M. Díaz, Pilar López-Reina, Sergio Sáez (Hospital Virgen de la Salud, Teruel).
Asturias: Lisardo Iglesias, Carmen Pascual González (Hospital Universitario Central de Asturias – HUCA, Oviedo); Quiroga (Hospital de Cabueñes, Gijón); Águeda García-Rodríguez (Hospital Valle del Nalón, Langreo).
Baleares: Lorenzo Socias, Pedro Ibánez, Marcío Borges-Sa, A. Socias, del Castillo A (Hospital Son LLatzer, Palma de Mallorca); Ricard Jordà Marcos (Clínica Rotger, Palma de Mallorca); José M. Bonell (USP. Clínica Palmaplanas, Palma de Mallorca); Ignacio Amestarán (Hospital Son Dureta, Palma de Mallorca).
Canarias: Sergio Ruiz-Santana, Juan José Díaz (Hospital Dr Negrín, Las Palmas de Gran Canaria); Montserrat Sisón (Hospital Doctor José Molina, Lanzarote); David Hernández, Ana Trujillo, Luis Regalado (Hospital General la Palma, La Palma); Leonardo Lorente (Hospital Universitario de Canarias, Tenerife); Mar Martín (Hospital de la Candelaria, Tenerife), Sergio Martínez, J.J. Cáceres (Hospital Insular de Gran Canaria).
Cantabria: Borja Suberviola, P. Ugarte (Hospital Universitario Marqués de Valdecilla, Santander).
Castilla La Mancha: Fernando García-López (Hospital General, Albacete); Ángel Álvaro Alonso, Antonio Pasilla (Hospital General La Mancha Centro, Alcázar de San Juan); M. Luisa Gómez Grande (Hospital General de Ciudad Real, Ciudad Real); Antonio Albaya (Hospital Universitario de Guadalajara, Guadalajara); Alfonso Canabal, Luis Marina (Hospital Virgen de la Salud, Toledo).
Castilla y León: Juan B. López Messa(Complejo Asistencial de Palencia, Palencia), M. Jesús López Pueyo (Hospital General Yagüe, Burgos); Zulema Ferreras (Hospital Universitario de Salamanca, Salamanca); Santiago Macias (Hospital General de Segovia, Segovia); José Ángel Berezo, Jesús Blanco Varela (Hospital Universitario Río Hortega, Valladolid), A. Andaluz Ojeda (Hospital Universitario, Valladolid); Antonio Álvarez Terrero (Hospital Virgen de la Concha, Zamora); Fabiola Tena Ezpeleta (Hospital Santa Bárbara, Soria).
Cataluña: Rosa M. Catalán (Hospital General de Vic, Vic); Miquel Ferrer, Antoni Torres (Hospital Clínic, Barcelona); Sandra Barbadillo (Hospital General de Catalunya–CAPIO, Barcelona); Lluís Cabré (Hospital de Barcelona, Barcelona); Assumpta Rovira (Hospital General de l’Hospitalet, L’Hospitalet); Francisco Álvarez-Lerma, Antonia Vázquez, Joan Nolla (Hospital Del Mar, Barcelona); Francisco Fernández, Joaquim Ramón Cervelló (Centro Médico Delfos, Barcelona); Rafael Mañéz, J. Ballús, Rosa M. Granada (Hospital de Bellvitge, Barcelona); Jordi Vallés, Marta Ortíz, C. Guía (Hospital de Sabadell, Sabadell); Fernando Arméstar, Joaquim Páez (Hospital Dos De Mayo, Barcelona); Jordi Almirall, Xavier Balanzo (Hospital de Mataró, Mataró); Jordi Rello, Elena Arnau, Lluis Llopart, Mercedes Palomar (Hospital Vall d’Hebron, Barcelona); Iñaki Catalán (Hospital Sant Joan de Déu, Manresa); Josep M. Sirvent, Cristina Ferri, Nerea López de Arbina (Hospital Josep Trueta, Girona); Mariona Badía, Montserrat Valverdú-Vidal, Fernando Barcenilla (Hospital Arnau de Vilanova, Lleida); Mònica Magret (Hospital Sant Joan de Reus, Reus); M.F. Esteban, José Luna (Hospital Verge de la Cinta, Tortosa); Juan M. Nava, J González de Molina (Hospital Universitario Mutua de Terrassa, Terrassa); Zoran Josic (Hospital de Igualada, Igualada); Francisco Gurri (Hospital Quirón, Barcelona); Alejandro Rodríguez, Thiago Lisboa, Diego de Mendoza, Sandra Trefler (Hospital Universitario Joan XXIII, Tarragona), Rosa María Díaz (Hospital San Camil, Sant Pere de Ribes, Barcelona).
Extremadura: Juliá-Narváez José (Hospital Infanta Cristina, Badajoz); Alberto Fernández-Zapata, Teresa Recio, Abilio Arrascaeta, M. José García-Ramos, Elena Gallego (Hospital San Pedro de Alcántara, Cáceres); F. Bueno (Hospital Virgen del Puerto, Plasencia).
Galicia: M. Lourdes Cordero, José A. Pastor, Luis Álvarez-Rocha (CHUAC, A Coruña); Dolores Vila (Hospital Do Meixoeiro, Vigo); Ana Díaz Lamas (Hospital Arquitecto Marcide, Ferrol); Javier Blanco Pérez, M. Ortiz Piquer (Hospital Xeral-Calde, Lugo); Eleuterio Merayo, Victor Jose López-Ciudad, Juan Cortez, Eva Vilaboy (Complejo Hospitalario de Ourense, Ourense); Eva Maria Saborido (Hospital Montecelo, Pontevedra); Raul José González (H. Miguel Domínguez, Pontevedra); Santiago Freita (Complejo Hospitalario de Pontevedra, Pontevedra).
La Rioja: José Luis Monzón, Félix Goñi (Hospital San Pedro, Logroño).
Madrid: Frutos del Nogal Sáez, M. Blasco Navalpotro (Hospital Severo Ochoa, Madrid); M. Carmen García-Torrejón (Hospital Infanta Elena, Madrid);César Pérez-Calvo, Diego López (Fundación Jiménez Díaz, Madrid); Luis Arnaiz, S. Sánchez- Alonso, Carlos Velayos (Hospital Fuenlabrada, Madrid); Francisco del Río, Miguel Ángel González (Hospital Clínico San Carlos, Madrid); María Cruz Martín, José M. Molina (Hospital Nuestra Señora de América, Madrid); Juan Carlos Montejo, Mercedes Catalán (Hospital Universitario 12 de Octubre, Madrid); Patricia Albert, Ana de Pablo (Hospital del Sureste, Arganda del rey);José Eugenio Guerrero, Jaime Benitez Peyrat (Hospital Gregorio Marañón, Madrid); Enrique Cerdá, Manuel Alvarez, Carlos Pey (Hospital Infanta Cristina, Madrid);Montse Rodríguez, Eduardo Palencia (Hospital Infanta Leonor, Madrid); Rafael Caballero (Hospital de San Rafael, Madrid); Rafael Guerrero (Hospital Reina Sofía, Madrid); Concepción Vaquero, Francisco Mariscal, S. García (Hospital Infanta Sofía, Madrid); Almudena Simón (Hospital Nuestra Señora del Prado, Madrid); Nieves Carrasco (Hospital Universitario La Princesa, Madrid); Isidro Prieto, A Liétor, R. Ramos (Hospital Ramón y Cajal, Madrid); Beatriz Galván, Juan C. Figueira, M. Cruz Soriano (Hospital La Paz, Madrid); P Galdós, Bárbara Balandin Moreno (Hospital Puerta de Hierro, Madrid); Fernández del Cabo (Hospital Monte Príncipe, Madrid); Cecilia Hermosa, Federico Gordo (Hospital de Henares, Madrid); Alejandro Algora (Hospital Universitario Fundación Alcorcón, Madrid); Amparo Paredes (Hospital Sur de Alcorcón, Madrid); J.A. Cambronero (Hospital Universitario Príncipe de Asturias, Madrid); Sonia Gómez-Rosado (Hospital de Móstoles, Madrid).
Murcia: Sofía Martínez (Hospital Santa María del Rosell, Murcia); F. Felices Abad (Hospital Universitario Reina Sofía, Murcia); Mariano Martínez (Hospital Universitario Virgen de la Arrixaca, Murcia); Sergio Manuel Butí, Gil Rueda, Francisco García (Hospital Morales Messeguer, Murcia).
Navarra: Laura Macaya, Enrique Maraví-Poma, I. Jimenez Urra, L. Macaya Redin, A Tellería (Hospital Virgen del Camino, Pamplona); Josu Insansti (Hospital de Navarra, Pamplona).
País Vasco: Nagore González, Pilar Marco, Loreto Vidaur (Hospital de Donostia, San Sebastián); B. Santamaría (Hospital de Basurto, Bilbao); Juan Carlos Vergara, Jose Ramon Iruretagoyena Amiano (Hospital de Cruces, Bilbao); Alberto Manzano (Hospital Santiago Apóstol, Vitoria);Carlos Castillo Arenal (Hospital Txagorritxu, Vitoria).
Valencia: José Blanquer (Hospital Clinic Universitari, Valencia); Roberto Reig Valero, A. Belenger, Susana Altaba (Hospital General de Castellón, Castellón); Bernabé Álvarez-Sánchez (Hospital General de Alicante, Alicante); Santiago Alberto Picos (Hospital Torrevieja Salud, Alicante); Ángel Sánchez-Miralles (Hospital San Juan, Alicante); Juan Bonastre, M. Palamo, Javier Cebrian, José Cuñat (Hospital La Fe, Valencia); Belén Romero (Hospital de Manises, Valencia); Rafael Zaragoza (Hospital Dr. Peset, Valencia); Virgilio Paricio (Hospital de Requena, Valencia); Asunción Marques, S. Sánchez-Morcillo, S. Tormo (Hospital de la Ribera, Valencia); J. Latour (H. G. Universitario de Elche, Valencia), M. Ángel García (Hospital de Sagunto, Castellón).
Listado de investigadores integrantes del GETGAG al final del manuscrito, en el anexo 1.