Comparar los scores de gravedad anatómicos y fisiológicos en los pacientes traumáticos ingresados en unidad de cuidados intensivos (UCI) y crear modelos combinados que mejoren su precisión.
MétodoEstudio prospectivo de cohorte observacional. UCI polivalente de un hospital universitario de 2.o nivel. Se incluyeron los pacientes traumáticos mayores de 16 años ingresados en UCI (n=780). Se comparan los modelos anatómicos (ISS, NISS) con los modelos fisiológicos (T-RTS, APACHE II [APII]), MPM II). La probabilidad de muerte se calculó según metodología TRISS. La discriminación se valoró mediante curvas ROC (ABC [IC 95%]) y la calibración con el estadístico H de Hosmer-Lemeshow. Los modelos combinados se realizaron con metodología de árboles de clasificación tipo Chi Square Automatic Interaction Detection.
ResultadosMortalidad global del 14%. Los modelos fisiológicos son los que presentan mejores valores de discriminación (APII con 0,87 [0,84-0,90]). Todos los modelos tienen una mala calibración (p<0,01). El mejor modelo combinado es el que utiliza APII junto a ISS (0,88 [0,83-0,90]) y encuentra un grupo de pacientes (valores de APII entre 10-17) que necesita la puntuación ISS (punto de corte de 22) para diferenciar entre mortalidad del 7,5% asociada a pacientes mayores con antecedentes patológicos y del 25,0% en pacientes con mayor presencia de TCE.
ConclusionesLos modelos fisiológicos presentan ventajas sobre los anatómicos en los pacientes traumáticos ingresados en UCI. Los pacientes con puntuaciones bajas en los modelos fisiológicos requieren del análisis anatómico de las lesiones para determinar su gravedad.
The goals of this project were to compare both the anatomic and physiologic severity scores in trauma patients admitted to intensive care unit (ICU), and to elaborate mixed statistical models to improve the precision of the scores.
MethodsA prospective study of cohorts. The combined medical/surgical ICU in a secondary university hospital. Seven hundred and eighty trauma patients admitted to ICU older than 16 years of age. Anatomic models (ISS and NISS) were compared and combined with physiological models (T-RTS, APACHE II [APII], and MPM II). The probability of death was calculated following the TRISS method. The discrimination was assessed using ROC curves (ABC [CI 95%]), and the calibration using the Hosmer-Lemeshoẃs H test. The mixed models were elaborated with the tree classification method type Chi Square Automatic Interaction Detection.
ResultsA 14% global mortality was recorded. The physiological models presented the best discrimination values (APII of 0.87 [0.84-0.90]). All models were affected by bad calibration (P<.01). The best mixed model resulted from the combination of APII and ISS (0.88 [0.83-0.90]). This model was able to differentiate between a 7.5% mortality for elderly patients with pathological antecedents and a 25% mortality in patients presenting traumatic brain injury, from a pool of patients with APII values ranging from 10 to 17 and an ISS threshold of 22.
ConclusionsThe physiological models perform better than the anatomical models in traumatic patients admitted to the ICU. Patients with low scores in the physiological models require an anatomic analysis of the injuries to determine their severity.
Los scores de gravedad se han desarrollado para describir la gravedad de las lesiones o correlacionar el pronóstico estableciendo un riesgo de muerte mediante un valor numérico de probabilidad1,2.
La gravedad de un traumatismo depende de la reserva fisiológica del paciente (edad, comorbilidades), las lesiones anatómicas producidas y la repercusión fisiológica (hemodinámica, respiratoria y neurológica). Además hay que tener en cuenta que el resultado final también dependerá de la calidad asistencial que dispensemos a nuestros pacientes durante todo el proceso de asistencia3,4.
En la fase prehospitalaria el objetivo de un score es realizar un adecuado triaje de los pacientes más graves de forma rápida y sencilla para su traslado a un hospital según su nivel asistencial. El Triage-revised trauma score (RTS)5 evalúa la repercusión fisiológica a nivel respiratorio (frecuencia respiratoria), hemodinámico (tensión arterial sistólica) y neurológico según el Glasgow Coma Scale (GCS). Recientemente se ha publicado el score GAP donde se evalúa el GCS, la tensión arterial sistólica y la edad6. En los servicios de urgencias se sigue utilizando el Trauma and Injury Severity Score (TRISS) como modelo de riesgo de muerte7. El TRISS es un modelo mixto que combina la repercusión fisiológica (RTS) según las lesiones anatómicas (Injury Severity Score [ISS]) y el mecanismo lesional (contuso o penetrante)7.
En los últimos años se han desarrollado diferentes scores (Probability of Survival [PS]8, Trauma Risk Adjustment Model [TRAM]4, Revised Injury Severity Classification [RISC I-II9]) que han logrado mejorar la capacidad de discriminación y calibración al incluir otras variables (comorbilidad, ventilación mecánica, hemoglobina, exceso de base, etc.) disponibles en los servicios de urgencias.
En las unidades de cuidados intensivos (UCI) se utilizan scores de gravedad como el Acute Physiology and Chronic Health Evaluation (APACHE II), el Simplified Acute Physiologic Score (SAPS II) o el Mortality Probability Models (MPM II). Estos scores valoran el estado previo del paciente (edad), las comorbilidades asociadas y la repercusión fisiológica. Por el contrario, no han sido diseñados específicamente para la población traumática, ya que carecen de una valoración anatómica de las lesiones producidas ni del tipo de mecanismo lesional que lo produce10.
Actualmente no existe consenso de qué score de gravedad (anatómico, fisiológico, mixto) hay que utilizar en los pacientes traumáticos ingresados en UCI3.
El objetivo de este trabajo es comparar scores anatómicos (ISS11, New Injury Severity Score [NISS]12), fisiológicos (RTS5, MPM II-2413, APACHE II14) y mixto (TRISS7) en pacientes traumáticos graves en las primeras 24h de ingreso en UCI y encontrar modelos que puedan combinar estos scores para mejorar su precisión.
Material y métodoEstudio prospectivo de cohortes durante el periodo de tiempo comprendido entre enero de 2005 y diciembre de 2012, en una UCI de 16 camas polivalentes del Hospital Universitario Arnau de Vilanova de Lleida (con 450 camas) con un área de referencia de 450.000 habitantes. Nuestro centro está catalogado de nivel ii 2b, al disponer de servicio de Neurocirugía las 24h al día y de Medicina Intensiva.
Criterios de inclusión: todos los pacientes mayores de 16 años de causa traumática ingresados en UCI más de 24h.
Criterio de exclusión: datos incompletos, traslado a otro centro o muerte posterior a los 30 días de su ingreso.
Se comunicó al comité de ética del hospital la realización del estudio. Se determinó que no era necesario el consentimiento informado de los pacientes ya que los datos recogidos eran imprescindibles para su diagnóstico y seguimiento clínico. Se aseguró en todo momento el anonimato de los pacientes.
Se incluyeron las variables epidemiológicas de edad, género, fecha del ingreso en la UCI, etiología (tráfico, laboral y otros) y mecanismo del traumatismo.
Se utilizó el concepto de insuficiencia orgánica previa según definición del modelo APACHE II14. Se clasificó la comorbilidad según la clasificación de la American Society of Anesthesiologists Physical Status (ASA-PS): normal (ASA-PS-1), moderado (ASA-PS-2) y severo (ASA-PS-3, -4, -5)15.
Scores de gravedadSe recogieron las variables de frecuencia respiratoria, tensión arterial y nivel neurológico (GCS) en la fase prehospitalaria para el cálculo (RTS)5.
Se llevó a cabo un registro de las lesiones traumáticas de acuerdo con el Abbreviated Injury Scale (AIS-2005) updated 200816 para el cálculo de la gravedad anatómica (ISS, NISS)11,12. La probabilidad de supervivencia se calculó de forma prospectiva según metodología TRISS7.
El nivel de gravedad MPM II13 y APACHE II14 se calculó con los datos obtenidos en las primeras 24h de ingreso en la UCI.
Se realizó un seguimiento de la estancia y mortalidad a 30 días tanto en UCI como durante su ingreso en planta de hospitalización.
Análisis estadísticoLas variables discretas se describen como porcentajes y las continuas como media±desviación estándar. Para la comparación entre los distintos grupos (supervivientes y no supervivientes) se empleó el test estadístico de Mann-Whitney en variables continuas (no asunción de características paramétricas de las variables) o el test de chi-cuadrado para las categóricas. La correlación entre los distintos scores analizados se realizó mediante el cálculo del coeficiente de correlación de Spearman.
La precisión de los modelos de probabilidad de muerte a 30 días utilizados y creados se valoró midiendo sus propiedades de discriminación y calibración; discriminación con la realización de las curvas ROC y el cálculo de su área bajo la curva con su intervalo de confianza al 95%. La calibración valoró la concordancia entre la mortalidad observada y la esperada según los modelos y mediante el cálculo del estadístico H de Hosmer-Lemeshow (asumiendo buena calibración con p>0,05)17,18.
Se crearon modelos combinados, con los distintos scores utilizados, mediante metodología de árbol de clasificación (módulo AnswerTree del programa SPSS [versión 20.0]) con posibilidad de modelo de árbol de clasificación tipo Chi Square Automatic Interaction Detection (CHAID). Parámetros del modelo. Reglas de partición: Utiliza el test de chi-cuadrado (con la corrección de Bonferroni) para determinar la significación estadística en las particiones recursivas que va generando. Sistema de validación interna (cross validation) con 10 particiones. Criterio de parada de crecimiento del árbol con disminución del error total y número mínimo de casos en los nodos terminales (25 casos). Nivel de significación de división de nodos y de fusión de categorías con p<0,0519.
Para el cálculo estadístico se utilizó el programa informático SPSS (v20.0). Se consideró significativo todo valor de p<0,05.
ResultadosDurante el periodo de estudio 786 pacientes cumplieron los criterios de inclusión, se excluyeron 6 (por traslado a otro centro) quedando como grupo de estudio 780 pacientes.
En la tabla 1 se describen sus características demográficas diferenciadas según supervivencia. En general son pacientes jóvenes, con predominio de hombres, con pocos antecedentes patológicos e ingresados desde el Servicio de Urgencias del Hospital. Los pacientes que fallecen tienen más antecedentes (HTA, cardiopatía, insuficiencia orgánica) o comorbilidades (ASA) con una menor estancia en UCI y hospitalaria.
Características demográficas según mortalidad (n=780)
| Todos(n=780) | Vivos(n=682) | Muertos(n=98) | pc | |
|---|---|---|---|---|
| Edad (años)a | 46,4±19 | 45,5±18 | 52,2±23 | 0,013 |
| Sexo (hombre) (%) | 77,7 | 77,1 | 81,6 | 0,316 |
| Antecedentes (%) | ||||
| Diabetes | 6,9 | 6,9 | 6,8 | 0,927 |
| HTA | 14,7 | 13,5 | 23,5 | 0,012 |
| EPOC | 4,1 | 4 | 4,1 | 0,991 |
| Cardiopatía | 2,9 | 2,2 | 8,2 | 0,001 |
| IORG | 1,7 | 1,2 | 4,1 | 0,046 |
| ASA-PS (%) | <0,001 | |||
| Normal | 75,6 | 77,9 | 60,2 | |
| Moderado | 21,5 | 19,9 | 32,7 | |
| Severo | 2,8 | 2,2 | 7,1 | |
| Etiología (%) | 0,149 | |||
| Tráfico | 60 | 60,6 | 56,1 | |
| Laboral | 14,9 | 15,4 | 11,2 | |
| Otros | 25,1 | 24 | 32,7 | |
| Procedencia (%) | 0,013 | |||
| URG | 75,6 | 77,3 | 64,3 | |
| Quirófano | 17,2 | 15,7 | 26,6 | |
| Planta | 3,1 | 2,8 | 5,1 | |
| Hospital comarcal | 4,1 | 4,3 | 3,1 | |
| Estancia (días)b | ||||
| UCI | 8 (4-18) | 8 (5-19) | 5 (2-11) | <0,001 |
| Hospital | 19 (11-34) | 21 (12-36) | 6 (3-13) | <0,001 |
ASA-PS: American Society of Anesthesiologists Physical Status; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IORG: Insuficiencia orgánica; UCI: unidad de cuidados intensivos; URG: urgencias.
Las puntuaciones de los diferentes scores analizados se observan en la tabla 2. Todos los valores se mostraron más altos, de forma significativa, en los pacientes que fallecieron excepto RTS (con valores más bajos), que por su propia forma de creación tiene una interpretación inversa (muestra valores más bajos en los pacientes más graves).
Puntuaciones de los sistemas de ajuste de riesgo. Según mortalidad (n=780)
| Todos(n=780) | Vivos(n=682) | Muertos(n =98) | pa | |
|---|---|---|---|---|
| Anatómicos | ||||
| ISS | 18±917 (12-25) | 17±816 (10-22) | 25±1125 (17-29) | <0,001 |
| NISS | 25±1124 (17-29) | 23±1022 (17-29) | 36±1334 (27-43) | <0,001 |
| Fisiológicos | ||||
| RTS | 7±17 (6-8) | 7±17 (6-8) | 5±25 (4-7) | <0,001 |
| MPM II-24 | 14±207 (4-18) | 11±106 (3-13) | 36±2032 (17-53) | <0,001 |
| APACHE-II | 12±711 (6-16) | 10±610 (6-14) | 21±620 (16-25) | <0,001 |
| Sistema mixto | ||||
| TRISS | 12±195 (1-13) | 9±154 (1-9) | 34±3022 (7-53) | <0,001 |
APACHE II: Acute Physiology and Chronic Health Evaluation; ISS: Injury Severity Score; MPM II: Mortality Probability Models; NISS: New Injury Severity Score; RTS: Revised Trauma Score; TRISS: Trauma and Injury Severity Score.
Valores como media±desviación estándar y mediana (rango intercuartílico).
Existe una buena correlación entre los distintos modelos empleados (ver tabla 3). El valor negativo de algunos de los valores de correlación es debido a las características mencionadas del RTS.
Correlación entre valores de los sistemas de ajuste de riesgo de mortalidad (n=780)
| ISS | NISS | RTS | MPM II-24 | APACHE II | |
|---|---|---|---|---|---|
| NISS | 0,783 | -------- | |||
| RTS | −0,429 | −0,430 | -------- | ||
| MPM II-24 | 0,353 | 0,357 | −0,584 | -------- | |
| APACHE-II | 0,374 | 0,386 | −0,662 | 0,787 | -------- |
| TRISS | 0,636 | 0,571 | −0,726 | 0,698 | 0,668 |
APACHE II: Acute Physiology and Chronic Health Evaluation; ISS: Injury Severity Score; MPM II: Mortality Probability Models; NISS: New Injury Severity Score; RTS: Revised Trauma Score; TRISS: Trauma and Injury Severity Score.
Valores como coeficientes de correlación (rho de Spearman). Todos con p<0,001.
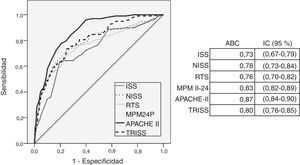
En la figura 1 se muestra la capacidad discriminativa de los scores según su área bajo la curva ROC. El modelo APACHE II obtiene el área más alta (0,88 [0,83-0,90]).
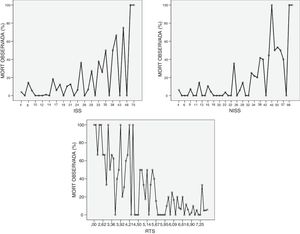
En la figura 2 se muestra el comportamiento de los scores anatómicos ISS y NISS y del fisiológico RTS. Observamos en la figura 2 que la escala ISS no sigue una función creciente de mortalidad al ingreso en UCI, produciéndose picos de mortalidad en los valores el cuadrado y una mala correlación en los valores bajos. Sucede lo mismo en la escala NISS. Si se observa que la escala RTS tiene un comportamiento lineal.
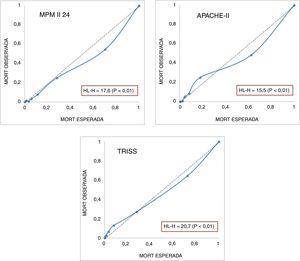
En la figura 3 se muestran las curvas de calibración de los modelos fisiológicos APACHE II y MPM II-24 y del TRISS. Se incluyen los valores del test H de Hosmer-Lemeshow que muestran una mala calibración. En el modelo APACHE II se observa que a mortalidades bajas la mortalidad observada es mayor que la esperada, siendo inversa si la probabilidad de muerte es elevada.
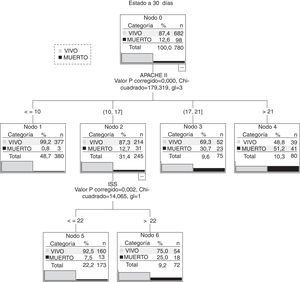
El modelo de árbol de clasificación que consigue mejor valor de área bajo la curva ROC (0,88 [0,84-0,90]) es el que combina APACHE II e ISS (fig. 4). Elige como primera variable la puntuación APACHE II y realiza 4 subdivisiones coherentes en aumento del porcentaje en mortalidad. Es en el grupo de valores entre 10 y 17 puntos de APACHE II (con 245 pacientes) donde el sistema ISS diferencia 2 subgrupos con un punto de corte de 22. Como se aprecia en la figura 4 corresponden a los nodos terminales 5 y 6.
El análisis de estos 2 subgrupos (ver tabla 4) encuentra que, sin haber diferencias en la puntuación media de APACHE II, la mortalidad es muy diferente (7,5 vs. 25%; p<0,001). Estos 2 subgrupos son diferentes en algunas variables. En el subgrupo con ISS≤22 puntos los pacientes son más mayores y con mayor presencia de insuficiencia orgánica previa y comorbilidad. Los pacientes con ISS>22 tienen valores de GCS menor. Vimos que la presencia de traumatismo craneoencefálico era mayor en este grupo (77,8 vs. 48; p=0,046).
Características diferenciales del grupo de pacientes con APACHE II entre 11-17 puntos según puntuación de ISS mayor o menor a 22 puntos (n=245)
| ISS≤22(n=173) | ISS>22(n=72) | pb | |
|---|---|---|---|
| Edad (años)a | 52,1±19 | 42,7±18 | <0,001 |
| Sexo (hombre) (%) | 74 | 81,9 | 0,182 |
| GCSa | 12±3 | 9±4 | <0,001 |
| APACHE IIa | 14±2 | 14±2 | 0,460 |
| IORG (%) | 35,3 | 13,9 | <0,001 |
| ASA-PS (%) | 0,002 | ||
| Normal | 64,7 | 86,1 | |
| Moderado | 30,6 | 13,9 | |
| Severo | 4,6 | 0 | |
| Mortalidad (%) | 7,5 | 25 | <0,001 |
APACHE II: Acute Physiology and Chronic Health Evaluation; ASA-PS: American Society of Anesthesiologists Physical Status; GCS: Glasgow Coma Score; IORG: insuficiencia orgánica; ISS: Injury Severity Score.
La población traumática ingresada en nuestra UCI tiene características similares a otras series tanto a nivel nacional como internacional. Se trata de pacientes jóvenes de predominio masculino, con pocas comorbilidades según la clasificación ASA-PS y una mortalidad del 14%. En nuestra serie los accidentes de tráfico superan la mitad de los ingresos, aunque las caídas y precipitaciones van aumentando en su incidencia9,20.
La gravedad de un traumatismo se puede definir según el grado de severidad de las lesiones anatómicas (AIS, ISS, NISS). El modelo anatómico ISS no sigue una función creciente de mortalidad21,22. Está demostrado que la escala ISS infraestima la mortalidad a valores bajos pero sobrestima en los valores más altos23. Este mismo comportamiento se observa en nuestra serie.
En 1997 Osler et al. propuso una modificación de la escala ISS que incluía las lesiones anatómicas más graves independientemente de la región corporal afectada (NISS)12. La mayoría de los estudios coinciden en que NISS tiene mayor capacidad de discriminación y calibración que ISS como es nuestro caso. NISS es equivalente a ISS en lesionados leves pero mejora significativamente en lesionados graves y en aquellos que sufren un traumatismo craneal24.
Una valoración exclusivamente anatómica no es suficiente para valorar la gravedad ya que depende de la repercusión fisiológica25. Clásicamente el modelo más utilizado es la metodología TRISS que combina el aspecto anatómico y el fisiológico7. A las lesiones anatómicas (ISS) se le une la repercusión fisiológica (RTS) y la reserva fisiológica (edad) según el tipo de trauma contuso o penetrante. TRISS es un excelente score pronóstico en pacientes jóvenes con lesiones anatómicas graves (ISS>15) pero infraestima la mortalidad en los pacientes mayores de 60 años26. Actualmente se observa un aumento progresivo de la edad de los pacientes traumáticos graves9,20.
Chico-Fernández et al. aplicaron la metodología TRISS en el estudio de pacientes traumáticos graves ingresados en las UCI españolas mostrando buenos niveles de discriminación pero una calibración inadecuada, especialmente en el traumatismo cerrado. En el mismo trabajo se observó que la metodología TRISS infraestimó la mortalidad en los pacientes con mortalidad predicha baja y la sobreestimó en pacientes con mortalidad predicha elevada27.
No olvidemos que la valoración fisiológica de TRISS se basa en el score RTS que fue diseñado para el triaje en el lugar del accidente y la necesidad de trasladar a un paciente a un centro de trauma28.
Es importante valorar la gravedad de la población a estudio. En el trabajo de Kahloul et al. de pacientes traumáticos con menor gravedad (ISS=9), los scores anatómicos tienen mejor calibración que los fisiológicos, incluso los modelos mixtos apenas mejoran la misma29. Cuanto mayor sea la repercusión fisiológica debido a la gravedad de las lesiones, como en el subgrupo de pacientes ingresados en UCI, mayor importancia tendrá la utilización de scores fisiológicos.
Las escalas de predicción de mortalidad que se utilizan en UCI (APACHE II, SAPS II y MPM II-24) no fueron diseñadas específicamente para la población traumática10. Estos scores aportan información de la reserva fisiológica y la repercusión fisiológica del traumatismo pero carecen de la valoración anatómica.
Al inicio de los años 90 se publicaban los primero trabajos con la escala APACHE en población traumática donde APACHE II se mostraba como un buen predictor de mortalidad respecto al RTS e ISS30. Posteriormente otros autores observaban una mala correlación con la mortalidad y únicamente en subgrupos de pacientes (alta comorbilidad y en traumatismo craneoencefálico) mejora su capacidad de discriminación31,32. En el trabajo de Dossett et al. APACHE II se mostraba como un buen predictor de mortalidad atribuido a la importancia de las variables fisiológicas como temperatura, creatinina sérica y GCS33.
En un estudio realizado en 6.905 pacientes traumáticos graves ingresados en UCI, el modelo fisiológico SAPS II sobrestimaba la mortalidad principalmente en el subgrupo de pacientes que son intervenidos de forma urgente y pacientes menores de 60 años. La fusión de los 2 scores (SAPS-TRISS) mejora el ajuste de riesgo26.
En los últimos años se ha producido un aumento significativo de la edad de los pacientes traumáticos y de las comorbilidades asociadas con una mayor repercusión fisiológica27. Este hecho puede explicar la mejor capacidad de calibración y discriminación de los scores fisiológicos o mixtos1,29.
Dentro de nuestros resultados, encontramos una buena correlación entre los distintos scores analizados lo que demuestra la correlación entre la gravedad de las lesiones anatómicas y la repercusión fisiológica.
Aunque el modelo fisiológico APACHE II es el que ofrece una mayor capacidad de discriminación, debe complementarse en el modelo anatómico (ISS) en ciertos grupos de pacientes. La metodología de árboles de clasificación es capaz de encontrar estos grupos con características diferenciales. El grupo de pacientes con puntuaciones relativamente bajas en APACHE II (en nuestros resultados entre 10 y 17 puntos) deben diferenciarse según su afectación medida por el ISS. Esta puntuación en APACHE II puede ser debida a pacientes mayores con comorbilidades asociadas, o a pacientes jóvenes con traumatismo craneoencefálico y afectación neurológica (medida con la escala de Glasgow). Es en estos pacientes jóvenes y sin antecedentes de enfermedad crónica donde la afectación neurológica condiciona una mayor mortalidad que no parece discriminar una puntuación del modelo APACHE II.
La principal limitación de nuestro trabajo es que ha sido realizado en un solo centro y con un tamaño limitado de pacientes. Para poder generalizar nuestros resultados habría que comprobarlos en otros grupos de pacientes.
Otra de las limitaciones viene determinada por la mala calibración que obtienen los distintos modelos aplicados a nuestra serie de pacientes traumáticos ingresados en UCI. Otros trabajos también han encontrado este resultado4,34. Este hecho nos obliga a buscar nuevos modelos, o modificaciones de los disponibles, para mejorar la precisión en determinar la gravedad en este grupo de pacientes.
En los pacientes traumáticos ingresados en UCI los modelos fisiológicos presentan ventajas sobre los anatómicos. Hay subgrupos de estos pacientes (con puntuaciones bajas en los scores fisiológicos) que requieren la participación de la repercusión anatómica para una correcta determinación de su gravedad.
AutoríaLS y JT diseñaron el trabajo y analizaron los resultados. Todos los autores participaron en la recogida de datos, interpretación de resultados y realización de las conclusiones. para la elaboración del manuscrito, todos los autores contribuyeron y aceptaron el documento final.
Conflicto de interesesNo conflicto de intereses.