Determinar la incidencia de insuficiencia renal aguda (IRA) en pacientes críticos usando RIFLE y AKIN.
DiseñoEstudio observacional prospectivo multicéntrico, realizado durante un año desde febrero de 2010. Se emplearon RIFLE y AKIN aplicando los criterios urinario (criterio U) y creatinina (criterio C) juntos y separados.
ÁmbitoNueve Unidades de Cuidados Críticos (UCC) polivalentes de Argentina.
PacientesUn total de 627 pacientes críticos mayores de 18 años de edad internados en UCC durante más de 48 h; motivos de exclusión: imposibilidad de cuantificar diuresis, instrumentación quirúrgica de la vía urinaria y necesidad de terapias de soporte renal (TSR).
Variables de interésSe utilizó una diuresis horaria calculada (DHC) para aplicar el criterio U.
ResultadosLa incidencia de IRA fue de 69,4 y 51,8% (RIFLE y AKIN, respectivamente). El criterio U detectó IRA en el 59,5% de los casos, mientras que el criterio C identificó IRA en el 34,7% (RIFLE) y 25,3% (AKIN). La mortalidad fue de 40,9 y 44,6% según RIFLE y AKIN, respectivamente, significativamente mayor a la de los pacientes sin IRA, y aumentó con la gravedad de la enfermedad. (Procesamiento de datos: Excel, SQL y SPSS. Test de Levenne, comparación de medias/promedios con t de Student y chi-cuadrado, con 95% de confianza).
ConclusionesRIFLE identificó más casos de IRA que AKIN. El criterio U fue más eficaz que el criterio C. La presencia de IRA y sus niveles de gravedad tuvieron correlación con la mortalidad pero no con los días de estancia en UCC. La implementación de la DHC fue útil para unificar la aplicación del criterio C y lograr resultados comparables.
To determine the incidence of acute renal failure (ARF) in critically ill patients using the RIFLE and AKIN criteria.
DesignA prospective, multicenter observational study with a duration of one year from February 2010 was carried out. RIFLE and AKIN were employed using the urinary (UC) and creatinine criteria (CC) jointly and separately.
ScopeNine polyvalent Critical Care Units (CCUs) in Argentina.
PatientsA total of 627 critical patients over 18 years of age were admitted to the CCU for more than 48h. Exclusion criteria: inability to quantify diuresis, surgical instrumentation of the urinary tract, and need for renal support therapy (RST).
Variables of interestCalculated hourly diuresis (CHD) was used to apply the UC.
ResultsThe incidence of ARF was 69.4% and 51.8% according to RIFLE and AKIN, respectively. UC detected ARF in 59.5% of cases, while CC identified ARF in 34.7% (RIFLE) and 25.3% (AKIN). The mortality rate was 40.9% and 44.6% according to RIFLE and AKIN respectively, was significantly higher than in patients without ARF, and increased with disease severity (Data processing: Excel, SQL and SPSS. Levene test, comparison of means with Student t and chi-squared, with 95% confidence interval).
ConclusionsRIFLE identified more cases of ARF. UC proved more effective than CC. The presence of ARF and severity levels were correlated to mortality but not to days of stay in the CCU. Implementation of the unified CHD was useful for implementing UC and achieving comparable results.
Durante décadas han existido grandes dificultades para definir el síndrome que ahora denominamos insuficiencia renal aguda (IRA). El inconveniente de no contar con una única definición comenzó a plantearse en una revisión donde se observó que en 28 estudios publicados entre los años 1965 y 19891 se utilizaron distintos criterios para su diagnóstico.
Bellomo, Kellum y Ronco en el 20012 propusieron unificar la definición de IRA y consideraron que solo 2 de las múltiples funciones del riñón, la producción de orina y la excreción de productos residuales del metabolismo nitrogenado, son de determinación fácil y rutinaria en todas las Unidades de Cuidados Críticos (UCC)3. Así es que, en la Segunda Conferencia de Consenso Internacional del grupo Acute Diálisis Quality Initiative (ADQI) realizada en el 20044 se propuso para el diagnóstico y estratificación de IRA el método RIFLE, con 3 niveles de disfunción renal aguda «Risk», «Injury» y «Failure» según los cambios en los niveles plasmáticos de creatinina o ritmo urinario.
La validez de este método y su capacidad predictiva de la mortalidad han sido evaluadas en varios trabajos. Ricci et al.5, en una revisión sistemática de todos los estudios que utilizaron RIFLE entre 2004 y 2007, identificaron 24 artículos (más de 71.000 pacientes), poco comparables entre sí y con debilidades: cohortes pequeñas, poblaciones de distintas características (población sana, quemados graves, trasplante de médula ósea, cirugía cardíaca, trasplante hepático, etc.), o realizados en una única institución. No sorprende que en esta revisión se haya observado una incidencia de IRA extremadamente variable: del 10 al 82%.
En el año 20076 se publicaron los resultados de una segunda conferencia de consenso realizada con miembros representantes en Cuidados Críticos y Nefrología (Acute Kidney Injury Network) en la que se propuso el método AKIN con el objetivo de mejorar la sensibilidad y especificidad del sistema RIFLE.
Grandes estudios evaluaron ambos métodos. Bagshaw et al.7 publicaron en el 2008 los resultados del análisis de una base de datos con más de 120.000 pacientes en el que se comparan los sistemas RIFLE y AKIN. La incidencia de IRA fue de 36,1 y 37,1%, respectivamente, y a pesar de sus debilidades, concluye que AKIN no ofrece ventajas con respecto a la sensibilidad, consistencia ni capacidad predictiva de RIFLE.
Osterman et al.8 en 2008 aplicaron la clasificación AKIN en 22.300 pacientes, hallando una incidencia de IRA del 35,4% y una buena correlación entre la gravedad de IRA y el pronóstico, aunque solo el grado más severo mostró ser un factor de riesgo independiente de mortalidad. Joannidis et al.9 publicaron en 2009 una comparación realizada en 14.300 pacientes RIFLE vs. AKIN a partir de datos del SAPS-3, mostrando una incidencia de IRA de 28,5 y 38,5%, respectivamente; RIFLE mostró mayor consistencia y alta tasa de detección de IRA, aunque la falta de datos de ritmo urinario sesgó los resultados, ya que no pudieron diferenciarse los grados 1 y 2 de AKIN y los grados I y F de RIFLE. Ambos estudios demostraron un incremento en la morbimortalidad asociado al desarrollo de IRA.
En el 2010 se publicó un consenso internacional realizado en Canadá en 200710 que tuvo el objetivo de establecer recomendaciones sobre prevención y manejo de la IRA en el paciente crítico. En él se consideró que la cistatina-C es un marcador promisorio que parece detectar IRA más tempranamente que los cambios en la creatinina plasmática, pero que, sin embargo, este y otros biomarcadores (NGAL, molécula-1 de injuria renal, interleucina-18) aún carecen de utilidad por estar en fase de estudio. Se concluyó entonces que el principal marcador sigue siendo la creatinina plasmática (a pesar de las desventajas dadas por la influencia del peso corporal, estado catabólico, presencia de rabdomiólisis, efectos dilucionales y drogas u otras sustancias que alteran su secreción), así como la medición de la diuresis. En consecuencia, recomiendan el uso de RIFLE y AKIN para realizar el diagnóstico de IRA, haciendo observar que, aunque aún requiere validación, AKIN permite una identificación más temprana de los pacientes con IRA que RIFLE.
Nuestros objetivos fueron determinar la incidencia de IRA en distintas UCC, usando los criterios de RIFLE y AKIN aplicados estrictamente a las definiciones de consenso, y comparar el valor pronóstico de ambos métodos para predecir mortalidad y tiempo de estancia en UCC.
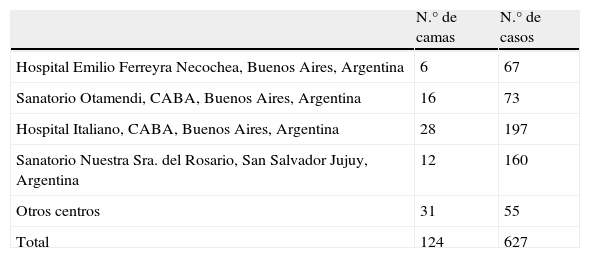
Pacientes y métodosPoblación estudiadaSe estudió en forma prospectiva a 627 pacientes, entre febrero de 2010 y febrero de 2011, provenientes de 9 UCC polivalentes (tabla 1). Se obtuvo consentimiento del Comité de Ética de cada uno de los centros.
Centros intervinientes
| N.° de camas | N.° de casos | |
| Hospital Emilio Ferreyra Necochea, Buenos Aires, Argentina | 6 | 67 |
| Sanatorio Otamendi, CABA, Buenos Aires, Argentina | 16 | 73 |
| Hospital Italiano, CABA, Buenos Aires, Argentina | 28 | 197 |
| Sanatorio Nuestra Sra. del Rosario, San Salvador Jujuy, Argentina | 12 | 160 |
| Otros centros | 31 | 55 |
| Total | 124 | 627 |
CABA: Ciudad Autónoma de Buenos Aires; Otros centros: Instituto Ecuatoriano de Seguridad Social (IESS) de Portoviejo, Manaví, Ecuador; Hospital Pablo Soria de San Salvador de Jujuy, Argentina; Hospital Municipal Ramón Santamarina de Tandil, Buenos Aires, Argentina; Hospital Municipal Agudos Leónidas Lucero de Bahía Blanca, Buenos Aires Argentina.
Se incluyó a pacientes mayores de 18 años de edad internados en UCC durante al menos 48 h, quienes fueron evaluados durante los 7 primeros días de internación. Los motivos de exclusión fueron: imposibilidad de cuantificar la totalidad de la diuresis en cualquier momento del período de estudio, instrumentación quirúrgica de la vía urinaria (talla vesical, nefrostomías, fístulas urinarias, etc.) y la necesidad de terapias de soporte renal (TSR), ya fuera nueva (estadios «Loss» y «End» de RIFLE) o crónica.
Recolección y análisis de datosSe utilizó el programa Excel para la recolección de datos, y se registraron: edad, sexo, origen étnico, peso actual (informado por el paciente o sus familiares), talla, índice de masa corporal (IMC), puntuación de APACHE II y SOFA al ingreso, enfermedad de ingreso quirúrgica o clínica, días de estancia en UCC, y mortalidad en UCC y a los 30, 60 y 90 días del alta. Las puntuaciones APACHE II y SOFA fueron calculadas sin excluir los parámetros de creatinina.
La recolección de orina se realizó de 2 maneras, según el paciente tuviera o no sondada la vía urinaria. En pacientes no sondados se cuantificó cada micción, mientras que en aquellos con sonda vesical la orina se recolectó cada 2 h. En ambos casos, a partir de estas cantidades se calculó el promedio horario desde la recolección previa.
En todos los casos la diuresis horaria se expresó con relación al peso del paciente, obteniéndose entonces la diuresis horaria calculada (DHC) expresada en ml/kg/h. En todos los pacientes se registró la creatinina plasmática medida (CPM) diariamente.
A partir de los datos de edad, sexo, origen étnico, CPM y raza, se calculó automáticamente, según la fórmula Modification of Diet in Renal Disease (MDRD)11, la creatinina plasmática basal (CPB), definida como el valor de creatinina ideal para cada paciente, asumiendo una tasa de filtrado glomerular normal de 75ml/min/1,73m2, asignando para cada grupo etario, sexo y origen étnico un valor teórico normal de CPB.
Todos los pacientes fueron evaluados mediante RIFLE y AKIN (tablas 1 y 2). Como se establece por consenso, el cumplimiento de uno o más de los criterios urinario (U) y creatinina (C) determinó el diagnóstico de IRA (IRA-UC). Además, ambos criterios fueron evaluados por separado.
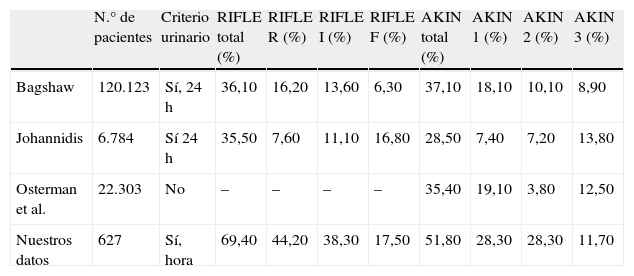
Incidencia de IRA en estudios publicados
| N.° de pacientes | Criterio urinario | RIFLE total (%) | RIFLE R (%) | RIFLE I (%) | RIFLE F (%) | AKIN total (%) | AKIN 1 (%) | AKIN 2 (%) | AKIN 3 (%) | |
| Bagshaw | 120.123 | Sí, 24 h | 36,10 | 16,20 | 13,60 | 6,30 | 37,10 | 18,10 | 10,10 | 8,90 |
| Johannidis | 6.784 | Sí 24 h | 35,50 | 7,60 | 11,10 | 16,80 | 28,50 | 7,40 | 7,20 | 13,80 |
| Osterman et al. | 22.303 | No | – | – | – | – | 35,40 | 19,10 | 3,80 | 12,50 |
| Nuestros datos | 627 | Sí, hora | 69,40 | 44,20 | 38,30 | 17,50 | 51,80 | 28,30 | 28,30 | 11,70 |
A partir de la DHC se identificaron los casos que cumplieron primero con el criterio U, antes que con el criterio C, durante 6, 12 y 24h continuadas. De esta manera, los pacientes fueron categorizados simultáneamente para RIFLE y AKIN, a cada hora y durante los 7 días de estudio, en uno de los 4 grados posibles. Para RIFLE: RIFLE cero (sin IRA), R (risk), I (injury) y F (failure). Para AKIN: AKIN 0, AKIN 1, AKIN 2 y AKIN 3. A partir de estos resultados horarios de RIFLE y AKIN, el programa detectó el grado más severo de IRA por cada día de estudio, obteniéndose entonces una categorización diaria de IRA solo por criterio U según RIFLE y AKIN.
Insuficiencia renal aguda según criterio creatinina (IRA-C)A partir de los registros de CPM y CPB se identificaron los casos que cumplieron primero con el criterio C, antes que con el criterio U, diariamente. Para RIFLE se consideraron los aumentos diarios de la CPM con respecto a la CPB, categorizando a los pacientes, solo según criterio C, en: RIFLE cero, R, I y F. Para AKIN se consideraron los aumentos de la CPM con respecto a la CPM en las 48 h previas, por lo cual el registro de IRA se tuvo solo en los días 3, 5 y 7 de estudio, obteniendo uno de los 4 grados posibles: AKIN cero, AKIN 1, AKIN 2 y AKIN 3.
Insuficiencia renal aguda según ambos criterios (IRA-UC)Se identificó a los pacientes que cumplieron con los criterios U y C a la vez, categorizándolos en los 4 niveles posibles de IRA, tanto para RIFLE como para AKIN.
No se consideró el estado de volemia ni el aporte previo de fluidos.
El análisis de las variables seleccionadas se realizó mediante un programa que capturó los registros de las planillas, formando una base de datos en SQL. La base de datos se analizó por medio de Stadistical Package for the Social Sciences (SPSS).
Se controló la homogeneidad de las variables a través del test de Levenne, con el 95% de confianza. Para detectar diferencias estadísticas entre las instituciones participantes se utilizó el test de comparación de medias/promedios t de Student, con el 95% de confianza. En el caso de sexo/género se testeó la diferencia de proporción de mujeres entre las instituciones a través del test de chi-cuadrado (con el mismo nivel de confianza).
ResultadosCaracterísticas de la muestraDe la serie total de casos (n=627) los valores medios fueron: edad de 62 años (de 18 a 97); 63% hombres y 37% mujeres; IMC de 26,4 (de 12,4 a 70,3); días de estancia de 13,6; APACHE 15; SOFA 5; 27,6% posquirúrgicos (cirugía electiva 16,4%; de urgencia 11,2%).
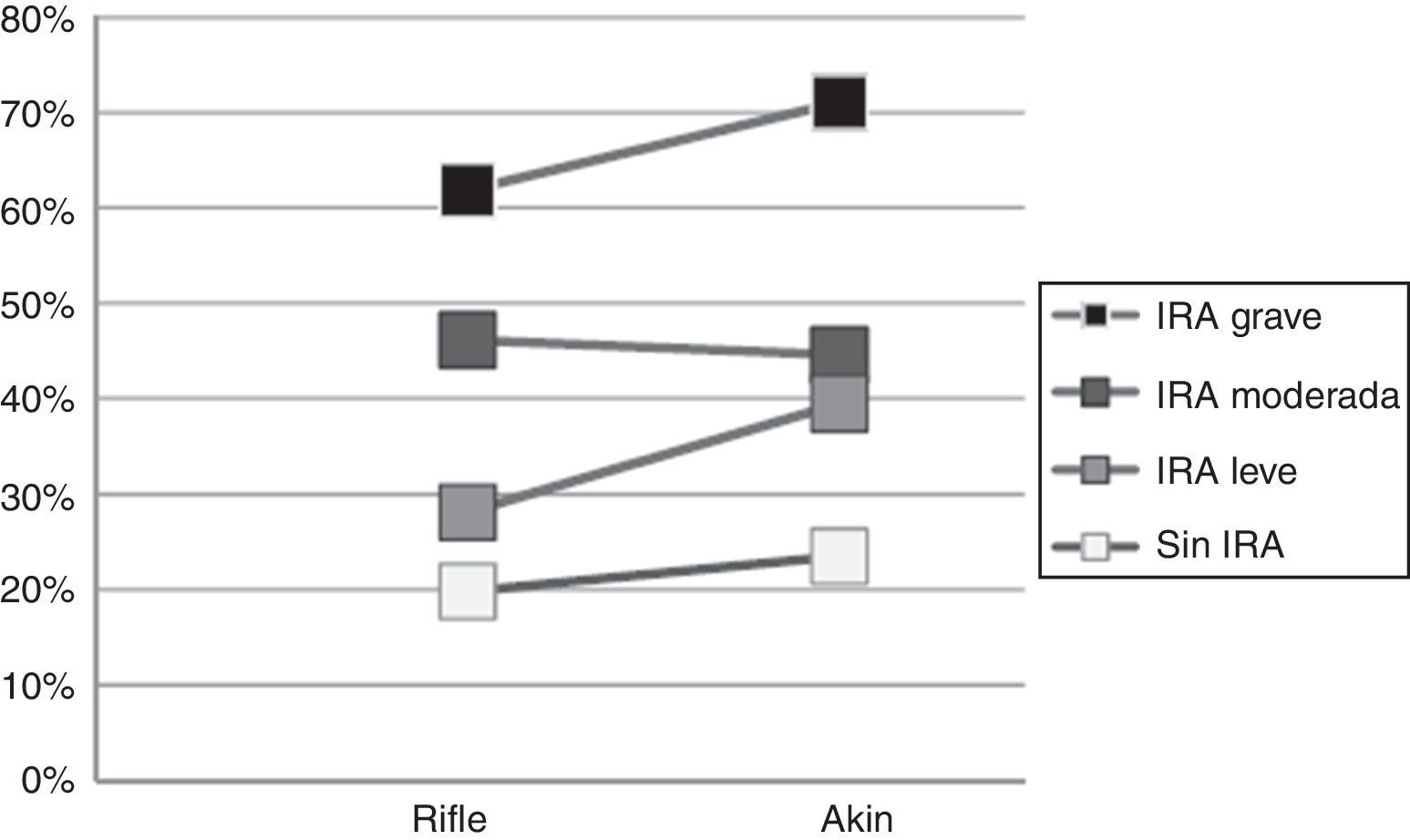
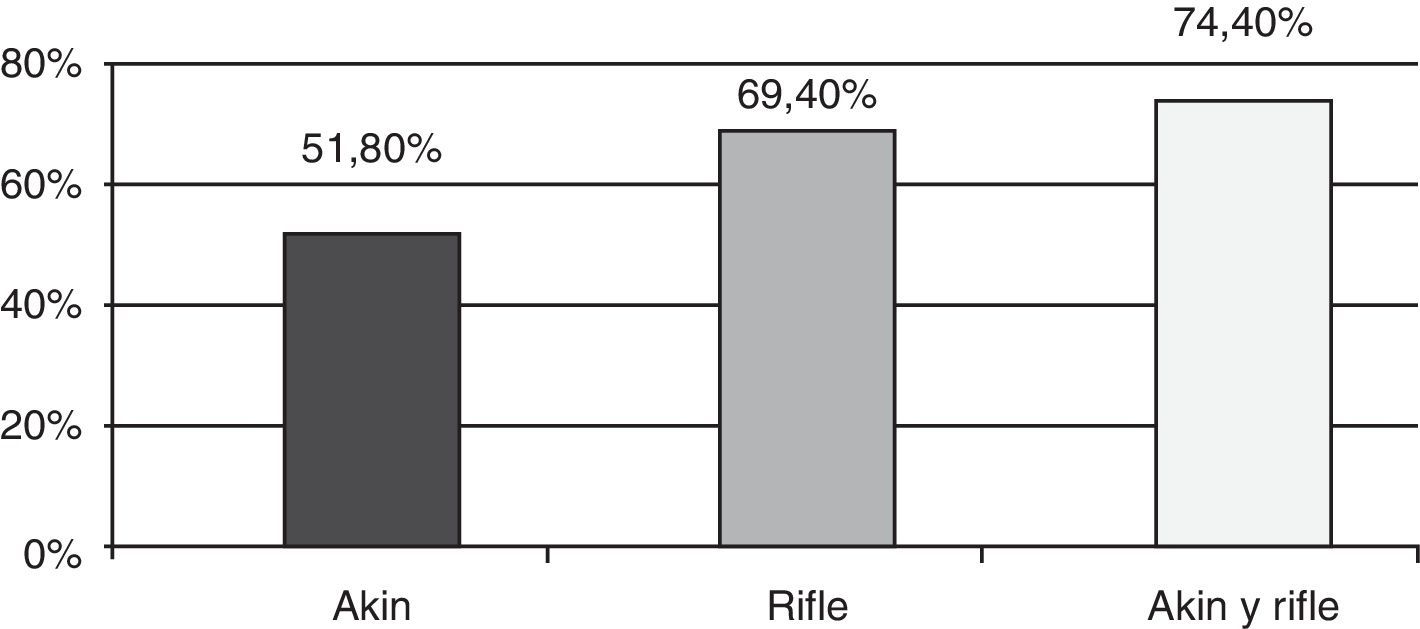
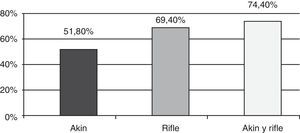
Incidencia de insuficiencia renal agudaEl 69,4% mostró algún grado de IRA según RIFLE, mientras que la proporción de pacientes con IRA según AKIN fue de 51,8% (fig. 1).
La mayor cantidad de pacientes con IRA presentó el grado más leve (R de RIFLE: 30,6% y AKIN 1: 31,1%), aunque RIFLE detectó mayor cantidad de pacientes con IRA de grado intermedio y grave (26,6 y 12,1%, respectivamente) que AKIN (14,7 y 6,1%, respectivamente).
El 8,7% de los pacientes categorizados con IRA según RIFLE no registraron IRA según AKIN, mientras que el 9,8% de los pacientes con IRA según AKIN no registraron IRA según RIFLE. Cuando se aplicaron ambos métodos a la vez, se detectó una mayor cantidad de casos de IRA (467 pacientes) que aplicando RIFLE solo (435 pacientes) o AKIN solo (325 pacientes) (fig. 1).
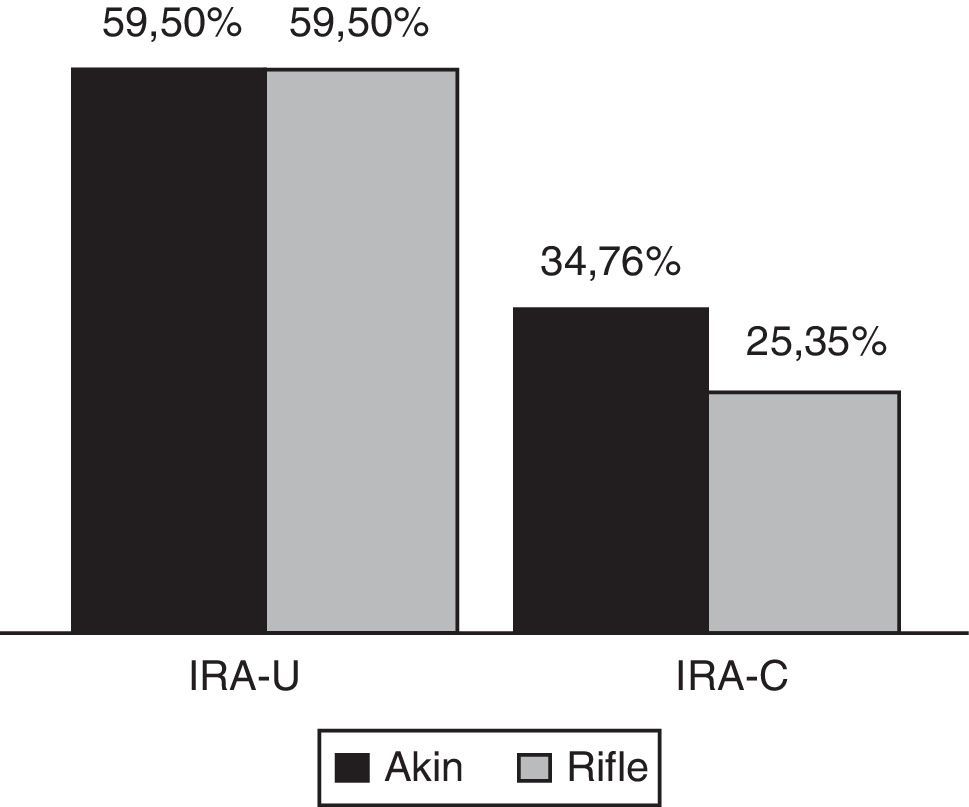
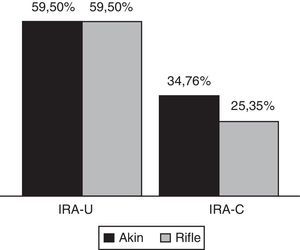
Cuando se analizan los datos solo según el criterio U, los resultados son iguales para RIFLE y AKIN ya que ambos sistemas comparten idénticos puntos de corte según consenso. La proporción de casos de IRA que cumplió primero con el criterio U antes que con el criterio C fue de 59,5%, sin diferencias significativas con cuando se cumplieron ambos criterios a la vez. En cambio, los casos de IRA que cumplieron antes con el criterio C fueron menos que los que cumplieron ambos criterios a la vez: 34,7% para RIFLE y 25,3% para AKIN (fig. 2).
No hubo diferencias significativas con respecto a los días de estancia en UCC (media de 14 días) en los pacientes con IRA y sin IRA, evaluados tanto por RIFLE como por AKIN.
Los pacientes con IRA RIFLE fueron significativamente más añosos que aquellos sin IRA RIFLE y, a mayor grado de severidad, la edad fue mayor. Esta tendencia fue similar en los pacientes evaluados por AKIN pero los valores no fueron significativos. Ninguna de las 2 escalas mostró diferencias significativas en la incidencia de IRA con respecto al género, aunque cuando se evaluó solo el criterio U la proporción de hombres fue mayor a medida que aumentó la gravedad de IRA, tanto para RIFLE como para AKIN. El IMC fue significativamente mayor (media 27) en los pacientes con IRA. Las puntuaciones de APACHE II y SOFA fueron significativamente mayores a medida que aumentó el grado de severidad de IRA, tanto en RIFLE como en AKIN. La mayor proporción de pacientes con IRA fueron no quirúrgicos. Solo 34 pacientes recibieron TSR (31 casos hemodiálisis diaria intermitente, y 3 casos terapia de reemplazo renal continua), y los motivos de su indicación fueron: anuria, acidosis, sobrecarga de volumen, shock refractario, elevación progresiva de la creatinina plasmática e hiperpotasemia.
La diuresis diaria de los pacientes sin IRA fue de 2.268ml/día en RIFLE y de 2.109ml/día en AKIN. Este valor fue menor en los pacientes con IRA, y mostró valores significativamente menores a medida que aumentó el grado de severidad. Sin embargo, cuando se evaluó la sensibilidad de la diuresis diaria para la detección de los pacientes con IRA, se observó un área bajo la curva ROC para RIFLE de 66,7 y de 62,8% para AKIN, es decir una baja sensibilidad. A su vez, cuando se evaluó a los pacientes solo por criterio U se observó que la diuresis diaria fue significativamente menor a medida que aumentó el riesgo IRA. Quienes no registraron IRA mostraron la media más alta (2.177ml/día) y este valor fue significativo con respecto a todos los grados de IRA.
La CPM de los pacientes sin IRA según RIFLE fue de 0,77mg/dl, mientras que en los pacientes sin IRA según AKIN fue de 1,01mg/dl. Estos valores fueron más altos en los pacientes con IRA categorizados según RIFLE, siendo significativamente mayores a medida que aumentó el grado de severidad. La correlación entre valores de CPM con la presencia de IRA y su severidad no se observó en los pacientes categorizados por el sistema AKIN. Por otra parte, la CPM de los pacientes evaluados solo por criterio U también mostró valores significativamente más altos en los niveles más severos. Sin embargo, cuando se evaluó la sensibilidad de la CPM para la detección de IRA, se observó un área bajo la curva ROC para RIFLE de 75,5 y de 59,9% para AKIN.
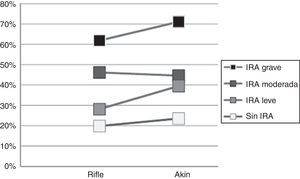
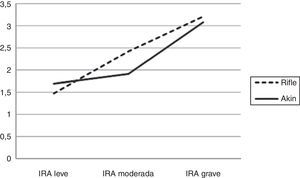
MortalidadLa mortalidad global (mortalidad en UCC hasta los 90 días del alta) fue de 40,9 y 44,6% de los pacientes con IRA RIFLE e IRA AKIN, respectivamente, significativamente mayor a la de los pacientes sin IRA (19,79 y 23,5% para RIFLE y AKIN, respectivamente). Estos valores fueron similares a los obtenidos cuando el diagnóstico de IRA se realizó aplicando solo el criterio C (IRA-C: 49,08 y 51,7% según RIFLE y AKIN, respectivamente) o solo el criterio U (IRA-U: 41,82% según RIFLE y AKIN). La proporción de fallecidos fue significativamente mayor a mayor grado de severidad de IRA (fig. 3). El grado más severo presentó valores marcadamente mayores (71,1 y 61,8% para AKIN y RIFLE, respectivamente).
En AKIN la mortalidad del grado más severo fue significativamente mayor a la de los grados leve y moderado. En RIFLE, las mortalidades de los grados moderado y grave fueron bastante mayores a las del grado más leve o a la de los pacientes sin IRA. La mayor proporción de muertes ocurrió en la UCC, tanto en los pacientes sin IRA como en los casos con cualquier grado de IRA.
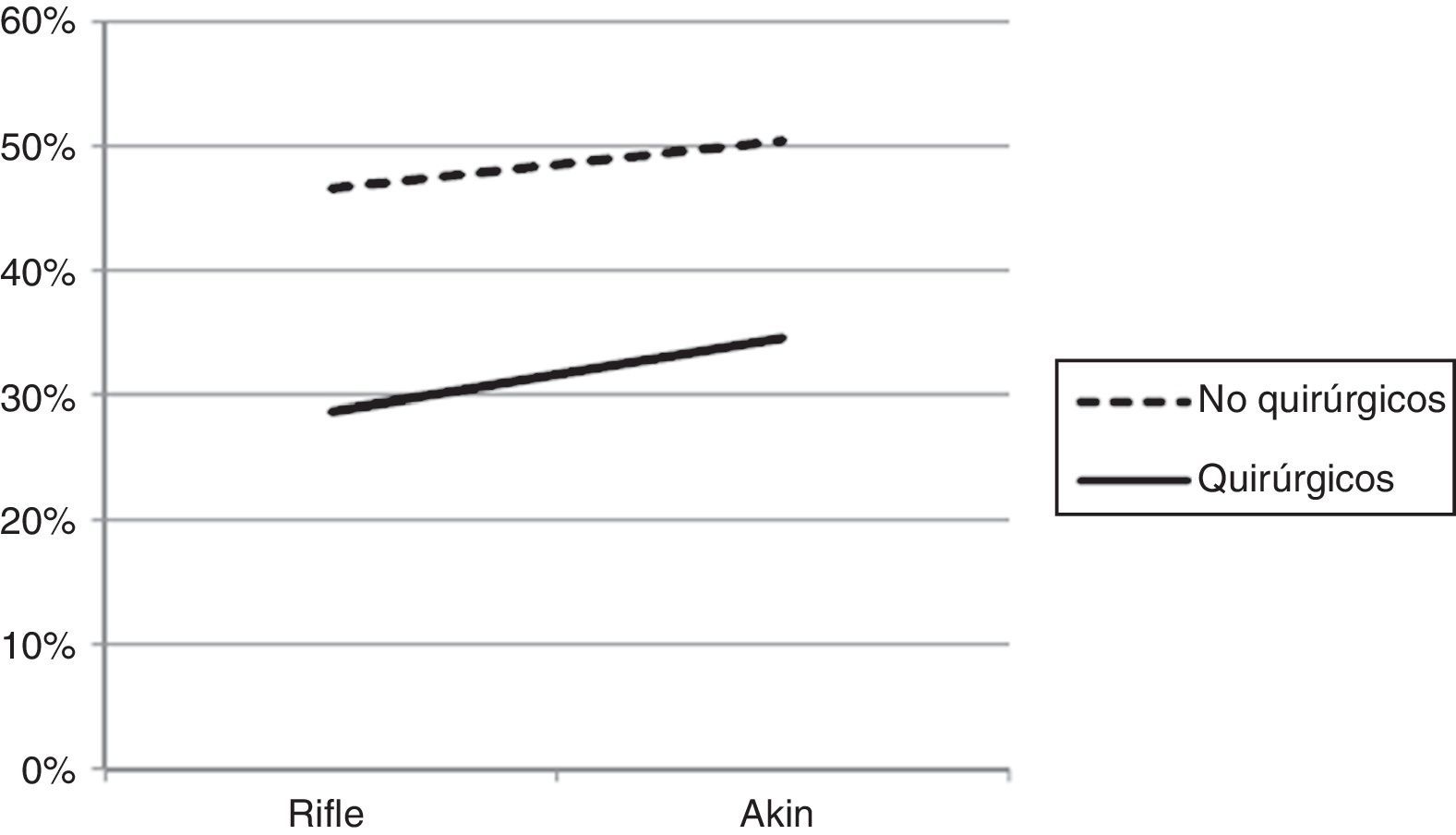
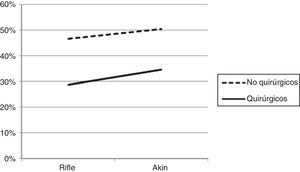
La mortalidad fue mayor en aquellos con enfermedades no quirúrgicas (46,56 y 50,40%, respectivamente) que en los quirúrgicos (28,69 y 34,56%, respectivamente), tanto en los pacientes con IRA categorizados por RIFLE como por AKIN (fig. 4).
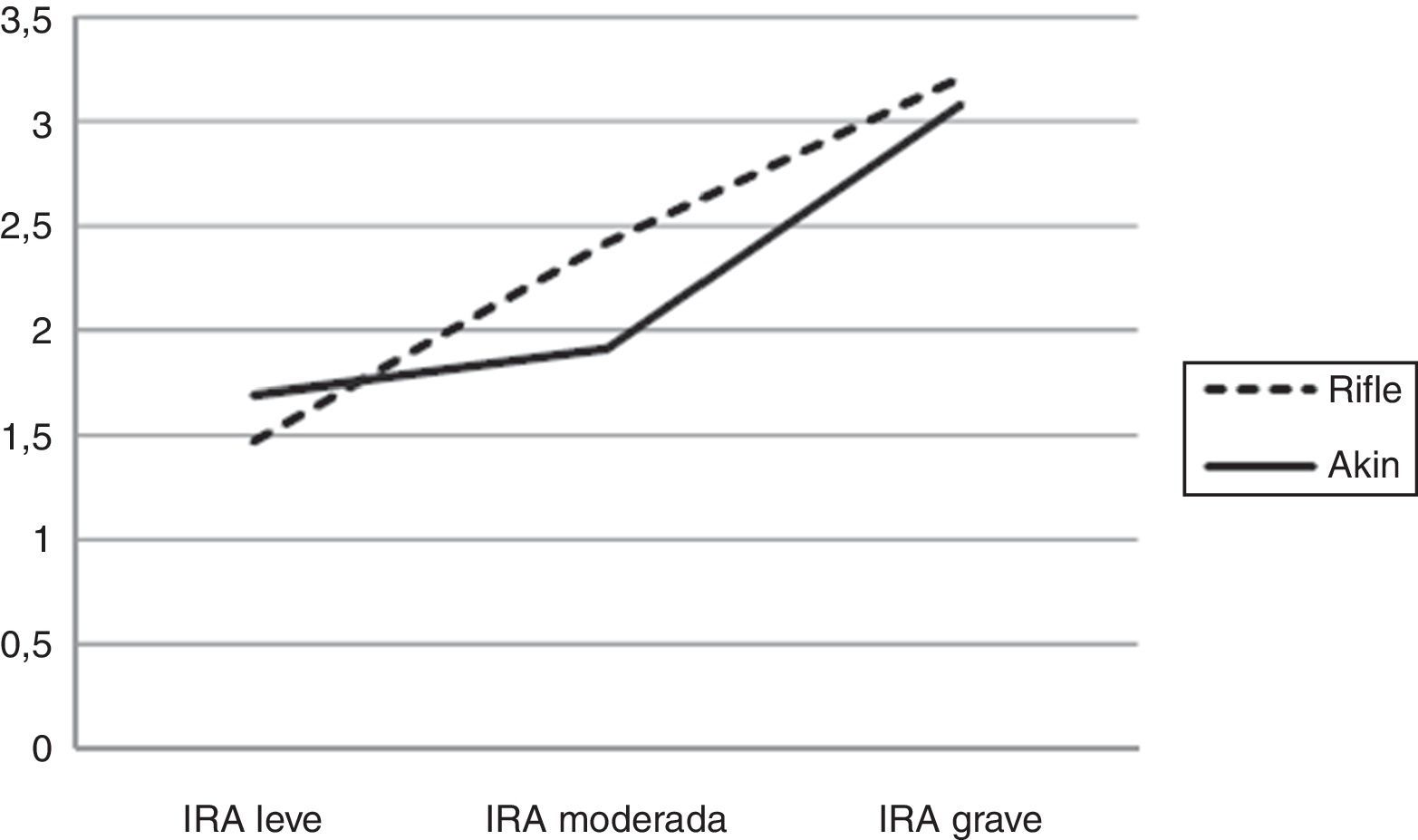
El riesgo relativo de muerte fue progresivamente mayor a medida que aumentó la severidad de IRA, tanto en los pacientes categorizados por RIFLE como por AKIN (fig. 5).
DiscusiónEn nuestros resultados, la incidencia de IRA fue mayor a la de los grandes trabajos publicados, tanto al utilizar el sistema RIFLE como el AKIN (tabla 2). Esta mayor incidencia se observó en todos los grados de severidad.
El sistema RIFLE categorizó mayor cantidad de pacientes con IRA que AKIN, a diferencia del trabajo de Brochard10. La diferente incidencia de IRA en RIFLE y AKIN fue a expensas de los casos de severidad intermedia y grave, siendo la proporción de pacientes con IRA de grado leve similar en RIFLE y AKIN. Por otra parte, hubo pacientes categorizados como IRA según RIFLE pero que no mostraron IRA según AKIN, y viceversa, lo cual hace suponer que el uso de ambos sistemas a la vez aumenta la capacidad de detección de este síndrome, y esto se ha confirmado en los resultados.
Cuando se comparan RIFLE y AKIN, las diferencias solo pueden atribuirse al criterio C, ya que el criterio U tiene exactamente iguales puntos de corte en ambos sistemas. Se ha detallado ampliamente en la bibliografía la debilidad del uso de la creatinina plasmática para el diagnóstico de IRA. En el caso de RIFLE, el criterio C se basa en la comparación de la CPM actual con la CPB que pretende representar la «creatinina ideal» de cada paciente, y es estimada según la fórmula MDRD. Esta última ha sido validada solo en pacientes estables, situación poco frecuente en los enfermos críticos, e ignora la relación no lineal entre los niveles de creatinina y la TFG. Además, esta fórmula incluye datos que no suelen ser confiables en la UCC: el peso del paciente muchas veces es desconocido o se encuentra alterado por la ganancia o pérdida de agua corporal, al igual que el volumen de distribución de la creatinina. Por otra parte, la fórmula también incluye un valor «normal» de TFG estimado en 75ml/min/m2 en forma arbitraria, siendo que en realidad esta puede variar ampliamente en sujetos normales que se alimentan de manera diferente o que cuentan con distintos niveles de reserva de la función renal3,12. Tampoco tiene en cuenta los cambios que ocurren en los niveles de CPM por causas no renales, como ocurre en los pacientes con disminución de la masa muscular o de la función hepática. Todo esto ha llevado a cuestionar la utilidad de la CPB en RIFLE. En el caso de AKIN se compara la CPM actual con la CPM de las 48 h previas. Aquí el valor de creatinina previo no es calculado sino medido, haciendo creer que los resultados podrían ser más confiables que en RIFLE. Sin embargo, un paciente puede presentar una CPM previa ya elevada como consecuencia de que la IRA podría haberse desencadenado días antes de la determinación y, así, la comparación entre ambos valores no detectaría IRA. Así es que el análisis de los cambios en la creatinina es cuestionada en ambos métodos, y la discusión se centra en cuál de los 2 es más confiable. Dado que no existe un «patrón de oro» para definir IRA, no es posible comparar la especificidad de ambos métodos. Sin embargo, como sugirió Bellomo en el 20043, la importancia de la definición de IRA no parece radicar en que esta sea «correcta» o «confiable», sino en su utilidad. Creemos entonces que el método más útil debería ser aquel capaz de detectar una mayor cantidad de casos de IRA con el objeto de implementar en ellos acciones preventivas o terapéuticas tempranas, por más que esto implique la presencia de falsos positivos.
Si nos basamos en que el método más útil es aquel que detecta mayor cantidad de pacientes con IRA, RIFLE sería más útil que AKIN. A su vez, el uso de RIFLE y AKIN simultáneamente en un mismo paciente tendría aún mayor utilidad que RIFLE solo.
En nuestro trabajo, el criterio U detectó mayor cantidad de pacientes con IRA que el criterio C y, por lo tanto, fue más eficaz. Esta mayor sensibilidad del criterio U podría explicarse por el hecho de que hemos categorizado a los pacientes en forma horaria (según una diuresis horaria calculada), a diferencia de la creatinina que requiere de un nuevo valor a las 24h en el caso de RIFLE o a las 48 h en el caso de AKIN.
En nuestra experiencia, detectamos una gran variación en la forma de monitorear la diuresis en los distintos centros participantes, mientras que en los trabajos publicados también se evidencia una falta de unidad en su determinación. Por otra parte, cuando no está cateterizada la vía urinaria no es posible registrar la orina producida a cada hora, haciendo teóricamente imposible la aplicación del criterio U recomendado por consenso en estos pacientes, quienes, a pesar de encontrarse quizás en un estado clínico menos crítico, no están exentos de presentar IRA. Por estos motivos es por lo que decidimos implementar la DHC, pudiendo hacer aplicable los sistemas RIFLE y AKIN con mayor precisión y obtener resultados comparables en todos los pacientes, con o sin sondas urinarias.
Cuando la diuresis se evaluó en mililitros por día, la sensibilidad para el diagnóstico de IRA fue de 66,7 y 62,8 con respecto a RIFLE y AKIN, respectivamente; es decir, el valor aislado de la diuresis diaria fue de poca utilidad diagnóstica. Sin embargo, la caída del ritmo diurético horario mostró buena correlación con la presencia de IRA y de grados más severos de la enfermedad, por lo que la relación de la diuresis/tiempo sí podría considerarse de valor pronóstico.
El aumento de los valores de CPM en los pacientes con IRA no se correlacionó con la progresión de la gravedad de IRA cuando se utilizó el sistema AKIN, aunque al utilizar RIFLE esta correlación sí existió. Aquí debemos recordar que los datos de creatinina fueron registrados diariamente en RIFLE y, en cambio, cada 48 h en AKIN, con lo cual podemos suponer que los aumentos de CPM tendrían valor pronóstico cuando la creatinina es medida al menos cada 24 h. Por otra parte, los valores aislados de CPM mostraron una sensibilidad del 75,5 y 59,9% con respecto a RIFLE y AKIN, es decir, de escasa utilidad diagnóstica.
Coincidentes con los trabajos publicados, nuestros datos de mortalidad en los pacientes con IRA fueron significativamente mayores que los de los pacientes sin IRA, tanto al utilizar RIFLE como AKIN, observándose los valores más altos al aumentar la severidad de la enfermedad. Los resultados fueron similares al categorizar a los pacientes por criterio U o por criterio C separadamente. También es coincidente la mayor proporción de las muertes observada en los pacientes no quirúrgicos.
En concordancia con la bibliografía, nuestros resultados muestran que los pacientes con IRA fueron más añosos y con mayor cantidad de enfermedades previas, y tuvieron valores de IMC, puntuación APACHE II y SOFA mayores que los de los pacientes sin IRA. No hubo diferencias significativas con respecto al género ni días de estancia en UCC. Además, pudimos observar que la mayor incidencia de IRA ocurrió en pacientes no quirúrgicos.
ConclusionesDado que no existe un «patrón de oro» para conocer la sensibilidad y especificidad reales de los sistemas RIFLE y AKIN, su evaluación debería tener la finalidad de demostrar cuál de los 2 métodos es más útil para mejorar el pronóstico de los pacientes críticos.
La bibliografía revisada hasta la actualidad sigue mostrando datos difícilmente comparables, a pesar de las definiciones establecidas por consenso. Quizás la incidencia de IRA informada en los estudios publicados habría sido mayor si el criterio U hubiese sido aplicado estrictamente.
A pesar de las recomendaciones, sigue sin precisarse la forma en que se debería medir la diuresis, sobre todo en pacientes sin sonda urinaria. En nuestra experiencia, la DHC nos permitió aplicar el criterio urinario en forma estandarizada para todos los pacientes, independientemente de los intervalos de recolección de diuresis y de la presencia o no de sonda urinaria, por lo que proponemos su utilización.
Creemos que la originalidad de este estudio está, sobre todo, en el hecho de haber aplicado el criterio U exactamente como se recomienda por consenso, a diferencia de la mayoría de los estudios, en los cuales se reconoce como debilidad que los datos de diuresis fueron insuficientes o inexistentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interes.