Existen controversias sobre la influencia del sistema de humidificación en la incidencia de infecciones respiratorias asociadas a la ventilación mecánica invasiva (VMI). Nuestro objetivo fue evaluar las diferencias en la incidencia de neumonía y traqueobronquitis asociadas a la ventilación mecánica (NAV y TAV respectivamente) con humidificación pasiva y activa.
DiseñoEstudio retrospectivo cuasi-experimental de tipo pre-postintervención.
ÁmbitoUCI polivalente de 14 camas.
PacientesSe incluyeron todos los pacientes conectados a la VMI durante>48horas durante los años 2014 y 2016.
IntervencionesDurante el año 2014 se empleaba humidificación pasiva con un intercambiador calor-humedad (HME) y, durante 2016, humidificación activa (HH) con calentamiento de la tubuladura inspiratoria. Se establecieron medidas idénticas para la prevención de NAV (proyecto Neumonía Zero).
Variables de interés principalesSe estimaron tasas de incidencia NAV y TAV por 1.000 días de VMI en ambos grupos y se valoraron diferencias estadísticamente significativas mediante regresión Poisson.
ResultadosSe incluyeron 287 pacientes (116 con HME y 171 con HH). La densidad de incidencia de NAV por 1.000 días de VMI fue de 5,68 en el grupo de HME y 5,80 en el grupo de HH (p=ns). La densidad de incidencia de TAV fue 3,41 y 3,26 casos por 1.000 días de VMI con HME y HH respectivamente (p=ns). Se identificó como factor de riesgo de NAV la duración de la VMI.
ConclusionesEn nuestro estudio la humidificación activa en pacientes ventilados durante>48horas no se asoció con un aumento de las complicaciones infecciosas respiratorias.
There is controversy regarding the influence of humidification systems upon the incidence of respiratory infections associated to invasive mechanical ventilation (IMV). An evaluation was made of the differences in the incidence of pneumonia and tracheobronchitis associated to mechanical ventilation (VAP and VAT, respectively) with passive and active humidification.
DesignA retrospective pre-post quasi-experimental study was carried out.
SettingA polyvalent ICU with 14 beds.
PatientsAll patients connected to IMV for>48hours during 2014 and 2016 were included.
InterventionsDuring 2014, passive humidification with an hygroscopic heat and moisture exchanger (HME) was used, while during 2016 active humidification with a heated humidifier (HH) and an inspiratory heated wire was used. Identical measures for the prevention of VAP were established (Zero Pneumonia Project).
Main outcome measuresThe incidence of VAP and VAT was estimated for 1000 days of IMV in both groups, and statistically significant differences were assessed using Poisson regression analysis.
ResultsA total of 287 patients were included (116 with HME and 171 with HH). The incidence density of VAP per 1000 days of IMV was 5.68 in the HME group and 5.80 in the HH group (p=ns). The incidence density of VAT was 3.41 and 3.26 cases per 1000 days of VMI with HME and HH respectively (p=ns). The duration of IMV was identified as a risk factor for VAP.
ConclusionsIn our population, active humidification in patients ventilated for>48hours was not associated to an increase in respiratory infectious complications.
En la actualidad, la importancia de que los gases administrados en ventilación mecánica lleguen al paciente en condiciones adecuadas de calor y humedad a través de los circuitos del respirador es indiscutible. Múltiples estudios han demostrado que la humidificación deficiente de dichos gases perpetuada en el tiempo ocasiona alteraciones como disfunción mucociliar, inflamación, ulceración y necrosis del epitelio respiratorio, así como un aumento de la viscosidad de las secreciones respiratorias. Esto consecuentemente se traduce en un aumento de la incidencia de obstrucción del tubo endotraqueal, de la resistencia al flujo aéreo, de atelectasias e infecciones respiratorias (neumonía y traqueobronquitis) asociadas a la ventilación mecánica1.
La intubación orotraqueal supone un cortocircuito a la naso-oro-faringe, zona anatómica encargada de administrar el 75% del calor y de la humedad de los gases durante la respiración. Además, hay que tener en cuenta que los gases medicinales habitualmente se encuentran en condiciones de baja temperatura (10-15°C), anhidrosis (humedad absoluta [HA] 0-0,5 mgH2O/l y humedad relativa [HR] 2%). Por ello, se han desarrollado diversos métodos de calentamiento y humidificación de los gases administrados durante la ventilación mecánica: los humidificadores pasivos o narices artificiales (Heat and Moisture Exchangers [HME]) y los humidificadores activos (Heat Humidifiers [HH])1,2.
Los HME actúan de forma pasiva atrapando el calor y la humedad del aire espirado por el paciente y devolviéndolos en la siguiente inspiración. Sus principales ventajas son su sencillez y bajo coste; sin embargo, están contraindicados en caso de abundantes secreciones respiratorias y en caso de ventilación con volúmenes corrientes bajos (como en la ventilación protectora) debido a que incrementan el espacio muerto, lo que puede aumentar la PaCO2. Los humidificadores activos se componen de una cámara reservorio de agua estéril calentada por una placa. Los gases medicinales fríos y anhidros pasan por la cámara adquiriendo calor y humedad hasta un acondicionamiento óptimo (37°C, HA 44mg H2O/l y HR 100%) y son transportados por la tubuladura inspiratoria hacia el paciente. Habitualmente se emplean tubuladuras dotadas de un alambre calentador que impide la condensación del vapor de agua al disminuir la temperatura en el trayecto del calentador al paciente3.
Al instaurar la ventilación mecánica, los mecanismos de defensa habituales, como la tos y el aclaramiento mucociliar, se encuentran disminuidos, lo que aumenta considerablemente el riesgo de infección. La neumonía asociada a la ventilación (NAV) constituye la principal causa de mortalidad debida a infecciones relacionadas con la atención hospitalaria, sobre todo cuando es provocada por microorganismos multirresistentes. Su diagnóstico en ocasiones es impreciso, lo que conduce a sobretratamiento antibiótico4–7.
Existen controversias sobre cuál es el sistema de humidificación más adecuado y sobre su influencia en la incidencia de la infección respiratoria asociada a la ventilación mecánica. El objetivo principal de este estudio fue evaluar las diferencias en la incidencia de infección asociada a ventilación mecánica (NAV y TAV) entre paciente ventilados con humidificación pasiva y activa, una vez instauradas todas las medidas preventivas de la infección asociada a la ventilación incluidas en el Programa Neumonía Zero.
Pacientes y métodoSe realizó un estudio de cohortes retrospectivo unicéntrico cuasi-experimental de tipo pre-postintervención, durante los meses de enero a diciembre del año 2014 y de enero a diciembre del año 2016, en el Servicio de Medicina Intensiva de un hospital univesitario de tercer nivel de 14 camas con atención a pacientes médicos, traumáticos y quirúrgicos, con un 52% de pacientes en VM y un Apache-II medio de 17,5 puntos. Se incluyeron de manera consecutiva todos los pacientes conectados a la ventilación mecánica invasiva (VMI) durante más de 48horas. Se excluyeron a los pacientes menores de 18 años. Los pacientes recibieron humidificación desde el momento de la intubación.
Durante el año 2014 se empleó humidificación pasiva con intercambiadores calor-humedad higroscópicos con filtro antibacteriano (modelo EdithFlex de la marca AirlifeTM®) en todos los pacientes ventilados, que según la casa comercial, proporciona una HA de entre 32,5 y 33,5 cmH2O/l, añadiendo un volumen de espacio muerto de 90ml. Los dispositivos HME se recambiaron cada 72horas según protocolo, pudiendo ser recambiados antes si se observaba contaminación del filtro por secreciones respiratorias o mínima condensación que causara aumento en las resistencias de la vía aérea.
Durante el año 2016 todos los pacientes fueron tratados mediante humidificación activa con una cámara de llenado automático (Fisher&Paykel® MR850), con alambre calentador de la tubuladura inspiratoria, a una temperatura de 37°C (HA 44mgH2O/l, HR 100%). El circuito se recambió cada 21 días en caso de VMI prolongada.
Los pacientes ventilados mecánicamente durante el año 2015 no fueron incluidos, al tratarse de un periodo de cambio en la estrategia de humidificación debido a la implantación del uso de humidificación activa en los pacientes conectados a la VMI.
En ambos periodos del estudio se establecieron las mismas medidas para la prevención de la NAV en el marco de participación en el Proyecto Nacional Neumonía Zero: educación y entrenamiento del personal sanitario en el manejo de la vía aérea (aspiración de secreciones bronquiales), higiene de manos estricta con soluciones alcohólicas cuando se manipula la vía aérea, higiene oral con solución de clorhexidina (0,12%), control y mantenimiento de la presión del neumotaponamiento, posición semiincorporada, promover procedimientos y protocolos que reducen el tiempo de ventilación (protocolos de weaning y de sedación), evitar el cambio programado del circuito del ventilador, humidificadores y tubos endotraqueales, descontaminación selectiva de la orofaringe (solución de tobramicina, colistina y nistatina) y empleo de tubos endotraqueales con sistema de aspiración continua de secreciones subglóticas8.
Se recogieron las siguientes variables: edad, sexo, factores de riesgo de neumonía asociada a la ventilación (infección por virus de la inmunodeficiencia humana [VIH], enfermedad renal crónica [ERC], enfermedad pulmonar obstructiva crónica [EPOC], diabetes mellitus [DM], trasplante, neoplasia activa, neutropenia, cirrosis hepática), escala APACHE-II al ingreso, días de ventilación mecánica invasiva, tipo de humidificación empleada, antibioterapia previa (definida como utilización de antibióticos por vía parenteral en las 24horas previas al inicio de la VMI), incidencia de NAV y TAV, días hasta el desarrollo de la neumonía, tipo de muestra microbiológica extraída (broncoaspirado, lavado broncoalveolar, catéter telescopado), resultado de los cultivos cuantitativos, días de estancia en UCI y estado al alta de UCI y al alta hospitalaria (vivo, exitus). Los datos fueron obtenidos retrospectivamente del sistema informático de gestión clínica de nuestro centro (IMASIS). Dos clínicos revisaron de forma independiente todos los pacientes ventilados mecánicamente durante el periodo de estudio y reevaluaron conjuntamente el diagnóstico de NAV y TAV. En caso de discordancia de opiniones, un tercer clínico actuó como revisor de desempate.
El diagnóstico de NAV se realizó según los criterios establecidos por la ECDC y para la TAV los establecidos por la CDC9. Se emplearon criterios clínicos (fiebre, leucocitosis o leucopenia, secreciones purulentas, auscultación respiratoria, tos, disnea o taquipnea y deterioro progresivo del intercambio gaseoso), radiológicos (nueva imagen sugestiva de neumonía en la radiografía de tórax o TAC torácica) y microbiológicos (cultivos cuantitativos de broncoaspirado, lavado broncoalveolar o catéter telescopado). Se consideró NAV precoz aquella desarrollada en ≤7 días del inicio de la VMI.
Análisis estadísticoPara el análisis estadístico inicial, las variables cuantitativas fueron expresadas mediante la mediana y los cuartiles (P25 y P75). Las variables categóricas se describieron mediante tabla de frecuencias (número y porcentaje).
Se evaluaron posibles diferencias entre los grupos de humidificación activa y pasiva mediante test Chi-cuadrado para las variables categóricas (o el test exacto de Fisher según correspondiere) y el test no paramétrico de Mann-Whitney para las variables continuas. Esos mismos test se utilizaron en el análisis bivariado para la valoración de posibles factores asociados a NAV y TAV. Asimismo, se realizó un análisis multivariado de los outcomes NAV y TAV, teniendo como factor principal el grupo de humidificación y ajustando por posibles factores de confusión, escogiendo aquellas variables para las cuales se encontraron diferencias significativas en la comparación entre los grupos de humidificación activa y pasiva.
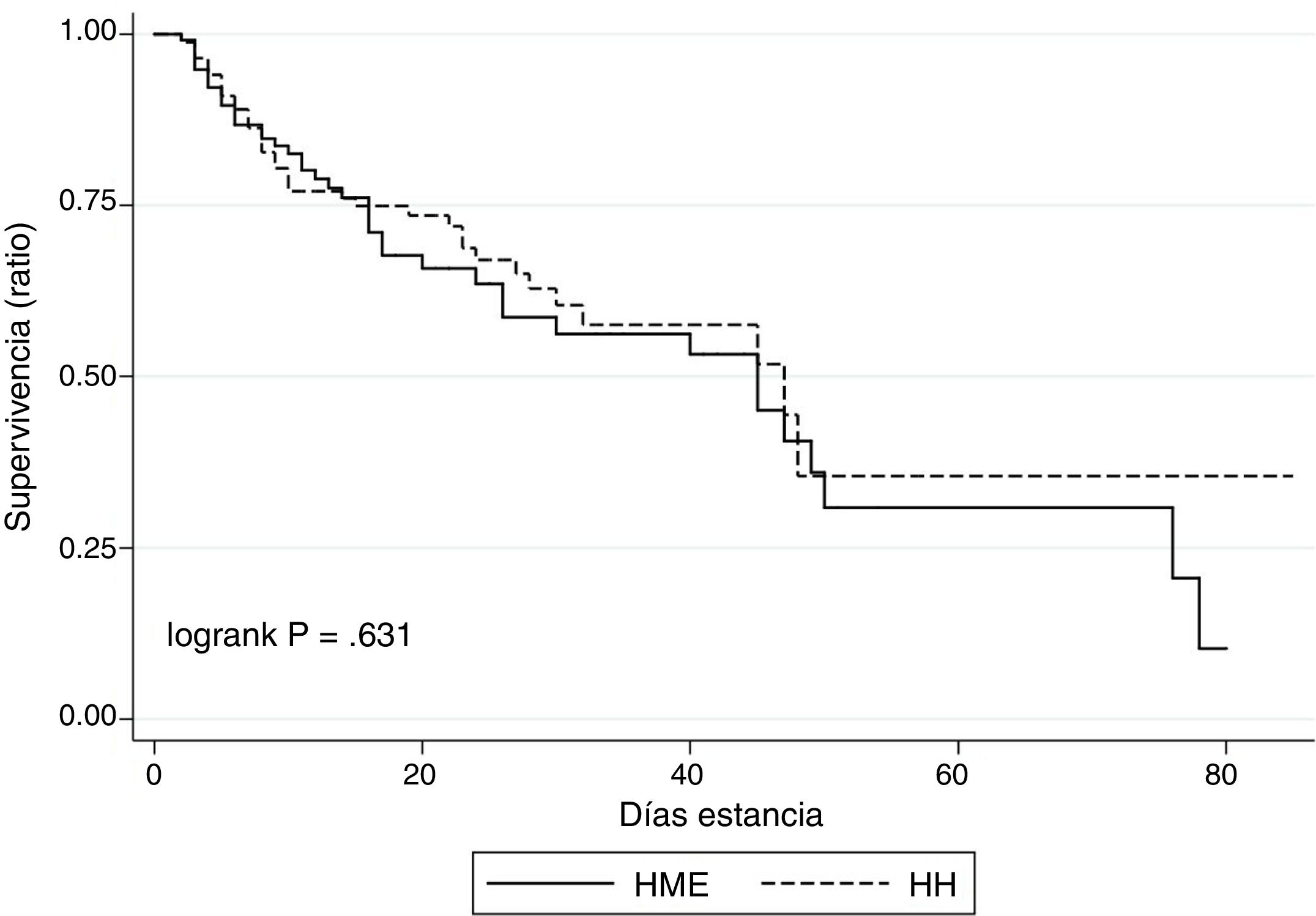
Se estimaron tasas de incidencia NAV y TAV por 1.000 días de VMI en ambos grupos, así como de NAV precoz y tardía, y se valoraron diferencias estadísticamente significativas mediante regresión Poisson contrastando la hipótesis de razón de tasas=1. Finalmente, se valoraron posibles diferencias entre grupos en la mortalidad intra-UCI. Para ello se dibujaron las curvas de supervivencia y se aplicó en test de log-rank.
Para el análisis estadístico se utilizó el programa STATA versión 15.1 (StataCorp, College Station, TX, EE. UU.). Se obtuvo la aprobación del CEIC 2018 del Hospital del Mar.
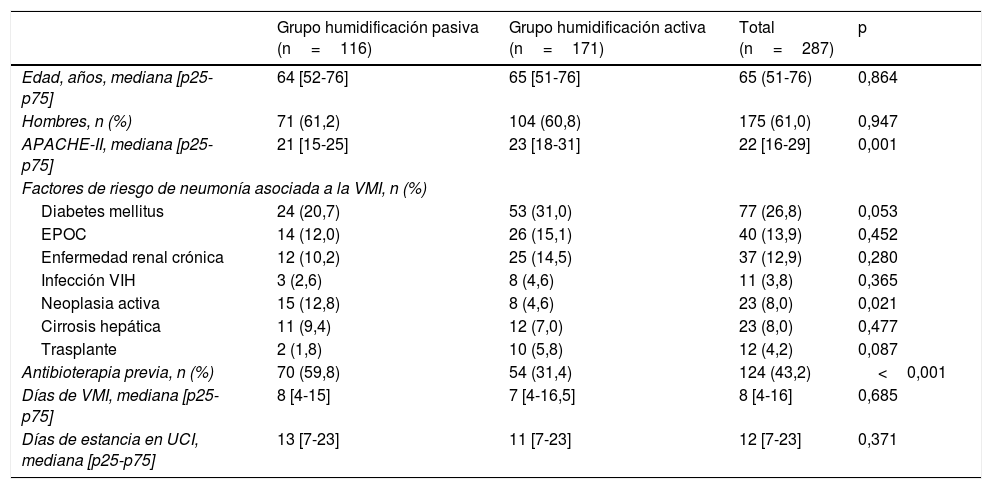
ResultadosSe analizaron 287 pacientes de los cuales 116 recibieron humidificación pasiva y 171 humidificación activa. Las características basales de los pacientes se muestran en la tabla 1. Los pacientes de ambos grupos presentaban características similares en cuanto a edad, sexo, escala APACHE-II, historia de diabetes mellitus, enfermedad pulmonar obstructiva crónica, enfermedad renal crónica, infección por el virus de la inmunodeficiencia humana, trasplante o neoplasia activa, días de ventilación mecánica y días de estancia en UCI. Se encontraron diferencias significativas en la prevalencia del diagnóstico de neoplasia activa y en la tasa de antibioterapia previa, definida como el inicio de tratamiento antibiótico en las 24horas previas al inicio de la ventilación mecánica invasiva, siendo ambos parámetros superiores en el grupo de HME.
Características basales de la población
| Grupo humidificación pasiva (n=116) | Grupo humidificación activa (n=171) | Total (n=287) | p | |
|---|---|---|---|---|
| Edad, años, mediana [p25-p75] | 64 [52-76] | 65 [51-76] | 65 (51-76) | 0,864 |
| Hombres, n (%) | 71 (61,2) | 104 (60,8) | 175 (61,0) | 0,947 |
| APACHE-II, mediana [p25-p75] | 21 [15-25] | 23 [18-31] | 22 [16-29] | 0,001 |
| Factores de riesgo de neumonía asociada a la VMI, n (%) | ||||
| Diabetes mellitus | 24 (20,7) | 53 (31,0) | 77 (26,8) | 0,053 |
| EPOC | 14 (12,0) | 26 (15,1) | 40 (13,9) | 0,452 |
| Enfermedad renal crónica | 12 (10,2) | 25 (14,5) | 37 (12,9) | 0,280 |
| Infección VIH | 3 (2,6) | 8 (4,6) | 11 (3,8) | 0,365 |
| Neoplasia activa | 15 (12,8) | 8 (4,6) | 23 (8,0) | 0,021 |
| Cirrosis hepática | 11 (9,4) | 12 (7,0) | 23 (8,0) | 0,477 |
| Trasplante | 2 (1,8) | 10 (5,8) | 12 (4,2) | 0,087 |
| Antibioterapia previa, n (%) | 70 (59,8) | 54 (31,4) | 124 (43,2) | <0,001 |
| Días de VMI, mediana [p25-p75] | 8 [4-15] | 7 [4-16,5] | 8 [4-16] | 0,685 |
| Días de estancia en UCI, mediana [p25-p75] | 13 [7-23] | 11 [7-23] | 12 [7-23] | 0,371 |
APACHE-II:Acute Physiology and Chronic Health Evaluation II; EPOC: enfermedad pulmonar obstructiva crónica; VIH: virus de la inmunodeficiencia humana; VMI: ventilación mecánica invasiva.
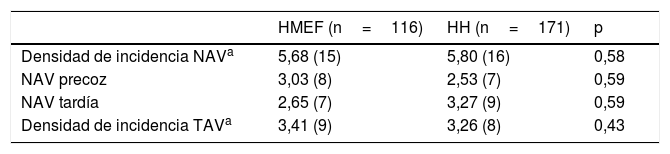
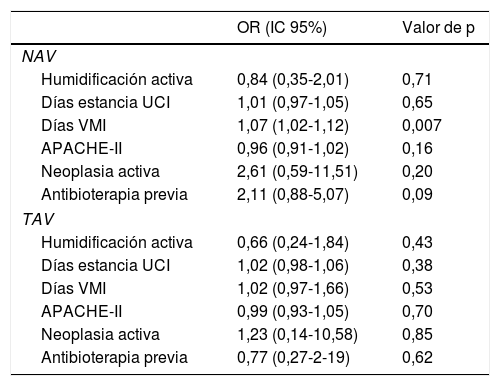
En la tabla 2 se muestra la densidad de incidencia de NAV y TAV según tipo de humidificador. En el análisis de regresión logística se identificó como único factor de riesgo para el desarrollo de infección asociada a la ventilación mecánica la duración de la VMI (OR 1,07 [IC 95%: 1,02-1,1]; p=0,007). La antibioterapia previa, aunque tampoco aumentó el riesgo de desarrollar NAV, sí presentó una tendencia a su incremento. No se identificó ningún factor de riesgo asociado con el desarrollo de TAV (tabla 3).
Densidad de incidencia de infección respiratoria asociada a la ventilación mecánica invasiva
| HMEF (n=116) | HH (n=171) | p | |
|---|---|---|---|
| Densidad de incidencia NAVa | 5,68 (15) | 5,80 (16) | 0,58 |
| NAV precoz | 3,03 (8) | 2,53 (7) | 0,59 |
| NAV tardía | 2,65 (7) | 3,27 (9) | 0,59 |
| Densidad de incidencia TAVa | 3,41 (9) | 3,26 (8) | 0,43 |
HH: heated-humidifiers; HMEF: heat and moisture exchangers; NAV: neumonía asociada a la ventilación; TAV: traqueobronquitis asociada a la ventilación; VMI: ventilación mecánica invasiva.
Análisis de regresión logística de factores de riesgo para NAV y TAV
| OR (IC 95%) | Valor de p | |
|---|---|---|
| NAV | ||
| Humidificación activa | 0,84 (0,35-2,01) | 0,71 |
| Días estancia UCI | 1,01 (0,97-1,05) | 0,65 |
| Días VMI | 1,07 (1,02-1,12) | 0,007 |
| APACHE-II | 0,96 (0,91-1,02) | 0,16 |
| Neoplasia activa | 2,61 (0,59-11,51) | 0,20 |
| Antibioterapia previa | 2,11 (0,88-5,07) | 0,09 |
| TAV | ||
| Humidificación activa | 0,66 (0,24-1,84) | 0,43 |
| Días estancia UCI | 1,02 (0,98-1,06) | 0,38 |
| Días VMI | 1,02 (0,97-1,66) | 0,53 |
| APACHE-II | 0,99 (0,93-1,05) | 0,70 |
| Neoplasia activa | 1,23 (0,14-10,58) | 0,85 |
| Antibioterapia previa | 0,77 (0,27-2-19) | 0,62 |
HH: heated-humidifiers; IC 95%: intervalo de confianza 95%; NAV: neumonía asociada a la ventilación; OR: odds ratio; TAV traqueobronquitis asociada a la ventilación; UCI: unidad cuidados intensivos; VMI: ventilación mecánica invasiva.
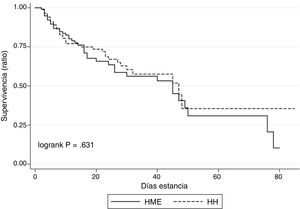
La tasa de mortalidad intra-UCI de la muestra fue del 31,6%, sin encontrar diferencias significativas entre la cohorte que empleó humidificación pasiva y activa (36,2% y 28,2% respectivamente; p=0,628). En la figura 1 se muestra el análisis de supervivencia intra-UCI (curvas de Kaplan-Meier).
A nivel microbiológico los microorganismos más frecuentes en ambos grupos fueron los bacilos gramnegativos, seguidos de los grampositivos, virus y hongos, tanto en los casos de NAV como de TAV. En 3 (20%) casos de ventilación con HME y en 5 (31,2%) casos de NAV se aisló Candida albicans en las muestras respiratorias, interpretado como colonización. En la tabla 4 se describen los microorganismos aislados.
Aislamiento en muestras respiratorias en los casos de NAV
| HME | HH | |
|---|---|---|
| NAV | ||
| Gram negativos, n (%) | 12 (48) | 13 (52) |
| Escherichia coli | 1 (4) | 1 (4) |
| Klebsiella pneumoniae | 3 (12) | 2 (8) |
| Enterobacter spp | 1 (4) | 1 (4) |
| Haemophilus influenzae | 1 (4) | 1 (4) |
| Stenotrophomonas maltophilia | 3 (12) | 1 (4) |
| Serratia marcescens | 1 (4) | 1 (4) |
| Providencia stuartii | 0 (0) | 1 (4) |
| Citrobacter freundii | 1 (4) | 0 (0) |
| Acinetobacter baumannii | 0 (0) | 1 (4) |
| Pseudomonas aeruginosa | 1 (4) | 2 (8) |
| Achromobacter xylosoxidans | 0 (0) | 2 (8) |
| Gram positivos, n (%) | 7 (28) | 5 (20) |
| Staphylococcus aureus meticilín-sensible | 3 (12) | 2 (8) |
| Staphylococcus aureus meticilín-resistente | 1 (4) | 1 (4) |
| Streptococcus pneumoniae | 1 (4) | 0 (0) |
| Streptococcus constellatus | 1 (4) | 0 (0) |
| Enterococcus faecalis | 1 (4) | 1 (4) |
| Enterococcus faecium | 0 (0) | 1 (4) |
| Virus, n (%) | 5 (20) | 3 (12) |
| Virus herpes simple tipo 1 | 3 (12) | 3 (12) |
| Citomegalovirus | 2 (8) | 0 (0) |
| Hongos, n (%) | 1 (4) | 4 (16) |
| Aspergillus fumigatus | 1 (4) | 1 (4) |
| Aspergillus flavus | 0 (0) | 2 (8) |
| Aspergillus niger | 0 (0) | 1 (4) |
| TAV | ||
| Gramnegativos, n (%) | 7 (70) | 9 (69,2) |
| Escherichia coli | 0 (0) | 3 (23,1) |
| Enterobacter spp. | 0 (0) | 1 (7,8) |
| Haemophilus influenzae | 2 (20) | 0 (0) |
| Serratia marcescens | 0 (0) | 2 (15,4) |
| Stenotrophomonas maltophilia | 1 (10) | 0 (0) |
| Pseudomonas aereuginosa | 3 (30) | 3 (23,1) |
| Proteus mirabillis | 1 (10) | 0 (0) |
| Grampositivos, n (%) | 2 (20) | 4 (30,7) |
| Staphylococcus aureus meticilín-sensible | 1 (10) | 2 (15,4) |
| Streptococcus pneumoniae | 1 (10) | 0 (0) |
| Streptococcus agalactiae | 0 (0) | 1 (7,8) |
| Enterococcus faecium | 0 (0) | 1 (7.8) |
| Virus, n (%) | 1 (10) | 0 (0) |
| Virus herpes simple tipo 1 | 1 (10) | 0 (0) |
HH: heated-humidifiers; HME: heat and moisture exchangers; NAV: neumonía asociada a la ventilación; TAV traqueobronquitis asociada a la ventilación.
Este estudio compara la influencia del tipo de humidificación empleada en la incidencia de NAV y TAV una vez instauradas todas las medidas incluidas en el Proyecto Nacional Neumonía Zero. Ningún estudio previo ha evaluado su impacto en la incidencia de TAV. La mayoría de estudios publicados datan de antes del año 2006, pocos son los estudios que posteriormente se han realizado y ninguno de ellos en el contexto de un programa de prevención. La evidencia más actual se basa en los metaanálisis publicados, que recogen estudios de hace más de 10 años que pueden no reflejar la situación actual tras las mejoras aplicadas en este campo y, además, se trata de estudios de baja calidad altamente heterogéneos en cuanto a los criterios utilizados en cuanto a la definición de neumonía se refiere10–14.
La NAV era la causa más frecuente de infección nosocomial en las UCI nacionales hasta la implantación del Proyecto Neumonía Zero15. Su importante impacto en la morbimortalidad, con un aumento asociado de estancia hospitalaria en una media de 7 a 9 días por paciente y mortalidad atribuible entre el 33% y el 50%16, justifica el interés continuo en el conocimiento de los factores que pueden influir en su fisiopatogenia y en la búsqueda de estrategias para su prevención. La TAV es un diagnóstico intermedio entre colonización traqueobronquial y la NAV y, aunque la bibliografía actualmente es contradictoria, está por determinar si se puede considerar como un paso evolutivo a NAV17.
Debido a la discordancia en las conclusiones de los estudios publicados, las guías y recomendaciones de las diferentes sociedades científicas, basadas en la evidencia disponible, no recomiendan qué tipo de humidificación es preferible para prevenir la NAV8,18. La humidificación pasiva presenta menor rendimiento en términos de calor y humedad respecto a la humidificación activa18. Una de las principales desventajas de los HME es el incremento del espacio muerto que depende principalmente del volumen interno del filtro, lo que podría suponer una carga difícil de tolerar en pacientes con baja reserva ventilatoria, especialmente relevante cuando la enfermedad obliga a implementar estrategias de ventilación protectora19–24. La mayor resistencia que pueden aportar los HME, aunque en ocasiones considerada despreciable, podría no ser así en el caso de acumulación de líquido por condensación o impactación de secreciones. Por otra parte, con el uso de los HH se ha descrito riesgo de lesión de la vía aérea por temperatura excesiva, limitación al flujo de aire por condensación en las tubuladuras, aparición de asincronías y posible colonización del circuito3,25,26.
El proyecto Neumonía Zero se inició en 2011 en 181UCI del territorio español. Con la implementación de las medidas incluidas se objetivó una reducción superior al 50% en la densidad de incidencia nacional de NAV (desde 9,83 a 4,34/1.000 días de VMI) tras 19-21 meses desde el inicio del proyecto. Dichos resultados se mantuvieron constantes en los años siguientes, lo que indica que las recomendaciones han sido incorporadas en la práctica diaria habitual de nuestras UCI27. Según el informe anual del registro ENVIN-HELICS (Estudio nacional de infección nosocomial en las unidades de cuidados intensivos), la densidad de incidencia de NAV en 2014 fue de 6,31/1.000 días de VMI y de 6,26/1.000 días de VMI en 201628. En nuestro estudio la densidad de incidencia para NAV durante el mismo periodo de tiempo se encuentra por debajo de dichos resultados, y se asemeja más a los resultados registrados por el registro Envin-Helics a nivel nacional en 2018 (5,87/1.000 días de VMI)28. Así mismo se encuentra por debajo del estándar de 7 episodios por 1.000 días de VMI recomendado en el año 2017 en los indicadores de calidad de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias29. Esto sugiere que nuestro grupo se encuentra altamente sensibilizado y que presenta una amplia experiencia en el control de la infección nosocomial en el paciente crítico. Por ello hemos querido evaluar, en este contexto, el posible impacto de 2 sistemas de humidificación en la incidencia no solo de NAV, sino también de TAV, sin encontrar diferencias en su densidad de incidencia, lo que confirma la seguridad de la humidificación activa en este ámbito.
En nuestros resultados destaca un mayor número de aislamientos de Aspergillus como causa de neumonía en el grupo de HH: 4 aislamientos en 3 pacientes del grupo HH y un aislamiento en un paciente del grupo HME, sin poder extraer conclusiones al respecto debido al pequeño tamaño de la muestra. Asimismo se aisló Candida albicans en 3 pacientes del grupo HME y 5 pacientes del grupo HH, considerado como colonización en todos los casos. Dicho aumento de aislamiento de hongos en los pacientes portadores de HH en nuestro estudio debe ser interpretado con cautela, y hacen falta estudios de calidad que certifiquen nuestros hallazgos.
El presente estudio tiene varias limitaciones. En primer lugar, el carácter cuasiexperimental, retrospectivo y unicéntrico de nuestro estudio conlleva lógicos problemas de validez externa. Además, el tamaño muestral no es grande, si bien se asemeja al de estudios similares publicados previamente. En segundo lugar, la prevalencia de neoplasia activa y de antibioterapia parenteral previa a la intubación era significativamente mayor en el grupo de HME, lo cual puede haber influenciado nuestros resultados. No obstante, ninguno de los 2 parámetros fue identificado como factor de riesgo para NAV y TAV en el análisis de regresión logística. En tercer lugar, el diagnóstico de NAV, si bien se realizó según los criterios del CDC, no se llevó a cabo mediante un procedimiento invasivo para todos los pacientes. Sin embargo, se emplearon cultivos cuantitativos de muestras como broncoaspirado, lavado broncoalveolar o catéter telescopado en todos los casos. Por último, destaca la baja tasa de densidad de incidencia de TAV encontrada en nuestra serie, probablemente relacionada con las dificultades para su diagnóstico clínico, pudiendo pasar desapercibida en ocasiones y pudiendo ser confundida con la NAV ante la presencia de infiltrados radiológicos de otras causas. No obstante, se intentó disminuir dicho sesgo mediante la revisión de cada caso por separado por 2 clínicos diferentes, e incluyendo la evaluación por un tercer clínico como revisor de desempate en caso de discordancia en la recogida de datos.
Nuestros datos sugieren que no existen diferencias entre los HME y los HH respecto a la incidencia de NAV ni TAV una vez implementado un paquete de medidas de prevención de NAV. Sin embargo, se necesitan estudios prospectivos de calidad que comparen los diferentes tipos de HME y HH con la finalidad de poder sacar conclusiones más firmes y útiles en la práctica clínica diaria.
Autoría- •
Lucía Picazo Moreno: diseño del estudio, adquisición de datos y redacción del borrador del artículo.
- •
M. Pilar Gracia Arnillas: diseño del estudio, interpretación de datos recogidos, revisión crítica del contenido intelectural y aprobación definitiva de la versión que se presenta.
- •
Rosana Muñoz-Bermúdez: análisis de los datos recogidos, revisión crítica del contenido intelectual, aprobación definitiva de la versión que se presenta.
- •
Xavier Durán: análisis de los datos recogidos, revisión crítica del contenido intelectual, aprobación definitiva de la versión que se presenta.
- •
Francisco Álvarez Lerma: interpretación de los datos recogidos, revisión crítica del contenido intelectual y aprobación definitiva de la versión que se presenta.
- •
Joan-Ramón Masclans: concepción y diseño del estudio, análisis e interpretación de los datos obtenidos, revisión crítica del contenido intelectual y aprobación definitiva de la versión que se presenta.
El grupo de investigación en el IMIM del Servicio de Medicina Intensiva del Hospital del Mar recibe apoyos a la investigación por parte de Fisher & Paykel.