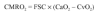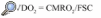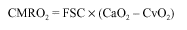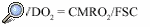INTRODUCCIÓN
En los últimos años, ante la disminución de la morbilidad y la mortalidad cardiológicas durante la cirugía cardíaca con circulación extracorpórea, se ha acrecentado el interés por las lesiones neurológicas que aparecen tras este tipo de cirugía.
Nos proponemos revisar de forma actualizada el tipo de alteraciones neurológicas y psicológicas que se producen durante la cirugía cardíaca, su epidemiología, los mecanismos fisiopatológicos que condicionan su aparición, así como el modo de monitorizar los parámetros cerebrales en este tipo de procedimientos quirúrgicos, los sistemas de protección neurológica y su aplicación durante la circulación extracorpórea.
La búsqueda bibliográfica se ha realizado a través de la base de datos electrónicos Medline (1966-2001) y la Cochrane Library (2001), a través de Internet.
LESIONES NEUROLÓGICAS DURANTE LA CIRUGÍA CARDÍACA
Los últimos años se han caracterizado por una mejora en los métodos de protección miocárdica durante la cirugía cardíaca con circulación extracorpórea (CEC), lo que se ha traducido en un claro descenso en la morbilidad y la mortalidad. Ello ha ocasionado un creciente interés por otros temas colaterales como la protección cerebral durante la CEC. Tras la cirugía cardíaca con CEC se ha descrito una incidencia de disfunción neuropsicológica en el 20-70% de los pacientes, registrándose lesiones neurológicas graves con accidente isquémico cerebral en el 2-5%1,2. Por otra parte, las complicaciones neurológicas han llegado a convertirse en una de las principales causas de morbilidad y mortalidad asociadas con este tipo de cirugía. Más de un 20% del total de muertes relacionadas con la cirugía cardíaca son debidas a esta causa1.
Aunque clásicamente se vio que las complicaciones neurológicas eran hasta dos veces más frecuentes en la cirugía valvular, en la que se abrían las cámaras cardíacas, en comparación con la cirugía de revascularización coronaria, estudios más recientes han evidenciado una mayor incidencia de complicaciones neurológicas en pacientes sometidos a cirugía de revascularización coronaria (11%) frente a los pacientes de cirugía valvular (7%)3. La causa parece estar en relación con la reciente introducción de la angioplastia coronaria transluminal percutánea (ACTP), que permite que muchos pacientes coronarios sean operados en fases más avanzadas de su enfermedad. Esta incidencia se dispara a un 16,6% en aquellos pacientes en los que se realiza cirugía combinada valvular y coronaria4.
Recientemente Taggart et al5 pusieron en duda el concepto clásico que consideraba la CEC como la principal responsable del daño neurológico que aparecía tras la cirugía cardíaca. Estos autores comparaban la función neuropsicológica en pacientes sometidos a cirugía de revascularización coronaria con CEC y sin CEC, antes de la cirugía, en el momento del alta y tres meses después, encontrando deterioros en las funciones cognitivas similares en ambos grupos. Estos datos se han confirmado posteriormente en un estudio más amplio6. En cambio, otros autores han observado una tendencia a la disminución de las complicaciones neurológicas al realizar cirugía de revascularización coronaria sin CEC, aunque sin diferencias estadísticamente significativas7,8. No obstante, no hay ningún trabajo hasta la fecha aleatorizado y prospectivo al respecto.
En un reciente estudio multicéntrico y prospectivo9 sobre 2.108 pacientes se establecieron dos categorías de daño neurológico: el tipo I, caracterizado por lesiones focales, estupor o coma, y el tipo II, en aquellos casos en los que aparecía deterioro de la función intelectual, disminución de la memoria o convulsiones. Del 6,1% de los pacientes que presentaron lesiones neurológicas, el 3,1% pertenecía al grupo I, y el 3,0%, al grupo II. Los pacientes con lesiones neurológicas tenían una mortalidad más alta (21% en el grupo I; 10% en el grupo II, y 2% en los pacientes sin lesiones neurológicas) y un tiempo de hospitalización más largo.
Lesiones neurológicas focales
La incidencia de infarto cerebral tras la CEC varía de un 2 a un 5%, incrementándose con la edad: de un 1% en pacientes entre los 51 y los 60 años hasta un 7% en los mayores de 75 años10.
El infarto cerebral suele ser evidente en cuanto el paciente despierta tras la cirugía. Un deterioro prolongado del estado de conciencia sugiere la existencia de infartos cerebrales múltiples. En la tomografía axial computarizada (TAC) cerebral aparecen pequeños infartos múltiples, habitualmente en la región parietooccipital o en el cerebelo, pero también en las regiones parasagitales de ambos hemisferios cerebrales. El factor de riesgo más importante de aparición de infarto cerebral tras la cirugía cardíaca es la embolización por placas de ateroma aórticas o burbujas de aire durante las maniobras de canulación o pinzamiento aórtico7,11. Se ha utilizado el ecocardiograma transesofágico para localizar el punto óptimo de canulación y disminuir la incidencia de lesiones neurológicas12.
Sin embargo, una peculiaridad de la lesión cerebral es que la localización puede ser más importante que su extensión13. Una lesión del hemisferio derecho debe ser tres veces mayor que una lesión del hemisferio izquierdo (dominante), en una localización anatómica homóloga, para ser evidente clínicamente. En modelos experimentales se ha visto que si se aumenta el flujo cerebral durante la CEC, se envían más émbolos al cerebro y se afecta la distribución de los mismos. Así, si la corteza cerebral es más activa metabólicamente durante el accidente embólico, las lesiones producirán alteraciones del comportamiento más evidentes que si afectan a la sustancia blanca subcortical13. Esto supone un problema añadido en la valoración y estudio de estas lesiones.
Las hemorragias cerebrales, al contrario que los infartos, son raras en el postoperatorio inmediato de la cirugía cardíaca. Los estudios más amplios publicados no registran casos de hemorragia3,4,9. En cambio, sí describen una alta incidencia de lesiones de nervios periféricos, hasta un 12% (el 58% de ellas eran lesiones del plexo braquial y el 42% restante, lesiones de otros nervios periféricos).
Daño neurológico difuso
La encefalopatía, caracterizada por la alteración del nivel de conciencia, con confusión y desorientación, acompañada con frecuencia por agitación, comportamiento paranoico y alucinaciones, corresponde a las lesiones de tipo II y puede llegar a afectar de un 18 a un 33% de los pacientes que se operan bajo CEC14. No obstante, estos cuadros se han descrito en un 9% de pacientes sometidos a otro tipo de cirugías15 y también en pacientes ingresados en unidades de cuidados intensivos (UCI). Estos cuadros son especialmente comunes entre los ancianos y en pacientes con enfermedades metabólicas o renales. Suelen ser autolimitados y habitualmente mejoran con la resolución de la enfermedad, el apoyo familiar, la restauración del ritmo circadiano normal y la vuelta a su entorno natural.
La TAC suele ser normal en estos cuadros. En cambio, la resonancia nuclear magnética (RNM) puede evidenciar un edema cerebral difuso a las pocas horas del final de la cirugía, que tiende a resolverse en los días siguientes16.
Alteraciones cognitivas
De un 33 a un 83% de los pacientes experimentan dificultades cognitivas tras la cirugía cardíaca14,17. Las funciones más frecuentemente afectadas son: memoria, capacidad de atención, concentración y ciertas habilidades motrices. En un estudio con 232 pacientes sometidos a cirugía de revascularización coronaria a los que se realizó un estudio cognitivo preoperatorio, se objetivó un empeoramiento cognitivo en el 66% de los pacientes en el momento del alta hospitalaria (6,2 [2,3] días, con un rango de 3 a 21 días). En un 34% persistía a las 6 semanas de la intervención y en un 19,4% se mantenía a los 6 meses18. Estos datos han sido corroborados posteriormente en otro trabajo19.
FISIOLOGIA CEREBRAL DURANTE LA CIRCULACION EXTRACORPOREA
Según el principio de Fick, el consumo metabólico de oxígeno cerebral (CMRO2) es el producto del flujo sanguíneo cerebral (FSC) por la diferencia entre el contenido arterial y venoso de oxígeno en el cerebro (CaO2 y CvO2). Por tanto, existe una relación directa entre el FSC y el CMRO2.
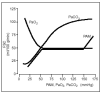
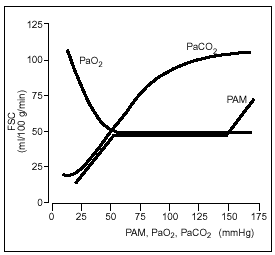
El cerebro tiene la capacidad de mantener el FSC a pesar de los cambios en la presión arterial media (PAM). Este fenómeno se denomina autorregulación. Entre unos límites de PAM de 50-140 mmHg no hay variaciones significativas del FSC, en tanto permanezca constante el CMRO21 (fig. 1).
Figura 1. Curvas de autorregulación cerebral. FSC: flujo sanguíneo cerebral; PAM: presión arterial media.
Si la PAM desciende por debajo de 50 mmHg, el FSC resulta gravemente comprometido, y si la PAM se eleva por encima del límite superior de autorregulación, el FSC se eleva rápidamente causando distensión o rotura de los vasos sanguíneos cerebrales, con edema cerebral o hemorragias graves1.
El FSC normal en adultos sanos es de 50 ml/ 100 g/min, y el CMRO2 oscila entre 3,4 y 3,5 ml/ 100 g/min. Durante la cirugía cardíaca con CEC en hipotermia, la anestesia per se origina un descenso del 50% del FSC; posteriormente, tras la entrada en CEC y secundariamente a la hemodilución aguda, aumenta el FSC a sus valores iniciales y, por último, por la hipotermia, desciende de nuevo un 50%.
El CMRO2, en cambio, se reduce a 1,5-2,0 ml/ 100 g/min antes de entrar en CEC (efecto de la anestesia per se), sin que se vea afectado por la he modilución. El CMRO2 disminuye exponencialmente con los descensos de temperatura (aproxima damente un 7% por cada grado centígrado que desciende la temperatura corporal) en la zona más lineal de la curva entre los 27 y los 37 °C de tem peratura corporal.
El FSC se mantiene durante la CEC a través del flujo de la máquina de CEC. Durante la CEC se mantiene la autorregulación flujo-presión1, por lo que, si el flujo de la máquina mantiene una adecuada PAM, el FSC no se verá afectado durante la CEC.
Existen dos tipos de flujo de las máquinas de CEC: flujo pulsátil y no pulsátil. Este último reduce el FSC y el CMRO2 de forma independiente y genera disfunción de la microvasculatura cerebral1. El flujo pulsátil, en cambio, puede minimizar estas alteraciones de la microcirculación cerebral durante la CEC, habiéndose obtenido beneficios en el pH cerebral, PaCO2, y PaO2, cuando se comparó20 con el flujo no pulsátil con flujos de 25 ml/kg/min. En casos de perfusiones con flujos bajos o con tiempos largos de perfusión, sería preferible la asistencia pulsátil20 frente a la no pulsátil.
Efecto de las diversas variables fisiológicas sobre el FSC y el CMRO2
El FSC varía linealmente con la presión arterial de CO2 (PaCO2) en un rango de 20-80 mmHg. En la tabla 1 se recoge el efecto de las diversas variables fisiológicas sobre el FSC.
Efecto de los agentes anestésicos sobre el FSC y el CMRO2
Los agentes anestésicos y la profundidad anestésica afectan al FSC y al CMRO2. El fentanilo y sufentanilo reducen ligeramente ambos parámetros, manteniendo intacta la autorregulación cerebral21. El midazolam reduce el FSC y el CMRO2 de manera dependiente de la dosis, al igual que los barbitú ricos, que a su vez aumentan las resistencias cerebrovasculares21. Los anestésicos por vía inhalatoria reducen el CMRO2, pero aumentan el FSC22, considerándose que producen abolición de la autorregulación metabólica. A concentraciones bajas (dos veces la concentración alveolar mínima) inducen un electroencefalograma (EEG) isoeléctrico17. El óxido nitroso también aumenta el FSC, alcanzando una meseta a partir de una concentración del 30%23, si bien no se emplea habitualmente durante la cirugía cardíaca por su efecto inotrópico negativo.
Efecto de otros fármacos no anestésicos sobre el FSC y el CMRO2
Si la PAM se mantiene dentro de los límites de la autorregulación, la utilización de vasoconstrictores y catecolaminas tiene poco efecto sobre el FSC y el CMRO21.
En cuanto a los vasodilatadores, se ha objetivado que el nitroprusiato no tiene efecto directo como vasodilatador cerebral durante la circulación extracorpórea con hipotermia moderada y anestesia con fentanilo24. La nitroglicerina a las dosis utilizadas habitualmente para la isquemia miocárdica carece de efecto sobre el FSC o el CMRO21 cuando la PAM se mantiene en los límites de la autorregulación.
FACTORES RELACIONADOS CON LA APARICION DE DAÑO NEUROLOGICO TRAS LA CIRUGIA CARDIACA
Categorizaremos los factores relacionados con la aparición de daño neurológico durante la cirugía cardíaca en dos grandes grupos: preoperatorios e intraoperatorios.
Factores clínicos preoperatorios
Hipertensión
La hipertensión incontrolada provoca un desplazamiento de la autorregulación del FSC a valores más elevados de PAM. Este proceso se desarrolla progresivamente en el tiempo, por lo que los pacientes toleran bien la hipertensión1. El tratamiento antihipertensivo prolongado, especialmente en pacientes jóvenes, puede revertir esta adaptación a la hipertensión25. La autorregulación presión-flujo vuelve a la normalidad después de varias semanas de tratamiento en pacientes hipertensos. No se sabe si estos cambios también son reversibles en pacientes ancianos25. En éstos se debe mantener una alta presión de perfusión, durante la CEC, para garantizar una perfusión cerebral adecuada. Hay algún estudio que demuestra que la hipertensión es un factor predictor de la aparición de lesiones neurológicas difusas en pacientes sometidos a CEC9, debido a la hipotensión relativa que se produce durante la CEC, entrando en una zona de PAM donde se pierde la autorregulación, disminuyendo linealmente el FSC al disminuir la presión26.
Diabetes insulinodependiente
Los pacientes diabéticos insulinodependientes, sometidos a CEC, tienen disfunción de la autorregulación entre el flujo y el metabolismo27. Croughwell et al27 demostraron que, en la fase de recalentamiento, los pacientes diabéticos eran incapaces de elevar el FSC, aumentando la extracción de oxígeno, al contrario que los no diabéticos.
Edad
La edad es uno de los principales factores de riesgo de presentación de lesiones neurológicas tras cirugía cardíaca9,10 y está asociada con disminuciones tanto del FSC como del CMRO2. En cambio, la respuesta de la circulación cerebral a los cambios de la presión arterial y de la PaCO2 no parece estar afectada28. Se desconoce el mecanismo por el cual aumenta el riesgo de lesión neurológica con la edad, pero parece relacionarse con la aparición de microémbolos, presencia de enfermedad cerebrovascular y alteraciones en la autorregulación cerebral1. Algunos autores dudan de esta relación entre la edad y una mayor incidencia de daño neurológico29.
Enfermedad cerebrovascular previa
Aunque se sabe que la presencia de enfermedad cerebrovascular previa, de accidentes isquémicos transitorios o de estenosis carotídea son importantes factores de riesgo9, no se ha logrado establecer un modo de mejorar el FSC en estos pacientes durante la CEC.
Se ha observado que la presencia de enfermedad isquémica cerebral previa altera los mecanismos de autorregulación cerebral. Pacientes con pequeños infartos cerebrales son incapaces de aumentar su FSC de forma compensadora durante la CEC30.
Factores clínicos intraoperatorios
Temperatura
El descenso de temperatura reduce considerablemente el FSC y el CMRO2. Se sabe que, de todos los factores que son manipulados durante la CEC (PPC, flujo de la bomba, PaCO2 y temperatura), es la temperatura el que más influencia tiene sobre el FSC31.
La hipotermia se utiliza como protección neurológica durante la CEC al reducir el metabolismo cerebral en un 7% por cada grado centígrado de descenso.
Debido a que la hipotermia disminuye el CMRO2 y la autorregulación del FSC está acoplada al metabolismo, la hipotermia también reduce el FSC. La reducción del FSC es lineal, mientras que la del CMRO2 es exponencial31. La relación FSC/CMRO2 aumenta al descender la temperatura, por lo cual en hipotermia moderada el FSC abastece con amplitud las necesidades metabólicas del cerebro31. En hipotermia moderada, la autorregulación presión-flujo se mantiene intacta.
En cambio, cuando se aplica hipotermia profunda a 15-20 °C, se observa un aumento en la relación FSC/CMRO2 y una pérdida de la autorregulación presión-flujo31.
Aunque la hipotermia ofrece protección contra la isquemia global, no siempre está presente en los períodos de mayor riesgo embolígeno (clampaje aórtico, canulación aórtica). No está claro su posible efecto protector frente a la isquemia focal1.
Manejo ácido-base. Ventajas e inconvenientes de los métodos alfa-stat y pH-stat
En hipotermia moderada se produce un aumento de la solubilidad del dióxido de carbono en soluciones acuosas. Por ello, la PaCO2 arterial disminuye un 4,5% y el pH aumenta 0,015 unidades por cada grado centígrado que desciende la temperatura corporal1. Cuando se analizan a bajas temperaturas los gases arteriales, el resultado global es un descenso de la PaCO2 y un aumento del pH ("alcalosis respiratoria").
Existen dos métodos para mantener el equilibrio ácido-base durante la CEC1. Hasta el comienzo de los años ochenta se intentaba corregir esta "alcalosis" introduciendo CO2 al paciente, a través de la máquina de CEC, para mantener un pH de 7,4 (método pH-stat). Actualmente se considera que esa "alcalosis respiratoria" es normal en hipotermia y no se corrige la PaCO2, dejándola evolucionar libremente (método alfa-stat). El manejo con el método alfa-stat añade las ventajas de mantener el pH intracelular cerebral en valores más normales, proteger la neutralidad intracelular electroquímica y mejorar la eficiencia de la función enzimática intracelular32.
¿Qué método es preferible durante la cirugía cardíaca cerebral? Depende. Hay varias causas que aconsejan la utilización del método pH-stat durante la parada circulatoria total con hipotermia profunda. El método pH-stat favorece el enfriamiento cerebral, debido probablemente a un aumento del FSC33, y prolonga el intervalo desde el comienzo de la parada circulatoria total, hasta la reducción de las reservas de oxígeno cerebral. En hipotermia profunda a 17 °C, el método pH-stat reduce el consumo de oxígeno cerebral un 30-40% más que el método alfa-stat34. Por el contrario, se ha evidenciado que en adultos sometidos a CEC con hipotermia moderada a 27 °C es preferible el método alfa-stat32, ya que el pronóstico neurológico y psicológico es ligeramente mejor17. No se conoce el mecanismo.
Flujo sistémico durante la circulación extracorpórea
El flujo sistémico durante la CEC se ajusta mediante la máquina de CEC, en función de la superficie corporal, el grado de hipotermia y la adecuada perfusión orgánica, evaluada por el consumo de oxígeno global, los gases arteriales y el equilibrio ácido-base49. Aunque habitualmente el flujo de la máquina de CEC se mantiene en un rango entre 1,6-2,4 l/min/m2 (40-70 ml/kg/min), no hay un acuerdo general sobre el nivel de flujo óptimo para mantener una perfusión cerebral adecuada en todas las situaciones clínicas1.
Presión de perfusión cerebral (PPC)
Asumiendo que la presión venosa central es 0 mmHg durante la CEC, y que la presión intracraneal es constante y normal, los cambios en la presión arterial media se correlacionarán directamente con los cambios en la PPC. Se ha demostrado que la autorregulación presión-flujo permanece intacta con una presión arterial media de 30 mmHg si se mantiene el equilibrio ácido-base por el método alfa-stat35. Dado que el transporte y el consumo de oxígeno en el cerebro tienen más importancia que la PPC en la mayoría de los pacientes durante la CEC, no sería necesaria la práctica habitual de mantener una presión de perfusión superior a 50 mmHg, utilizando vasoconstrictores35, exceptuando a aquellos pacientes con alteración de la autorregulación (hipertensos, diabéticos insulinodependientes, entre otros) o enfermedad cerebrovascular grave, al desconocerse el rango inferior de PPC que determinaría cambios en el FSC.
Hemodilución
La viscosidad de la sangre influye en el FSC a través de la ecuación de Hagen-Poiseuille, según la cual el flujo sanguíneo es inversamente proporcional a la viscosidad. Durante la CEC, la hemodilución disminuye la viscosidad, aumentando el FSC1 y permitiendo contrarrestar el aumento del flujo secundario a la aplicación de la hipotermia.
Sin embargo, es muy difícil establecer un "hematócrito óptimo" durante la CEC para asegurar un transporte de oxígeno y una reología sanguínea óptimas para la microcirculación.
Duración de la circulación extracorpórea
El efecto del tiempo de CEC sobre la perfusión cerebral es motivo de controversia. Aunque se ha observado una disminución del FSC en relación con el tiempo de CEC32, esta disminución no se acompaña de una reducción paralela en el CMRO2, lo que indica que la capacidad del FSC para adaptarse a las demandas metabólicas disminuye con la duración de la CEC36. En un estudio clínico reciente, el tiempo de CEC se correlacionaba directamente con la aparición de infartos cerebrales tras la cirugía4.
Tratamiento de la glucemia
Aunque los valores globales de glucemia no afectan directamente al FSC o al CMRO2 durante la CEC, la presencia de hiperglucemias en el momento de la isquemia neuronal podría aumentar el daño cerebral1. Cuando la demanda celular de oxígeno supera al aporte, se produce conversión anaeróbica de la glucosa a lactato. Algunos modelos experimentales de isquemia global han demostrado aumento del daño isquémico inducido por la glucosa37.
La cirugía cardíaca con CEC se asocia con una inhibición de la secreción de insulina e hiperglucemia38, lo que, sumado al riesgo de isquemia cerebral global o focal, convertiría el mantenimiento de la glucemia en límites normales en un objetivo prioritario. De todas formas, tampoco se ha podido demostrar convincentemente la asociación entre hiperglucemia y daño neurológico durante la CEC. Metz y Keats39 compararon la utilización de glucosa al 5% en la solución de cebado de la máquina de CEC, frente a soluciones sin glucosa. Aunque las glucemias eran tres o 4 veces superiores utilizando glucosa, no pudo demostrarse un aumento de la incidencia de lesiones neurológicas. Existen opiniones dispares sobre el control exhaustivo de la glucemia intraoperatoria durante la CEC. Hay autores a favor40 y en contra41.
Los diabéticos insulinodependientes pierden el equilibrio normal entre el flujo sanguíneo cerebral y el metabolismo durante la CEC con hipotermia y tendrían un riesgo elevado de isquemia ante bajas presiones de perfusión o bajos flujos1.
Liberación de mediadores inflamatorios
Recientemente se ha planteado que la liberación de mediadores inflamatorios durante la CEC, provocando en ocasiones un síndrome de respuesta inflamatoria sistémica, estaría relacionada con la aparición de daño neurológico tras la cirugía car díaca, al aparecer edema cerebral por cambios en la permeabilidad de la membrana hematoence fálica42.
Sin embargo, un estudio clínico fue incapaz de demostrar relación entre los valores de interleucina 6, factor del complemento C4 y marcadores de la fibrinólisis con la aparición de deterioro neuropsicológico43.
MONITORIZACION CEREBRAL Y SU APLICACION DURANTE LA CIRCULACION EXTRACORPOREA
Monitorización del FSC
Método indirecto de Kety-Schmidt
Es el método clásico de referencia1. Se basa en el principio de Fick. Requiere la administración de un marcador difusible, inerte e insoluble (133xenón, óxido nitroso). Cuanto mayor es el FSC, menor es el tiempo que tardan en equilibrarse las concentraciones arteriales y venosas del marcador utilizado.
Método del aclaramiento del 133xenón
Es un método simple y no invasivo, que se utiliza habitualmente para realizar las mediciones del FSC durante la CEC. Se ha comparado, con resultados positivos, con el método de Kety-Schmidt44. Consiste en la inyección de 133xenón en la circulación arterial. El FSC se calcula a partir del aclaramiento de partículas gamma del cerebro.
Doppler transcraneal
Se utiliza para valorar la circulación de los grandes vasos intracraneales111 mediante el principio Dop pler. Nuttall et al45 observaron durante la CEC que los cambios en la velocidad del FSC no se corre lacionaban con los métodos convencionales de medición.
Mediciones en la diferencia del contenido arteriovenoso de oxígeno (AVDO2)
Es la auténtica medición metabólica, determinada por la fórmula:
Los cambios en la extracción de oxígeno se reflejan en los cambios de la saturación arteriovenosa de la oxihemoglobina. La extracción cerebral normal de oxígeno es del 31,6%46.
Monitorización de la saturación venosa de oxígeno en el bulbo de la yugular (SjvO2)
La relación FSC/CMRO2 es proporcional a la SjvO247. Los valores normales oscilan entre el 54 y el 75%47. Se comenzó a monitorizar durante la CEC en 1992, observándose desaturación en la SjvO2 por debajo del 50% en la fase de recalentamiento en el 17-84% de los pacientes48-52. Esta desaturación llegó a asociarse con la aparición de disfunciones neuropsicológicas en el cuarto día del postoperatorio50. No obstante, esta relación no ha podido demostrarse en un estudio posterior53 en el que se valoraba el comportamiento cognitivo de los pacientes a los tres meses de la intervención. Se ha visto en pacientes con pequeños infartos cerebrales previos a la cirugía que estas desaturaciones eran significativamente mayores que en pacientes sin infarto cerebral previo54.
Se ha conjeturado que la causa de esta desaturación durante el recalentamiento residiría en una falta de acoplamiento entre el FSC y el CMRO2, probablemente por un aumento del CMRO2 en esta fase, sin una compensación adecuada en el FSC48,49,55. Sin embargo, recientemente han surgido otras posibles explicaciones, como la caída de la presión de perfusión que se produce durante la fase de recalentamiento56; o bien, por la hemodilución, la vasoconstricción secundaria a la hipocapnia y el desplazamiento a la izquierda de la curva de disociación de la oxihemoglobina durante la alcalosis y la hipotermia57. Dexter y Hindman57 proponían que, durante la hipotermia estable, el aumento en la SjvO2 no representaría una reducción en el CMRO2 con un exceso en el FSC, sino la incapacidad para mantener los requerimientos metabólicos, debido a un aumento de la afinidad de la hemoglobina por el oxígeno. La reducción de la SjvO2 en el recalentamiento no representaría necesariamente isquemia, por el contrario reflejaría la facilidad del oxígeno para ser transferido de la hemoglobina al cerebro. Sin embargo, Sapire et al51 ponen en duda esta hipótesis, ya que ellos observaron un aumento en la producción de lactato en un 58% de sus pacientes durante el recalentamiento, lo que apunta a un aporte inadecuado de oxígeno al cerebro, más que un desplazamiento de la curva de disociación de la hemoglobina, reforzado además porque ningún paciente presentaba aumento del lactato durante la fase de hipotermia.
No se ha establecido la utilidad real de la monitorización de la SjvO2 durante la cirugía cardíaca58 y, de hecho, no se monitoriza de forma habitual en todos los pacientes.
Monitorización de la saturación cerebral mediante espectroscopia cercana al infrarrojo (NIRS)
Es un método no invasivo que, mediante la absorción de luz a diferentes longitudes de onda en el rango cercano al infrarrojo, permite monitorizar las concentraciones en el tejido cerebral de oxihemoglobina, desoxihemoglobina, hemoglobina total y saturación de oxígeno de la hemoglobina12,59. Sin embargo, tiene varias limitaciones: la saturación cerebral que mide es una saturación mixta, arterial y venosa, fundamentalmente de pequeños vasos59, y por tanto no aporta información precisa y cuantitativa de la saturación venosa cerebral60.
Sólo un estudio observaba una buena correlación durante la CEC entre ambos métodos en la mayoría de los pacientes51, mientras que en el resto de los casos la correlación era muy pobre61.
Marcadores bioquímicos
S-100ß
Es una proteína de las células de la glía, ligada al calcio, cuya presencia en el plasma indicaría daño neuronal y aumento de la permeabilidad de la barrera hematoencefálica2. Se ha observado que alcanza un pico máximo al final de la CEC, con una vida media de eliminación de 130 min. Sus valores son superiores en la cirugía de revascularización coronaria con CEC frente a la misma cirugía sin CEC62,63, y también en la cirugía valvular comparada con la revascularización coronaria2.
Jonsonn et al64 observaron en 515 pacientes que la aparición de daño neurológico tras la CEC no se correlacionaba con la elevación temprana de la S-100ß, pero sí con los ascensos que aparecían entre las primeras 5 y 48 horas, tras la finalización de la cirugía.
Enolasa específica neuronal
Es la subunidad * de la enolasa, presente en el citoplasma neuronal, pero también en los eritrocitos y plaquetas, que se eleva en caso de hemólisis2. Aunque sus concentraciones se incrementan durante la CEC en la mayoría de los pacientes, esa persistencia tras las primeras 24 h del postoperatorio se asocia con la aparición de déficit neurológico65,66.
PROTECCION NEUROLOGICA DURANTE LA CIRUGIA CARDIACA
No farmacológicos
Hipotermia
Un descenso de la temperatura de 10 °C origina un descenso en el consumo de oxígeno cerebral de un 68%. Aunque la hipotermia y la anestesia general reducen el CMRO2, ambas actúan de forma independiente, siendo la hipotermia la que aporta una protección cerebral más significativa frente a la anoxia1. Se sabe que, al menos, parte del efecto neuroprotector de la hipotermia se debe a su acción sobre los mediadores de la isquemia67.
A principios de los años noventa se introdujeron las técnicas de cardioplejía hemática caliente con tinua en la cirugía de revascularización corona ria, operando en normotermia (33-35 °C) por sus beneficios sobre la función miocárdica68-70. En un estudio prospectivo69 de 1.732 pacientes sometidos a cirugía de revascularización coronaria y aleato rizados a CEC en normotermia o hipotermia, se observó una disminución de la presentación de bajo gasto y menores valores de isoenzimas cardíacas en el grupo de la normotermia, con una incidencia similar de infartos cerebrales en ambos grupos (el 1,6% en normotermia frente al 1,5% en hipotermia). Esto se ha confirmado en un estudio posterior con 2.585 pacientes, pero en este caso con la limitación de un diseño retrospectivo y no aleatorizado70. En cambio, otro estudio71 con 1.001 pacientes aleatorizados, aunque demostraba mejor protección miocárdica en el grupo de la cardioplejía caliente, encontró una tasa de infartos cerebrales significa tivamente mayor en el grupo de la normotermia frente a la hipotermia (un 3,1 frente a un 1,0%). La explicación puede residir en que la población de es te trabajo reunía más factores de riesgo neurológico, con mayor incidencia de pacientes diabéticos y/o con patología carotídea. Sin embargo, hay más evidencias a favor de la seguridad de la cirugía en normotermia, desde el punto de vista neurológico72,73.
Prevención del desprendimiento de placas de ateroma
Cada día parece más evidente la asociación de arteriosclerosis de la aorta ascendente con la aparición de infartos cerebrales en el postoperatorio, debidos al desprendimiento de las placas de ateroma durante las maniobras de canulación74. Hay estudios que resaltan la importancia de la ecocardiografía epiaórtica en la búsqueda de los lugares óptimos de canulación en este tipo de pacientes12. Utilizando incluso otros lugares alternativos de abordaje vascular (arteria axilar o subclavia), se logra disminuir la incidencia de infartos cerebrales12.
Prevención de microembolismos aéreos
Si bien el embolismo aéreo masivo durante la CEC es una incidencia muy rara, aumenta la evidencia clínica y experimental de que el embolismo cerebral por microburbujas de aire es común y podría asociarse con las lesiones neurológicas difusas, de forma dependiente de la dosis75. En un estudio sobre 374.819 intervenciones de cirugía extracorpórea hubo 429 casos de embolismo aéreo masivo, que causó daño neurológico permanente a 61 pacientes y otros 92 fallecieron76.
Según Kol et al77, en caso de sospecha de embolismo aéreo masivo durante la CEC, el paciente debe ser tratado con oxígeno hiperbárico lo más rápidamente posible, incluso antes de la aparición de síntomas neurológicos.
Otra posibilidad preventiva es la utilización de filtros en la línea arterial con el objetivo de atrapar las microburbujas y microagregados plaquetarios78, con lo que disminuye el número de embolismos aéreos detectados por Doppler transcraneal y mejora el pronóstico neuropsicológico79.
Hemodilución
La hemodilución isovolémica moderada mejora el pronóstico neurológico de la isquemia focal y global, mediante la reducción del hematócrito, máximo responsable de la viscosidad sanguínea80.
Perfusión cerebral durante la parada circulatoria total con hipotermia profunda
Se puede realizar perfusión cerebral retrógrada y anterógrada. La perfusión cerebral retrógrada, con hipotermia profunda y parada circulatoria total, consiste en la perfusión continua a través de la cava superior de suero frío con la idea de favorecer el aporte nutricional y garantizar el metabolismo cerebral durante la parada circulatoria total81,31. No se ha podido demostrar que disminuya realmente la incidencia de lesiones neurológicas81.
La perfusión cerebral selectiva anterógrada se realiza canulando ambas arterias carótidas, comunes e innominadas, y perfundiendo sangre con otra bomba independiente. Permite hacer parada circulatoria total a 25 °C, prolongando el "tiempo de seguridad neurológica" de la parada total. Varios estudios demuestran una reducción de las complicaciones cerebrales82,83.
Farmacológicos
Barbitúricos
Actúan disminuyendo el CMRO2 y el FSC, sobre el metabolismo de los ácidos grasos y sobre los radicales libres21. En un estudio, en el que se administró el barbitúrico previamente al inicio de la cirugía hasta alcanzar un electroencefalograma isoeléctrico, no pudo demostrarse una disminución de las complicaciones neurológicas tras la CEC84.
Antagonistas del calcio
La isquemia aumenta la concentración del calcio intracelular, desencadenando vasospasmo y agregación plaquetaria. Al administrar nimodipino a pacientes sometidos a CEC, los pacientes tratados presentaban mejores resultados en los tests verbales y visuales al cabo de 6 meses que el grupo control85. Sin embargo, en otro estudio se detectó un aumento de la mortalidad relacionada con aumento de la hemorragia en pacientes tratados con nimodipino y sometidos a recambio valvular86. No obstante, ambos estudios no son comparables, ya que la pauta de administración era diferente: en el primero se administró durante el intraoperatorio por vía intravenosa85, mientras que en el segundo los pacientes fueron tratados por vía oral y desde las 12 h previas a la intervención hasta el quinto día de postoperatorio86.
El nicardipino, otro antagonista del calcio, ha ofrecido resultados prometedores en modelos de isquemia cerebral al administrarlo en perros, aunque otros estudios indican que no es capaz de mantener la autorregulación cerebral87.
Gangliósido GM1
Son glicofosfolípidos que actuarían como neuroprotectores, en la isquemia focal y global67, modificando la respuesta de la membrana neuronal a diversas señales67. En un estudio realizado en cirugía cardíaca no se encontraron diferencias en los tests psicológicos a los 6 meses, al compararlo con placebo88.
Aprotinina
Es un fármaco antifibrinolítico que se ha utilizado en los últimos años para disminuir la hemorragia en la cirugía cardíaca. En un estudio realizado en cerdos, durante CEC con hipotermia profunda y parada circulatoria total, se observó que, tras 60 min de parada a 15 °C, la recuperación del metabolismo cerebral y el grado de edema fueron significativamente mejores en el grupo tratado con aprotinina frente al grupo control89.
Propofol
Es un agente anestésico que disminuye, simultáneamente y de forma equitativa, el CMRO2 y el FSC durante la CEC90. No obstante, se ha observado que su utilización en una dosis suficiente como para suprimir el electroencefalograma no reduce el daño neurológico durante la cirugía valvular91.
Lidocaína
Mitchell et al92 demostraron que la lidocaína en perfusión durante 48 h, a dosis antiarrítmica habitual, comenzando en la inducción anestésica, mejoraba el pronóstico neuropsicológico en los pacientes intervenidos de cirugía valvular.
Actuaría protegiendo a las neuronas del daño isquémico, evitando la producción de los aminoácidos excitatorios extracelulares aspartato, glutamato, glicina y taurina, e impidiendo la liberación de calcio intracelular92.
Antagonistas del glutamato
La inhibición de la liberación del glutamato neuronal con lamotrigina no disminuye la producción de S-100ß, la recuperación electroencefalográfica y el lactato cerebral en cerdos sometidos a CEC normotérmica93.
En cambio, la remacemida, otro antagonista del glutamato, tenía efectos beneficiosos en la función cognitiva de 171 pacientes intervenidos con cirugía de revascularización coronaria94.
Otros fármacos
Hay otros fármacos que también parecen tener un papel neuroprotector en la isquemia cerebral, pero no hay trabajos publicados durante la cirugía cardíaca con CEC. Entre ellos destacan los eliminadores de radicales libres, los bloqueadores de los canales de sodio, los bloqueadores del receptor NMDA (ketamina y MK-801) y el dextrometorfano.
CONCLUSIONES
Aunque cada vez se conocen más a fondo los mecanismos fisiopatológicos que condicionan la aparición de déficit neuropsicológicos tras la cirugía cardíaca, no existen datos concluyentes sobre los sistemas de monitorización y protección neurológica eficaces para prevenir estas disfunciones. Los estudios publicados hasta el momento tienen la limitación de su pequeño tamaño muestral.
Confiemos en poder afirmar, dentro de pocos años, que las lesiones neurológicas tras la cirugía cardíaca quedaron arrumbadas en los libros de historia de la medicina. De momento, como afirma Ricksten2, parece que avanzamos en la dirección adecuada, pero no lo suficientemente rápido.