Las infecciones se han convertido en una de las principales complicaciones de los pacientes con neumonía grave por SARS-CoV-2 que ingresan en UCI. El deficiente estado inmunitario, el desarrollo frecuente de fracaso orgánico con necesidad de tratamientos de soporte invasivos y las estancias prolongadas en áreas estructurales en gran medida saturadas de enfermos son factores de riesgo para el desarrollo de infecciones. El Grupo de Trabajo de Enfermedades Infecciosas y Sepsis GTEIS de la Sociedad Española de Medicina Intensiva y Unidades Coronarias SEMICYUC enfatiza la importancia de las medidas de prevención de infecciones relacionadas con los cuidados sanitarios, y de la detección y tratamiento precoz de las principales infecciones en el paciente con infección por SARS-CoV-2. La coinfección bacteriana, las infecciones respiratorias relacionadas con la ventilación mecánica, bacteriemia relacionada con el catéter, infección del tracto urinario asociado a dispositivo e infecciones oportunistas son desarrolladas.
Infections have become one of the main complications of patients with severe SARS-CoV-2 pneumonia admitted in ICU. Poor immune status, frequent development of organic failure requiring invasive supportive treatments, and prolonged ICU length of stay in saturated structural areas of patients are risk factors for infection development. The Working Group on Infectious Diseases and Sepsis GTEIS of the Spanish Society of Intensive Medicine and Coronary Units SEMICYUC emphasizes the importance of infection prevention measures related to health care, the detection and early treatment of major infections in the patient with SARS-CoV-2 infections. Bacterial co-infection, respiratory infections related to mechanical ventilation, catheter-related bacteremia, device-associated urinary tract infection and opportunistic infections are review in the document.
Acabamos de sobrepasar un año tras la descripción de los primeros casos de infección respiratoria por el coronavirus
SARS-CoV-21. El registro nacional COVID-19/SEMICYUC de los casos ingresados en las UCI españolas ha puesto de manifiesto un alto porcentaje de pacientes que desarrollan fracaso orgánico (100% respiratoria, 44% cardiovascular y 30% renal), estancias en UCI prolongadas (14 días [8-26]) y una mortalidad del 32,6% según los resultados de los primeros 2200 pacientes publicados2. Potere et al. en una revisión sistemática y metaanálisis de las primeras series de pacientes en UCI documentan una mortalidad del 34% que asciende hasta el 83% en los enfermos con ventilación mecánica3, significativamente mayor a la observada en el registro COVID-19/SEMICYUC2.
Podemos afirmar que los tratamientos empíricos y con escasa evidencia científica que se utilizaron en las fases iniciales de la pandemia desafortunadamente no han demostrado beneficios ni han modificado el curso ominoso de los casos graves atendidos en UCI4. Así mismo, los primeros datos aportados por el registro ENVIN-COVID, a partir del análisis de 1.525 pacientes COVID ingresados en UCI entre el 15 de marzo y 30 de mayo han demostrado que el 50% de ellos han presentado una o más infecciones relacionadas con la asistencia sanitaria y que las tasas de las distintas infecciones controladas se han multiplicado entre dos y cuatro veces (Informe ENVIN-COVID, 20205. Por ello, parece prudente enfatizar en las medidas de prevención de infecciones en la UCI, y en la detección precoz de las mismas con la intención de aplicar medidas de tratamiento adecuadas y precoces en el difícil reto de combatir la alta mortalidad asociada.
Con dicho objetivo el Grupo de Trabajo de Enfermedades infecciosas y Sepsis (GTEIS) de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) en la última reunión ordinaria celebrada acordó realizar una búsqueda bibliográfica del estado del arte actual y emitir unas recomendaciones de tratamiento emitidas por los autores de este documento que fueron escogidos por los coordinadores del Grupo de Trabajo en base a su experiencia en patología infecciosa.
Papel de los tratamientos inmunomoduladores en la infección nosocomialDurante los primeros meses de pandemia la reducción de una respuesta inmune disregulada se consideró una diana terapéutica potencial. Para ello, y aún sin evidencia científica clara se utilizaron con frecuencia múltiples fármacos antiinflamatorios e inmunomoduladores, tales como: glucocorticoides, bloqueantes de interleuquinas y/o sus receptores, antimaláricos, antimitóticos, inhibidores de calcineurina, etc. Sin embargo, estos fármacos no están exentos de efectos secundarios, siendo uno de los más graves la predisposición a la aparición de superinfecciones en el ámbito hospitalario.
El conocimiento respecto al efecto de los corticoides sobre el desarrollo de sobreinfecciones en estos pacientes con infección por SARS-CoV-2 es actualmente limitado. El metaanálisis de los ensayos clínicos que, hasta la fecha, han evaluado el empleo de corticoides en los pacientes críticos con infección por SARS-CoV-2 realizado por la Organización Mundial de la Salud llegó a la conclusión de que los estudios incluidos en el mismo aportaban escasos datos sobre los efectos adversos y que no podía realizarse un metaanálisis sobre los mismos6. Sin embargo, algunos trabajos sugieren que el empleo de corticoides puede asociarse a un incremento en la incidencia de determinadas infecciones como bacteriemias, especialmente cuando estos se asocian a otros inmunosupresores7.
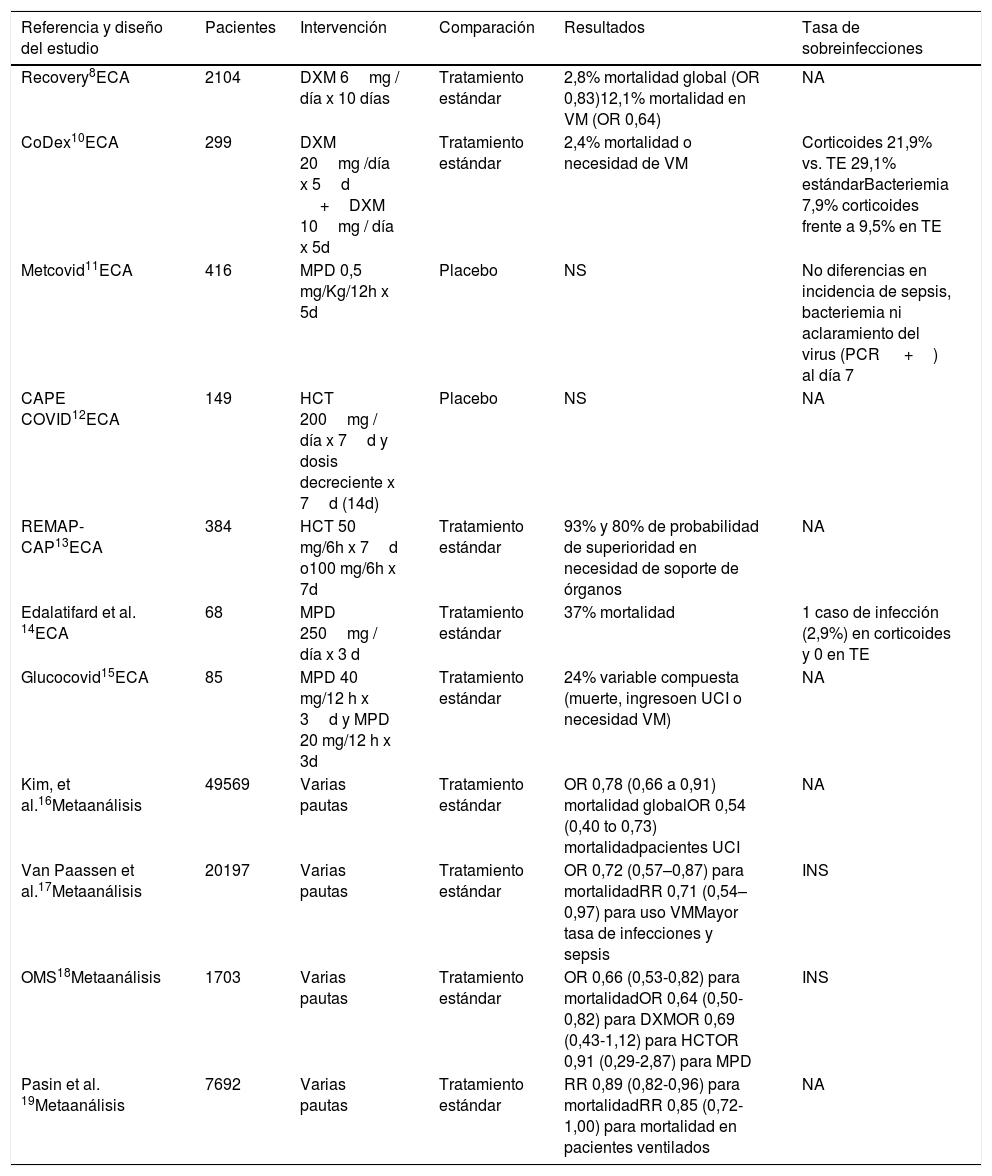
En base a la evidencia existente en el momento de redacción de este documento y siguiendo las pautas propuestas, entre otros por la Organización Mundial de la Salud, se recomienda el uso de corticosteroides, preferentemente dexametasona, para el tratamiento de pacientes con formas graves de COVID-198. Debe tenerse en cuenta que, aunque pacientes con grados más leves de insuficiencia respiratoria podrían beneficiarse de este tratamiento el máximo beneficio se ha observado en los pacientes críticos con ventilación mecánica (OR 0,66 [IC 95%, 0,53-0,82]). Monedero et al.9 han documentado que la administración de corticoides de forma precoz, antes de las primeras 48h de estancia en UCI, se asocia con menor riesgo de infección nosocomial (56,3% casos; OR 1,39, p=0,05) que aquellos que los reciben de forma más tardía (69,9% casos; OR=2,5 p<0,001) si bien el riesgo de infección es aún menor en aquellos pacientes que nunca recibieron el fármaco (48,2% de casos, OR=1). En la tabla 110–19 se detallan los principales estudios sobre uso de corticoides y su asociación con el desarrollo de infecciones. Respecto al corticoide a emplear y la dosis, se recomienda preferentemente el uso de dexametasona, a dosis de 6 a 7,5mg/día entre 7 y 10 días, al ser el principio activo utilizado en más estudios y el que ha demostrado un beneficio clínico estadísticamente significativo8.
Resumen de estudios que evalúan el efecto de los corticoides en la neumonía por SARS-CoV-2. Diseño, desenlace clínico y asociación con el desarrollo de infección
| Referencia y diseño del estudio | Pacientes | Intervención | Comparación | Resultados | Tasa de sobreinfecciones |
|---|---|---|---|---|---|
| Recovery8ECA | 2104 | DXM 6mg / día x 10 días | Tratamiento estándar | 2,8% mortalidad global (OR 0,83)12,1% mortalidad en VM (OR 0,64) | NA |
| CoDex10ECA | 299 | DXM 20mg /día x 5d +DXM 10mg / día x 5d | Tratamiento estándar | 2,4% mortalidad o necesidad de VM | Corticoides 21,9% vs. TE 29,1% estándarBacteriemia 7,9% corticoides frente a 9,5% en TE |
| Metcovid11ECA | 416 | MPD 0,5 mg/Kg/12h x 5d | Placebo | NS | No diferencias en incidencia de sepsis, bacteriemia ni aclaramiento del virus (PCR +) al día 7 |
| CAPE COVID12ECA | 149 | HCT 200mg / día x 7d y dosis decreciente x 7d (14d) | Placebo | NS | NA |
| REMAP-CAP13ECA | 384 | HCT 50 mg/6h x 7d o100 mg/6h x 7d | Tratamiento estándar | 93% y 80% de probabilidad de superioridad en necesidad de soporte de órganos | NA |
| Edalatifard et al. 14ECA | 68 | MPD 250mg / día x 3 d | Tratamiento estándar | 37% mortalidad | 1 caso de infección (2,9%) en corticoides y 0 en TE |
| Glucocovid15ECA | 85 | MPD 40 mg/12 h x 3d y MPD 20 mg/12 h x 3d | Tratamiento estándar | 24% variable compuesta (muerte, ingresoen UCI o necesidad VM) | NA |
| Kim, et al.16Metaanálisis | 49569 | Varias pautas | Tratamiento estándar | OR 0,78 (0,66 a 0,91) mortalidad globalOR 0,54 (0,40 to 0,73) mortalidadpacientes UCI | NA |
| Van Paassen et al.17Metaanálisis | 20197 | Varias pautas | Tratamiento estándar | OR 0,72 (0,57–0,87) para mortalidadRR 0,71 (0,54–0,97) para uso VMMayor tasa de infecciones y sepsis | INS |
| OMS18Metaanálisis | 1703 | Varias pautas | Tratamiento estándar | OR 0,66 (0,53-0,82) para mortalidadOR 0,64 (0,50-0,82) para DXMOR 0,69 (0,43-1,12) para HCTOR 0,91 (0,29-2,87) para MPD | INS |
| Pasin et al. 19Metaanálisis | 7692 | Varias pautas | Tratamiento estándar | RR 0,89 (0,82-0,96) para mortalidadRR 0,85 (0,72-1,00) para mortalidad en pacientes ventilados | NA |
d: días; DXM: dexametasona; ECA: ensayo clínico aleatorizado; HCT: hidrocortisona; INS: información insuficiente; MPD: metilprednisolona; NA: no aporta datos; NS: no significativo; OR: odds ratio; P: placebo; RR: riesgo relativo; VM: ventilación mecánica.
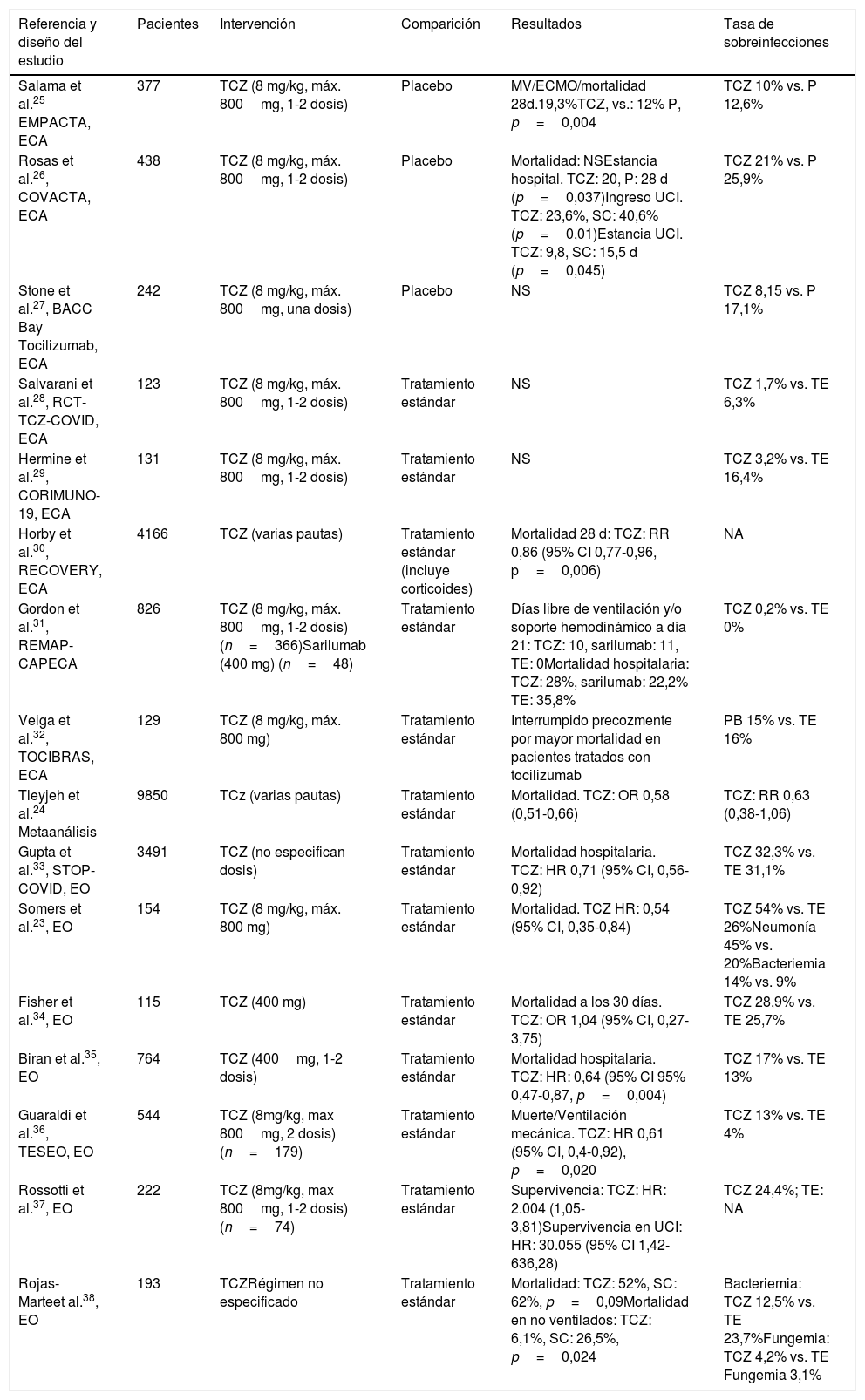
Su uso se justifica en que podría disminuir el componente inflamatorio asociado a la COVID-19, pero a su vez podría interferir en la respuesta inmunitaria frente a replicación viral (efecto perjudicial). Por ello, su indicación en esta patología resulta comprometida existiendo evidencia tanto a favor como en contra. El principal efecto secundario del fármaco es la predisposición al desarrollo de infecciones. Datos procedentes de la experiencia poscomercialización objetivaron cómo la complicación más frecuente fue la presencia de infecciones del tracto respiratorio superior, incluidas neumonías (>10% de pacientes) seguido de celulitis y reactivaciones herpéticas (1-10%) y más raramente diverticulitis (<1%)20,21. Un 3-7% de pacientes puede sufrir un cuadro infeccioso potencialmente grave22. En el contexto de la COVID-19, en un reciente trabajo Somers et al.23 evidencian cómo la administración de tocilizumab, en una cohorte de 154 pacientes con ventilación mecánica, se asoció con una mayor proporción de sobreinfecciones (54% frente a 26%; p <0,001). El foco neumónico (45%) y la bacteriemia (14%) fueron los más frecuentes, mientras que el germen más frecuentemente aislado fue Staphylococcus aureus(S. aureus) (51% de casos) pero sin diferencia en la tasa de letalidad a 28 días entre los pacientes tratados con tocilizumab con o sin superinfección [22% vs. 15%; p=0,42]. Sin embargo, en la mayoría de los estudios no se observa una mayor incidencia de infección en aquellos pacientes que recibieron el fármaco. En el mayor metaanálisis publicado, Tleyjeh et al. con 9850 pacientes24, el uso de tocilizumab no presentó una mayor tasa de infección nosocomial que el grupo control y sí se asoció a una menor tasa de mortalidad y/o necesidad de ventilación mecánica. En el mayor ensayo clínico realizado hasta el momento, el estudio RECOVERY, observan una disminución de la mortalidad [RR 0,86 (95% CI 0,77-0,96, p=0,006)], en el subgrupo de pacientes que recibió tocilizumab con PCR>75 y pulsioximetría <92%. Es de reseñar que el 82% de pacientes recibieron corticoides en ambos brazos y no aportan datos sobre la incidencia de infección nosocomial. En la tabla 2 se exponen los principales estudios sobre tocilizumab y su relación con la aparición de infecciones25–38.
Resumen de estudios que evalúan el efecto de tocilizumab en la neumonía por SARS-CoV-2: diseño, desenlace clínico y asociación con el desarrollo de infección
| Referencia y diseño del estudio | Pacientes | Intervención | Comparición | Resultados | Tasa de sobreinfecciones |
|---|---|---|---|---|---|
| Salama et al.25 EMPACTA, ECA | 377 | TCZ (8 mg/kg, máx. 800mg, 1-2 dosis) | Placebo | MV/ECMO/mortalidad 28d.19,3%TCZ, vs.: 12% P, p=0,004 | TCZ 10% vs. P 12,6% |
| Rosas et al.26, COVACTA, ECA | 438 | TCZ (8 mg/kg, máx. 800mg, 1-2 dosis) | Placebo | Mortalidad: NSEstancia hospital. TCZ: 20, P: 28 d (p=0,037)Ingreso UCI. TCZ: 23,6%, SC: 40,6% (p=0,01)Estancia UCI. TCZ: 9,8, SC: 15,5 d (p=0,045) | TCZ 21% vs. P 25,9% |
| Stone et al.27, BACC Bay Tocilizumab, ECA | 242 | TCZ (8 mg/kg, máx. 800mg, una dosis) | Placebo | NS | TCZ 8,15 vs. P 17,1% |
| Salvarani et al.28, RCT-TCZ-COVID, ECA | 123 | TCZ (8 mg/kg, máx. 800mg, 1-2 dosis) | Tratamiento estándar | NS | TCZ 1,7% vs. TE 6,3% |
| Hermine et al.29, CORIMUNO-19, ECA | 131 | TCZ (8 mg/kg, máx. 800mg, 1-2 dosis) | Tratamiento estándar | NS | TCZ 3,2% vs. TE 16,4% |
| Horby et al.30, RECOVERY, ECA | 4166 | TCZ (varias pautas) | Tratamiento estándar (incluye corticoides) | Mortalidad 28 d: TCZ: RR 0,86 (95% CI 0,77-0,96, p=0,006) | NA |
| Gordon et al.31, REMAP-CAPECA | 826 | TCZ (8 mg/kg, máx. 800mg, 1-2 dosis)(n=366)Sarilumab (400 mg) (n=48) | Tratamiento estándar | Días libre de ventilación y/o soporte hemodinámico a día 21: TCZ: 10, sarilumab: 11, TE: 0Mortalidad hospitalaria: TCZ: 28%, sarilumab: 22,2% TE: 35,8% | TCZ 0,2% vs. TE 0% |
| Veiga et al.32, TOCIBRAS, ECA | 129 | TCZ (8 mg/kg, máx. 800 mg) | Tratamiento estándar | Interrumpido precozmente por mayor mortalidad en pacientes tratados con tocilizumab | PB 15% vs. TE 16% |
| Tleyjeh et al.24 Metaanálisis | 9850 | TCz (varias pautas) | Tratamiento estándar | Mortalidad. TCZ: OR 0,58 (0,51-0,66) | TCZ: RR 0,63 (0,38-1,06) |
| Gupta et al.33, STOP-COVID, EO | 3491 | TCZ (no especifican dosis) | Tratamiento estándar | Mortalidad hospitalaria. TCZ: HR 0,71 (95% CI, 0,56-0,92) | TCZ 32,3% vs. TE 31,1% |
| Somers et al.23, EO | 154 | TCZ (8 mg/kg, máx. 800 mg) | Tratamiento estándar | Mortalidad. TCZ HR: 0,54 (95% CI, 0,35-0,84) | TCZ 54% vs. TE 26%Neumonía 45% vs. 20%Bacteriemia 14% vs. 9% |
| Fisher et al.34, EO | 115 | TCZ (400 mg) | Tratamiento estándar | Mortalidad a los 30 días. TCZ: OR 1,04 (95% CI, 0,27-3,75) | TCZ 28,9% vs. TE 25,7% |
| Biran et al.35, EO | 764 | TCZ (400mg, 1-2 dosis) | Tratamiento estándar | Mortalidad hospitalaria. TCZ: HR: 0,64 (95% CI 95% 0,47-0,87, p=0,004) | TCZ 17% vs. TE 13% |
| Guaraldi et al.36, TESEO, EO | 544 | TCZ (8mg/kg, max 800mg, 2 dosis) (n=179) | Tratamiento estándar | Muerte/Ventilación mecánica. TCZ: HR 0,61 (95% CI, 0,4-0,92), p=0,020 | TCZ 13% vs. TE 4% |
| Rossotti et al.37, EO | 222 | TCZ (8mg/kg, max 800mg, 1-2 dosis) (n=74) | Tratamiento estándar | Supervivencia: TCZ: HR: 2.004 (1,05-3,81)Supervivencia en UCI: HR: 30.055 (95% CI 1,42-636,28) | TCZ 24,4%; TE: NA |
| Rojas-Marteet al.38, EO | 193 | TCZRégimen no especificado | Tratamiento estándar | Mortalidad: TCZ: 52%, SC: 62%, p=0,09Mortalidad en no ventilados: TCZ: 6,1%, SC: 26,5%, p=0,024 | Bacteriemia: TCZ 12,5% vs. TE 23,7%Fungemia: TCZ 4,2% vs. TE Fungemia 3,1% |
d: días; ECA: ensayo clínico aleatorizado; ECMO: oxigenación con membrana extracorpórea; EO: estudio observacional; INS: información insuficiente; NA: no aporta datos; NS: no significativo; OR: odds ratio; P: placebo; RR: riesgo relativo; TCZ: tocilizumab; VM: ventilación mecánica; VNI: ventilación no invasiva.
Finalmente, es necesario recordar que el fármaco produce inhibición de los reactantes de fase aguda de síntesis hepática tales como la proteína C reactiva39, lo que limita el valor de estos en el diagnóstico y respuesta al tratamiento de la infección nosocomial y la sepsis.
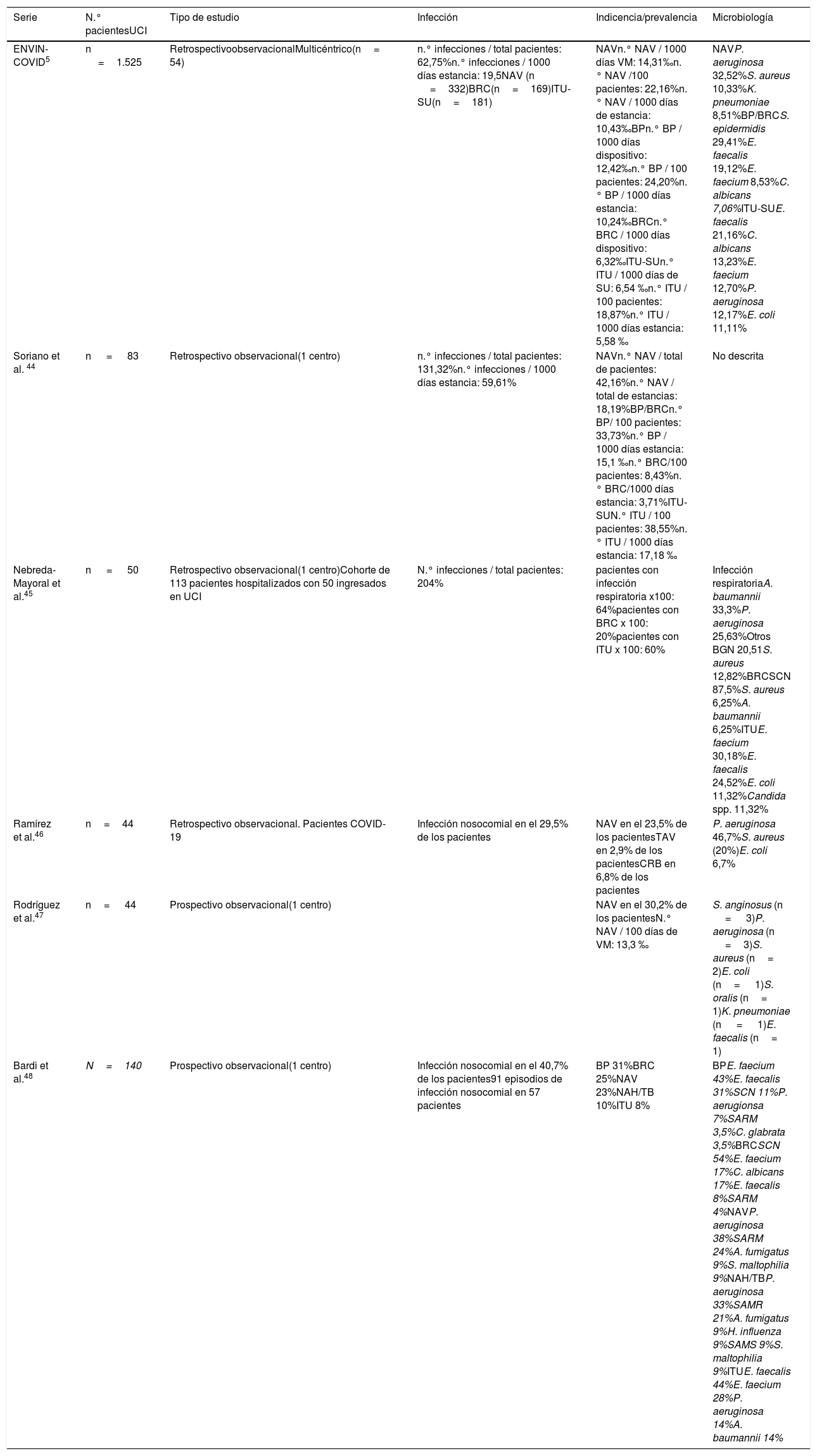
Prevención de las infecciones relacionadas con los cuidados sanitariosLa implementación de las recomendaciones de los Proyectos Zero ha demostrado su eficacia para disminuir la aparición de infecciones relacionadas con la asistencia sanitaria durante la estancia de los pacientes en las UCI de nuestro país40,41. Las tasas de las distintas infecciones relacionadas con dispositivos invasores publicadas por el registro ENVIN en el año 201942 cumplieron de forma sobrada los estándares de calidad de la SEMICYUC43. Durante la fase inicial de la pandemia COVID-19 la aplicación de los planes de contingencia, elaborados para atender la creciente demanda asistencial, incorporaron importantes cambios estructurales, funcionales y humanos que han supuesto barreras para el cumplimiento de las medidas de prevención establecidas. En los últimos meses (tabla 3), se han comunicado importantes incrementos en las tasas de IRAS en los pacientes COVID-19 ingresados en diferentes UCI españolas44–48. El Consejo Asesor de los Proyectos de Seguridad de Pacientes Críticos publicó recientemente un documento49 en el que se proponía la adaptación de las recomendaciones de los Proyectos Zero durante la pandemia por SARS-CoV-2. En el anexo 2 se resumen las medidas contempladas en el documento que se complementa con la adaptación de los cuidados de los dispositivos invasores durante el traslado de pacientes o durante el decúbito prono, la prevención de las úlceras por presión y la aplicación de la higiene corporal.
Incidencia documentada de complicaciones infecciosas en series de pacientes con neumonía grave por SARS-CoV-2
| Serie | N.° pacientesUCI | Tipo de estudio | Infección | Indicencia/prevalencia | Microbiología |
|---|---|---|---|---|---|
| ENVIN-COVID5 | n =1.525 | RetrospectivoobservacionalMulticéntrico(n= 54) | n.° infecciones / total pacientes: 62,75%n.° infecciones / 1000 días estancia: 19,5NAV (n =332)BRC(n=169)ITU-SU(n=181) | NAVn.° NAV / 1000 días VM: 14,31‰n.° NAV /100 pacientes: 22,16%n.° NAV / 1000 días de estancia: 10,43‰BPn.° BP / 1000 días dispositivo: 12,42‰n.° BP / 100 pacientes: 24,20%n.° BP / 1000 días estancia: 10,24‰BRCn.° BRC / 1000 días dispositivo: 6,32‰ITU-SUn.° ITU / 1000 días de SU: 6,54 ‰n.° ITU / 100 pacientes: 18,87%n.° ITU / 1000 días estancia: 5,58 ‰ | NAVP. aeruginosa 32,52%S. aureus 10,33%K. pneumoniae 8,51%BP/BRCS. epidermidis 29,41%E. faecalis 19,12%E. faecium 8,53%C. albicans 7,06%ITU-SUE. faecalis 21,16%C. albicans 13,23%E. faecium 12,70%P. aeruginosa 12,17%E. coli 11,11% |
| Soriano et al. 44 | n = 83 | Retrospectivo observacional(1 centro) | n.° infecciones / total pacientes: 131,32%n.° infecciones / 1000 días estancia: 59,61% | NAVn.° NAV / total de pacientes: 42,16%n.° NAV / total de estancias: 18,19%BP/BRCn.° BP/ 100 pacientes: 33,73%n.° BP / 1000 días estancia: 15,1 ‰n.° BRC/100 pacientes: 8,43%n.° BRC/1000 días estancia: 3,71%ITU-SUN.° ITU / 100 pacientes: 38,55%n.° ITU / 1000 días estancia: 17,18 ‰ | No descrita |
| Nebreda-Mayoral et al.45 | n = 50 | Retrospectivo observacional(1 centro)Cohorte de 113 pacientes hospitalizados con 50 ingresados en UCI | N.° infecciones / total pacientes: 204% | pacientes con infección respiratoria x100: 64%pacientes con BRC x 100: 20%pacientes con ITU x 100: 60% | Infección respiratoriaA. baumannii 33,3%P. aeruginosa 25,63%Otros BGN 20,51S. aureus 12,82%BRCSCN 87,5%S. aureus 6,25%A. baumannii 6,25%ITUE. faecium 30,18%E. faecalis 24,52%E. coli 11,32%Candida spp. 11,32% |
| Ramírez et al.46 | n=44 | Retrospectivo observacional. Pacientes COVID-19 | Infección nosocomial en el 29,5% de los pacientes | NAV en el 23,5% de los pacientesTAV en 2,9% de los pacientesCRB en 6,8% de los pacientes | P. aeruginosa 46,7%S. aureus (20%)E. coli 6,7% |
| Rodríguez et al.47 | n= 44 | Prospectivo observacional(1 centro) | NAV en el 30,2% de los pacientesN.° NAV / 100 días de VM: 13,3 ‰ | S. anginosus (n = 3)P. aeruginosa (n =3)S. aureus (n= 2)E. coli (n= 1)S. oralis (n= 1)K. pneumoniae (n = 1)E. faecalis (n= 1) | |
| Bardi et al.48 | N=140 | Prospectivo observacional(1 centro) | Infección nosocomial en el 40,7% de los pacientes91 episodios de infección nosocomial en 57 pacientes | BP 31%BRC 25%NAV 23%NAH/TB 10%ITU 8% | BPE. faecium 43%E. faecalis 31%SCN 11%P. aerugionsa 7%SARM 3,5%C. glabrata 3,5%BRCSCN 54%E. faecium 17%C. albicans 17%E. faecalis 8%SARM 4%NAVP. aeruginosa 38%SARM 24%A. fumigatus 9%S. maltophilia 9%NAH/TBP. aeruginosa 33%SAMR 21%A. fumigatus 9%H. influenza 9%SAMS 9%S. maltophilia 9%ITUE. faecalis 44%E. faecium 28%P. aeruginosa 14%A. baumannii 14% |
BP: bacteriemia primaria; BRC: bacteriemia relacionada con catéter; ITU-SU: infección del tracto urinario relacionada con sonda uretral; NAH: neumonía adquirida en el hospital; NAV: neumonía asociada a ventilación mecánica; SAMS: S. aureus meticicilinsensible; SARM: S. aureus resistente a meticilina; SCN: Staphylococcus coagulasa negativa; SU sonda uretral; TB: traqueobronquitis.
A pesar de que se documenta una baja incidencia de coinfección bacteriana en pacientes hospitalizados con SARS-CoV-250, la observada en UCI del Registro COVID-19/SEMICYUC fue del 9,3%2, la recomendación que emitimos en este documento va encaminada a contemplar esta posibilidad conocedores del riesgo y aumento de la mortalidad que supone retrasar el tratamiento de una complicación de este tipo51.
Ha de considerarse prioritario realizar una búsqueda diagnóstica proactiva de la coinfección en las formas clínicas graves. Los criterios clínicos clásicos de fiebre, insuficiencia respiratoria e infiltrado radiológico son comunes a la neumonía viral y por tanto no discriminan la posibilidad de coinfección bacteriana. Probablemente el signo clínico diferenciador sean las características de las secreciones que son escasas o inexistentes en la fase precoz de las neumonías víricas sin coinfección. Los pacientes que ingresan en UCI pueden provenir directamente del servicio de Urgencias, o proceder de planta de hospitalización, en estos últimos según los días de ingreso en planta, tratamientos previos y dispositivos invasivos utilizados podría plantearse la posibilidad de presentar infecciones relacionadas con los cuidados sanitarios, pero indistintamente la recomendación de búsqueda activa de complicaciones infecciosas al ingreso permanece invariable.
Aunque los valores de procalcitonina de forma aislada no se recomiendan para iniciar el tratamiento antibiótico52 es una herramienta más específica que la PCR, y sirve de ayuda junto con los datos clínicos y radiológicos para considerar la posibilidad de coinfección por lo que es recomendable su determinación al ingreso en UCI, hay autores que han determinado el punto de corte <0,1 ug/l para sugerir el diagnóstico de neumonía viral53,54 por su alto valor predictivo negativo, además será útil conocer su aclaramiento posterior en las decisiones de retirada de tratamiento antibiótico pautado de forma empírica. Indicamos por tanto la toma de muestras respiratorias al ingreso en UCI, al menos un aspirado traqueal en intubados y una muestra de esputo en los que no lo están. En la tabla 4 se detallan las peticiones al laboratorio de microbiología recomendadas para el estudio de la muestra respiratoria.
Langford et al. evaluaron la presencia de coinfección bacteriana en un metaanálisis55 que contemplaba el análisis de más de 3000 pacientes. El 3,5% de los pacientes presentó coinfección, inferior a lo descrito en pacientes con infección por influenza. Analizando los pacientes críticos presentaron datos de 5 estudios documentando coinfección en 14 de los 144 pacientes totales de este grupo, representando un 9,7%. No aportan datos etiológicos en pacientes críticos, pero parece razonable contemplar Streptococcus pneumoniae y S. aureus como posibles bacterias más frecuentes en las neumonías adquiridas en la comunidad. Con estos datos se ha planteado un debate en si es recomendable iniciar un tratamiento antibiótico empírico o no. Lo que no genera dudas es que se ha de investigar la potencial presencia de coinfección bacteriana en todos los casos. Una postura, que consideramos prudente, puede ser iniciar tratamiento antibiótico considerando los patógenos habituales de neumonía adquirida en la comunidad y en función de la información microbiológica ajustar o retirar a las 48-72 h. En caso de iniciar una pauta antibiótica empírica recomendamos tratamiento en combinación de una cefalosporina de tercera generación como ceftriaxona o cefotaxima asociando levofloxacino o azitromicina, aunque también podría indicarse una cefalosporina de quinta generación como la ceftarolina.
Infecciones respiratorias relacionadas con la ventilación mecánicaLas infecciones respiratorias relacionadas con la ventilación mecánica (IRVM), incluida la traqueobronquitis asociada a la ventilación mecánica y la neumonía asociada a la ventilación mecánica (NAVM) son comunes en pacientes críticamente enfermos que reciben ventilación mecánica56. Los pacientes con neumonía por SARS-CoV-2 podrían tener un mayor riesgo de IRVM57, debido al síndrome de dificultad respiratoria aguda (SDRA) y a la larga duración de la ventilación mecánica. El SDRA es un factor de riesgo bien conocido de NAVM58,59, y se ha publicado que su incidencia en pacientes ventilados mecánicamente con neumonía por SARS-CoV-2 es elevada con cifras entre 42-89%60,61. Asimismo, el SARS-CoV-2 es responsable de alteraciones de la respuesta inmune del paciente.
Recientemente dos grupos de nuestro país62,63 han publicado su experiencia con una incidencia que alcanza para las infecciones adquiridas en UCI hasta incluso en el casi 52% de los pacientes siendo el foco respiratorio el más frecuente en ambas series, conllevando en uno de ellos una mortalidad significativamente superior62. Pseudomonas aeruginosa fue el microorganismo más frecuentemente aislado30,40.
Rouze et al.64 llevaron a cabo un estudio multicéntrico para determinar la relación entre la infección por SARS-CoV-2 y la incidencia y etiología de IRVM. El estudio se realizó en 36 UCI en Europa (28 centros en Francia, 3 en España, 3 en Grecia, 1 en Portugal y 1 en Irlanda). Lo interesante de este estudio es que incluyeron el mismo número de pacientes con ventilación mecánica por centro con infección por SARS-CoV-2, influenza o ausencia de infección viral. El hallazgo más interesante es que la incidencia de traqueobronquitis asociada a la ventilación mecánica y NAVM era mayor en pacientes con SARS-CoV-2 comparándolos con influenza o sin virus. Los bacilos gramnegativos fueron responsables de la mayoría de los primeros episodios de IRVM en los tres grupos de estudio. P. aeruginosa, Enterobacter spp. y Klebsiella spp. fueron las bacterias más comúnmente identificadas. La tasa de pacientes con IRVM con infecciones por bacterias multirresistentes fueron menores en la neumonía por
SARS-CoV-2 que en los otros dos grupos.
Para la elección del tratamiento empírico y/o dirigido, nos deberíamos basar en entidades clínicas y la gravedad de la presentación clínica, la presencia de factores de riesgo para una infección causada por un MMR, la existencia de comorbilidades y el conocimiento de la flora local y la tasa de mutirresistencias del propio centro según su algoritmo propuesto65. El aumento de resistencias bacterianas, la alta incidencia demostrada en estas infecciones por bacilos gramnegativos como Klebsiella spp. y Pseudomonas spp. nos llevan a contemplar tratamientos empíricos con actividad frente a esta etiología entre los que se encuentra carbapenémicos, cuya aparición de resistencias va en aumento, ceftacidima avibactam y ceftolozano tazobactam cuyo espectro de actividad cubre estas posibilidades. La duración del tratamiento no está claramente definida y en esta infección en especial debido al importante daño pulmonar causado y debe ser individualizado. Deberemos así mismo tener presente siempre la posibilidad tanto de disminuir la duración del tratamiento como de desescalada con el uso de escalas tales como Clinical Pulmonary Infection score CPIS y biomarcadores como PCR y sobre todo PCT65 en combinación pueden ser de ayuda.
En la tabla 5 se enumeran de forma resumida las recomendaciones de manejo de la NAVM en pacientes con COVID.
Recomendaciones para el manejo de las infecciones respiratorias asociadas a la ventilación mecánica en el paciente crítico con neumonía por SARS-CoV-2
| - Debido a su alta incidencia se debe tener un alto índice de sospecha e iniciar tratamiento antibiótico precoz |
| - El tratamiento empírico y/ o dirigido se debe basar en entidades clínicas y la gravedad de la presentación clínica, la presencia de factores de riesgo para una infección causada por un MMR, la existencia de comorbilidades, el posible uso de técnicas rápidas y el conocimiento de la flora local y la tasa de mutirresistencias del propio centro |
| - Deberá realizarse cobertura combinada inicial empírica con betalactámicos antipseudomónicos incluyendo ceftacidima avibactam o ceftolozano-tazobactam más quinolonas o aminoglucósidos |
| - No es preciso la cobertura empírica de SAMR si su incidencia en el centro es baja o nula |
| - Con el objeto de evitar un uso no racional de los antibióticos se deberá suspender el tratamiento si no se documenta infección |
| - En el tratamiento dirigido se recomienda monoterapia y la posibilidad de reducción de espectro |
| - La duración del tratamiento debe ser individualizada, puede ser necesario en estos enfermos una mayor duración que dependerá de la evolución clínica, uso de biomarcadores y presencia de multirresistencia |
Bacteriemia-Zero ha reducido la incidencia de bacteriemia relacionada con el catéter (BRC)40 pero en los momentos de máxima ocupación y expansión de camas de críticos, ha sido difícil mantener el cumplimiento de las medidas recomendadas por este y otros programas similares en nuestras unidades49. Se ha detectado una mayor incidencia de bacteriemia nosocomial en pacientes
COVID-19 ingresados en el hospital que en pacientes no COVID (5,3% vs. 1,4%, p<0,001) siendo, además, el ingreso en UCI un factor de riesgo66. El informe
ENVIN-COVID 2020ha descrito una tasa de incidencia de 6,32 casos por 1000 días de catéter venoso central5, mucho mayor a la habitual en nuestras unidades. Resultados similares, e incluso peores, se han descrito en otros estudios: Giacobbe et al. han documentado una incidencia de bacteriemia nosocomial de 47 episodios por 1000 pacientes-día, correspondiendo un 73% a bacteriemias primarias y relacionadas con catéter67; sin embargo, Buetti et al., en su estudio de casos-controles, encuentran que los pacientes COVID-19 no tienen mayor riesgo de BRC que los no COVID-1968. En lo que coinciden ambos estudios es en describir un mayor riesgo de BRC en pacientes tratados con corticoides, tocilizumab o anakinra, hallazgos que no han podido ser confirmados en los ensayos clínicos de dichos fármacos.
Las situaciones en las que debemos sospechar BRC, así como los procedimientos diagnósticos a seguir, no son distintas de los pacientes no COVID-1969. En cuanto al tratamiento, no existe evidencia que nos haga establecer unas pautas de tratamiento distintas a las habituales, pero debemos tener en cuenta algunas consideraciones. A efectos de selección de la terapia antimicrobiana y de retirada de catéter, los pacientes tratados con corticoides o tocilizumab deben considerarse inmunosuprimidos, al menos durante el tratamiento con corticoides y entre 2 y 4 semanas tras la administración de tocilizumab. Debemos adaptar el tratamiento antimicrobiano al perfil de resistencias local, con especial atención a los cambios en la microbiología que puedan aparecer tanto derivados de las peculiaridades del paciente COVID-19 (tabla 3), alta frecuencia de tratamiento con cefalosporinas al ingreso, como de la asistencia a pacientes críticos en áreas distintas a las habituales.
Infección del tracto urinario asociado a dispositivoEn los datos del ENVIN-HELICS del año 20205 que recoge el análisis de 1525 pacientes con neumonía por SARS-CoV-2 en la primera oleada, 19% de las infecciones relacionadas con la asistencia sanitaria ITU-SU con una tasa de incidencia de 6,54 ITU-SU por mil días de sonda uretral. Existen múltiples factores que pueden estar involucrados en la predisposición a desarrollar ITU-SU, en los que cabe destacar su larga estancia en UCI, alteración de la inmunidad, necesidad de ser portadores de sonda urinaria y el haber recibido antibióticos. La estrategia de prevención de ITU-SU en UCI está ampliamente desarrollada en el proyecto ITU-ZERO70 y no presenta aspectos diferenciales en el paciente con infección por SARS-CoV-2. El germen más frecuentemente aislado ha sido Enterococus faecalis (tabla 3). El cambio observado en la microbiología en las ITU-SV en los pacientes con neumonía SARS-CoV-2, debe interpretarse con cautela puesto que puede estar justificado por el abordaje terapéutico inicial que se hizo con las cefalosporinas y que en la actualidad ha cambiado. Por lo que, hasta nuevos datos, el tratamiento antibiótico en estos pacientes debe asegurar la cobertura de BGN, teniendo en cuenta el porcentaje nada despreciable de aislamiento de P. aeruginosa. El tratamiento antifúngico puede realizarse con fluconazol en pacientes con candiduria sintomática y en aquellos con candiduria asintomática con riesgo de enfermedad diseminada como los pacientes neutropénicos, inmunosuprimidos o pacientes con manipulaciones urológicas. En caso de infección por Candida krusei o Candida glabrata resistente a azoles puede emplearse anfotericina B deoxicolato iv. Las equinocandinas han sido eficaces en algunos casos a pesar de su escasa eliminación urinaria. La tendencia actual respecto a la duración del tratamiento son pautas de ciclos cortos entre 3 y 7 días71,72.
Infecciones oportunistas con especial énfasis a la infección fúngica invasoraLa neumonía por SARS-CoV-2 en sus formas más graves se ha asociado a un aumento de la incidencia de infecciones de este tipo, aunque la estancia prolongada en UCI, los tratamientos con corticoides y/o inmunomoduladores pueden identificarse como factores de riesgo en estos enfermos cada vez cobra más fuerza la teoría de que la infección por este virus y el desarrollo de SDRA ocasionan una disfunción linfocitaria73 que puede favorecer el desarrollo de infecciones oportunistas. Nos centraremos en las dos infecciones oportunistas más frecuentes en el paciente COVID-19: aspergilosis pulmonar invasiva y reactivación de Herpesviridae. Se ha observado un notable aumento de los aislamientos por Candida spp. pero su manejo no difiere del de los pacientes sin infección por SARS-CoV-2.
Aspergilosis pulmonar asociada a la infección por SARS-CoV-2La aspergilosis pulmonar es una temida complicación por su alta mortalidad en el paciente crítico en ventilación mecánica, ya en la pandemia por Influenza A H1N1v en el año 2009 hubo autores que describieron un aumento de su incidencia en los pacientes que desarrollaron síndrome de distrés respiratorio74. Este hallazgo también ha sido documentado en pacientes con neumonía grave por SARS-CoV-275,76, por tanto, hemos de incluir este perfil clínico como de riesgo y por tanto recomendar una búsqueda activa de la aspergilosis.
Los criterios clínicos y radiológicos pueden ser de ayuda en el reto diagnóstico de esta complicación, pero en ningún modo ofrecen la especificidad suficiente para llegar per se al diagnóstico77,78. Las dificultades en su detección han motivado la urgencia de recomendaciones específicas para pacientes con SARS-CoV-2 que sugieren estrategias diagnósticas79,80. Por ello hemos de recomendar en primer lugar considerar estos pacientes de riesgo para iniciar una búsqueda activa de aspergilosis e indicar la toma de muestras respiratorias, ya que la determinación de galactomanano en suero en pacientes no neutropénicos presenta una baja sensibilidad, preferiblemente invasiva mediante fibrobroncoscopia para afinar en la diferenciación entre colonización e infección, solicitando al laboratorio de microbiología la realización de tinción de calcofluor y/o KOH en busca de presencia de elementos fúngicos en la muestra directa, la determinación cuantitativa de galactomanano y el cultivo. La pandemia por
SARS-CoV-2 está suponiendo una importante sobrecarga de trabajo y no todos los días de la semana hay disponibilidad para montar la cuantificación de Ag galactomanano, los resultados del crecimiento del hongo en el cultivo pueden tardar y por ello hemos de plantear la posibilidad de realizar otras técnicas más rápidas y de aceptable sensibilidad como el ensayo de flujo lateral (LFA) cuyos resultados ofrecerían al clínico una información muy valiosa para iniciar precozmente el tratamiento antifúngico81. Otros procedimientos diagnósticos como la determinación del hongo mediante PCR, técnica de espectrometría de masas o la determinación de antígeno en orina no están disponibles en la mayoría de los laboratorios actualmente, pero sin duda suponen un futuro prometedor en el reto diagnóstico que supone esta enfermedad82. En la tabla 6 detallamos las recomendaciones para el manejo de la aspergillosis en pacientes críticos con neumonía por SARS-CoV-2. No difieren de las actualmente establecidas independientemente de presentar neumonía por SARS-CoV-2. Voriconazol e isavuconazol son considerados el tratamiento de primera línea83, si bien hemos de destacar un mejor perfil de seguridad para isavuconazol en el paciente crítico que suele desarrollar complicaciones como la disfunción renal o hepática. Además, voriconazol precisa para su uso adecuado de la necesidad de monitorizar sus niveles plasmáticos. Anfotericina B en su formulación lipídica es una posibilidad ante el creciente aumento de cepas resistentes a azoles en nuestro país84. Recientemente han sido publicadas las recomendaciones de la ECMM/ISHAM en la que recomiendan este tratamiento con anfotericina B o la posibilidad de tratamiento combinado de azoles con una equinocandina en aquellos casos con resistencia a azoles85.
Recomendaciones para el manejo de aspergilosis pulmonar en el paciente crítico con neumonía por SARS-CoV-2
| 1. Considere a todo paciente con neumonía grave por SARS-CoV-2 de riesgo para presentar aspergilosis pulmonar |
| 2. Indique búsqueda activa de aspergilosis tomando muestra respiratoria preferentemente invasiva mediante fibrobroncoscopia |
| 3. Evalúe la presencia de los siguientes criterios diagnósticos y si están presentes inicie tratamiento antifúngico precozmente: |
| -. Criterios clínicos: fiebre, y/o empeoramiento de la función respiratoria determinada por la relación paO2/FiO2 no justificadas por otras causas |
| -. Criterios radiológicos: presencia de infiltrado radiológico en la radiografía simple de tórax |
| -. Criterios microbiológicos (cualquiera de ellos justifica iniciar tratamiento): |
| Detección de niveles de galactomanano en muestra respiratoria > 0,5 |
| PCR tiempo real /ensayo de flujo lateral (LFA) positivo* |
| Visión directa de elementos fúngicos, hifas, en la muestra respiratoria. (Tinción de calcofluor) |
| Crecimiento de Aspergillus spp. en cultivo |
Como corolario hemos de destacar que la clave para combatir la alta mortalidad descrita en la aspergilosis pulmonar en el paciente crítico está en el inicio precoz del tratamiento y para ello será clave identificar al paciente con SARS-CoV-2 como perfil de riesgo e iniciar precozmente una búsqueda activa de esta complicación infecciosa.
Reactivación Herpesviridae en el paciente crítico COVID-19La familia Herpesviridae incluye diversos virus de los cuales el virus herpes simplex (VHS) y el citomegalovirus (CMV) serán el objeto de esta revisión. Estos virus tienen la capacidad de mantenerse en un estado de latencia tras la primoinfección, latencia desde la que es posible la reactivación si las circunstancias son propicias. La posibilidad de infección sistémica o confinada a un órgano por VHS o CMV en el paciente crítico inmunocompetente es un tema sometido a intenso debate. Algunos autores consideran que la detección, por PCR cuantitativa o cualitativa, de la presencia del virus no debe considerarse indicación de tratamiento ya que no todos los trabajos han mostrado un efecto beneficioso del mismo en términos de mortalidad86. No obstante, un reciente metaanálisis concluyó que el tratamiento con aciclovir se asociaba a una disminución de mortalidad hospitalaria y a los 30 días87. Factores como un elevado número de copias del virus, la ausencia de respuesta al tratamiento antibiótico o la presencia de datos citológicos en el lavado brocoalveolar apoyarían la existencia de una neumonía por VHS y por tanto el inicio del tratamiento88,89.
En el caso del paciente COVID-19 cada vez existen más publicaciones que apuntan a una elevada frecuencia de reactivación de VHS y CMV90,91. Una vez más la interpretación del resultado puede ser compleja. No obstante, dado el estado de relativa inmunosupresión causado por la linfopenia y el uso de medicación, y la publicación de casos clínicos que demuestran histológicamente la afectación tisular profunda92,93, el tratamiento debe considerarse de forma precoz.
El diagnóstico microbiológico, por PCR preferiblemente cuantitativa, debe perseguirse en todo paciente que sufra un deterioro respiratorio+/- un proceso infeccioso, sobre todo si se descarta el origen bacteriológico o no hay respuesta a los antibióticos88,89. Se recomienda el uso de muestras invasivas, lavado broncoalveolar o minilavado. El estudio serológico para VHS y CMV y la cuantificación de CMV en plasma pueden ser de apoyo en la evaluación del caso.
El tratamiento de la infección por VHS se realizará con aciclovir. Ganciclovir es el fármaco de elección para CMV aunque la presencia de resistencias o la falta de respuesta podrían hacer necesario el uso de foscarnet.
Consideraciones finalesLa principal limitación de este documento radica en que las recomendaciones emitidas no se sustentan en ningún análisis de evidencia debido a que actualmente queda mucho por conocerse respecto al manejo de esta pandemia y apenas hay estudios de adecuado diseño que nos permitan emitir soportarlas, es por ello que deban considerarse de bajo grado. Sin embargo, podemos concluir que las escasas evidencias sobre tratamientos eficaces dirigidos frente a la infección viral por SARS-CoV-2 en pacientes graves soportan que la base del tratamiento del enfermo crítico sea el tratamiento de soporte, la prevención de aparición de infecciones relacionadas con la asistencia sanitaria y la precocidad en la detección y tratamiento de las complicaciones infecciosas que se ha documentado son frecuentes en estos enfermos.
Autoría/colaboradoresTodos los autores forman parte del GTEI de la SEMICYUC y fueron seleccionados por sus coordinadores para la elaboración del documento.
Han participado en el desarrollo de todas las secciones y han aprobado la versión final. AE y RZ han coordinado el proyecto del que ha resultado este documento.
Conflicto de interesesAE ha participado en ponencias/actividades formativas organizadas por Pfizer, Gilead, MSD.
PVC ha participado en ponencias/actividades formativas organizadas por Pfizer, Shionoghi, MSD.
RZ ha participado en ponencias/actividades formativas organizadas por Pfizer, Shionoghi, MSD, Gilead.
El resto de los autores declaran no tener ningún conflicto de intereses.