Actualmente, el control estricto de temperatura mediante hipotermia inducida (entre 32 y 36 oC) se considera un tratamiento de primera línea en el manejo de pacientes con parada cardiaca recuperada que ingresan en Unidades de Cuidados Intensivos. Su objetivo es disminuir el daño neurológico secundario a anoxia cerebral. Aunque existen múltiples evidencias sobre sus beneficios, el empleo de esta técnica en nuestro país es pobre y todavía existen temas controvertidos como temperatura óptima, velocidad de instauración, duración y proceso de calentamiento. El objetivo de este trabajo es desarrollar la evidencia científica actual y las recomendaciones de las principales guías internacionales. El enfoque de este documento se centra también en aplicación práctica del control estricto de la temperatura en la parada cardiaca recuperada en nuestras Unidades de Cuidados Intensivos Generales o Cardiológicas, principalmente en los métodos de aplicación, protocolos, manejo de las complicaciones y elaboración del pronóstico neurológico.
Targeted temperature management (TTM) through induced hypothermia (between 32-36 oC) is currently regarded as a first-line treatment during the management of post-cardiac arrest patients admitted to the Intensive Care Unit (ICU). The aim of TTM is to afford neuroprotection and reduce secondary neurological damage caused by anoxia. Despite the large body of evidence on its benefits, the TTM is still little used in Spain. There are controversial issues referred to its implementation, such as the optimal target body temperature, timing, duration and the rewarming process. The present study reviews the best available scientific evidence and the current recommendations contained in the international guidelines. In addition, the study focuses on the practical implementation of TTM in post-cardiac arrest patients in general and cardiological ICUs, with a discussion of the implementation strategies, protocols, management of complications and assessment of the neurological prognosis.
En la actualidad, la tasa de mortalidad de la parada cardiaca (PCR) extrahospitalaria es extremadamente elevada y de los pacientes que sobreviven, solo un 13%, según el registro español Out-of-Hospital Spanish Cardiac Arrest Registry (OSHCAR)1, una cuarta parte lo hacen con algún tipo de secuela neurológica.
Son pocas las medidas que han demostrado mejorar el pronóstico de estos pacientes. Una de las medidas más eficaces es el reconocimiento temprano del cuadro clínico seguido del inicio oportuno de una reanimación cardiopulmonar (RCP) efectiva2. Otra medida que ha demostrado mayor impacto en el pronóstico es el control estricto de temperatura (TTM por sus siglas en inglés, Targeted Temperature Management) mediante hipotermia inducida mantenida durante un periodo de tiempo determinado. Los beneficios del TTM en el paciente recuperado de una parada cardiaca (PCR) extrahospitalaria por ritmo desfibrilable se han establecido de forma sólida y, desde hace años, se considera tratamiento de primera línea para disminuir el daño neurológico secundario a la anoxia mantenida. En los pacientes recuperados de una PCR extrahospitalaria por ritmo no desfibrilable, también existe evidencia científica, aunque en menor nivel, de un posible beneficio del TTM3.
Hasta ahora, en España no existía un documento que recogiera la evidencia y adaptara las guías clínicas existentes a las necesidades de los hospitales del país. Por ello, la Sociedad Española de Cardiología (SEC) y la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) vieron la necesidad de redactar un documento que acerque la evidencia científica, las recomendaciones de las principales sociedades internacionales y la aplicación práctica de la TTM en la parada cardiaca recuperada a nuestras Unidades de Cuidados Intensivos. Este documento servirá de guía a las unidades clínicas que quieran incorporarse a la terapia o mejorar su implantación.
MetodologíaPara elaborar el documento de expertos se creó un grupo de trabajo de profesionales de ámbito nacional con amplia experiencia y compromiso en el tratamiento del paciente posresucitación mediante la terapia con hipotermia y control de temperatura. Este grupo revisó la evidencia disponible y puso en común su práctica clínica para determinar aquello en lo que el consenso es pleno dentro del grupo e incluirlo como recomendación básica para las unidades que incorporen el TTM.
Se realizó una búsqueda en PubMed de todos los estudios, tanto observacionales como ensayos clínicos (excluyendo pacientes pediátricos), con los siguientes términos del Tesauro: targeted temperature management, hypothermia, therapeutic hypothermia, cardiac arrestandneuroprotection, outcome, clinical trial, prospective study, observational study, metaanalysis. Se revisaron solo artículos en español o en inglés y no hubo restricción temporal de esta búsqueda. Se obtuvo el texto completo de todos los artículos seleccionados.
El grupo participó en una reunión presencial el primero de marzo de 2018 donde se revisó el estado del arte del tratamiento del paciente posresucitación mediante la terapia con hipotermia y control de temperatura debatiéndose entre todos los estudios y meta-análisis identificados. En dicha reunión se aprobó la estructura de este documento repartiéndose entre los asistentes los diversos apartados para una primera redacción. Con todo ello, se redactó un primer borrador (RFR) que se distribuyó a todo el grupo. Una segunda reunión presencial se realizó el día 26 de septiembre para la discusión de este documento-borrador. El documento final se ha confeccionado con la literatura publicada hasta mayo de 2019 y ha sido revisado y aprobado por todos los firmantes en la última reunión presencial el 23 de mayo del 2019.
El documento cuenta con el soporte y los avales de la SEMICYUC y de la SEC.
Neuroprotección posparada cardiacaUno de cada 10 pacientes con parada cardiaca sobrevive, pero solo la mitad sobreviven con un aceptable estado neurológico. Tras una parada cardiaca recuperada se desencadena un síndrome posresucitación caracterizado por lesión cerebral, disfunción miocárdica, síndrome de isquemia-reperfusión sistémico y los condicionantes clínicos responsables de la parada cardiaca4.
Hay una serie de procedimientos que ayudan a reducir el daño secundario a la lesión isquémica general y a tratar el síndrome posresucitación (tabla 1)5-7.
Procedimientos para la reducción del daño neurológico secundario5-7
| Coronariografía en pacientes con STEMI o con sospecha de parada de origen cardiaco |
| Identificación del factor etiológico |
| Cuidados respiratorios evitando la hipoxemia y la hiperoxia |
| Monitorización hemodinámica con control arterial invasivo, un acceso venoso central, y la monitorización del gasto cardiaco |
| Ecocardiografía precoz |
| Medición de la saturación venosa mixta, el ácido láctico y la diuresis |
| Monitorización estricta de la natremia, la glucemia y la posición de la cabeza |
| Detección y tratamiento de las convulsiones |
STEMI: infarto con elevación del segmento ST.
La neuromonitorización mediante técnicas mínimamente invasivas (oximetría cerebral, Doppler transcraneal, pruebas de imagen) puede ayudar en la toma de decisiones y en la detección temprana de hipertensión craneal o isquemia.
Las estrategias de neuroprotección pueden limitar la pérdida secundaria de tejido nervioso y mejorar los resultados funcionales8. Hay dos estrategias fundamentales de neuroprotección: mantener un adecuado aporte de oxígeno y modular el consumo para adaptarlo a la oferta. Para ello, existen diferentes opciones terapéuticas entre las que actualmente destaca el TTM9. La neuroprotección farmacológica en los enfermos neurocríticos, sean posparada o de otro tipo, no ha proporcionado los efectos deseados10.
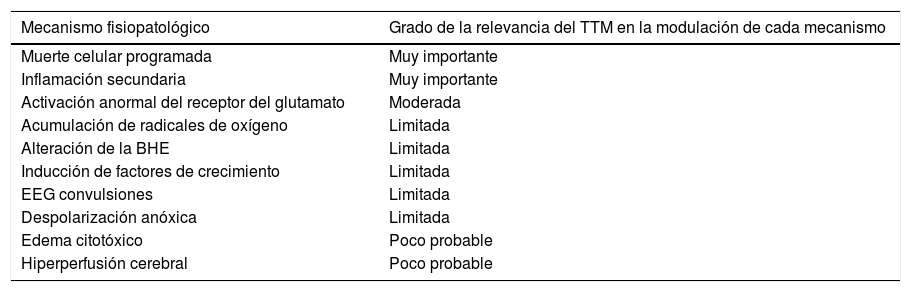
Hipotermia y neuroprotecciónLa relación entre lesiones neurológicas y termorregulación es compleja. La hipotermia durante la hipoxia-isquemia/reperfusión actúa por diferentes mecanismos, pero fundamentalmente reduciendo la despolarización anóxica, la excitotoxicidad, la exposición a radicales libres y la disfunción de la barrera hematoencefálica11,12. En la tabla 2 se listan los diferentes mecanismos fisiopatológicos en el síndrome posresucitación después de una PCR y el grado de influencia de la hipotermia en cada uno de ellos para modularlos.
Mecanismo de actuación de la hipotermia y grado de relevancia en cada mecanismo fisiopatológico en el síndrome posresucitación11
| Mecanismo fisiopatológico | Grado de la relevancia del TTM en la modulación de cada mecanismo |
|---|---|
| Muerte celular programada | Muy importante |
| Inflamación secundaria | Muy importante |
| Activación anormal del receptor del glutamato | Moderada |
| Acumulación de radicales de oxígeno | Limitada |
| Alteración de la BHE | Limitada |
| Inducción de factores de crecimiento | Limitada |
| EEG convulsiones | Limitada |
| Despolarización anóxica | Limitada |
| Edema citotóxico | Poco probable |
| Hiperperfusión cerebral | Poco probable |
BHE: barrera hematoencefálica.
La hipotermia tiene diferentes efectos potencialmente beneficiosos en el manejo post- PCR: reduce el metabolismo permitiendo que los órganos toleren periodos de isquemia más prolongados sin que se produzca un daño irreversible; tiene el potencial de reducir los daños producidos por la reperfusión, especialmente los daños neurológicos inducidos por la liberación de mediadores inflamatorios tras recuperar el flujo sanguíneo. A su vez, la hipotermia también reduce la respuesta inflamatoria y aumento de la presión intracraneal, así como el riesgo de fiebre como consecuencia de la respuesta inflamatoria sistémica (tabla 2)12.
TTM en cuidados posresucitaciónEl uso de TTM está recomendado en todas las guías de práctica clínica sobre cuidados posresucitación. Su nivel de aceptación e implementación es variable (actualmente en España se emplea en menos del 20% de los candidatos1), pero los grupos que han adoptado esta estrategia han obtenido buenos resultados13.
Cuestiones a considerar en el manejo del TTMNivel de temperatura objetivo- –
El nivel óptimo de temperatura en el TTM aún no está definido.
- –
Existe mayor evidencia de un efecto favorable con 33 oC (32-34 oC) que el tratamiento estándar sin método controlado de temperatura, aunque no existen diferencias significativas entre tres objetivos de temperatura central, que son 32-33 y 34 oC12,14-16. Hay un acuerdo generalizado de que cuando se elige una temperatura diana de 36 oC, esta se mantiene de una forma menos estricta17.
- –
El estudio de Nielsen et al. buscó definir una temperatura objetivo de TTM, sin encontrar diferencias con método controlado de temperatura de 33 oC versus 36 oC18. Posteriormente, la evidencia muestra que hay un peor pronóstico en los pacientes con manejo estándar en quienes se ha aumentado el objetivo de temperatura a 36 oC19,20. Sin embargo, la aparición de fiebre en estos pacientes (que empeora el pronóstico) y la aplicación laxa de los protocolos de hipotermia, son dos factores que hacen que no se pueda atribuir totalmente que la temperatura objetivo de la hipotermia sea lo que mejora la supervivencia en el grupo de intervención.
- –
Por estas razones, se ha diseñado el estudio internacional multicéntrico Targeted hypothermia versus targeted normotermia after out-of-hospital cardiac arrest (TTM2, ClinicalTrials.gov: NCT03114033), que compara TTM de 33 oC versus normotermia y tratamiento temprano de fiebre (≥ 38.7 oC), cuyos resultados son esperados21.
- –
No existen ensayos sobre el efecto de la velocidad de reducción de la temperatura en el pronóstico. Existen estudios observacionales en los que no se ha encontrado evidencia de que la velocidad en lograr la temperatura objetivo tenga alguna repercusión en los desenlaces clínicos22, incluso en aquellos pacientes en que el TTM se inicia en el ámbito prehospitalario23.
- –
En el síndrome de posresucitación (isquemia-reperfusión) existe edema cerebral que producirá un incremento de la presión intracraneal ocasionando una isquemia cerebral adicional que agravará el daño neurológico ya producido. En este síndrome existe una ventana de tiempo crítica, desde el momento que recupera la circulación espontánea hasta el desencadenamiento de la respuesta inflamatoria, en la cual la reducción de la temperatura corporal puede tener un efecto beneficioso. Se cree que esta ventana puede ser de unas 4-5 horas24.
- –
Se desconoce la duración que debe tener el TTM. El único estudio en pacientes que ha comparado el efecto del TTM a 33 oC durante 24 versus 48 horas, no demostró superioridad, pero sí una tendencia a mejores resultados con duraciones más prolongadas de 24 horas25.
- –
Hasta el momento no existen estudios sobre cómo debería de realizarse el regreso a la normotermia y si debe de ser espontánea o controlada.
- –
En general, cuando el TTM se ha realizado con métodos clásicos, como hielo o mantas aislantes, se emplea un calentamiento pasivo ya que resulta muy difícil hacerlo a una velocidad establecida.
- –
Cuando utilizan métodos de control con retroalimentación suele emplearse una tasa de calentamiento controlada, habitualmente de entre 0,1 y 0,5 oC por hora, con la finalidad de evitar rebotes. La normotermia controlada deberá mantenerse más allá del periodo de hipotermia, ya que frecuentemente se producen fenómenos de hipertermia.
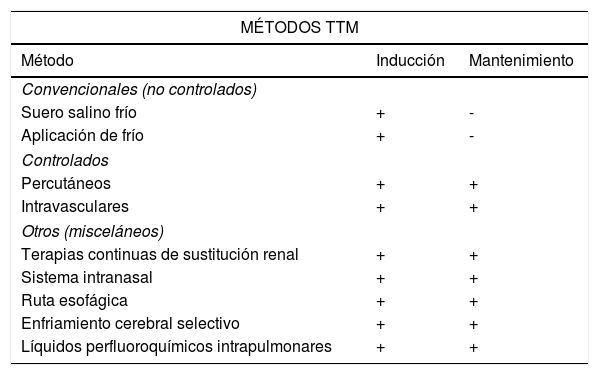
Existen diferentes métodos para inducir, mantener y revertir el TTM en la práctica clínica. Existen los métodos convencionales no controlados, los métodos controlados percutáneos e intravasculares y otros métodos (tabla 3).
Métodos para inducción y mantenimiento del TTM30
| MÉTODOS TTM | ||
|---|---|---|
| Método | Inducción | Mantenimiento |
| Convencionales (no controlados) | ||
| Suero salino frío | + | - |
| Aplicación de frío | + | - |
| Controlados | ||
| Percutáneos | + | + |
| Intravasculares | + | + |
| Otros (misceláneos) | ||
| Terapias continuas de sustitución renal | + | + |
| Sistema intranasal | + | + |
| Ruta esofágica | + | + |
| Enfriamiento cerebral selectivo | + | + |
| Líquidos perfluoroquímicos intrapulmonares | + | + |
La comparación entre ellos26-29 muestra que son equivalentes para inducir la hipotermia terapéutica, pero los dispositivos controlados resultan los más efectivos para mantener la TTM30.
Métodos convencionales no controladosSuelen utilizarse para inducir TTM y como métodos adyuvantes a métodos más avanzados.
Infusión de suero salino frío27,29Es un método ampliamente disponible, sencillo y de bajo costo, útil para inducir TTM, aunque no es efectivo para mantenerla. Generalmente se realiza usando una bolsa de presión para aumentar la velocidad de infusión. Un litro de suero salino frío infundido en 15 minutos puede reducir la temperatura central 1 oC. Se utilizan volúmenes de hasta dos litros intravenosos, generalmente de suero salino 0,9%. Presenta riesgo de efectos adversos por sobreenfriamiento y, adicionalmente, puede causar sobrecarga de volumen y edema agudo pulmonar, por lo que no es conveniente en pacientes con insuficiencia cardiaca, alteración de la función renal, síndrome de distrés respiratorio o datos de sobrecarga de volumen.
Aplicación de frío27,29Tradicionalmente se ha utilizado la aplicación de bolsas de hielo y más recientemente las almohadillas de gel con base de carbón, que logran disminuir la temperatura 3,5 oC/hora (sistema de enfriamiento EMCOOLS®), una tasa más rápida que cuando se utiliza la infusión de suero salino frío de aprox. 2 oC/hora. Es un técnica sencilla y rápida, incluso en el ámbito extrahospitalario, pero presenta riesgo de causar irritación y quemaduras cutáneas y no es el mejor método para utilizar en caso de pérdida de la continuidad de la piel (como en dermatitis exfoliativas o quemaduras extensas). La aparición de temblores asociados a la disminución de la temperatura suele ser más común con esta técnica.
Métodos controladosMétodos percutáneos26,30Se administran haciendo uso del principio de la conductividad térmica. Se hace circular un medio líquido o aire frío a través de sábanas de enfriamiento, chalecos o almohadillas en contacto con la superficie del paciente30. Estos métodos suelen reducir la temperatura corporal a una tasa de 0,5 a 1 oC/hora, aunque la velocidad en alcanzar la temperatura deseada será distinta según el dispositivo.
El Arctic Sun® (Medivance, Bard, Beckton Dickinson, Louisville, CO) es un sistema percutáneo no invasivo para el TTM que consigue regular y controlar la temperatura de forma rápida. Controla temperaturas en un rango de 32 a 38,5 oC. Su funcionamiento se basa en la circulación de agua fría dentro de una serie de almohadillas adheridas sobre la piel. Su módulo electrónico se conecta a las almohadillas desechables que transfieren la energía térmica directamente sobre la piel del enfermo y lo aíslan de la temperatura ambiental. Es un sistema servocontrolado que monitoriza la temperatura corporal cada segundo y la compara con el protocolo deseado, ajustando la temperatura del agua circulante 30 veces cada hora.
Métodos intravasculares26,28,30Se consideran métodos invasivos. Hay dos dispositivos disponibles en el mercado: el sistema Thermoguard XP® (Zoll, Chelmsford, MA) y el InnerCool RTx® con el catéter Accutrol® (Phillips). El primero utiliza diferentes tipos de catéteres venosos centrales que pueden colocarse por vía subclavia, yugular interna o femoral. La temperatura objetivo se obtiene haciendo circular suero salino 0,9% en asa cerrada a través del balón del catéter. El InnerCool RTx® utiliza un solo tipo de catéter que tiene un sensor de temperatura para control preciso. Estos sistemas avanzados de enfriamiento permiten el control computarizado de la temperatura con un mecanismo de servocontrol31. Con estos sistemas las tasas de sobreenfriamiento son menores y se producen menos fallos en obtener la temperatura objetivo. Sin embargo, los resultados no son mejores que con otras técnicas y presentan un riesgo sobreañadido de infecciones intravasculares, trombosis venosa y complicaciones locales por la inserción de los catéteres.
Otros métodos- –
Otros métodos incluyen: métodos de enfriamiento extracorpóreo, el uso de terapia de reemplazo renal continuo, enfriamiento vesical y esofágico30. Existen situaciones particulares donde se podría elegir una técnica distinta a las anteriores dependiendo de las necesidades y condiciones clínicas del paciente. Sin embargo, muchas de ellas se encuentran en fases primarias de investigación y son necesarios estudios clínicos adecuados y a mayor escala para generalizar su uso (tabla 3). El enfriamiento esofágico ha demostrado ser un método eficaz para mantenimiento32. El método de enfriamiento intranasal se ha utilizado con éxito para la fase de inducción, aunque no ha mejorado los desenlaces en cuanto a supervivencia y pronóstico neurológico33.
Existe un grado de recomendación I, con un nivel de evidencia B (a partir de ensayos clínicos con asignación aleatoria, evidencia moderada para la recomendación) para la aplicación del TTM en casos de pacientes con PCR extrahospitalaria recuperada con ritmo desfibrilable. El TTM debe realizarse en base a un protocolo hospitalario que establezca los criterios y procedimientos a realizar.
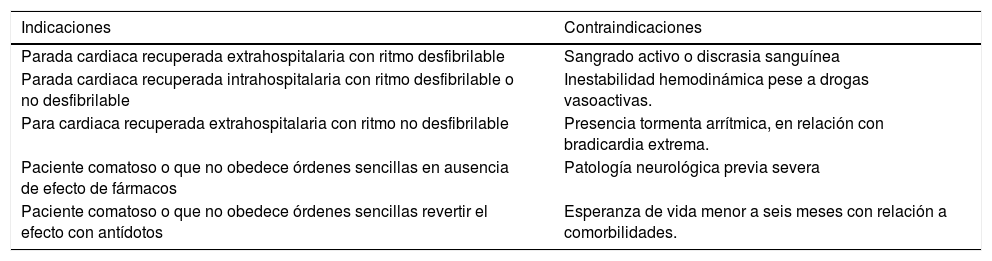
Indicaciones y contraindicacionesLa indicación de mayor evidencia científica para la aplicación del TTM es la PCR recuperada extrahospitalaria con ritmo desfibrilable. Sin embargo, ya se ha mencionado antes que existen otras indicaciones con menor nivel de evidencia que se enlistan en orden en la tabla 4. En esta misma tabla se listan las contraindicaciones del TTM, que incluyen las principales complicaciones durante la hipotermia, que incluyen las más importantes como la coagulopatía y aparición de arritmias.
Indicaciones y contraindicaciones del TTM15,34
| Indicaciones | Contraindicaciones |
|---|---|
| Parada cardiaca recuperada extrahospitalaria con ritmo desfibrilable | Sangrado activo o discrasia sanguínea |
| Parada cardiaca recuperada intrahospitalaria con ritmo desfibrilable o no desfibrilable | Inestabilidad hemodinámica pese a drogas vasoactivas. |
| Para cardiaca recuperada extrahospitalaria con ritmo no desfibrilable | Presencia tormenta arrítmica, en relación con bradicardia extrema. |
| Paciente comatoso o que no obedece órdenes sencillas en ausencia de efecto de fármacos | Patología neurológica previa severa |
| Paciente comatoso o que no obedece órdenes sencillas revertir el efecto con antídotos | Esperanza de vida menor a seis meses con relación a comorbilidades. |
- –
Algunos expertos recomiendan que la demora en el inicio del tratamiento sea de máximo 6-12 h desde el PCR, aunque otros recomiendan que el TTM se logre lo más pronto posible sin especificar un límite de tiempo.
- –
Los métodos controlados son los recomendables para realizar toda la técnica del TTM. Por tanto, los métodos no controlados serían útiles como adyuvantes únicamente en la inducción del TTM, no en el mantenimiento.
- –
Se sugiere mantener el TTM al menos 24 h en situación de hipotermia y hasta las 72 h desde que se produce el insulto en fase de normotermia controlada4,18,34.
- –
El retorno a la normotermia debe hacerse de forma controlada y activa con una tasa de recalentamiento entre los 0,2 oC/h y los 0,5 oC/h34 y una temperatura objetivo de 36,5-37 oC35. En las últimas recomendaciones europeas para la aplicación del TTM se recomienda que esta sea lenta de 0,15-0,25 oC/h36.
La monitorización del paciente debe incluir6:
- a.
Control invasivo de TA mediante catéter arterial y mantenimiento de tensiones arteriales medias (TAM) para mantener la presión de perfusión cerebral > 60 mmHg (en la mayoría de los casos ésta se encuentra alrededor de 80 mmHg, como se aplica en el manejo general de los pacientes neurocríticos). Sería adecuado tomar en cuenta el estado de la autorregulación cerebral.
- b.
Pulsioxímetro. Mantener un valor entre 94-98%, para evitar hiperoxemia6,37.
- c.
BIS: monitorización del nivel de vigilia del paciente, especialmente útil en pacientes sometidos a miorrelajación.
- d.
Monitorización ECG continua, para controlar el ritmo y detectar cualquier alteración precozmente.
- e.
EEG continuo recomendado sobre todo en pacientes sometidos a bloqueo neuromuscular para detectar posibles estatus mioclónicos.
La hipotermia incremente el riesgo de hemorragias y de transfusiones sanguíneas debido a una alteración de los parámetros de la coagulación que tiene lugar a partir de un descenso de 0,5 oC de temperatura39.
Complicaciones infecciosasSon frecuentes (hasta en un 70% de casos) y se ven favorecidas por el síndrome inflamatorio posparada cardiaca y la atenuación de la respuesta inmunitaria por la hipotermia. La ausencia de fiebre impide el diagnóstico temprano de la infección, por lo que la incidencia de sepsis es casi el doble con hipotermia (13 vs. 7%)14. Las neumonías son las más habituales (85%). Generalmente no se asocian con un incremento de la mortalidad39.
Trastornos hidroelectrolíticos y metabólicosDurante la hipotermia hay un aumento del tono simpático, responsable de la vasoconstricción y la reducción de la perfusión de los órganos. Esto favorece el desarrollo de acidosis metabólica con descenso del pH (de 7,37 a 7,31) y un incremento del lactato. La reducción de la demanda metabólica3,39 puede suponer un incremento del CO2 y cambios de ventilación durante la fase de recalentamiento que podrían provocar vasoconstricción cerebral.
La hiperglucemia es habitual por reducción de la síntesis de insulina41, pero no se recomienda tratarla por debajo de 180 mg/dL para evitar hipoglucemias.
Durante el enfriamiento se produce hipopotasemia e hipomagnesemia que favorecen la aparición de arritmias ventriculares potencialmente letales, por lo que ambos iones deben ser monitorizados31.
Complicaciones cardiovascularesLa hipotermia produce efectos directos en el corazón, como alteraciones del ECG (prolongación PR, ensanchamiento QRS y QTc) y aparición de arritmias. También puede existir un aumento de la frecuencia cardiaca (al inicio del TTM) seguida de una bradicardia sinusal (40-45 lpm) que reduce el gasto cardiaco entre un 25 y 40%39,41. Sin embargo no se ha descrito inestabilidad hemodinámica como consecuencia directa de la hipotermia42.
EscalofríosEs uno de los fenómenos más frecuentes durante la inducción del TTM. Se producen como respuesta fisiológica normal al descenso de la temperatura, en un intento de producir calor y aumentan el consumo de oxígeno en un 50-400%. Los escalofríos aparecen principalmente cuando la temperatura desciende entre 35-37 oC; una vez que se logra la temperatura objetivo de 32-34 oC, son menos frecuentes43. Se acompañan de hipertensión, aumento de la frecuencia cardiaca y vasoconstricción, y dificultan la fase de enfriamiento39.
Los escalofríos deben prevenirse tempranamente. Entre las opciones terapéuticas se encuentran44: antipiréticos/antiinflamatorios, agentes vasodilatadores, opioides, alfa-agonistas (i.e., dexmedetomidina), anestésicos y sedantes, agonistas de la serotonina y relajantes neuromusculares.
La administración de sulfato de magnesio a dosis de 0,5 a 1 mg/h intravenoso (objetivo en suero: 3-4 mg/dL)45, aumenta la velocidad de enfriamiento y la comodidad cuando se usan métodos controlados percutáneos, disminuyendo el tono del músculo liso y la vasodilatación subsecuente, causando una disminución de los escalofríos. Como beneficio añadido, el sulfato de magnesio tiene propiedades neuroprotectoras como agonista N-metil-D-aspartato (NMDA). A pesar de que el control de escalofríos con sulfato de magnesio suele ser menor que con fármacos sedantes y opioides, su perfil de bajos efectos adversos lo hace atractivo para su uso.
Los fármacos opioides son los más utilizados (e.g., fentanil, morfina, meperidina). La meperidina es posiblemente el más efectivo, y tiene una acción sinérgica con la buspirona en la supresión de escalofríos. Sin embargo, debe monitorizarse la aparición de convulsiones o daño renal asociados al uso combinado de estos dos fármacos44,45. Los alfa-agonistas, como la dexmedetomidina, disminuyen la aparición de escalofríos, sin embargo, su uso está limitado por la aparición de bradicardia e hipotensión.
Suelen ser necesarios los sedantes en conjunto con opioides, titulando la dosis en función de la supresión de los escalofríos. Entre ellos se encuentran el propofol y benzodiacepinas. En casos graves se pueden utilizar relajantes neuromusculares. Sin embargo, se debe considerar que los relajantes pueden enmascarar la aparición de convulsiones, cuya aparición es frecuente en los pacientes post-PCR recuperada.
Efectos sobre la farmacocinética de los medicamentosHay que tener en cuenta que el TTM induce cambios sobre la absorción, la cinética y el metabolismo de los fármacos y conocerlos para modificar el tratamiento en esto pacientes42,46.
Neuropronóstico tras parada cardiaca y tratamiento con control de temperaturaLa mayoría de los pacientes que sobreviven a una parada cardiaca se encuentran en coma inmediatamente después de la recuperación de la circulación como resultado de la isquemia transitoria difusa cerebral. Uno de cada tres tiene una recuperación de la conciencia retrasada (72 horas después de la instauración del TTM y la suspensión de la sedación) y un 23% permanece en coma tras una semana de ingreso47. Entre el 15 y el 30% de los pacientes con buen pronóstico se despiertan entre 48 horas y 10-12 días después de suspender la sedación.
El establecimiento temprano de un pronóstico funcional, que pueda distinguir entre despertar lento y daño irreversible o catastrófico, de forma estructurada y multimodal, es primordial para adecuar el esfuerzo terapéutico47-49. El pronóstico funcional queda establecido entre los tres y los seis meses tras el episodio. Un mal pronóstico funcional incluye la muerte de causa neurológica, el estado vegetativo y la discapacidad grave.
Herramientas para establecer el pronóstico neurológicoExploración clínica. Es la piedra angular de la toma de decisiones. Debe hacerse una aproximación estandarizada con protocolos escritos, registro en la historia clínica y exploraciones repetidas49. Es fundamental el valor pronóstico de la exploración física, sobre todo el aspecto motor de la escala de Glasgow (GCS), reflejos pupilares y corneales.
Electroencefalografía (EEG)50. Es una evaluación recomendable. No se ve influenciada por las temperaturas habituales del TTM, aunque sí por los fármacos sedantes. Además, es una evaluación importante para descartar un estatus epiléptico no convulsivo, una entidad tratable y que empeora el pronóstico de los pacientes51.
Potenciales evocados. Es la prueba más fiable para la predicción del pronóstico neurológico en pacientes posparada cardiaca con TTM, con una RPF (tasa de falsos positivos) de 0,4% [IC: 0-2%]49.
En un metaanálisis reciente, la evaluación clínica a pie de cama y la realización de potenciales evocados fueron útiles de predecir el pronóstico neurológico en pacientes en TTM, cuya especificidad es mejor cuando se realiza después de 72 horas52.
Espectroscopia cercana al infrarrojo. No se ha definido un papel claro de esta técnica para establecer el pronóstico neurológico post-PCR extrahospitalaria53.
Biomarcadores. Valoran el daño neuronal, son fáciles de obtener y sus resultados son independientes de la sedación47.
Pruebas de imagen. El TAC es fundamental cuando existe traumatismo craneoencefálico o lesión hemorrágica y en el diagnóstico temprano de la lesión isquémica cerebral pasadas 24 horas.
Según el metaanálisis de Golan et al.52, de 2014, los tres test que predicen mal pronóstico con nivel de falsos positivos (RFP) bajo son: no reflejos pupilares más de 24 horas (RFP: 2% [IC: 1-6%] pero baja sensibilidad), no reflejo corneal más de 24 horas (RFP: 4% [IC: 1-9%]) y ausencia de potenciales bilaterales evocados (RFP 3% [IC: 1-7%]). Otras pruebas con peor RFP son el GCS < 2 (alta sensibilidad del 70-80% y baja especificidad), los patrones EEG de mal pronóstico, el estatus mioclónico y las elevadas concentraciones de enolasa a las 72 horas. También será importante conocer los factores asociados con un buen pronóstico como: el EEG con reactividad temprana en las primeras 12 horas, reactividad auditiva en el EEG en el segundo día y la RMN sin alteraciones de la difusión en la primera semana.
De acuerdo con las guías del European Resuscitation Council y de la European Society of Intensive Care Medicine (ERC-ESCIM) 201448 los potenciales evocados con ausencia de componentes N20 tienen una buena capacidad de discriminación en normotermia. El EEG tiene un valor alto con la falta de reactividad y la presencia de brotes de supresión, pero no se debe utilizar antes de las 72 horas por el riesgo de interferencia con el TTM y la sedación; y debe utilizarse junto con otros test. Los datos sobre la validez de la neuroimagen, biomarcadores, o ambos, no son concluyentes a limitados52,54.
Aproximación multimodalLa recomendación más extendida para realizar un neuropronóstico es la aproximación multimodal con diversos elementos clínicos, instrumentales y de laboratorio (tabla 5).
Aproximación multimodal para realizar el neuropronóstico
| 1-2 días | PCR/TTM/recalentamiento | |
|---|---|---|
| 3-5 días | RMNExcluir factores de confusión (sedación residual) | Vidas medias, medición de niveles, BIS evolución |
| Paciente inconsciente M:1-2Sin reflejos pupilares y cornealAusencia de N20SSP bilateral | Mal pronóstico muy probable Falsos+< 5% 95% IC | |
| Si no se cumple lo anterior 24 horas de observación con neuroprotección | ||
| Estatus de mioclonías precoz < 48 hNiveles altos enolasaEEG con brotes de supresiónLesión anóxica difusa en TAC o RMN | Deben ser tratadas. Si son refractarias al tratamiento, indican mal pronóstico* | |
| Otras situaciones: reevaluar, empoderamiento familiar, observar | Pronóstico indeterminado |
PCR: parada cardiorrespiratoria; RMN: resonancia magnética; TAC: tomografía axial computada; TTM: control estricto de la temperatura.
Se recogen a continuación las recomendaciones alcanzadas por el grupo de expertos.
Control de temperatura y neuroprotección- –
El control de temperatura ha sido la manera fundamental de establecer neuroprotección en los enfermos con síndrome de posparada cardiaca en los últimos 15 años.
- –
La neuroprotección farmacológica en los enfermos neurocríticos, sean posparada o de otro tipo, no ha proporcionado los efectos deseados.
- –
Con la evidencia existente en la actualidad se recomienda el control estricto de la temperatura entre 32 y 36 oC en los pacientes en coma recuperados de una parada cardiaca. La evidencia es mayor con niveles bajos de temperatura.
- –
El nivel elegido de temperatura debe de mantenerse al menos 24 horas. Hay algún estudio que presenta mejores resultados en terapias más prolongadas.
- –
El calentamiento debe de ser controlado entre 0,2 y 0,5 oC por hora y mantenerse la normotermia de forma activa durante al menos 24 horas adicionales.
- –
Antes de elegir el método ideal de control de temperatura se deben tener en cuenta diferentes factores, aplicando los conocimientos técnicos, disponibilidad y aplicabilidad que requiere la utilización de cada uno, y que pueden influir sensiblemente en su efectividad.
- –
Cuando se induce TTM, la aparición de temblores (tiritonas) asociados a hipotermia, suelen hacer necesarios la sedación y bloqueo neuromuscular de los pacientes.
- –
Tanto los métodos percutáneos como los intravasculares son efectivos para mantener la temperatura recomendada durante 12-24 horas, pero deben considerarse la mayor precisión de los dispositivos que regulan la temperatura de forma constante y los riesgos asociados a los dispositivos invasivos.
- –
Dependiendo de la experiencia de los centros hospitalarios, es común que se utilicen 2 o más métodos de control de temperatura simultáneamente para lograr la reducción de la temperatura. No obstante, se deben tomar en cuenta los riesgos de sobrepasar el límite terapéutico y evitar riesgos para los pacientes.
- –
Los métodos convencionales (hielo, mantas de agua, etc.) no tienen capacidad de autorregulación con lo que, aunque pueden ser útiles para ayudar en la velocidad del enfriamiento, no se recomiendan para el mantenimiento de la temperatura por su escasa precisión y su dificultad en el manejo.
- –
Los métodos controlados son los indicados para la inducción (en combinación o no con métodos convencionales) y el mantenimiento del control de temperatura, sin que haya diferencias significativas en cuanto a lo que a evolución clínica se refiere entre ellos. Ambos métodos (percutáneo o intravascular) son válidos, pero debe valorarse siempre el riesgo para el paciente del método invasivo.
- –
El método de enfriamiento intranasal se ha utilizado con éxito para la fase de inducción, aunque no ha mejorado los desenlaces en cuanto a supervivencia y pronóstico neurológico.
- –
Otros métodos incluyen: métodos de enfriamiento extracorpóreo, el uso de terapia de reemplazo renal continuo, enfriamiento vesical y esofágico.
- –
El enfriamiento esofágico ha demostrado ser un método eficaz para mantenimiento.
- –
Es necesaria la elaboración de un protocolo que especifique de forma clara a qué pacientes que se va a realizar la terapia y de qué forma se va a realizar, con el fin de homogeneizar el tratamiento de los pacientes y optimizar los resultados.
- –
El protocolo debería incluir aspectos relacionados con la técnica, con la prevención de complicaciones, con el manejo general del paciente y con la valoración neurológica.
- –
El papel de enfermería en la implementación de la técnica de manejo de temperatura en UCI es fundamental. Poder disponer de personal con una buena formación en el manejo de esta técnica y de este tipo de pacientes resulta crucial para su éxito.
La compañía Bard BD ha dado soporte logístico para facilitar las reuniones de expertos sin influir en el contenido del documento. RFR ha recibido honorarios de MSD, Pfizer, Shionogi, BD, Philips, Jafron, Toray y Thermofisher. MCF ha realizado labores de consultoría e información por BD e Innovasc. El resto de autores no refiere conflictos de interés.
El grupo de expertos agradece la colaboración de los siguientes especialistas en el desarrollo de la revisión y elaboración de recomendaciones:
Amaia Martiarena Orce. Médico adjunto en medicina intensiva, Complejo Hospitalario de Navarra.
Ara Murillo Pérez. Supervisora de enfermería, unidad de medicina intensiva, Hospital 12 de octubre, Madrid.
Juan Carlos Ruiz Rodríguez. Médico adjunto en el servicio de medicina intensiva del Hospital Vall d́ Hebrón, Barcelona.
Erika Plata Menchaca. Investigadora clínica del grupo Shock, Disfunción Orgánica y Resucitación (SODIR) del Vall d’Hebron Institut de Recerca (VHIR), Barcelona
Ana Loza Vázquez. Médico adjunto del servicio de Medicina Intensiva del Hospital Nuestra Señora de Valme, en Sevilla.
Francisco Lucena Calderón. Médico adjunto del servicio de Medicina Intensiva del Hospital Nuestra Señora de Valme, en Sevilla.
Sandra Rosillo Rodríguez. Médico adjunto de la unidad de cuidados agudos cardiológicos, servicio de cardiología del hospital de la Paz.