INTRODUCCIÓN
La incidencia de síndrome coronario agudo con elevación de ST (SCACEST) en la mujer durante el embarazo y puerperio oscila entre 1:10.000-1:30.000 gestaciones1,2. Es de esperar que vaya en aumento, dada la tendencia general a embarazos en edades cada vez mayores, con el consiguiente incremento en la prevalencia de los factores de riesgo cardiovascular. La primera referencia publicada data de 19223 y desde entonces se han comunicado alrededor de 150 publicaciones de casos aislados. Las revisiones que recogen un mayor número de casos se publicaron en el año 1996 e incluyen un total de 125 y 136 casos bien documentados4,5.
EPIDEMIOLOGÍA
La presentación del SCACEST durante el embarazo es más frecuente en multíparas, en la tercera década y durante el tercer trimestre de gestación, siendo la localización más frecuente la cara anterior. En cambio el SCACEST posparto ocurre más frecuentemente en primíparas jóvenes con preeclampsia4-6.
Su aparición constituye una situación de alto riesgo materno-fetal, con una mortalidad materna elevada que varía entre el 19% y el 24%. Ésta es superior en los casos que acontecen en el tercer trimestre de gestación, así como también cuando el parto ocurre en los 14 días postinfarto1,4,5. En relación con el método del parto, se ha constatado una mortalidad del 11% en aquellas mujeres que tuvieron el parto por vía vaginal frente a un 20% de mortalidad entre las pacientes sometidas a cesárea, aunque los grupos no son comparables puesto que generalmente se sometían a cesárea aquellas con problemas obstétricos y los casos de cardiopatías más graves7.
Se ha descrito una mortalidad fetal del 13%, la mayoría de los casos asociados con el fallecimiento de la madre y el resto debido a la existencia de abortos espontáneos4.
ETIOLOGÍA
Entre los factores a considerar por su relación con el SCACEST durante el embarazo se encuentran los factores de riesgo coronario clásicos, de los cuales el tabaco y la hipertensión arterial son los más prevalentes entre las pacientes que lo desarrollan, así como el uso previo de anticonceptivos orales, toxemia del embarazo y edad avanzada de la madre5,8.
Son de resaltar, asimismo, las importantes alteraciones en el sistema de la coagulación y de la fibrinólisis que ocurren durante el embarazo y que contribuyen a aumentar el riesgo de trombosis coronaria. Estas alteraciones incluyen la disminución de la liberación del activador tisular del plasminógeno, cambios en las concentraciones de los factores de la coagulación y la reducción de la concentración de proteína S9,10.
Otro factor etiológico importante son los cambios histológicos de la pared arterial, tales como la pérdida de la disposición normal de las fibras elásticas, la fragmentación de las fibras de reticulina y el descenso del contenido de mucopolisacáridos, todos ellos inducidos por modificaciones hormonales durante la gestación11.
También hay que tener en cuenta los cambios fisiológicos que suceden en el sistema cardiovascular durante el embarazo y el parto, y que constituyen un terreno propicio para la manifestación de la cardiopatía isquémica: la anemia fisiológica y la disminución de la presión sanguínea diastólica, el aumento de la volemia de hasta un 40% en el tercer trimestre y el aumento del gasto cardíaco, fundamentalmente durante el trabajo del parto12.
De manera más ocasional, algunos fármacos utilizados con relativa frecuencia durante el embarazo y el parto también se han asociado con la aparición de SCACEST, como alcaloides ergóticos, bromocriptina, ritodrina y nifedipino4.
Además, la presencia de determinadas enfermedades se ha asociado con la aparición de SCACEST durante el embarazo y parto, como feocromocitoma, síndrome antifosfolípido, síndrome de Ehlers-Danlos, enfermedad de Still, enfermedad de Kawasaki y enfermedades del colágeno3.
FISIOPATOLOGÍA
En cuanto a la fisiopatología, según los datos angiográficos publicados por diversos autores, en el 43% de las pacientes se encontraron lesiones ateromatosas con o sin trombo intracoronario, más comúnmente en mujeres durante el período anteparto. Se ha descrito la presencia de trombos sin evidencia de enfermedad aterosclerótica en el 21% de las pacientes evaluadas, coronarias normales en un 29% de los casos y disección de las coronarias en un 16% de las pacientes, siendo ésta la principal causa de infarto en el período posparto4,5.
CASO CLÍNICO
Se trataba de una mujer de 32 años, gestante de 11 semanas, sin hábitos tóxicos ni factores de riesgo cardiovascular conocidos. Con antecedentes de alergia a penicilina y aborto espontáneo 4 meses previos al ingreso.
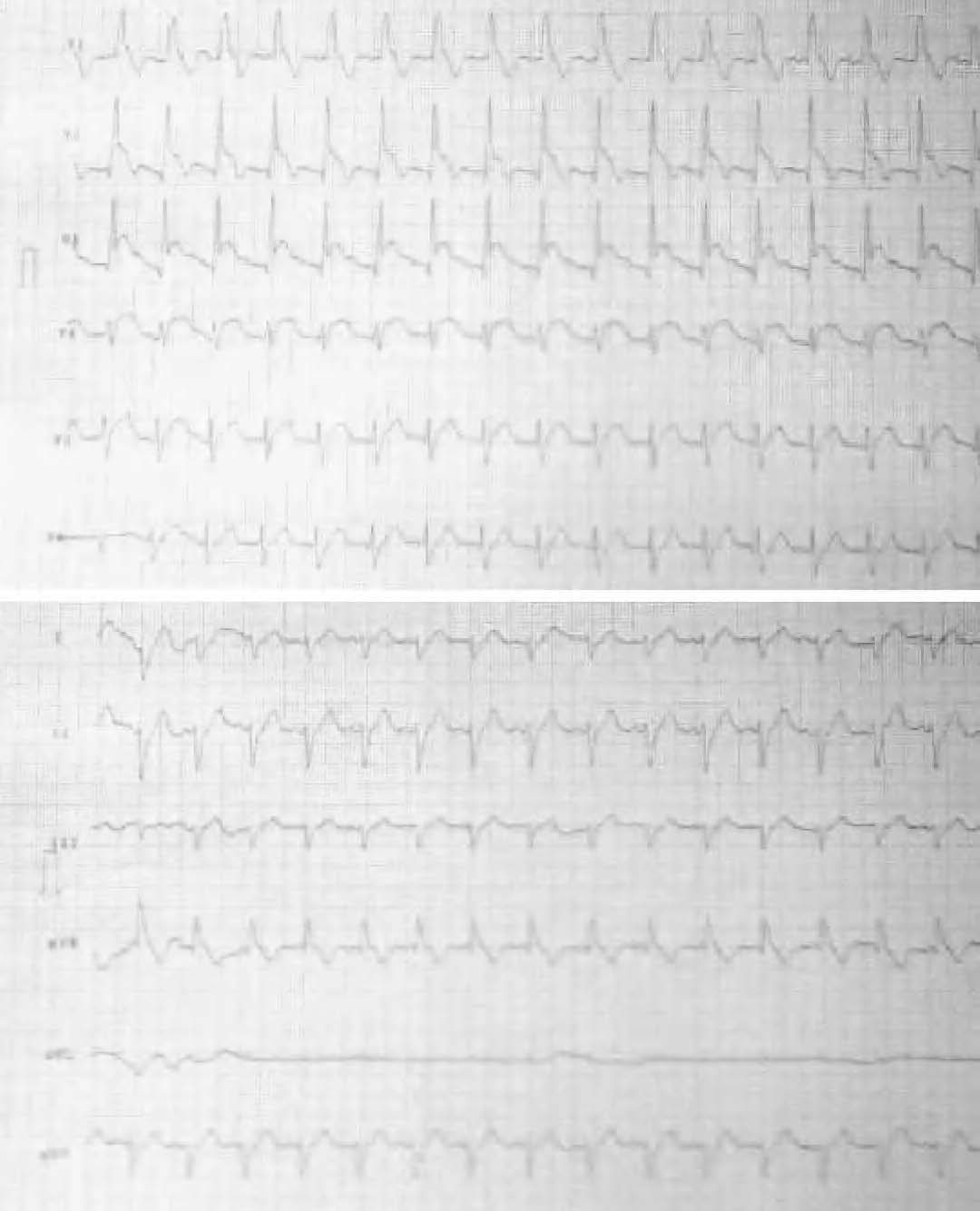
Acudió al Servicio de Urgencias por episodio de dolor torácico típico, encontrándose la paciente normotensa y evidenciándose en el electrocardiograma (ECG) taquicardia sinusal a 110 lpm y una corriente de lesión subepicárdica de V2 a V5 (fig. 1). En la exploración física no se objetivaron alteraciones, destacando en la analítica inicial leucocitosis con neutrofilia y troponina elevada.
Figura 1. Electrocardiograma de la paciente en el momento del ingreso.
Inicialmente se administró tratamiento con cloruro mórfico 3 mg por vía intravenosa (IV), diazepam 5 mg por vía oral (VO), nitroglicerina 10 mcg/minuto IV, ácido acetilsalicílico (AAS) 200 mg VO, enoxaparina 30 mg IV, clopidogrel 300 mg VO y ranitidina 50 mg IV; obteniéndose una buena respuesta inicial al tratamiento médico, cediendo las manifestaciones clínicas y eléctricas.
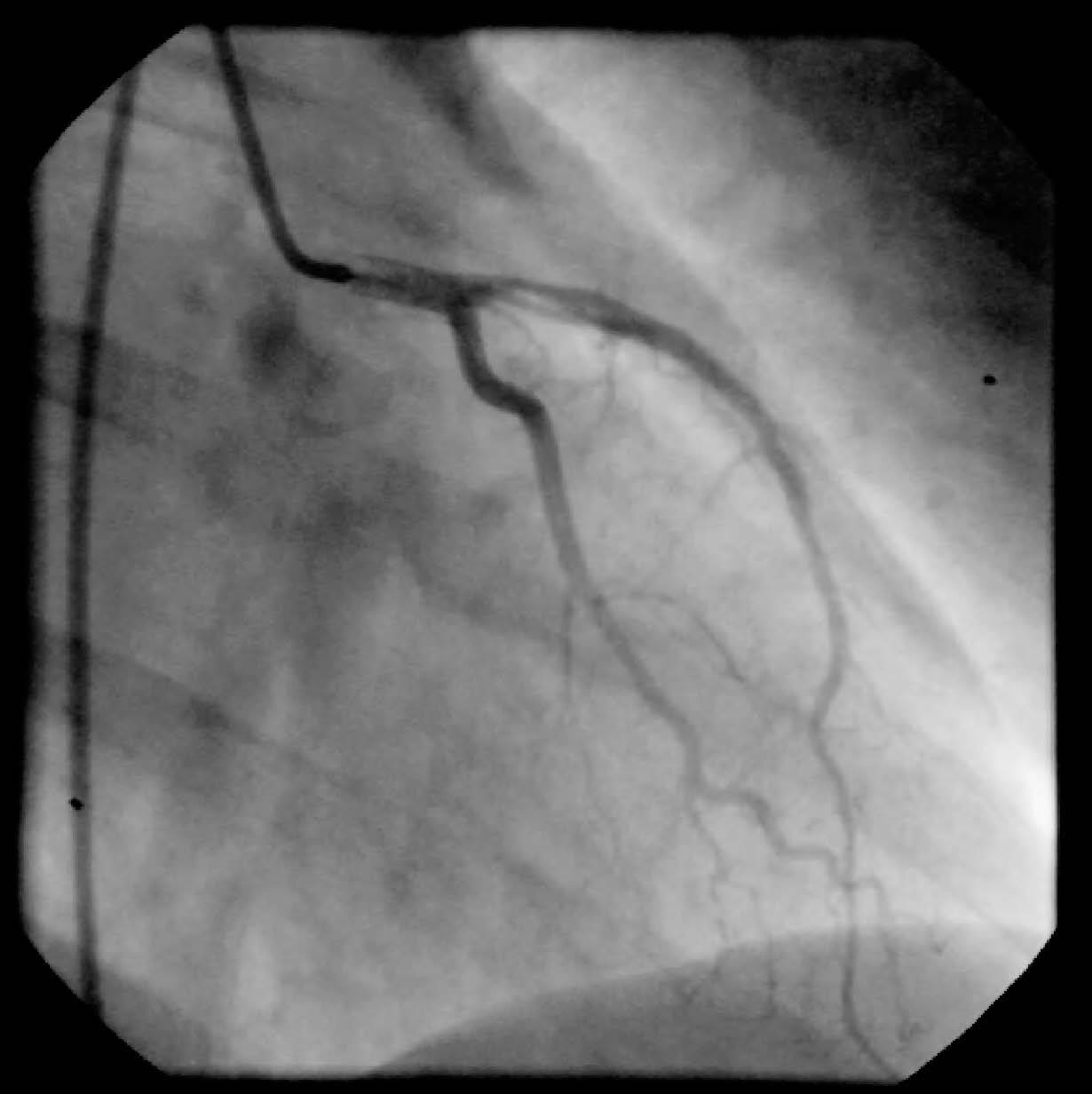
Ante la contraindicación relativa de la fibrinólisis en este contexto, se decidió la realización de un cateterismo cardíaco. En éste se objetivó arteria descendente anterior con una estenosis proximal inferior al 30%, con contenido trombótico y un flujo TIMI III (trombolysis in myocardial infarction). No se observaron lesiones en otros vasos, y la fracción de eyección ventricular fue normal. Asimismo, se evidenció una hipocinesia anterior (fig. 2).
Figura 2. Coronariografía en la que se observa la arteria descendente anterior proximal con contenido trombótico pero con buen flujo distal.
Dada la respuesta positiva eléctrica y clínica al tratamiento médico y los hallazgos de la coronariografía, se decidió no intervenir en un primer momento y observar la evolución.
Posteriormente se le realizó una ecocardiografía transtorácica que mostró el ventrículo izquierdo no dilatado ni hipertrófico con función sistólica moderadamente deprimida, acinesia septobasal, septomedial y discinesia septoapical. Un estudio de hipercoagulabilidad inicial resultó normal.
Durante su estancia en el hospital la paciente permaneció asintomática, realizándosele antes del alta una ergometría que no mostró signos de isquemia a baja carga. Fue dada de alta a los 12 días sin complicaciones, en tratamiento con bisoprolol y AAS.
En la semana 38 de gestación, una vez excluida la presencia de alteraciones fetales y con la paciente asintomática, se decidió suspender el tratamiento una semana y realizar una cesárea de la que se obtuvo un recién nacido sano. El período posparto cursó sin incidencias, siendo reintroducido el tratamiento posteriormente.
TRATAMIENTO DEL SCACEST EN EMBARAZO Y PUERPERIO
La estrategia de tratamiento óptima del SCACEST en mujeres durante el embarazo y puerperio no se ha establecido. Dada la baja incidencia de esta entidad clínica, no existen ensayos clínicos controlados y aleatorizados que comparen la intervención coronaria percutánea con la terapia fibrinolítica, y tampoco existen guías clínicas que establezcan el tratamiento farmacológico más adecuado de los disponibles actualmente, por lo que sólo podemos basarnos en los escasos datos observacionales publicados5,13. De cualquier modo, el tratamiento del SCACEST durante el embarazo está condicionado por los efectos que tanto técnicas como fármacos pudieran tener sobre el desarrollo normal de la gestación.
CORONARIOGRAFÍA
Dado que la situación de embarazo figura dentro de las contraindicaciones relativas del tratamiento fibrinolítico14,15, la mayoría de autores proponen la realización de una angiografía coronaria inmediata y la angioplastia coronaria transluminal percutánea, si procede, con o sin implantación de stent16,17.
Aunque este procedimiento se ha llevado a cabo con éxito durante el embarazo y el período posparto precoz en determinados casos, la experiencia en este grupo de pacientes es muy limitada18-21. Igualmente, ha de tenerse en cuenta que si se coloca un stent, debe continuarse con un tratamiento antiagregante combinado prolongado cuya seguridad en este grupo de población tampoco se ha establecido22,23. Por otra parte, se desconoce la seguridad de los stents coronarios recubiertos de fármacos inmunosupresores (paclitaxel, sirolimus, etc.) en mujeres embarazadas. Además, dado el riesgo de exposición fetal a la radiación, ha de valorarse especialmente durante las semanas 10-17 de gestación; y en caso de indicarse, debería realizarse con las máximas medidas de protección, recomendándose el acceso braquial16,24.
TRATAMIENTO FARMACOLÓGICO
Terapia fibrinolítica
Englobada en la categoría C de teratogenicidad, su uso se ve limitado en el embarazo, aunque, según algunos autores, la base para su contraindicación relativa en este período es estrictamente teórica y probablemente se haya adoptado a partir de la implantación de protocolos de investigación, en los que el embarazo era directamente un criterio de exclusión25,26.
La escasa experiencia clínica descrita en relación a la utilización de fibrinolíticos durante el embarazo ha sido mayoritariamente con estreptocinasa, urocinasa y alteplasa en pacientes con embolismo pulmonar masivo14,27-40, trombosis venosa profunda41, trombosis de prótesis valvulares42-50, ictus51 y SCACEST52-56. Aunque en la mayoría de los casos se describe una evolución fetal favorable y no se han comunicado casos de hemorragia fetal o efectos teratógenos, se han documentado complicaciones que incluyen hemorragia materna, parto precoz y pérdida fetal27,28,41.
Hasta la fecha se desconoce el verdadero riesgo de hemorragia tras la fibrinólisis sistémica en mujeres embarazadas23, aunque una revisión reciente de todos los casos publicados sitúa el porcentaje de mortalidad materna en un 1,2% y la aparición de complicaciones hemorrágicas en un 8,1% de las pacientes14. Además, el riesgo de hemorragia se incrementa cuando el tratamiento fibrinolítico se administra en el período periparto4,54.
Los escasos estudios disponibles sobre el uso de fibrinolíticos durante el embarazo no han encontrado un efecto teratogénico. Además, la mayoría de los casos de pérdida fetal comunicados no pueden relacionarse directamente con el tratamiento, aunque esta posible asociación tampoco puede descartarse por completo4. Sin embargo, dado el riesgo elevado de complicaciones hemorrágicas, la mayoría de autores coinciden en que la administración de fibrinolíticos en gestantes debería restringirse a determinados casos individualizados, y tras una cuidadosa consideración de los pros y contras del tratamiento, limitándolo a gestantes con SCACEST cuando la coronariografía no pueda realizarse de manera urgente y cuando el infarto ocurra antes de la semana 14 de gestación por la posible embriopatía17,57.
Morfina
Englobada también en la categoría C de teratogenicidad, el uso de la morfina en este contexto es puntual para el tratamiento del dolor, y las dosis requeridas suelen ser bajas, por lo que el potencial efecto negativo queda muy limitado. De todas maneras, no se han descrito casos en los que se asocie la utilización terapéutica de morfina con el desarrollo de malformaciones congénitas, pero, puesto que atraviesa la placenta, puede causar depresión respiratoria neonatal cuando se administra previamente al parto58.
La morfina se excreta en la leche en cantidades traza, por lo que, aunque se ha comunicado un caso de secreción de concentraciones elevadas de morfina en la leche materna sin que se observaran efectos adversos en el lactante, se considera compatible con la lactancia materna59.
Diazepam
Englobado en la categoría D de teratogenicidad, diazepam y su metabolito, el desmetildiazepam, atraviesan la placenta y se acumulan en la circulación fetal y en los tejidos durante la organogénesis, alcanzando niveles en el feto hasta 3 veces superiores a los obtenidos en la madre60.
Al igual que con la morfina, es poco probable su uso prolongado. En general, los efectos de las benzodiazepinas durante el embarazo son controvertidos: algunos estudios manifiestan la asociación de su empleo con varios tipos de malformaciones congénitas, mientras que otros no encuentran relación alguna61.
Además, el diazepam puede acumularse en la leche materna, por lo que no se recomienda su utilización en mujeres durante el período de lactancia.
Tratamiento anticoagulante: heparinas de bajo peso molecular
Las heparinas están englobadas en la categoría B de teratogenicidad, y, generalmente, se consideran los fármacos anticoagulantes de elección durante el embarazo porque presentan un perfil adecuado de eficacia y seguridad, no cruzan la placenta y no se han relacionado con malformaciones fetales, a diferencia de los anticoagulantes orales62.
Se han publicado 3 revisiones sistemáticas sobre el uso de heparinas de bajo peso molecular (HBPM) durante el embarazo tanto para el tratamiento de eventos trombóticos agudos como para tromboprofilaxis incluyendo un total de 1.851 pacientes. En la mayoría de estas mujeres no se han observado efectos adversos graves, siendo la frecuencia de complicaciones hemorrágicas baja y sin que se hayan descrito hemorragias graves, ni casos de trombocitopenia atribuibles al tratamiento con enoxaparina. Además, ninguno de los casos de malformaciones congénitas observados en estos estudios se consideró relacionado con la administración de enoxaparina63,64.
Se recomiendan las mismas precauciones que en la población general cuando estas pacientes son sometidas a anestesia epidural u otras técnicas anestésicas regionales. En el caso de parto espontáneo, debe suspenderse el tratamiento y, en caso de hemorragia, debe valorarse la utilización de sulfato de protamina y hemoderivados para reducir el riesgo de sangrado y permitir una anestesia epidural segura62.
Por su elevado peso molecular y su inactivación en el tracto gastrointestinal, la posible repercusión en el lactante se considera despreciable59,61.
Ácido acetilsalicílico
El AAS está englobado en la categoría C de teratogenicidad, y su seguridad durante el embarazo es un aspecto muy debatido, especialmente en el tercer trimestre, en el que dosis elevadas de AAS pueden conducir a hemorragias graves en la madre y en el feto, malformaciones congénitas y cierre prematuro del ductus arteriosus65,66.
Se ha comprobado la seguridad de dosis bajas de AAS (¾ 150 mg/día) durante el segundo y tercer trimestre de gestación en cuanto al riesgo de hemorragias feto-maternas67-69.
Un estudio prospectivo controlado en el que se incluyeron 46 mujeres con historia de tromboembolismo o trombofilia concluye que la administración de 100 mg/día de AAS en combinación con enoxaparina, 40 mg/día, fue segura y bien tolerada en todos los trimestres de gestación70.
Aunque el AAS es secretado en la leche materna en bajas concentraciones, se ha recomendado precaución en su utilización por parte de mujeres en pe ríodo de lactancia, sin que se hayan comunicado efectos adversos59.
Clopidogrel
Encuadrado en la categoría B de teratogenicidad, la seguridad de clopidogrel en el embarazo se desconoce, especialmente cuando se emplea en combinación con AAS. Estudios en conejos y ratas sugieren que no produce toxicidad fetal, sin embargo, no se han llevado a cabo estudios en humanos71,72.
Sólo se han comunicado en la literatura cuatro casos aislados de pacientes en las que se empleó clopidogrel durante la gestación con buena evolución13,16,71,72. Sin embargo, el departamento de farmacovigilancia del laboratorio responsable refiere diez casos de exposición a clopidogrel en esta situación, presentándose en uno de ellos distrés respiratorio agudo al nacimiento que se resolvió favorablemente.
Estudios llevados a cabo en ratas han demostrado que el clopidogrel y sus metabolitos son excretados en la leche materna, sin embargo, no se conoce si el fármaco es excretado en la leche humana71,72.
Nitratos
Están encuadrados en la categoría C de teratogenicidad, y han sido empleados durante el embarazo en el tratamiento de la hipertensión, la isquemia miocárdica y el infarto. No se han observado efectos adversos del tratamiento con estos fármacos durante el embarazo, sin embargo, se recomienda un manejo cuidadoso para evitar la posible hipotensión materna y sus repercusiones fetales73.
No se dispone de datos acerca de su paso a la leche materna.
Bloqueadores beta
Están englobados en la categoría C de teratogenicidad, y todos ellos atraviesan la placenta. Sin embargo, existe experiencia suficiente con algunos de ellos (propanolol, atenolol, labetalol y metoprolol) que sugiere que su administración durante la gestación es segura, aunque se han descrito de manera anecdótica algunos efectos adversos como retraso en el crecimiento fetal, bradicardia, hipoglucemia, hiperbilirrubinemia y apnea al nacer74. Dado que los no selectivos pueden aumentar la actividad uterina, es preferible la utilización de agentes selectivos ß1.
Todos los bloqueadores beta son bases débiles y se acumulan en concentraciones más altas en la leche materna que en el plasma. Considerando además su posible acumulación en el lactante por la inmadurez de su sistema enzimático hepático, la monitorización de efectos adversos debe ser estrecha74. El propanolol y el labetalol son los que se encuentran en menores concentraciones en la leche materna debido a que tienen una mayor tasa de unión a proteínas plasmáticas, por lo que en principio serían los bloqueadores beta la elección en esta situación.
Inhibidores de la enzima convertidora de angiotensina
Están encuadrados en la categoría C de teratogenicidad en el primer trimestre y en la categoría D en el segundo y tercer trimestres. Son fármacos contraindicados durante el embarazo debido al aumento en la incidencia de enfermedad y muerte fetal. Las complicaciones comunicadas incluyen oligohidramnios, retraso del crecimiento intrauterino, parto prematuro, insuficiencia renal fetal y neonatal, malformaciones óseas, ductus arteriosus persistente, hipoplasia pulmonar, síndrome de distrés respiratorio, hipotensión prolongada y muerte fetal75,76.
Sin embargo pueden utilizarse con seguridad durante la lactancia materna.
Bloqueadores de los canales de calcio
Englobados en la categoría C, la experiencia creciente con nifedipino durante el embarazo para el tratamiento de hipertensión, preeclampsia, isquemia miocárdica y tocólisis han permitido comprobar su seguridad77. Sin embargo, se dispone de información más limitada acerca de la utilización de verapamilo y diltiazem, habiéndose asociado la utilización de diltiazem a una baja incidencia de malformaciones cardiovasculares61.
Nifedipino, verapamilo y diltiazem se consideran compatibles con la lactancia materna59.
Estatinas
Encuadradas en la categoría X de teratogenicidad, son escasos los trabajos en los que se comunica la evolución clínica de la utilización de estatinas durante el embarazo. Una revisión reciente sugiere un aumento de malformaciones del sistema nervioso central y esqueleto en niños nacidos tras una exposición a estatinas durante el primer trimestre de la gestación78. Además, se ha descrito su teratogenicidad en ratas, por lo que su utilización está contraindicada en gestantes79,80.
CONCLUSIONES
El tratamiento del síndrome coronario agudo en la mujer embarazada es controvertido, dados los datos limitados que existen acerca de la seguridad, tanto para la madre como para el feto, de los procedimientos diagnósticos y terapéuticos utilizados.
Por todo ello, tanto los procedimientos diagnósticos y terapéuticos, como el tratamiento médico, han de evaluarse de manera individualizada y en un contexto multidisciplinar, en el que médicos y farmacéuticos, en base a la evidencia disponible y la experiencia personal, han de diseñar la estrategia de actuación más adecuada.
De manera general, el manejo del SCACEST en pacientes gestantes no es distinto al de las no gestantes, a excepción de la contraindicación relativa de la terapia fibrinolítica durante el embarazo.
Se recomienda la administración de AAS, oxigenoterapia en gafas nasales, controlar la ansiedad y el dolor mediante el uso de diazepam y morfina, instaurar terapia antihipertensiva y antianginosa con nitroglicerina y bloqueadores beta, y anticoagulación con heparina.
En caso de requerirse actuaciones terapéuticas por complicaciones derivadas del infarto, las decisiones se deben tomar según la información disponible de los tratamientos que se contemplen. En general, a excepción de los inhibidores de la enzima convertidora de la angiotensina y la amiodarona, los fármacos vasoactivos, otros antiarrítmicos y los bloqueadores de los canales de calcio, no presentan contraindicaciones absolutas.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún
conflicto de intereses.