La infección por el virus SARS-CoV-2, denominada COVID-19 (COronaVIrus Disease 19), fue detectada inicialmente en China en diciembre 2019, y posteriormente se ha diseminado rápidamente por todo el mundo, hasta el punto de que el 11 de marzo la Organización Mundial de la Salud declaró que el brote podría definirse como pandemia. La COVID-19 presenta un cuadro que oscila desde episodios leves seudogripales a otros graves e incluso potencialmente mortales debido, sobre todo, a insuficiencia respiratoria aguda. Es frecuente el ingreso de estos pacientes en nuestros servicios de Medicina Intensiva en relación con un síndrome de distrés respiratorio agudo. La falta de un tratamiento con evidencia científica ha llevado al empleo de diferentes pautas terapéuticas, en muchas ocasiones, con modificaciones rápidas de los protocolos. Recientes revisiones en revistas de prestigio han destacado la falta de terapias probadas y la necesidad de ensayo clínicos que permitan establecer pautas de tratamiento claras y objetivas. Este documento tiene por objeto ofrecer una actualización de la terapia que se está aplicando en la actualidad, y una ayuda en la asistencia diaria, sin pretender sustituir los protocolos adoptados en cada centro.
Infection by the SARS-CoV-2 virus, known as COVID-19 (COronaVIrus Disease-19) was initially detected in China in December 2019, and has subsequently spread rapidly throughout the world, to the point that on March 11 the World Health Organization (WHO) reported that the outbreak could be defined as a pandemic. COVID-19 disease ranges from mild flu-like episodes to other serious and even life-threatening conditions, mainly due to acute respiratory failure. These patients are frequently admitted to our Intensive Care Units in relation to acute respiratory distress syndrome. The lack of a treatment based on scientific evidence has led to the use of different management guidelines, in many cases with rapid changes in the applied protocols. Recent reviews in reputed journals have underscored the lack of proven therapies and the need for clinical trials to establish clear and objective treatment guidelines. The present study provides an update on the currently applied treatment, and intends to offer help in relation to daily care, without seeking to replace the protocols adopted in each individual center.
La infección por el virus SARS-CoV-2, denominada COVID-19 (COronaVIrus Disease 19), fue detectada inicialmente en China en diciembre 20191, y posteriormente se ha diseminado rápidamente por todo el mundo, hasta el punto de que el 11 de marzo la OMS declaró que el brote podría definirse como pandemia2. En nuestro país, la SEMICYUC ha elaborado un Plan de Contingencia para organizar la asistencia a los pacientes críticos con COVID-193. SARS-CoV-2 provoca un cuadro que oscila desde episodios leves seudogripales a otros graves e incluso potencialmente mortales debido, sobre todo, a insuficiencia respiratoria aguda. Es frecuente el ingreso de estos pacientes en nuestros servicios de Medicina Intensiva en relación con síndrome de distrés respiratorio agudo (SDRA)4–6. La falta de un tratamiento respaldado por suficiente evidencia científica ha llevado al empleo de diferentes pautas terapéuticas y modificaciones rápidas de los protocolos. Recientes revisiones y editoriales han destacado la falta de terapias probadas y la necesidad de ensayos clínicos que permitan establecer pautas de tratamiento basadas en la evidencia7–9.
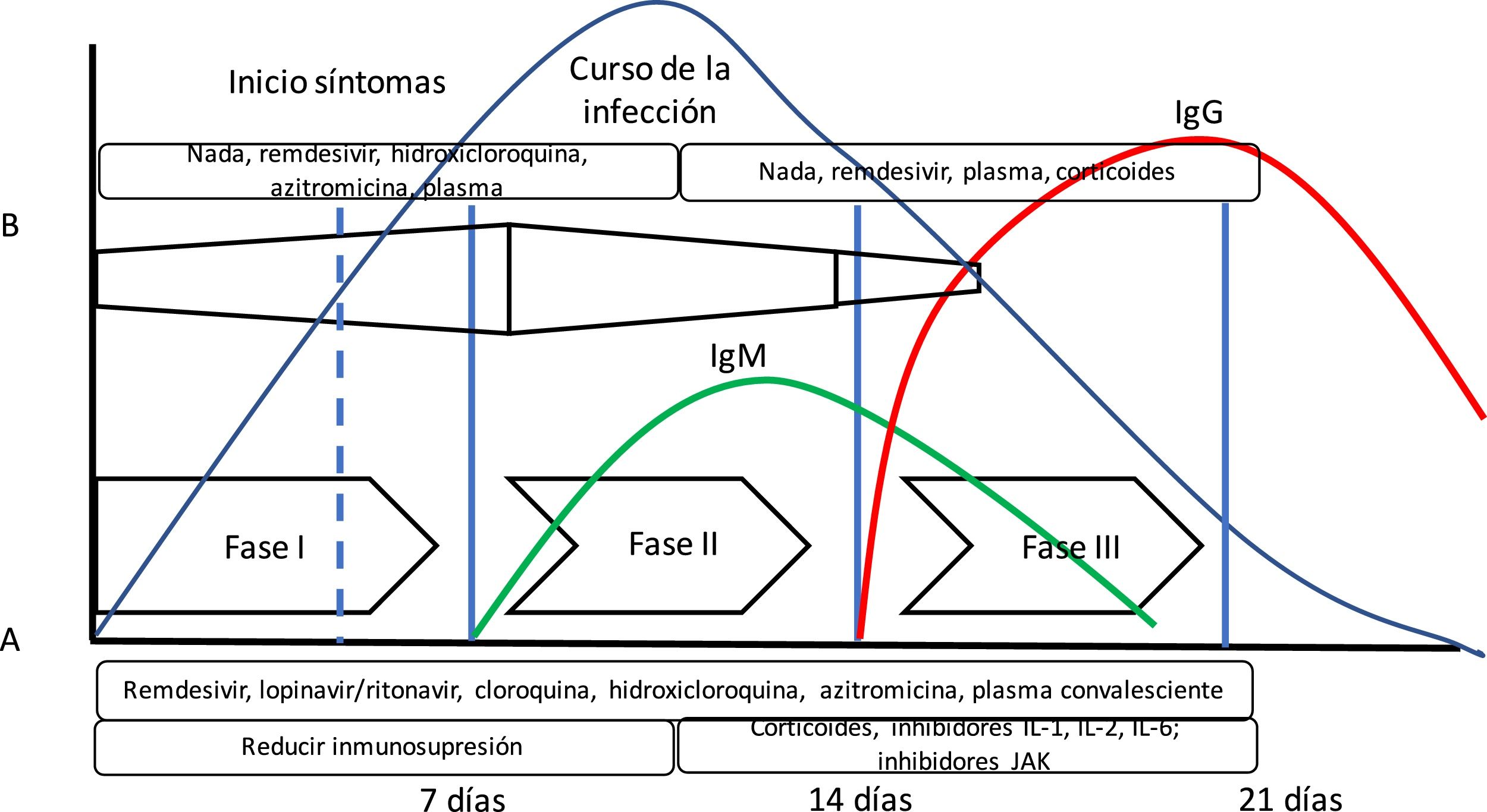
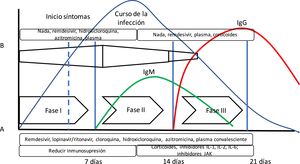
Se ha propuesto la teoría de que la enfermedad COVID-19 presenta varias fases evolutivas. La fase inicial estaría caracterizada por una elevada carga vírica, por lo que sería el momento ideal para administrar un tratamiento antivírico efectivo. En una segunda fase, predominaría la respuesta inflamatoria (incluso hablándose de tormenta de citoquinas), donde los fármacos antiinflamatorios tendrían mayor importancia10 (fig. 1). Sin embargo, esta teoría no se ha podido confirmar hasta el momento.
Evolución de la infección por SARS-CoV-2. En la gráfica se puede apreciar la disposición del curso de la infección por SARS-CoV-2 junto con la respuesta inmune mediada por anticuerpos. Además, se ha añadido (A) la propuesta de fases de Siddiqi y Mehra10 y la evolución de la respuesta inmune adaptativa mediada por la producción de anticuerpos y la evolución de una infección vírica habitual. Siddiqi y Mehra proponen un sistema de estadificación clínica en 3 fases para facilitar una nomenclatura uniforme. Así, proponen una fase i o de infección precoz, una fase ii o fase pulmonar, y una fase iii o fase hiperinflamatoria, junto con un tratamiento potencial en cada fase. Sin embargo, esto difiere en algo de lo que presenta la respuesta del organismo a una infección vírica (B). En la respuesta a la infección vírica, la respuesta inmune innata se inicia al principio de la infección, hasta que tras unos días existe la respuesta inmune adaptativa con producción de anticuerpos. Así, algunos fármacos utilizados en el tratamiento para COVID-19 pueden bloquear la interleuquina-1 que activa células T, o la interleuquina-6 que participa en la maduración de las células B que serán las que formarán los anticuerpos.
Para la elaboración de este documento se ha realizado una búsqueda bibliográfica en PubMed con las palabras COVID-19 o SARS-CoV-2 o coronavirus y treatment o therapy o tratamiento. De los diferentes fármacos que se han utilizado no se han revisado algunos con poco uso actualmente como ribavirina o ivermectina. El objetivo de este documento es aportar una actualización de la terapia que se está aplicando en la actualidad, y una ayuda en la asistencia diaria, sin pretender sustituir los protocolos adoptados en cada centro.
Tratamiento antivíricoLopinavir/ritonavirLopinavir es un inhibidor de la proteasa empleado en el tratamiento del virus de la inmunodeficiencia humana y que presenta actividad in vitro ante el virus SARS-CoV-1, causante en 2003 del síndrome de distrés respiratorio agudo severo (SARS)11. La combinación con ritonavir prolonga su vida media. También presenta actividad contra el coronavirus causante del MERS-CoV (Middle East respiratory syndrome)12.
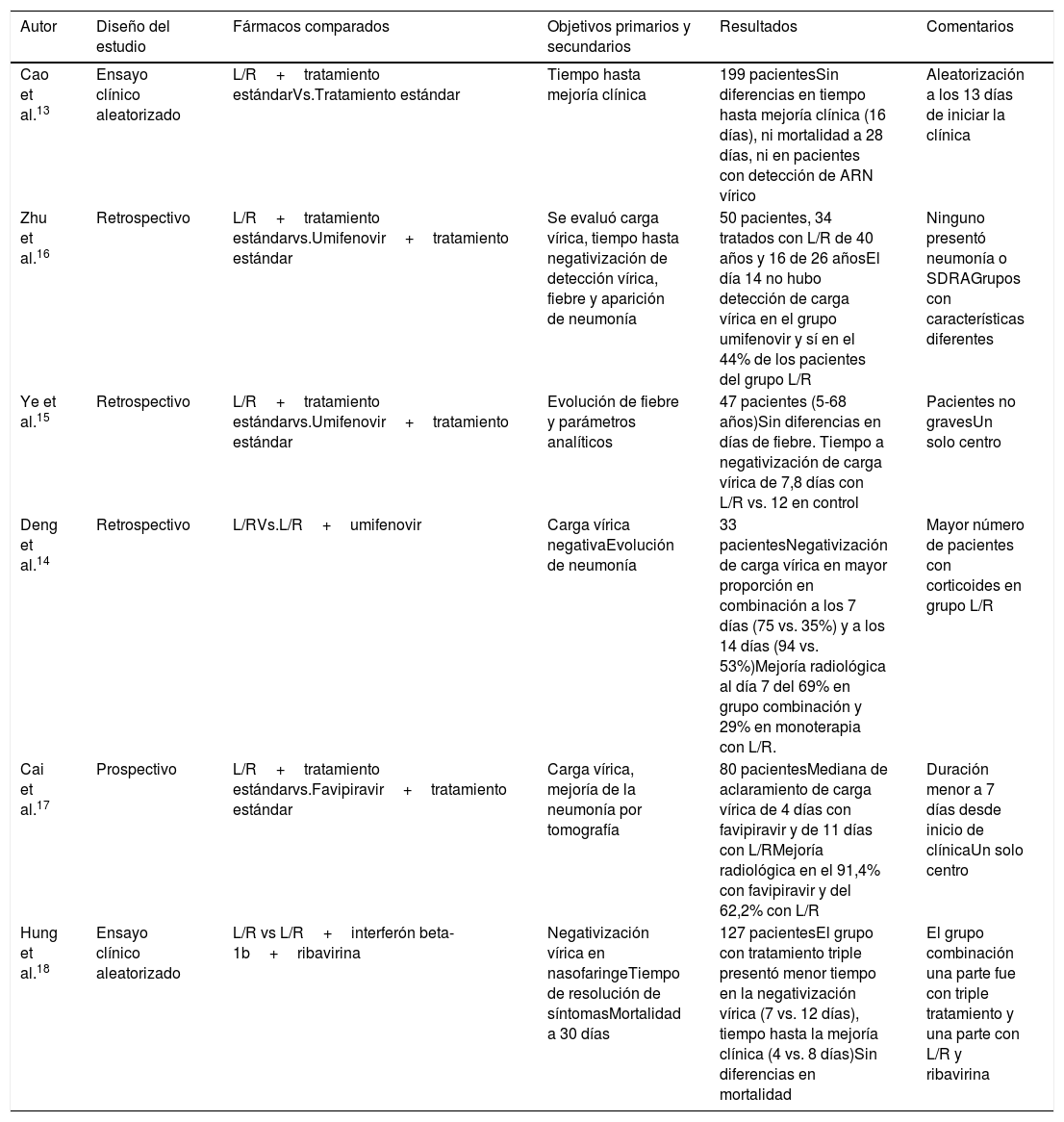
En base a su actividad ante otros coronavirus, se ha postulado que podría ser efectivo frente a SARS-CoV-2. Sin embargo, en el primer ensayo clínico aleatorizado (que incluyó a 199 pacientes), publicado recientemente, su uso no muestra mejoría en comparación con el tratamiento estándar13. Se incluyeron 199 pacientes (alrededor del 15% recibieron oxigenoterapia de alto flujo [OAF] o ventilación mecánica no invasiva, y solo 2 ventilación mecánica invasiva [VM]) que fueron aleatorizados con una mediana de evolución de 13 días (en el subgrupo de menos de 12 días tampoco se observaron diferencias). En la tabla 1 se presentan los diferentes estudios13–18.
Estudios con lopinavir/ritonavir
| Autor | Diseño del estudio | Fármacos comparados | Objetivos primarios y secundarios | Resultados | Comentarios |
|---|---|---|---|---|---|
| Cao et al.13 | Ensayo clínico aleatorizado | L/R+tratamiento estándarVs.Tratamiento estándar | Tiempo hasta mejoría clínica | 199 pacientesSin diferencias en tiempo hasta mejoría clínica (16 días), ni mortalidad a 28 días, ni en pacientes con detección de ARN vírico | Aleatorización a los 13 días de iniciar la clínica |
| Zhu et al.16 | Retrospectivo | L/R+tratamiento estándarvs.Umifenovir+tratamiento estándar | Se evaluó carga vírica, tiempo hasta negativización de detección vírica, fiebre y aparición de neumonía | 50 pacientes, 34 tratados con L/R de 40 años y 16 de 26 añosEl día 14 no hubo detección de carga vírica en el grupo umifenovir y sí en el 44% de los pacientes del grupo L/R | Ninguno presentó neumonía o SDRAGrupos con características diferentes |
| Ye et al.15 | Retrospectivo | L/R+tratamiento estándarvs.Umifenovir+tratamiento estándar | Evolución de fiebre y parámetros analíticos | 47 pacientes (5-68 años)Sin diferencias en días de fiebre. Tiempo a negativización de carga vírica de 7,8 días con L/R vs. 12 en control | Pacientes no gravesUn solo centro |
| Deng et al.14 | Retrospectivo | L/RVs.L/R+umifenovir | Carga vírica negativaEvolución de neumonía | 33 pacientesNegativización de carga vírica en mayor proporción en combinación a los 7 días (75 vs. 35%) y a los 14 días (94 vs. 53%)Mejoría radiológica al día 7 del 69% en grupo combinación y 29% en monoterapia con L/R. | Mayor número de pacientes con corticoides en grupo L/R |
| Cai et al.17 | Prospectivo | L/R+tratamiento estándarvs.Favipiravir+tratamiento estándar | Carga vírica, mejoría de la neumonía por tomografía | 80 pacientesMediana de aclaramiento de carga vírica de 4 días con favipiravir y de 11 días con L/RMejoría radiológica en el 91,4% con favipiravir y del 62,2% con L/R | Duración menor a 7 días desde inicio de clínicaUn solo centro |
| Hung et al.18 | Ensayo clínico aleatorizado | L/R vs L/R+interferón beta-1b+ribavirina | Negativización vírica en nasofaringeTiempo de resolución de síntomasMortalidad a 30 días | 127 pacientesEl grupo con tratamiento triple presentó menor tiempo en la negativización vírica (7 vs. 12 días), tiempo hasta la mejoría clínica (4 vs. 8 días)Sin diferencias en mortalidad | El grupo combinación una parte fue con triple tratamiento y una parte con L/R y ribavirina |
L/R: lopinavir/ritonavir.
Los efectos adversos más frecuentes son diarrea, náuseas, vómitos, hipertrigliceridemia e hipercolesterolemia. Los pacientes también pueden presentar pancreatitis o prolongación del QT. Se ha de tener presente que los 2 componentes son inhibidores de la isoforma CYP3A del P450, lo que favorece las interacciones con diversos fármacos de uso común en UCI.
RemdesivirRemdesivir es un profármaco, perteneciente al grupo de análogos de los nucleótidos, que se metaboliza intracelularmente en un análogo de adenosina trifosfato que inhibe las ARN polimerasas víricas. Presenta amplia actividad contra virus de la familia de los filovirus (virus Ébola, virus de Marburg), coronavirus (SARS-CoV-1, MERS-CoV) y paramixovirus (virus respiratorio sincitial) entre otros. Remdesivir se ha evaluado también como profilaxis en modelos animales ante infección por MERS y SARS19.
Remdesivir presenta menos interacciones que otros antivíricos, con un perfil de seguridad probado en estudios en fase 1 en más de 500 pacientes con infección por virus Ébola.
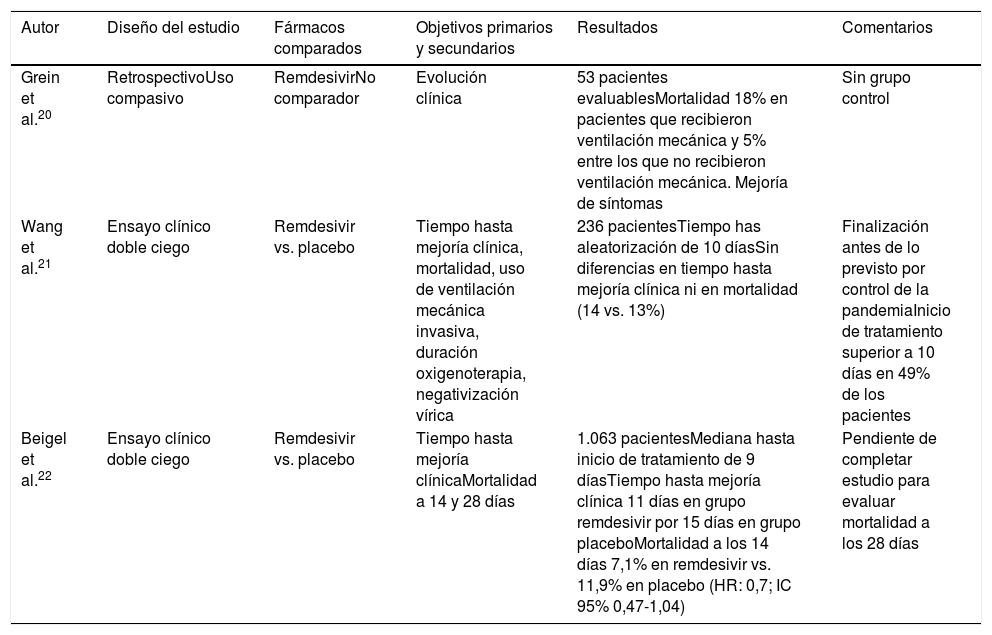
Se han publicado recientemente varios estudios sobre el uso de remdesivir en COVID-19 (tabla 2). El primero de ellos evalúa el uso compasivo de remdesivir en pacientes con COVID-1920. De los 53 pacientes analizados, el 57% recibió VM y el 8% ECMO. La mortalidad global fue del 13% (18% entre pacientes en VM, 5% entre los no ventilados).
Estudios con remdesivir
| Autor | Diseño del estudio | Fármacos comparados | Objetivos primarios y secundarios | Resultados | Comentarios |
|---|---|---|---|---|---|
| Grein et al.20 | RetrospectivoUso compasivo | RemdesivirNo comparador | Evolución clínica | 53 pacientes evaluablesMortalidad 18% en pacientes que recibieron ventilación mecánica y 5% entre los que no recibieron ventilación mecánica. Mejoría de síntomas | Sin grupo control |
| Wang et al.21 | Ensayo clínico doble ciego | Remdesivir vs. placebo | Tiempo hasta mejoría clínica, mortalidad, uso de ventilación mecánica invasiva, duración oxigenoterapia, negativización vírica | 236 pacientesTiempo has aleatorización de 10 díasSin diferencias en tiempo hasta mejoría clínica ni en mortalidad (14 vs. 13%) | Finalización antes de lo previsto por control de la pandemiaInicio de tratamiento superior a 10 días en 49% de los pacientes |
| Beigel et al.22 | Ensayo clínico doble ciego | Remdesivir vs. placebo | Tiempo hasta mejoría clínicaMortalidad a 14 y 28 días | 1.063 pacientesMediana hasta inicio de tratamiento de 9 díasTiempo hasta mejoría clínica 11 días en grupo remdesivir por 15 días en grupo placeboMortalidad a los 14 días 7,1% en remdesivir vs. 11,9% en placebo (HR: 0,7; IC 95% 0,47-1,04) | Pendiente de completar estudio para evaluar mortalidad a los 28 días |
Entre los estudios aleatorizados, Wang et al. evaluaron remdesivir vs. placebo en 237 pacientes adultos en Hubei (China)21. Aleatorizaron pacientes con hasta 12 días de evolución desde la aparición de los síntomas (mediana: 11 días), y se permitió el uso concomitante de lopinavir-ritonavir, interferón o corticoides. El tratamiento con remdesivir no se asoció a mejoría clínica.
Beigel et al.22 aleatorizaron 1.059 pacientes a recibir remdesivir o placebo, con una mediana de 9 días desde el inicio de síntomas. El tiempo de recuperación fue inferior en los pacientes tratados con remdesivir (11 vs. 15 días), aunque esa diferencia no se apreció en los pacientes con VM. La mortalidad a los 14 días fue del 7,1% con remdesivir y del 11,9% con placebo (0,47-1,04), quedando pendiente la evaluación de la mortalidad a los 28 días. Por otro lado, un estudio comparando el tratamiento con remdesivir en pautas de 5 o 10 días (en pacientes sin VM) no mostró diferencias en el estado clínico al día 1423.
Se han detectado efectos adversos como anemia o descenso del filtrado glomerular hasta en un 28,8% de los pacientes, con similar incidencia en el grupo que recibió placebo. También se ha observado la aparición de hipotensión arterial durante la infusión22.
Recientemente, el Ministerio de Sanidad ha aprobado su uso en pacientes con COVID-19 hospitalizados con enfermedad grave24.
Hidroxicloroquina y azitromicinaLa hidroxicloroquina es una 4-aminoquinolina antipalúdica que ha demostrado tener actividad in vitro contra diversos virus de ARN, incluido el SARS-CoV-225. Sin embargo, el potencial efecto del citado fármaco in vivo es una incógnita en la actualidad.
Se cree que hidroxicloroquina actúa a través de múltiples mecanismos26: inhibición de la entrada vírica, inhibición de la liberación vírica en la célula huésped, bloqueo de la activación de las proteasas endosómicas, reducción de la infectividad vírica y modulación inmune.
En comparación con la cloroquina, en estudios in vitro, la hidroxicloroquina ha demostrado ser más potente en la inhibición del COVID-1927,28. Se ha demostrado que, empleando una dosis segura de sulfato de hidroxicloroquina (6-6,5mg/kg/día) se alcanzan niveles séricos de 1,4–1,5μM en humanos, teóricamente suficientes para inhibir la infección por SARS-CoV-229.
Pese a los beneficios teóricos, los ensayos clínicos publicados hasta la fecha aportan una evidencia aún inconsistente. En varios estudios controlados realizados en hospitales chinos, el tratamiento con cloroquina ha logrado, en comparación con controles, prevenir el desarrollo de neumonía, mejorar la imagen radiológica pulmonar, acelerar la negativización del virus y acortar la duración de la enfermedad30–32. Sin embargo, estos estudios cuentan con importantes limitaciones metodológicas que provocan que sus resultados sean, al menos, cuestionables.
También se ha empleado azitromicina en asociación a hidroxicloroquina. Un estudio francés con escaso tamaño muestral y otros déficits metodológicos objetivó que el tratamiento con hidroxicloroquina aceleraba la conversión al estado de seronegatividad para el virus y que esta situación mejoraba con la combinación con azitromicina33.
Un estudio multicéntrico y retrospectivo ha comparado hidroxicloroquina, azitromicina, ambas en combinación o ninguno de ellos34. En este estudio, con 1.438 pacientes hospitalizados, el tratamiento con hidroxicloroquina, azitromicina o la combinación de ambos no se asoció a mejoría en la mortalidad hospitalaria. Por tanto, es necesario generar más evidencia al respecto, más aún teniendo en cuenta que tanto la hidroxicloroquina como la azitromicina se asocian con la prolongación del intervalo QT.
La eficacia de la hidroxicloroquina se está evaluando actualmente en al menos 30 ensayos clínicos.
Actualmente el Ministerio de Sanidad de España recomienda el empleo de hidroxicloroquina en el contexto de ensayos clínicos24.
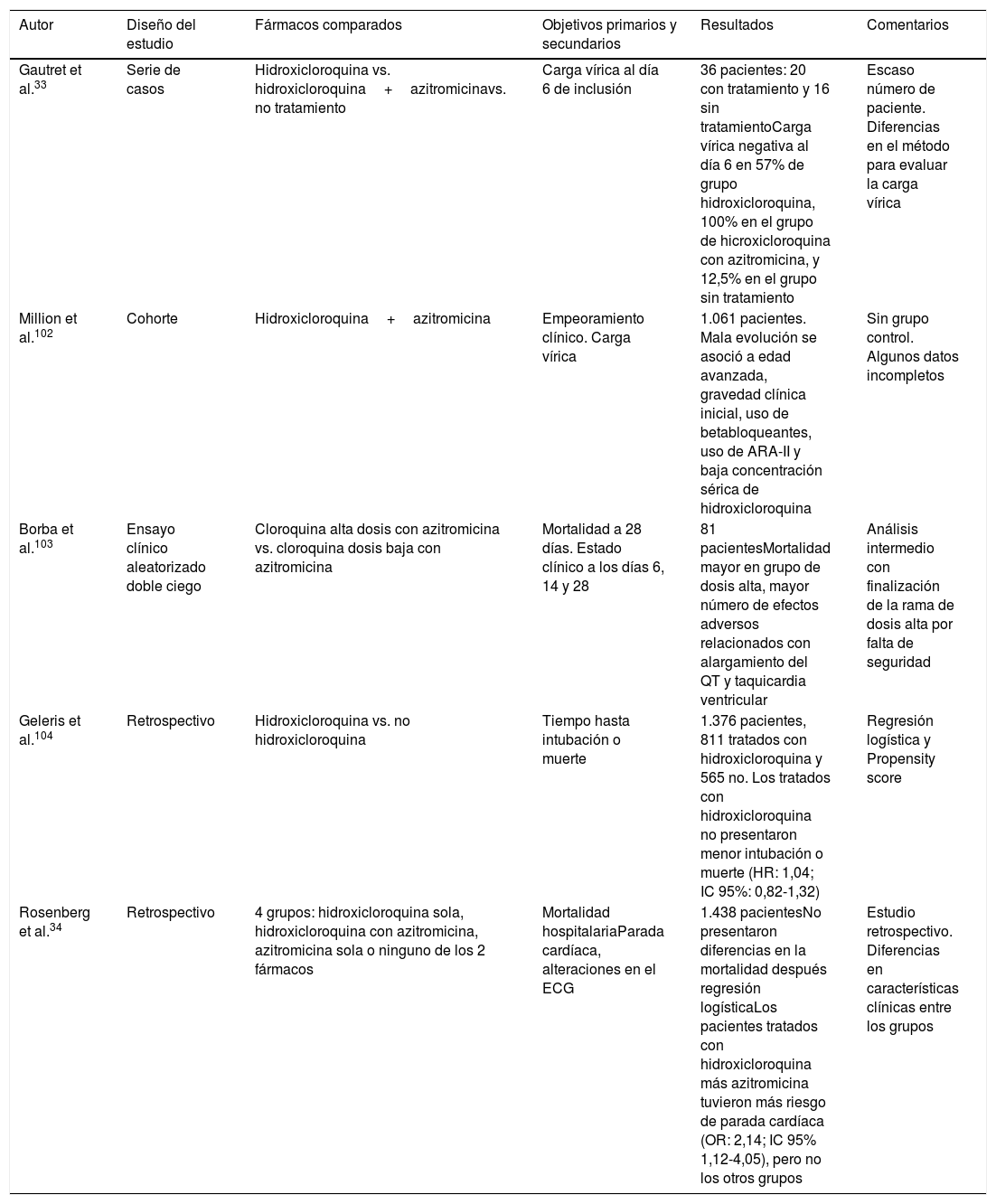
El uso de hidroxicloroquina está contraindicado en tratamiento concomitante con natalizumab (empleado en esclerosis múltiple) y agalsidalsa α o β (indicado en enfermedad de Fabry). Igualmente debe realizarse ajuste posológico de hipoglucemiantes, digoxina, betabloqueantes y antipsicóticos (clorpromazina, levomepromazina) dado que potencia su efecto. Su administración debe realizarse con precaución en caso de miastenia gravis, porfiria, patología retiniana, epilepsia (disminuye el umbral de convulsión), daño hepático, insuficiencia renal, déficit de 6-P-deshidrogenasa. Se debe extremar la precaución cuando sea administrada en asociación con fármacos que prolongan el intervalo QT. En la tabla 3 se describen algunos estudios del tratamiento con hidroxicloroquina y azitromicina.
Estudios con hidroxicloroquina y azitromicina
| Autor | Diseño del estudio | Fármacos comparados | Objetivos primarios y secundarios | Resultados | Comentarios |
|---|---|---|---|---|---|
| Gautret et al.33 | Serie de casos | Hidroxicloroquina vs. hidroxicloroquina+azitromicinavs. no tratamiento | Carga vírica al día 6 de inclusión | 36 pacientes: 20 con tratamiento y 16 sin tratamientoCarga vírica negativa al día 6 en 57% de grupo hidroxicloroquina, 100% en el grupo de hicroxicloroquina con azitromicina, y 12,5% en el grupo sin tratamiento | Escaso número de paciente. Diferencias en el método para evaluar la carga vírica |
| Million et al.102 | Cohorte | Hidroxicloroquina+azitromicina | Empeoramiento clínico. Carga vírica | 1.061 pacientes. Mala evolución se asoció a edad avanzada, gravedad clínica inicial, uso de betabloqueantes, uso de ARA-II y baja concentración sérica de hidroxicloroquina | Sin grupo control. Algunos datos incompletos |
| Borba et al.103 | Ensayo clínico aleatorizado doble ciego | Cloroquina alta dosis con azitromicina vs. cloroquina dosis baja con azitromicina | Mortalidad a 28 días. Estado clínico a los días 6, 14 y 28 | 81 pacientesMortalidad mayor en grupo de dosis alta, mayor número de efectos adversos relacionados con alargamiento del QT y taquicardia ventricular | Análisis intermedio con finalización de la rama de dosis alta por falta de seguridad |
| Geleris et al.104 | Retrospectivo | Hidroxicloroquina vs. no hidroxicloroquina | Tiempo hasta intubación o muerte | 1.376 pacientes, 811 tratados con hidroxicloroquina y 565 no. Los tratados con hidroxicloroquina no presentaron menor intubación o muerte (HR: 1,04; IC 95%: 0,82-1,32) | Regresión logística y Propensity score |
| Rosenberg et al.34 | Retrospectivo | 4 grupos: hidroxicloroquina sola, hidroxicloroquina con azitromicina, azitromicina sola o ninguno de los 2 fármacos | Mortalidad hospitalariaParada cardíaca, alteraciones en el ECG | 1.438 pacientesNo presentaron diferencias en la mortalidad después regresión logísticaLos pacientes tratados con hidroxicloroquina más azitromicina tuvieron más riesgo de parada cardíaca (OR: 2,14; IC 95% 1,12-4,05), pero no los otros grupos | Estudio retrospectivo. Diferencias en características clínicas entre los grupos |
El interferón-β 1b tiene actividad antivírica e inmunorreguladora, siendo un tratamiento empleado en la esclerosis múltiple. Interferón-β 1b ha demostrado presentar actividad in vitro contra SARS-CoV y MERS35,36. También se ha observado una reducción de la carga vírica de MERS en modelos animales37. Se ha empleado en monoterapia o en combinación con lopinavir/ritonavir. Un ensayo clínico en fase 2 ha comparado la combinación de lopinavir/ritonavir junto a ribavirina e interferón-β 1b vs. lopinavir/ritonavir en 127 pacientes en Hong Kong18, mostrando que la combinación negativizó antes la detección vírica mediante proteína C reactiva (PCR). Este estudio se diseñó para que interferón-β 1b no se administrara en el período de mayor inflamación por sus efectos proinflamatorios.
Se ha descrito que el interferón reduce la actividad del citocromo P450, por lo que hay que tener presente las potenciales interacciones farmacológicas38. Los efectos adversos más frecuentes son un cuadro gripal con fiebre, escalofríos, cefalea, artralgia o mialgia. También se ha descrito hipoglucemia, diarrea, aumento de transaminasas, anemia o trombocitopenia entre otros39.
Tratamiento antiinflamatorioCorticoidesLa respuesta inmunitaria del paciente parece desempeñar un importante papel en la fisiopatología tanto del daño pulmonar agudo como del SDRA. Los pacientes con COVID-19, particularmente aquellos con neumonía y SDRA, tienen niveles elevados de citoquinas proinflamatorias y otros biomarcadores inflamatorios40. Este es el motivo por el que algunos autores postulan el empleo de esteroides en este grupo de pacientes. Sin embargo, los resultados obtenidos en otras infecciones víricas muestran que su empleo por vía sistémica puede no solo no ser beneficioso, sino que puede asociarse a un incremento de la replicación y diseminación víricas41–43. Por otro lado, es dudoso que puedan asimilarse los resultados de los estudios de corticoides en pacientes en SDRA a los pacientes COVID-19, dado que estos estudios incluyen también a pacientes que presentan SDRA de causas extrapulmonares o no relacionadas con un origen infeccioso44.
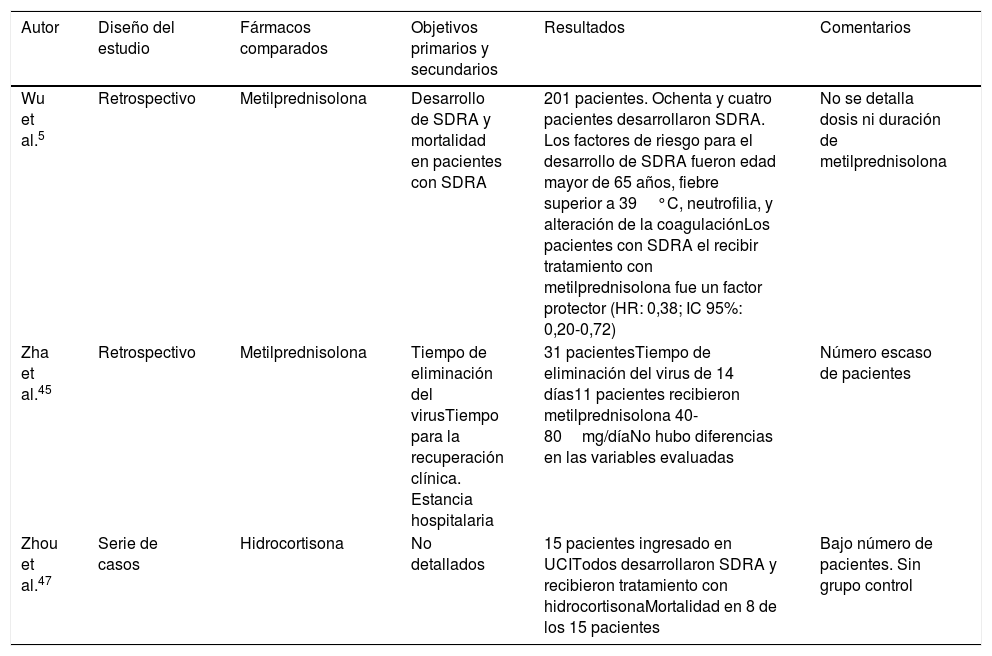
La evidencia actual sobre la utilidad de los corticoides sistémicos en pacientes con infección por COVID-19 es muy limitada. El trabajo de Wu et al.5 es un estudio retrospectivo de un solo centro que incluyó a 201 pacientes con neumonía por COVID-19, de los que 84 presentaron SDRA. En este grupo, el uso de metilprednisolona se correlacionó con una reducción significativa de la mortalidad (HR: 0,38; IC 95%: 0,20-0,72). En la tabla 4 se reseñan otros estudios45–47.
Estudios con corticoides
| Autor | Diseño del estudio | Fármacos comparados | Objetivos primarios y secundarios | Resultados | Comentarios |
|---|---|---|---|---|---|
| Wu et al.5 | Retrospectivo | Metilprednisolona | Desarrollo de SDRA y mortalidad en pacientes con SDRA | 201 pacientes. Ochenta y cuatro pacientes desarrollaron SDRA. Los factores de riesgo para el desarrollo de SDRA fueron edad mayor de 65 años, fiebre superior a 39°C, neutrofilia, y alteración de la coagulaciónLos pacientes con SDRA el recibir tratamiento con metilprednisolona fue un factor protector (HR: 0,38; IC 95%: 0,20-0,72) | No se detalla dosis ni duración de metilprednisolona |
| Zha et al.45 | Retrospectivo | Metilprednisolona | Tiempo de eliminación del virusTiempo para la recuperación clínica. Estancia hospitalaria | 31 pacientesTiempo de eliminación del virus de 14 días11 pacientes recibieron metilprednisolona 40-80mg/díaNo hubo diferencias en las variables evaluadas | Número escaso de pacientes |
| Zhou et al.47 | Serie de casos | Hidrocortisona | No detallados | 15 pacientes ingresado en UCITodos desarrollaron SDRA y recibieron tratamiento con hidrocortisonaMortalidad en 8 de los 15 pacientes | Bajo número de pacientes. Sin grupo control |
Respecto a las recomendaciones institucionales, tanto la OMS como los Centers for Disease Control and Prevention (CDC) americanos no recomiendan el empleo de corticoides más allá del entorno de los ensayos clínicos o el tratamiento específico de pacientes con COVID-19 y shock séptico o condiciones basales que los requieran, del tipo de exacerbación de EPOC o asma. El comité de expertos de la American Thoracic Society tampoco establece ninguna recomendación acerca del empleo de corticoides48 Por su parte, las pautas de la Surviving Sepsis Campaig (SSC) sugieren, en adultos con COVID-19 y SDRA en VM, usar corticoides sistémicos, con un grado de recomendación débil49.
En cuanto a la dosis a emplear, los regímenes utilizados en China fueron fundamentalmente metilprednisolona 40-80mg iv diariamente durante un curso de 3-6 días50. Dosis equivalentes de dexametasona (7-15mg diarios) podrían tener la ventaja de estimular una menor retención de líquidos, ya que la dexametasona tiene menos actividad mineralocorticoide51.
Tratamiento inmunomoduladorAl igual que en otras entidades causadas por coronavirus, como pueden ser el SARS, en el que se comprobó la existencia de niveles séricos muy elevados de citoquinas proinflamatorias, como interleucina-6 (IL-6), factor de necrosis tumoral α e IL-1252; y el MERS, en el que se constató la producción elevada de IL-6, IL-1b e IL-853; la tormenta de citoquinas parece ser uno de los principales mecanismos responsables del fallecimiento de los pacientes COVID-19, en los que se han detectado niveles elevados de citoquinas como IL-6, IL-2, IL-7, IL-10, factor estimulante de colonias de granulocitos, proteína inducible por interferón-γ (IPI0), proteína inflamatoria de macrófagos 1a (MIP1A), proteína quimioatractiva de monocitos (MCP1) y factor de necrosis tumoral α 1. La rápida activación de los monocitos y las células T produce una reacción en la que IL-6 y el factor estimulante de colonias de granulocitos desempeñan un papel fundamental, provocando una respuesta inflamatoria que podría ser la responsable de la alteración del intercambio gaseoso entre el alvéolo y el capilar, y también de la progresión a la fibrosis pulmonar y la disfunción orgánica54. Los niveles de las citoquinas mencionadas parecen relacionarse con la gravedad y el pronóstico de la enfermedad.
Para el diagnóstico de la tormenta de citoquinas podemos basarnos en la presencia de SDRA, junto con la de alteraciones de parámetros analíticos como ferritina, PCR, dímero D, lactato deshidrogenasa, recuento de linfocitos e IL-6. Actualmente no existe una escala validada para el diagnóstico de la tormenta de citoquinas secundaria a COVID-19, por lo que se recomienda una evaluación seriada de dichos marcadores y de la situación respiratoria de estos pacientes para seleccionar aquellos que puedan beneficiarse de la administración de terapia antiinflamatoria; la escala HScore (tabla 1 de material adicional) puede ser de ayuda, aunque no es suficientemente sensible ni precoz55,56.
Entre las opciones terapéuticas que se han propuesto, las más importantes son las siguientes:
TocilizumabTocilizumab es un anticuerpo monoclonal recombinante que se une y bloquea tanto el receptor soluble como el receptor de membrana de la IL-6. Entre sus aplicaciones habituales está el tratamiento de la artritis reumatoide (AR) y también forma parte del tratamiento del síndrome de liberación de citoquinas tras la terapia CAR-T (terapia de células T con receptor de antígeno quimérico)57. Al actuar sobre el receptor y no sobre la IL-6 circulante, los niveles de IL-6 no son útiles para monitorizar la respuesta al tratamiento, ya que incluso pueden aumentar tras su administración.
Actualmente existen varios ensayos clínicos en período de reclutamiento de pacientes COVID-19 con diferentes grados de severidad, pero por el momento, disponemos únicamente de los resultados de 2 pequeños estudios retrospectivos.
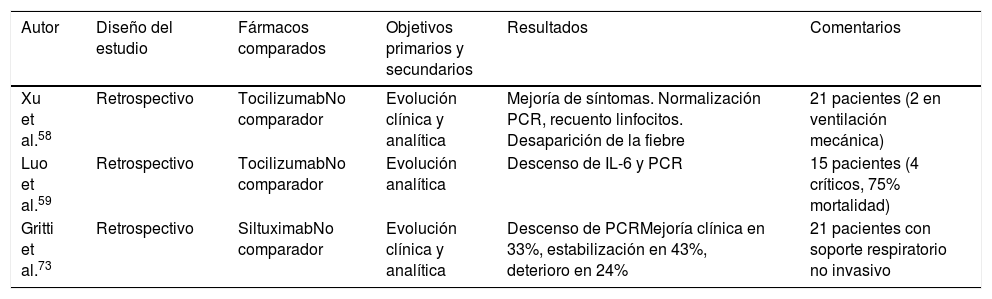
El primero de ellos consiste en un análisis retrospectivo de 21 pacientes COVID-19 tratados en 2 hospitales de China. Diecisiete de ellos cumplían criterios de enfermedad grave (≥30 respiraciones/min, SaO2≤93% respirando aire ambiente o relación PaO2/FiO2≤300), y 4 de enfermedad crítica (necesidad de VM, shock o ingreso en UCI). Los 21 pacientes recibieron lopinavir y metilprednisolona y una dosis de 400mg iv de tocilizumab, 3 de ellos, además, recibieron una segunda dosis a las 12h (por persistencia de la fiebre). Dos de los pacientes recibieron VM, uno más ventilación mecánica no invasiva y 9 pacientes OAF. En los 21 pacientes, que presentaban niveles elevados de IL-6, se observaron resultados clínicos (normalización de la temperatura, alivio sintomático y mejoría de la oxigenación), analíticos (normalización del recuento de linfocitos y de la PCR) y radiológicos favorables. En este estudio no se observaron reacciones adversas al fármaco58.
En otra serie retrospectiva de pacientes COVID-19 (15 pacientes: 2 con enfermedad moderada, 6 con enfermedad grave y 7 con enfermedad crítica), procedentes de un único centro en China, 8 de los cuales recibieron tratamiento con metilprednisolona y todos ellos con niveles de IL-6 elevados), se observaron también resultados analíticos generalmente favorables (descenso de PCR y de IL-6). Sin embargo, de los 7 pacientes críticos, en 4 de ellos no se obtuvo una respuesta analítica favorable, falleciendo 3 de ellos59. En la tabla 5 se describen algunos estudios con inmunomoduladores.
Estudios con inmunomoduladores
| Autor | Diseño del estudio | Fármacos comparados | Objetivos primarios y secundarios | Resultados | Comentarios |
|---|---|---|---|---|---|
| Xu et al.58 | Retrospectivo | TocilizumabNo comparador | Evolución clínica y analítica | Mejoría de síntomas. Normalización PCR, recuento linfocitos. Desaparición de la fiebre | 21 pacientes (2 en ventilación mecánica) |
| Luo et al.59 | Retrospectivo | TocilizumabNo comparador | Evolución analítica | Descenso de IL-6 y PCR | 15 pacientes (4 críticos, 75% mortalidad) |
| Gritti et al.73 | Retrospectivo | SiltuximabNo comparador | Evolución clínica y analítica | Descenso de PCRMejoría clínica en 33%, estabilización en 43%, deterioro en 24% | 21 pacientes con soporte respiratorio no invasivo |
La administración de tocilizumab está contraindicada en el contexto de infecciones graves activas. Los efectos secundarios relacionados con mayor frecuencia con la administración de tocilizumab son: infecciones del tracto respiratorio superior, nasofaringitis, cefalea, hipertensión y elevación de transaminasas hepáticas. Las reacciones adversas más graves fueron infecciones graves, complicaciones de diverticulitis y reacciones de hipersensibilidad60.
Debido a la ausencia de resultados concluyentes, la SSC y el comité de expertos de la American Thoracic Society no establecen una recomendación acerca del uso de tocilizumab48,49, sin embargo, las recomendaciones de la Comisión Nacional de Salud de China y otros expertos recomiendan su empleo en pacientes críticos con elevación de IL-661,62.
La recomendación actual del Ministerio de Sanidad de España es administrarlo en aquellas fases de la enfermedad en las que resulta más probable que frenar la cascada inflamatoria tenga un efecto sobre la necesidad de ventilación24 (ver tabla 2 en material adicional).
Excepcionalmente, se puede valorar una segunda infusión a las 12h desde la primera infusión en aquellos pacientes que experimenten un repunte de los parámetros analíticos tras una primera respuesta favorable.
SarilumabSarilumab es otro antagonista del receptor de la IL-6, empleado también en el tratamiento de la AR, que está siendo evaluado en pacientes COVID de diferente gravedad en varios ensayos clínicos (NCT04357808, NCT04315298, NCT04327388, NCT04324073, NCT04322773), pero no disponemos de resultados clínicos hasta el momento63. No se encuentra disponible fuera de ensayos clínicos.
Inhibidores de la proteína-quinasa 1 asociada a AP2Baricitinib, fedratinib, sunitinib y erlinitib son inhibidores de la proteína quinasa 1 asociada a AP2 (AAK1), reguladora de la endocitosis mediada por clatrina a través de la cual entran en la célula la mayoría de los virus. De ellos, fedratinib, sunitinib y erlinitib se asocian a serios efectos secundarios que hacen dudar sobre su utilidad en pacientes COVID. Por su parte, baricitinib inhibe también la quinasa asociada a la cyclina G (otro regulador de la endocitosis) y es, además, un inhibidor de janus quinasas (JAK), por lo que se ha sugerido su uso para reducir tanto la entrada del virus en las células como la respuesta inflamatoria64,65, sin embargo existen dudas acerca de su posible eficacia, dado que, al mismo tiempo, produce un descenso de la respuesta antivírica mediada por interferón66.
Las reacciones adversas notificadas con más frecuencia en los pacientes tratados con baricitinib fueron aumento del colesterol LDL (33,6%), infecciones del tracto respiratorio superior (14,7%) y náuseas (2,8%)67.
A día de hoy no disponemos de resultados del empleo de baricitinib en COVID-19, aunque existen ensayos clínicos en fase de reclutamiento (NCT04390464, NCT04346147) y otros 2 a la espera de comenzar el mismo.
AnakinraAnakinra es un antagonista recombinante del receptor de la IL-1, empleado en AR y enfermedad de Still.
El análisis del subgrupo de pacientes con síndrome de activación macrofágica de un ensayo clínico que evaluó la administración de anakinra en pacientes con sepsis y fracaso multiorgánico demostró una reducción de la mortalidad a los 28 días frente a placebo68. El síndrome de activación macrofágica, subgrupo de linfohistiocitosis hemofagocítica, se presenta como una tormenta de citoquinas que provoca un fracaso multiorgánico generalmente mortal en poco tiempo, habitualmente está asociada a enfermedades reumatológicas, pero puede ser desencadenado por infecciones víricas. Se han observado niveles elevados de IL-1, IL-6, IL-18, receptor soluble de IL-2, FNT e IFN-γ. Se ha propuesto que anakinra puede formar parte del tratamiento de síndrome de activación macrofágica y algunos autores proponen su empleo también en la tormenta de citoquinas secundaria a COVID-1969.
Los efectos adversos más frecuentes del tratamiento con anakinra son reacciones locales en el lugar de inyección, aparición de infecciones graves y descenso de neutrófilos70.
Actualmente existen diferentes ensayos clínicos en pacientes con COVID de diferentes grados de gravedad (NCT04364009, NCT04324021, NCT04357366, NCT04339712, NCT04330638), pero no disponemos de resultados clínicos que permitan establecer una recomendación acerca del uso de anakinra.
RuxolitinibRuxolitinib (RXT) es un inhibidor selectivo de las quininas asociadas a Janus (JAK1 y JAK 2), mediadores implicados en la hematopoyesis y la función inmune (participan en la transducción de otras citosinas proinflamatorias y antiinflamatorias). Se utiliza en el tratamiento de la AR, la mielofibrosis y la policitemia vera y se ha postulado su uso para reducir la tormenta de citoquinas inflamatorias71. Actualmente está siendo siendo evaluado en 2 ensayos clínicos en el tratamiento del COVID-19 (NCT04362137, NCT04377620, NCT04334044, NCT04338958, NCT04348695) pero no se dispone todavía de datos.
El Ministerio de Sanidad lo incluye entre las opciones de tratamiento de COVID-19, bien como uso compasivo, bien a través de un ensayo clínico24. En la tabla 3 de material adicional se resumen los criterios de empleo y las contraindicaciones de RXT.
Las reacciones adversas notificadas de forma más frecuente fueron trombocitopenia, neutropenia y anemia. Las 3 reacciones adversas no hematológicas más frecuentes fueron hematomas (21,3%), mareo (15,3%) y cefalea (14,0%). Los pacientes tratados con RXT han sufrido infecciones graves bacterianas, micobacterianas, fúngicas, víricas y otras infecciones oportunistas72.
Siltuximab (STX)Siltuximab (SXT) es un inhibidor de la IL-6, empleado en la enfermedad de Castleman en pacientes negativos para virus de la inmunodeficiencia humana y virus herpes-8.
Se han publicado los datos de 21 pacientes COVID-19 con neumonía/SDRA en Italia que recibieron SXT. Recibieron una dosis de 11mg/kg iv (durante una hora), y una segunda dosis a discreción del médico tratante, que recibieron 5 pacientes. De los 21 pacientes, en un 33% se observó mejoría de su estado clínico, en un 43% su situación se estabilizó y el 24% empeoró, incluyendo un fallecimiento. Debe destacarse que los 21 pacientes recibían soporte respiratorio no invasivo73.
El Ministerio de Sanidad plantea su uso en las mismas situaciones que RXT24.
En la tabla 3 de material adicional se resumen los criterios de empleo y las contraindicaciones de STX.
Los efectos secundarios más frecuentes del empleo de STX son las infecciones (incluyendo las infecciones de las vías respiratorias altas), prurito, erupción, artralgia y diarrea. La reacción adversa más grave asociada al uso de siltuximab fue la reacción anafiláctica74
Profilaxis antitrombótica y anticoagulaciónMuchos de los enfermos críticos, especialmente los que fallecen, con COVID-19 desarrollan coagulopatía75–79. Se ha descrito tanto un estado de coagulación intravascular diseminada79,80 como un estado de hipercoagulabilidad diferente, descrito mediante tromboelastografía, acompañado de marcadores de inflamación elevados81. La inmovilización, la respuesta inflamatoria, la hipoxia y el desarrollo de coagulación intravascular diseminada aumentan el riesgo trombótico de estos pacientes y se ha especulado sobre el papel que la trombosis microvascular puede desempeñar en la hipoxemia y el fallo multiorgánico.
La incidencia de complicaciones trombóticas en el paciente crítico oscila entre el 25-100%82–87 dependiendo de la intensidad de su búsqueda y del tratamiento administrado. Se ha observado mayor mortalidad en los pacientes con trombosis (HR: 5,4; IC 95%: 2,4-12) y que la anticoagulación basal previene las complicaciones trombóticas (HR: 0,29; IC 95%: 0,091-0,92)83.
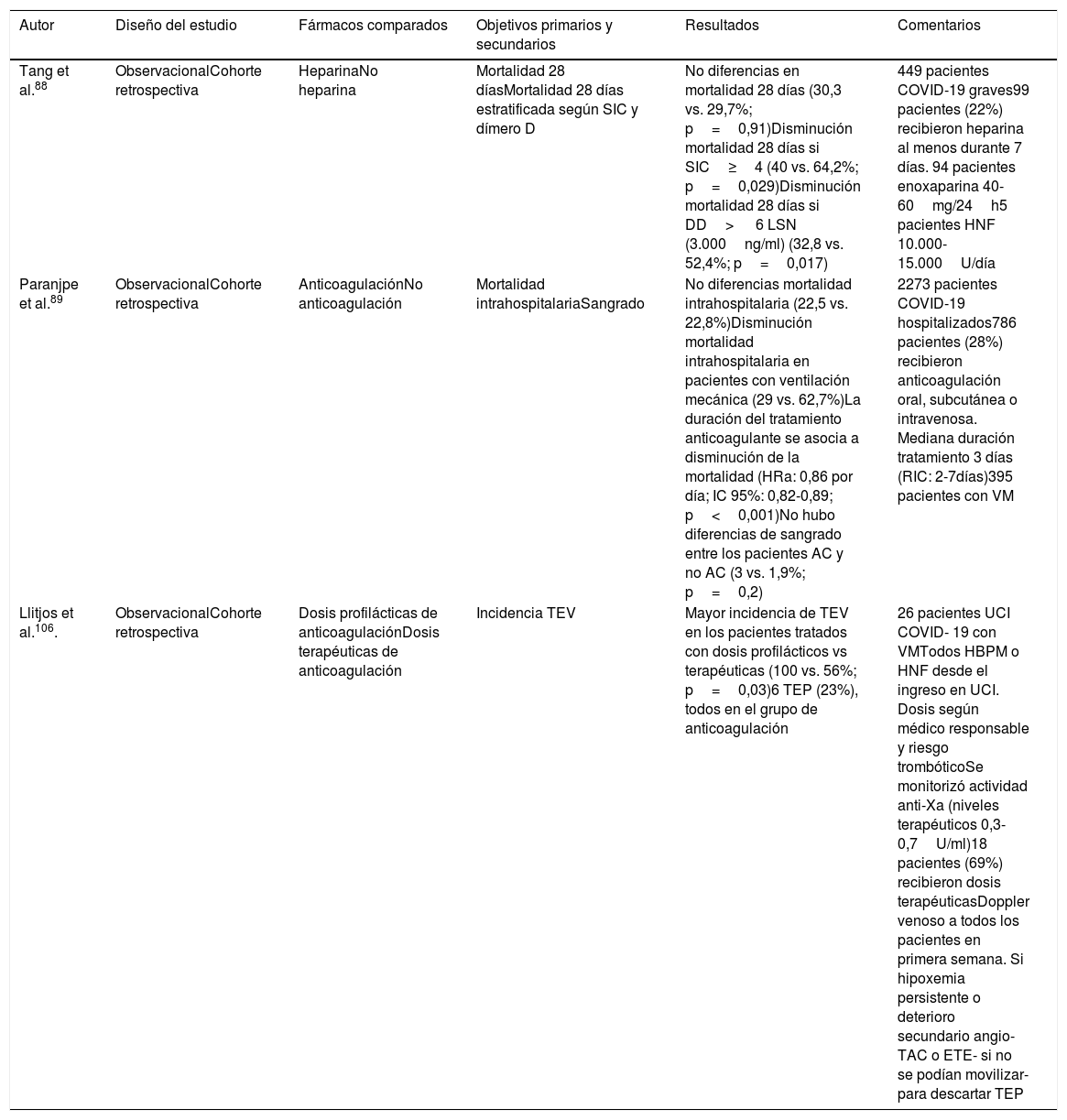
Hasta el momento, solo 2 estudios observacionales han investigado la asociación de la tromboprofilaxis y la anticoagulación con la mortalidad. Un reciente estudio no encontró diferencias significativas en la mortalidad valorada a los 28 días, entre pacientes tratados con dosis profilácticas de heparina (40-60mg/24h de enoxaparina durante al menos 7 días) respecto aquellos que no la recibieron (30,3 vs. 29,7%; p=0,91)79. Sin embargo, en los subgrupos de pacientes con SIC≥4 y con valores de dímeros D superiores a 3.000ng/ml, la mortalidad a los 28 días fue significativamente más baja (40 vs. 64,2%; p=0,029 y 32,8% vs. 52,4%, p=0,017, respectivamente) en los pacientes tratados con heparina88. Paranjpe et al.89 tampoco encontraron diferencias en la mortalidad intrahospitalaria (22,5 vs. 22,8%) de los pacientes que recibían anticoagulación oral, intravenosa o subcutánea respecto a los que no la recibían. Sin embargo, la mortalidad intrahospitalaria disminuía en el subgrupo de pacientes con ventilación mecánica anticoagulados (29 vs. 62,7%) y la duración del tratamiento anticoagulante se asociaba a una disminución de la mortalidad (HRa: 0,86 por día, IC 95%: 0,82-0,89; p<0,001). Destacar que no hubo diferencias de sangrado entre los pacientes anticoagulados y no anticoagulados (3 vs. 1,9%; p=0,2).
Se precisan estudios aleatorizados para las indicaciones de terapia antitrombótica y anticoagulante en estos pacientes.
En las tablas 6 y 7 se detallan estudios de trombosis, anticoagulación y tromboprofilaxis en pacientes con COVID-19.
Estudios sobre trombosis en pacientes con COVID-19
| Autor | Diseño del estudio | Fármacos comparados | Objetivos primarios y secundarios | Resultados | Comentarios |
|---|---|---|---|---|---|
| Cui et al.105 | Descriptivo | Incidencia TEV | TEV 20/81 (25%) | 81 pacientes UCI COVID-19No profilaxis trombótica | |
| Klok et al.82 | Descriptivo | Incidencia acumulada variable compuesta TEV (TEP, TVP) y TA (IAM, ictus, embolismo arterial periférico)Incidencia acumulada de cada evento trombótico | Variable compuesta 31% (IC 95%: 20-41%)TEV 27% (IC 95%: 17-37%)TA 3,7% (IC 95%: 0-8,2%)TEP complicación más frecuente (n=25, 81%) | 184 pacientes UCI COVID-19Pruebas diagnósticas solo si existía sospecha clínicaTodos al menos tromboprofilaxis17 pacientes (9,2%) anticoagulados por indicación previa139 pacientes (76%) permanecían ingresados en UCI cuando fue publicadoMediana seguimiento 7 días (RIC: 1-13) | |
| Klok et al.83 | Reevaluación de estudio previoDescriptivoAjuste por riesgo competitivo de muerte | Incidencia acumulada variable compuesta TEV (TEP, TVP) y TA (IAM, ictus, embolismo arterial periférico)Incidencia acumulada de cada evento trombótico | Variable compuesta ajustada por riesgo competitivo 49% (IC 95%: 41–57%)Los pacientes con trombosis tienen más riesgo de morirse, HR: 5,4 (IC 95%: 2,4-12)La anticoagulación basal previene las complicaciones trombóticas, HR: 0,29 (IC 95%: 0,091-0,92)La anticoagulación basal no se asoció con mortalidad, HR: 0,79 (IC 95%: 0,35-1,8) | Mediana seguimiento 14 días (RIC: 6-19) | |
| Helms et al.84 | ObservacionalCohorte prospectiva UCI COVID-19 (n=150)Cohorte histórica prospectiva UCI no COVID-19 (n=233)Propensity score | Incidencia TEV COVID-19 vs no-COVID-19Incidencia de cada evento trombótico en COVID-19 vs. no COVID-19 | Los pacientes COVID-19 con SDRA presentan más complicaciones trombóticas que los pacientes con no COVID-19 con SDRA (11,7 vs. 4,8%; OR: 2,6 [1,1-6,1], p=0,035), principalmente TEP (11,7 vs. 2,1%; OR: 6,2 [1,6-23,4], p=0,008)En cohorte COVID-19 (n=150):TEV 64 (42,6%)TEP 25 (16,75%)Hemorragias 4 (2,7%) | Tras el emparejamiento:77 pacientes con SDRA por COVID-19145 pacientes con SDRA por no COVID-19 de causa bacteriana o víricaTodos heparina profiláctica (77,9 vs. 75,9%) o anticoagulante (22,1 vs. 24,1%).Pruebas diagnósticas solo si existía sospecha clínica | |
| Thomas et al.85 | Descriptivo | Incidencia de la variable compuesta TEP, TVP y TA (IAM, ictus, embolismo arterial periférico) | Incidencia acumulada de la variable compuesta 29% (IC 95%: 12-49%)TEV 27% (IC 95%: 10-47).TA 4% (IC 95%: 1-12)5 TEP (7,9%)2 IAM (2,9%) | 63 pacientes COVID-19 UCISolo estudio trombosis si síntomasMediana seguimiento 8 días (rango 1-28)Todos tromboprofilaxis con dalteparina ajustada a peso y función renal | |
| Middeldorp et al.86 | Observacional. Cohorte retrospectivaModelo de riesgo competitivo | 1.a Incidencia de TVP, TEP o trombosis en otras localizaciones diagnosticadas por pruebas de imagen pacientes planta vs. pacientes UCI2.a Incidencia de TVP, TEP o trombosis en otras localizaciones sintomáticas | Incidencia acumulada en UCI a los 21 días (59%;[IC 95%:42-72])Incidencia acumulada en planta a los 21 días (9,2% [IC 95%: 2,6-21)La proporción de pacientes con TEV fue mayor en UCI que en planta (47 vs. 3,3%; HR: 7,9 [IC 95%: 2,8-23])La proporción de pacientes con TEV sintomático fue mayor en UCI que en planta (28 vs. 3,3%; HR: 3,9; [IC 95%: 1,3 -12])Ninguno de los pacientes anticoagulados por otros motivos desarrolló TEV | 198 pacientes COVID-19 hospitalizados75 pacientes en UCI (38%)Mediana seguimiento UCI 15 días (RIC: 9-20)Mediana seguimiento planta 4 días (RIC: 2-7)Todos al menos tromboprofilaxis19 pacientes (9,6%) recibían anticoagulación por indicación previa | |
| Lodigiani et al.87 | Descriptivo | Porcentaje de TEV y arterial (SCA/IAM, ictus)Porcentaje CID | Trombosis 7,7%TEP 2,5%SCA/IAM 2,5%/1,1%CID 2,2%Ictus 2,5%.Trombosis UCI 16,7%La mitad de los casos de trombosis se diagnosticaron en las primeras 24h | 388 pacientes COVID-19 hospitalizados61 pacientes (16%) en UCITromboprofilaxis 100% en UCI, 75% en las planta de hospitalización |
Estudios sobre anticoagulación y tromboprofilaxis en pacientes con COVID-19
| Autor | Diseño del estudio | Fármacos comparados | Objetivos primarios y secundarios | Resultados | Comentarios |
|---|---|---|---|---|---|
| Tang et al.88 | ObservacionalCohorte retrospectiva | HeparinaNo heparina | Mortalidad 28 díasMortalidad 28 días estratificada según SIC y dímero D | No diferencias en mortalidad 28 días (30,3 vs. 29,7%; p=0,91)Disminución mortalidad 28 días si SIC≥4 (40 vs. 64,2%; p=0,029)Disminución mortalidad 28 días si DD> 6 LSN (3.000ng/ml) (32,8 vs. 52,4%; p=0,017) | 449 pacientes COVID-19 graves99 pacientes (22%) recibieron heparina al menos durante 7 días. 94 pacientes enoxaparina 40-60mg/24h5 pacientes HNF 10.000-15.000U/día |
| Paranjpe et al.89 | ObservacionalCohorte retrospectiva | AnticoagulaciónNo anticoagulación | Mortalidad intrahospitalariaSangrado | No diferencias mortalidad intrahospitalaria (22,5 vs. 22,8%)Disminución mortalidad intrahospitalaria en pacientes con ventilación mecánica (29 vs. 62,7%)La duración del tratamiento anticoagulante se asocia a disminución de la mortalidad (HRa: 0,86 por día; IC 95%: 0,82-0,89; p<0,001)No hubo diferencias de sangrado entre los pacientes AC y no AC (3 vs. 1,9%; p=0,2) | 2273 pacientes COVID-19 hospitalizados786 pacientes (28%) recibieron anticoagulación oral, subcutánea o intravenosa. Mediana duración tratamiento 3 días (RIC: 2-7días)395 pacientes con VM |
| Llitjos et al.106. | ObservacionalCohorte retrospectiva | Dosis profilácticas de anticoagulaciónDosis terapéuticas de anticoagulación | Incidencia TEV | Mayor incidencia de TEV en los pacientes tratados con dosis profilácticos vs terapéuticas (100 vs. 56%; p=0,03)6 TEP (23%), todos en el grupo de anticoagulación | 26 pacientes UCI COVID- 19 con VMTodos HBPM o HNF desde el ingreso en UCI. Dosis según médico responsable y riesgo trombóticoSe monitorizó actividad anti-Xa (niveles terapéuticos 0,3-0,7U/ml)18 pacientes (69%) recibieron dosis terapéuticasDoppler venoso a todos los pacientes en primera semana. Si hipoxemia persistente o deterioro secundario angio-TAC o ETE- si no se podían movilizar- para descartar TEP |
AC: anticoagulados; CID: coagulación intravascular diseminada; DD: dímero D; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; HR: hazard ratio; HRa: HR ajustada; IAM. infarto agudo de miocardio; IC: intervalo de confianza; LSN: límite superior de la normalidad; RIC: rango intercuartílico; SCA: síndrome coronario agudo; SIC: coagulopatía inducida por sepsis; TA: trombosis arterial; TEP: tromboembolismo pulmonar; TEV: tromboembolismo venoso; TVP: trombosis venosa profunda; VM: ventilación mecánica.
Basándonos en la evidencia científica actual y en recomendaciones de otras sociedades internacionales90–95 se sugieren los esquemas terapéuticos de las tablas 8 y 9.
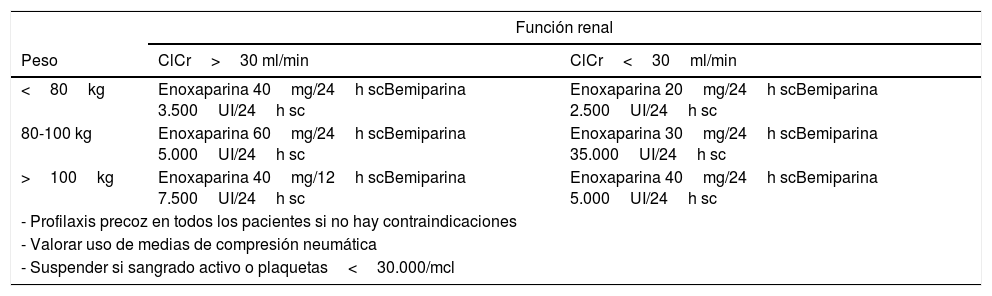
Dosis de profilaxis antitrombótica
| Función renal | ||
|---|---|---|
| Peso | ClCr>30 ml/min | ClCr<30ml/min |
| <80kg | Enoxaparina 40mg/24h scBemiparina 3.500UI/24h sc | Enoxaparina 20mg/24h scBemiparina 2.500UI/24h sc |
| 80-100 kg | Enoxaparina 60mg/24h scBemiparina 5.000UI/24h sc | Enoxaparina 30mg/24h scBemiparina 35.000UI/24h sc |
| >100kg | Enoxaparina 40mg/12h scBemiparina 7.500UI/24h sc | Enoxaparina 40mg/24h scBemiparina 5.000UI/24h sc |
| - Profilaxis precoz en todos los pacientes si no hay contraindicaciones | ||
| - Valorar uso de medias de compresión neumática | ||
| - Suspender si sangrado activo o plaquetas<30.000/mcl | ||
ClCr: aclaramiento de creatinina.
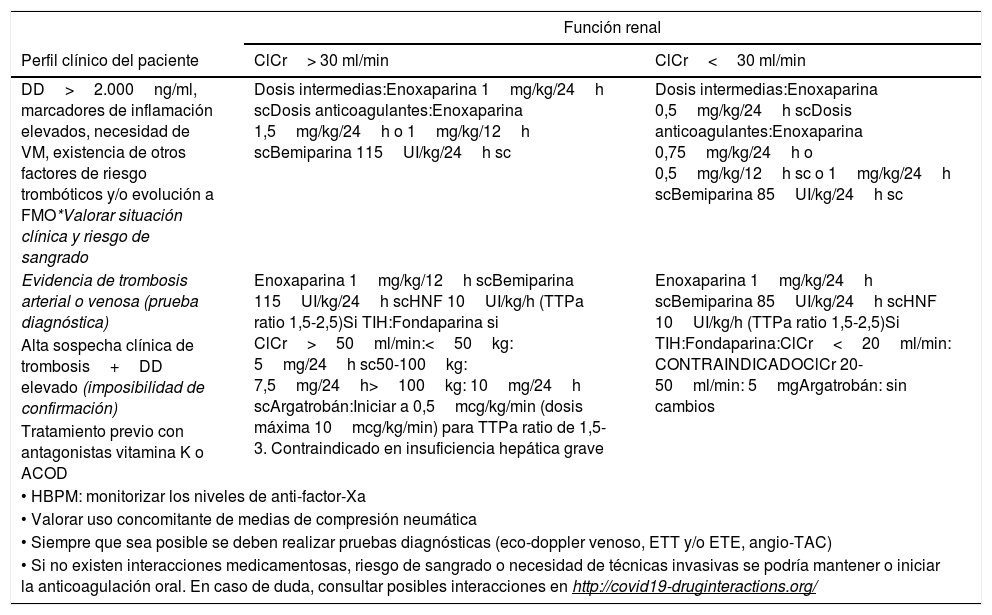
Dosis y recomendaciones de anticoagulación
| Función renal | ||
|---|---|---|
| Perfil clínico del paciente | ClCr> 30 ml/min | ClCr<30 ml/min |
| DD>2.000ng/ml, marcadores de inflamación elevados, necesidad de VM, existencia de otros factores de riesgo trombóticos y/o evolución a FMO*Valorar situación clínica y riesgo de sangrado | Dosis intermedias:Enoxaparina 1mg/kg/24h scDosis anticoagulantes:Enoxaparina 1,5mg/kg/24h o 1mg/kg/12h scBemiparina 115UI/kg/24h sc | Dosis intermedias:Enoxaparina 0,5mg/kg/24h scDosis anticoagulantes:Enoxaparina 0,75mg/kg/24h o 0,5mg/kg/12h sc o 1mg/kg/24h scBemiparina 85UI/kg/24h sc |
| Evidencia de trombosis arterial o venosa (prueba diagnóstica) | Enoxaparina 1mg/kg/12h scBemiparina 115UI/kg/24h scHNF 10UI/kg/h (TTPa ratio 1,5-2,5)Si TIH:Fondaparina si ClCr>50ml/min:<50kg: 5mg/24h sc50-100kg: 7,5mg/24h>100kg: 10mg/24h scArgatrobán:Iniciar a 0,5mcg/kg/min (dosis máxima 10mcg/kg/min) para TTPa ratio de 1,5-3. Contraindicado en insuficiencia hepática grave | Enoxaparina 1mg/kg/24h scBemiparina 85UI/kg/24h scHNF 10UI/kg/h (TTPa ratio 1,5-2,5)Si TIH:Fondaparina:ClCr<20ml/min: CONTRAINDICADOClCr 20-50ml/min: 5mgArgatrobán: sin cambios |
| Alta sospecha clínica de trombosis+DD elevado (imposibilidad de confirmación) | ||
| Tratamiento previo con antagonistas vitamina K o ACOD | ||
| • HBPM: monitorizar los niveles de anti-factor-Xa | ||
| • Valorar uso concomitante de medias de compresión neumática | ||
| • Siempre que sea posible se deben realizar pruebas diagnósticas (eco-doppler venoso, ETT y/o ETE, angio-TAC) | ||
| • Si no existen interacciones medicamentosas, riesgo de sangrado o necesidad de técnicas invasivas se podría mantener o iniciar la anticoagulación oral. En caso de duda, consultar posibles interacciones en http://covid19-druginteractions.org/ | ||
ClCr: aclaramiento de creatinina; DD: dímero D; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; FMO: fracaso multiorgánico; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; sc: subcutánea; TAC: tomografía axial computarizada; TIH: trombocitopenia inducida por heparina; TTPa: tiempo de cefalina; VM: ventilación mecánica.
El tratamiento con plasma convaleciente (PC) se ha utilizado clásicamente para la prevención y tratamiento de enfermedades infecciosas. Fue utilizado con éxito en el tratamiento de SARS, MERS y la pandemia de H1N1 de 2009. En un metaanálisis de 32 estudios de infección por SARS coronavirus y virus influenza, se demostró una reducción estadísticamente significativa de la mortalidad de pacientes con tratamiento con PC al compararlo con placebo y sin tratamiento (OR: 0,25; IC 95%: 0,14-0,45)96.
Duan et al. miden la efectividad del tratamiento con PC en 10 pacientes con COVID-19 grave97. Utilizan una transfusión de 200ml de plasma de pacientes recuperados con títulos de anticuerpos altos (1:640). Los efectos que observaron con la transfusión de PC fueron: 1) mejoría de los síntomas clínicos y en los parámetros de oxigenación, permitiendo desescalar de VM a OAF y de OAF a oxigenoterapia convencional; 2) reducción de las lesiones pulmonares; 3) mejoría de los parámetros de laboratorio (linfopenia, PCR, transaminasas).; 4) incremento del título de anticuerpos y desaparición del ARN del SARS-CoV-2; 5) mejor pronóstico (3 altas hospitalarias y 7 pacientes con mejoría clínica) al compararlo con grupo control (3 muertes, 6 casos de estabilización y uno de mejoría clínica) (p<0,001). No hubo reacciones adversas graves en ningún paciente. Concluyen que el tratamiento con PC podría ser una opción de tratamiento de rescate seguro y fácilmente accesible para pacientes con COVID grave. La dosis óptima y el momento de transfusión quedan por definir en estudios aleatorizados más potentes. Shen et al. obtuvieron resultados similares en la recogida de 5 casos de pacientes graves con COVID-19 en VM98. En global, las 2 series presentan un 0% de mortalidad en el grupo de transfusión por un 30% en el grupo control y sin efectos adversos.
En un estudio aleatorizado, Li et al.99 comparando en 103 pacientes tratamiento estándar con o sin la adición de PC; no han demostrado mejoría clínica a los 28 días, ni en la mortalidad (15,7% en grupo tratamiento vs. 24% en placebo; OR: 0,65 (IC 95%: 0,29-1,46) (p=0,3). Este estudio presenta importantes limitaciones, como un tiempo desde inicio de los síntomas a la aleatorización de unos 30 días, y una finalización precoz, al terminar la pandemia en China, lo que puede limitar la validez de los resultados. Sin embargo, como se apunta en el editorial acompañante, puede existir un beneficio en el subgrupo de pacientes más graves100.
Basándose en las series de Duan et al.97 y Shen et al.98, la Infectious Diseases Society of America (IDSA) recomienda la transfusión de PC en el contexto de un ensayo clínico8.
Las Guías de la SSC49 señalan que no hay suficiente evidencia para sugerir o recomendar el uso indiscriminado de plasma de pacientes convalescientes.
Inmunoglobulina intravenosaLa inmunoglobulina intravenosa (IgIV) Se ha utilizado como tratamiento coadyuvante para tratar una variedad de patógenos, ya sea como producto combinado, ya en una forma concentrada más centrada en el patógeno (hiperinmune). La posibilidad de que los anticuerpos protectores estén presentes en el producto combinado es mayor.
Cao et al. publican una serie de 3 casos que recibieron altas dosis de IgIV al inicio del SDRA, con una recuperación clínica y radiográfica satisfactoria101. Se utilizaron dosis elevadas de IgIV (0,3-0,5g/kg/día) durante 5 días, sin detectarse eventos adversos. En los 3 pacientes se observó una rápida mejoría clínica tras su administración. El momento de la administración de la IgIV es crítico y es posible que no exista beneficio si ya se ha producido un daño sistémico.
Según las Guías de la IDSA8, en este momento se desconoce la posible utilidad de la IgIV para el tratamiento del SARS-CoV-2. La SSC49 avisa contra el uso rutinario de las IgIV. Así, no existe suficiente evidencia para indicar o recomendar el uso indiscriminado de inmunoglobulinas.
Las dosis de los fármacos y las recomendaciones de las principales sociedades y organismos oficiales se encuentran recogidas en el anexo I y la tabla 4 del material adicional.
FinanciaciónLos autores no han recibido financiación para la elaboración del presente manuscrito.
Conflicto de interesesLos autores declaran no tener conflicto de interés con el presente manuscrito.