INTRODUCCIÓN
La administración de drogas y gases por vía inhalatoria es el método de elección para el tratamiento del asma aguda1-2. Esta vía se encuentra asociada a un comienzo de acción más rápido así como a menores efectos secundarios como consecuencia de las bajas dosis requeridas para obtener el efecto terapéutico en la vía aérea, y al hecho de que algunos medicamentos se absorben pobremente en la circulación. Este capítulo revisa los aspectos básicos de la inhaloterapia relacionados con el tratamiento del paciente asmático agudo no ventilado y ventilado, adolescente y adulto.
FUNDAMENTOS DEL TRATAMIENTO INHALATORIO
El paciente no ventilado
La inhaloterapia se define como la administración de medicamentos (aerosoles) o gases directamente en el árbol traqueobronquial y alveolar2. El éxito de la terapia con aerosoles depende de que una cantidad adecuada del medicamento alcance los receptores en los pulmones con mínimos efectos secundarios3. La efectividad del tratamiento estará determinada por múltiples factores.
En pacientes que respiran en forma espontánea, el tamaño de las partículas del aerosol es el determinante primario del depósito pulmonar. Los generadores de aerosoles utilizados con propósitos terapéuticos son heterodispersos (partículas de 0,5 a 35 μm de diámetro). El comportamiento de estos aerosoles se describe adecuadamente por medio de la mediana del diámetro de la masa aerodinámica (MMAD)3; el 50% de la masa del aerosol se encuentra conformado por partículas más pequeñas, y el otro 50% por partículas de mayor tamaño que la MMAD. Sólo las partículas con una MMAD entre 1 y 5 μm son depositadas eficientemente en el tracto respiratorio periférico (partículas "respirables" o "finas")4. Las partículas de mayor diámetro impactan en la vía aérea superior (orofaringe) y en las bifurcaciones debido a la inercia, mientras que las más pequeñas (< 0,5 μm) son exhaladas. Las partículas entre 1 y 5 μm son relativamente estables en el aire, y su depósito en los pulmones se incrementa por la acción de la gravedad. Por lo tanto, la probabilidad de que las partículas penetren en el árbol traqueobronquial se correlaciona con la MMAD: cuanto menor es la MMAD mayor penetración y mayor depósito en las ramas más finas del árbol bronquial4.
Finalmente, la velocidad de la partícula y el tiempo inspiratorio pueden afectar al depósito del aerosol. La velocidad se encuentra determinada por el generador del aerosol, y se correlaciona directamente con el depósito orofaríngeo (los inhaladores presurizados de dosis medida [IDMp] producen partículas con mayor velocidad que otros dispositivos). Desde el punto de vista del tratamiento del asma aguda, los nebulizadores de jet o neumáticos y los IDMp son los principales generadores de aerosoles utilizados (tabla 1).
A pesar de que los nebulizadores de jet son la forma más frecuente de generar aerosoles en el ámbito de los servicios de urgencia o emergencia, no hay evidencia clínica de su superioridad5. Para operar, requieren un gas presurizado (aire comprimido u oxígeno) que produce la atomización del líquido6. Si bien se pueden administrar medicamentos sin requerir coordinación con la inspiración del paciente, ello implica un tiempo de administración relativamente largo; además, son menos eficaces y más costosos, y están sujetos a una posible contaminación. En las mejores condiciones, alrededor de un 10% de la dosis total administrada puede depositarse en el pulmón. Entre los principales factores que afectan a la eficacia del nebulizador se encuentran el volumen de llenado y el flujo de oxígeno o aire7. El aumento del volumen de llenado incrementa la cantidad de medicamento nebulizado, debido a que los nebulizadores tienen un volumen residual fijo de aproximadamente 0,5 a 1,5 ml según el nebulizador; por lo tanto, un incremento del volumen de llenado reduce la proporción de este volumen residual. También el aumento del flujo de aire u oxígeno disminuye el tamaño de las partículas e incrementa la proporción de ellas en rango respirable producidas por el nebulizador. En términos generales, un volumen de llenado de 4 a 6 ml (medicamento y solvente) y un flujo de 6 a 8 l/min resultarán en una mayor cantidad de medicamento disponible para el paciente, aunque con un tiempo de nebulización prolongado (15 a 20 min). Sin embargo, el factor más importante en cuanto a variabilidad del volumen residual, masa del medicamento administrado y porcentaje de partículas en rango respirable es el nebulizador neumático seleccionado, y hay grandes diferencias (de más de 10 veces) entre aquellos comercialmente disponibles8. Cuando se utilizan máscaras y se respira por la nariz, se produce una reducción de hasta el 50% del depósito pulmonar. La máscara no debería utilizarse cuando se nebulizan corticoides y anticolinérgicos; para evitar los efectos del contacto de estas drogas con la cara y los ojos del paciente sería más adecuado el empleo de una pieza bucal.
La eficacia de los IDMp depende críticamente de la coordinación disparo-inspiración, presentando un alto depósito orofaríngeo (80% de la dosis). Sin embargo, permiten administrar grandes cantidades de medicamento en tiempos breves. El problema de la coordinación ha sido solucionado mediante la introducción de cámaras de inhalación de una válvula que se interponen entre el IDMp y el paciente. Dado que el tamaño de la partícula y su velocidad disminuyen con la distancia, la interposición de una cámara conduce a partículas respirables más pequeñas y estables, que presentan menor velocidad. La utilización de estos dispositivos reduce el depósito orofaríngeo (10-15 veces) con menores efectos secundarios, aumenta la cantidad de medicamento administrado que alcanza los pulmones, aunque en menor proporción que la reducción del depósito orofaríngeo (dado que muchas partículas se depositan en las paredes de la cámara de inhalación), y reduce el tiempo de tratamiento9. El uso de disparos múltiples dentro de la cámara en comparación con disparos únicos conduce a una reducción en la proporción de partículas respirables10. Finalmente, en las cámaras plásticas, debido a su superficie no conductora, se acumula carga electrostática, lo que produce un gran depósito del medicamento dentro de ellas9, que puede ser eliminado mediante cámaras de metal, o en el caso de las plásticas, mediante el lavado con jabón desionizante, o por medio de la administración de dosis repetidas del medicamento previas a su uso.
El paciente ventilado
A pesar de que durante la década pasada se ha producido una significativa reducción del número de pacientes con asma aguda que son ingresados en las Unidades de Cuidados Intensivos11, todavía algunos asmáticos requieren ser intubados y ventilados mecánicamente con el fin de mantener una vía aérea permeable, prevenir la aspiración, así como administrar medicamentos en forma de gases, soluciones o aerosoles12. Sólo un número relativamente pequeño de estudios no controlados ha examinado la administración de aerosoles en estos pacientes. Estas investigaciones han demostrado que la técnica de administración de aerosoles difiere en diversos aspectos de la utilizada en los no ventilados13 (tabla 2).
Durante la ventilación mecánica los nebulizadores de jet pueden operar en forma continua o intermitente (sólo durante la fase inspiratoria del ciclo)13. La forma continua requiere una fuente presurizada de gas, mientras que la intermitente requerirá una línea separada para conducir el flujo inspiratorio desde el ventilador al nebulizador. La forma intermitente es más eficiente en términos de la cantidad de aerosol administrada, debido a que minimiza las pérdidas del aerosol durante la fase espiratoria del ciclo. También, la eficacia de algunos nebulizadores puede disminuir como consecuencia de la baja presión del gas aportado por el ventilador (< 15 psi) comparada con la forma de operación continua que presenta un gas a mayor presión (> 50 psi).
El uso conjunto de un IDMp y una cámara ubicados en línea reduce la velocidad del aerosol y da tiempo para la evaporización del propelente, lo que permite la estabilización del tamaño de las partículas, y conduce a una disminución de las pérdidas producidas por el impacto del aerosol en el circuito del ventilador. Si bien se dispone de diversos tipos de adaptadores que permiten la conexión del IDMp con el circuito o con el tubo endotraqueal, diferentes estudios han demostrado que aquellos con forma de cámaras o espaciadores resultan en un incremento de 4 a 6 veces en la cantidad del aerosol administrada comparada con los que se adaptan de forma directa al tubo endotraqueal o al circuito del ventilador14.
El depósito pulmonar del aerosol se reduce como consecuencia del impacto de éste en el tubo endotraqueal. Si bien la disminución de la luz del tubo reduce la llegada del aerosol, la capacidad de distintos nebulizadores para hacer llegar el aerosol más allá del tubo no varía con diámetros comprendidos entre 7 y 9 mm. En realidad, otros factores influyen significativamente en la cantidad del aerosol depositada, como el tipo y la posición del generador del aerosol, los parámetros ventilatorios, así como la humedad y la densidad del gas en el circuito del ventilador.
La temperatura y la humedad del gas inspirado disminuyen el depósito pulmonar del aerosol tanto en un IDMp como en un nebulizador de jet, en aproximadamente un 40%14. Así, algunos investigadores han propuesto que al utilizar un IDMp se elimine el humidificador durante el tiempo requerido para administrar el aerosol. También, cuando los IDMp son utilizados junto con un espaciador cilíndrico colapsable, el circuito del ventilador no requiere ser desconectado durante el tratamiento, lo que reduce el riesgo de neumonía asociada al ventilador. Sin embargo, cuando se usa un nebulizador se requiere un tiempo prolongado para nebulizar el medicamento, así como la desconexión del circuito para eliminar la humidificación, lo que interrumpe la ventilación y aumenta el riesgo de neumonía asociada al ventilador. Es por ello que actualmente se recomienda nebulizar sin desconectar el humidificador.
El modo ventilatorio, incluidos el volumen corriente, el flujo aéreo, la frecuencia respiratoria y la relación tiempo inspiratorio/tiempo espiratorio (Ti/ Te), influye en el depósito del aerosol. Así, como una forma óptima de administración mediante un IDMp, deberá coordinarse el disparo dentro del espaciador o cámara con el comienzo de la inspiración. En esas condiciones, resulta en un depósito 30% mayor que cuando el disparo se hace durante la espiración15. Una adecuada administración del aerosol puede también obtenerse durante la modalidad asistida de ventilación, de forma tal que el patrón respiratorio del paciente estará en sincronía con el ventilador. Para obtener una adecuada deposición periférica, el volumen corriente del ventilador deberá ser mayor que el volumen de sus tubos. Así, en adultos, un volumen corriente igual o mayor de 500 ml se asocia con un adecuado depósito. También un tiempo inspiratorio más prolongado (Ti/Te > 0,3) permite la inhalación de una mayor proporción del aerosol. Por el contrario, debe tenerse en cuenta que en los pacientes asmáticos se seleccionan flujos inspiratorios elevados con el fin de reducir el tiempo inspiratorio y limitar la hiperinsuflación dinámica, lo cual tiende a disminuir el depósito pulmonar del aerosol.
Cuando el IDMp junto con una cámara es conectado en el circuito en una posición alejada del tubo endotraqueal (en la rama inspiratoria del circuito, a unos 10-15 cm del tubo), la cantidad del aerosol depositado en él se reduce y aumenta el depósito pulmonar. En forma similar, la ubicación del nebulizador a cierta distancia del tubo endotraqueal (30 cm) es más eficiente que su ubicación entre la Y del paciente y el tubo, debido a que el tubo del ventilador actúa como un espaciador para el aerosol acumulado entre los ciclos de la respiración16. Finalmente, la colocación de un espaciador entre el nebulizador y el tubo endotraqueal puede producir un modesto incremento del depósito.
TERAPIA INHALATORIA EN LA CRISIS ASMÁTICA
Los objetivos del tratamiento de un paciente con crisis de asma son: a) la corrección de la hipoxemia mediante la administración de O2; b) el alivio de la obstrucción de la vía aérea mediante la administración repetida de broncodilatadores inhalados, y c) la disminución de la inflamación así como la prevención de las recaídas, mediante la administración de corticoides sistémicos.
Gases
Oxigenoterapia
Dado que la hipoxemia durante la exacerbación asmática es producida por un descenso de la relación V/Q, puede habitualmente corregirse mediante pequeños incrementos de la fracción de O2 inspirada (1 a 3 l/min mediante máscara o cánula nasal). La utilización de concentraciones altas de este gas es todavía considerada como segura y recomendable17, a pesar de cierta evidencia de que la hiperoxia puede ser peligrosa para algunos pacientes. Recientemente, en el primer estudio aleatorizado y controlado sobre el efecto de la administración de dos concentraciones de O2 (FiO2, 28% frente a 100%) sobre el intercambio gaseoso de pacientes asmáticos agudos graves18, se ha demostrado que mientras que los pacientes que recibieron O2 al 28% presentaron una disminución de la PaCO2, los que recibieron el gas al 100% mostraron un incremento de la PaCO2, en especial los que tenían previamente al tratamiento una PaCO2 > 40 mmHg. Este fenómeno puede ser explicado por la desaparición de la vasoconstricción pulmonar hipóxica. Así, el tratamiento con O2 debe estar basado en la obtención de ciertos valores de PaO2 y SatO2 en vez de administrar concentraciones predeterminadas del gas. El objetivo debe consistir en mantener la SatO2 ≥ 92%.
Con respecto a la humidificación de las mezclas aire-O2 inspiradas, un estudio reciente ha demostrado que la deshidratación del aire espirado se presenta en pacientes asmáticos agudos y que la broncoconstricción inducida por aire seco puede ser prevenida mediante la humidificación del aire inspirado19, lo que sugiere que la humidificación de los gases inspirados podría ser adecuada.
Heliox
Durante la crisis asmática, el flujo se torna turbulento como consecuencia del aumento de la velocidad del gas y del estrechamiento de la vía aérea, que coincide con un incremento de las resistencias. Debido a su baja densidad, el heliox presenta el potencial de disminuir la resistencia de la vía aérea transformando el flujo turbulento en otro laminar, y así reducir el trabajo respiratorio. En forma adicional, se ha demostrado que cuando se nebuliza con heliox, se produce un aumento del aerosol depositado en la vía aérea20. Sin embargo, la evidencia actualmente disponible no demuestra que su utilización presente un beneficio en términos de función pulmonar u hospitalizaciones en el tratamiento de pacientes con asma aguda no ventilados21. En los pacientes que requieren ventilación mecánica los elevados flujos inspiratorios empleados producen un flujo turbulento que generará mayores pérdidas del medicamento en el circuito y la vía aérea superior. Recientemente, la investigación ha demostrado un incremento del depósito pulmonar de albuterol cuando se utiliza una mezcla de oxígeno-helio (80:20%) en el circuito del ventilador22. Así, como una forma para obtener un máximo depósito pulmonar a partir de un nebulizador durante la ventilación mecánica, se recomienda operar el nebulizador con O2 a 6-8 l/min y administrar el aerosol a través del circuito del ventilador que contiene heliox. Con este método, el aerosol depositado en la vía aérea inferior podría ser mayor del 50% del obtenido sólo con oxígeno en el circuito.
Aerosoles
Agonistas beta
Los agonistas-β2 inhalados de corta duración de acción son los medicamentos de elección en el tratamiento del asma aguda1,2,23. Presentan un comienzo de acción rápido (5 min) con 6 h de duración y escasos efectos secundarios. El salbutamol (albuterol en América del Norte) es el más utilizado en los servicios de emergencia en todo el mundo. Sin embargo, hay diversas áreas de controversia con relación al uso de estas sustancias en el asma aguda24.
La vía inhalatoria presenta un comienzo de acción más rápido y menores efectos secundarios. Aunque popular en algunos países, la evidencia disponible no apoya el uso de la vía intravenosa. Así, una reciente revisión sistemática con metaanálisis25 muestra que la utilización de esta vía no sólo no presenta ventajas en términos clínicos o de función pulmonar, sino que además se acompaña de mayores efectos secundarios.
Las dosis, así como los intervalos de administración, deberán determinarse de acuerdo con la gravedad del paciente y la respuesta al tratamiento. Un conjunto significativo de evidencia apoya el uso de dosis altas y repetidas23. Estudios previos han demostrado 2 patrones de respuesta diferentes al tratamiento inhalatorio con dosis repetidas de un agonista beta26. La mayoría de los pacientes presentará una buena respuesta, las dosis óptimas totales son 2,4 a 3,6 mg de salbutamol administrados mediante IDMp y cámara de inhalación (4 disparos cada 10 min) o 5 a 7,5 mg administrados mediante nebulizador de jet. Por el contrario, en un tercio de los pacientes el tratamiento tendrá escaso efecto, probablemente debido a la presencia de un componente inflamatorio en la vía aérea. Como consecuencia, la terapia broncodilatadora tiende a ser inefectiva, por lo que se requiere un tratamiento más prolongado. Así, si una crisis no se resuelve en un período relativamente corto (2 a 3 h), el paciente debería ser hospitalizado.
A pesar del neto predominio del nebulizador de jet como forma de administración de aerosoles broncodilatadores, la utilización del IDMp con cámara de inhalación produce una broncodilatación al menos equivalente en términos de hospitalizaciones, duración del tratamiento y función pulmonar, acompañada de numerosos efectos secundarios y menor tiempo de tratamiento en la emergencia5. Así, cada tratamiento puede administrarse en 1 a 2 min, comparado con los 15-20 min de un nebulizador. En nuestra experiencia, el uso de un IDMp junto con una cámara de inhalación de una válvula es la forma más adecuada para administrar rápidamente dosis altas de broncodilatadores, particularmente en los pacientes con asma aguda grave que presentan una alteración de su conciencia, con lo que se evita así muchas veces la intubación.
En general, se ha aceptado la superioridad de la nebulización continua sobre la intermitente. Sin embargo, una revisión con metaanálisis demuestra la equivalencia de ambos métodos de administración en términos de función pulmonar y hospitalizaciones de pacientes adultos con asma aguda, aunque con menores efectos secundarios con el empleo de la nebulización continua27.
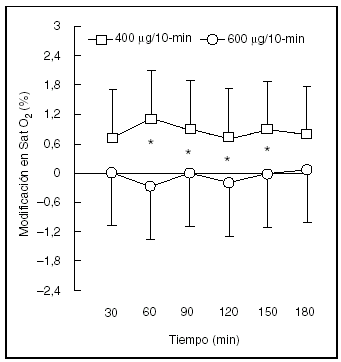
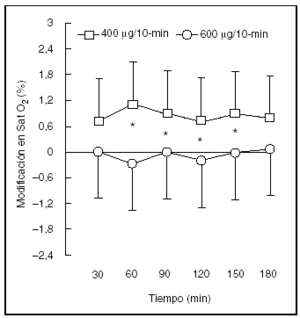
Finalmente, los efectos secundarios son dependientes de la dosis y pueden ocurrir con todas las rutas de administración, aunque son más pronunciados con las vías oral e intravenosa. Los efectos secundarios más importantes se encuentran mediados por receptores ubicados en el músculo liso de los vasos (taquicardia y taquiarritmia), músculo esquelético (temblor, hipopotasemia) y células involucradas en el metabolismo de los lípidos y carbohidratos (aumento de los ácidos grasos libres, de la insulina, la glucosa y el piruvato). La estimulación de los receptores β2 también parece contribuir a la patogénesis de la acidosis láctica durante el asma aguda grave, más frecuentemente cuando se utilizan agonistas beta por vía intravenosa. Otro efecto indeseado es la alteración ventilación/perfusión que conduce a un aumento de la diferencia alveolo-arterial de O2 por una acción vasodilatadora en el pulmón. Sin embargo, la caída resultante de la PaO2 es pequeña y de corta duración, por lo que presenta escasa significación clínica28 (fig. 1). La eficacia clínica de la aerosolterapia en el paciente ventilado es más difícil de evaluar como consecuencia de la ausencia de estudios controlados y de la diversidad de parámetros respiratorios utilizados. Dhand y Tobin29 aconsejan como técnica evaluadora la realización de oclusiones múltiples y rápidas de la vía aérea durante la inspiración con la persistente insuflación de un flujo de gas en forma constante. Esto permite determinar los distintos parámetros de las resistencias respiratorias máximas, mínimas, efectivas y la complianza pulmonar.
Figura 1. Cambios en la saturación de oxígeno en respuesta a dosis frecuentes de salbutamol inhalado mediante un inhalador presurizado de dosis medida (IDMp) y cámara espaciadora (4 o 6 disparos cada 10 min durante 3 h). Los valores se presentan como medias y desviación estándar. *p < 0,05. (Reproducida con permiso de Rodrigo G, Rodrigo C28.)
Con relación al paciente ventilado mecánicamente, diversos autores han analizado distintas relaciones de dosis-respuesta. Manthous et al30 realizaron un estudio prospectivo y aleatorizado para comparar 3 dosis de salbutamol (2,5, 5 y 7,5 mg) administradas cada 30 min con un nebulizador ubicado en la rama inspiratoria del circuito a 20 cm del tubo, y por otra parte, 10, 20, 30, y 40 disparos de salbutamol con IDMp y un adaptador en codo directo sobre el tubo orotraqueal. Los resultados obtenidos evidenciaron que 2,5 mg salbutamol nebulizado disminuye el gradiente presión (P) pico-P pausa. Dosis acumulativas de 7,5 mg llevaron a una mayor reducción pero con aumento de los efectos indeseables. Por último, 100 disparos de salbutamol con IDMp con adaptador directo al tubo no provocaron ninguna reducción de la presión de resistencia ni generaron efectos tóxicos. En otro estudio observacional, Manthous et al31 administraron a 10 pacientes que presentaban un gradiente P pico-P pausa >15 cm H2O, salbutamol en dosis de 5, 10, y 15 disparos cada 30 min con un IDMp y una cámara de inhalación ubicada en la rama inspiratoria a 10 cm del tubo en Y. Se evidenció que 5 disparos disminuyeron el gradiente de presión, 10 aún más, pero 15 no aumentaron el efecto. Estos y otros estudios han mostrado un mayor depósito del aerosol en el pulmón al utilizar IDMp en comparación con el nebulizador. Como consecuencia, el consenso actual indica que al igual que en los pacientes no ventilados, el IDMp junto con una cámara de inhalación es más eficiente que el nebulizador como forma de administrar aerosoles en pacientes ventilados mecánicamente.
Anticolinérgicos
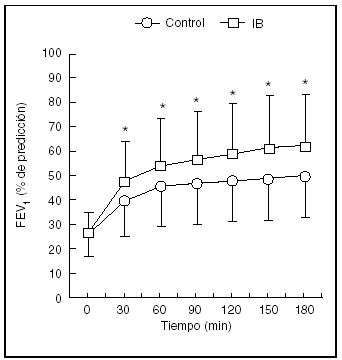
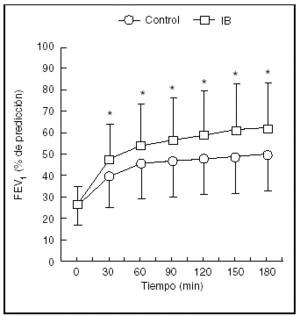
El uso de anticolinérgicos en forma simultánea con agonistas beta determina un beneficio adicional con efectos secundarios mínimos32-35, en especial cuando se utilizan protocolos terapéuticos con dosis múltiples. Los estudios reportan una importante reducción de las hospitalizaciones (odds ratio [OR] = 0,43; intervalo de confianza [IC] del 95%, 0,25-0,76) junto con incrementos significativos de la función pulmonar (diferencia final en el FEV1 = 0,5 l; IC del 95%, 0,3-0,7) (fig. 2).
Figura. 2. Cambios en el FEV1 en respuesta a dosis frecuentes de salbutamol inhalado mediante un inhalador presurizado de dosis medida (IDMp) (control) o salbutamol más bromuro de ipratropio (IB). En los datos se presentan valores medios y desviación estándar. * p < 0,01 comparado con el grupo control. (Reproducida con permiso de Rodrigo G, Rodrigo C34).
En definitiva, el uso de dosis múltiples de bromuro de ipratropio y agonista beta está indicado como tratamiento de primera línea en pacientes pediátricos y adultos con asma aguda grave. Dosis de 4 disparos de bromuro de ipratropio (80 μg) cada 10 min administradas mediante IDMp e inhalocámara o 500 μg nebulizados cada 20 min son muy efectivas.
Corticoides
Los corticoides administrados por vía sistémica deben ser considerados en el tratamiento de la mayoría de las crisis asmáticas17,23. Si bien estos medicamentos no son broncodilatadores, son extremadamente efectivos en la reducción de la inflamación de la vía aérea. La evidencia36,37 sugiere que: a) los corticoides sistémicos requieren probablemente entre 6 a 24 h para actuar; b) la administración por vías intravenosa u oral parecen ser equivalentes; y c) no produce beneficio la utilización de dosis muy elevadas. Así, 800 mg de hidrocortisona o 160 mg de metilprednisolona divididas en 4 dosis diarias se consideran adecuadas17,23. El período entre la administración y la mejoría es consistente con la idea de que el efecto beneficioso de los corticoides sistémicos resulta de un proceso de síntesis de nuevas proteínas (tabla 3).
En forma opuesta, existe evidencia que sugiere que los corticoides inhalados pueden mostrar efectos terapéuticos tempranos (< 3 h)38. Esta rápida respuesta se encontraría vinculada a un efecto tópico (vasoconstricción de la mucosa de la vía aérea), debido a la potenciación del efecto adrenérgico por modificación de los receptores postsinápticos39. De esta forma, para lograr una máxima eficacia, la administración de corticoides inhalados debería realizarse en forma repetida junto con los agonistas beta. Los datos concluyen que los corticoides inhalados reducen las hospitalizaciones cuando se comparan con placebo (OR = 0,30; IC de 95%, 0,16-0,57), pero no es claro el beneficio cuando se comparan con corticoides sistémicos40.
Finalmente, cierta evidencia disponible muestra que el uso de dosis elevadas de corticoides inhalados al alta de la emergencia puede ser equivalente a un tratamiento con corticoides por vía oral en la reducción de las recaídas a los 7 días, especialmente en asmáticos de gravedad moderada41.
Sulfato de magnesio
Su administración en forma de solución isotónica nebulizada junto con agonistas beta ha mostrado un beneficio en términos de función pulmonar exclusivamente en el subgrupo de pacientes más graves42. Sin embargo, el tratamiento utilizado en esos trabajos incluyó solamente la administración de agonistas beta. Como consecuencia, la magnitud de la respuesta al sulfato de magnesio podría diferir si se utilizaran otras intervenciones terapéuticas como los anticolinérgicos.