Los pacientes con cirrosis presentan un estado hemostático reequilibrado y altamente vulnerable. Valorar el riesgo hemorrágico en estos pacientes es complejo. Es esencial reconocer que las pruebas de coagulación convencionales no reflejan adecuadamente el riesgo real de sangrado o trombosis.
La comprensión detallada de este equilibrio y la aplicación de herramientas diagnósticas más precisas, como los test viscoelásticos, que pueden evaluar de manera más certera su estado de coagulación, facilitan el manejo clínico y pueden mejorar los resultados en estos pacientes.
El riesgo hemorrágico en estos pacientes está condicionado por factores propios de la enfermedad hepática, como la hipertensión portal, el estado hemostático alterado y por factores sistémicos como la presencia de infecciones y enfermedad renal, que son predictores independientes de riesgo de sangrado en procedimientos de alto riesgo. A continuación, se revisan estos conceptos y las recomendaciones de las guías de práctica clínica más recientes.
Patients with cirrhosis present a highly vulnerable and rebalanced hemostasis state. Assessing the bleeding risk in these patients is complex. It is essential to recognize that conventional coagulation tests do not adequately reflect the true risk of bleeding or thrombosis.
The detailed understanding of this balance and the application of more precise diagnostic tools, such as viscoelastic tests that can more accurately evaluate their coagulation status, facilitate clinical management and can improve the results in these patients.
The haemorrhagic risk of this group of patients is conditioned by specific factors of liver disease, such as portal hypertension and altered haemostatic status, and by systemic factors like the presence of infections and kidney disease, which are independent predictors of bleeding during high-risk procedures. These concepts and the recommendations from the most recent clinical practice guidelines are reviewed in this article.
Las enfermedades hepáticas tradicionalmente han sido vinculadas a trastornos hemorrágicos, sin embargo, la evidencia actual sugiere un riesgo significativo de complicaciones trombóticas1. Históricamente, se ha considerado que los pacientes cirróticos están «auto-anticoagulados» debido al déficit de factores de coagulación y a las alteraciones en las pruebas de laboratorio convencionales2. Sin embargo, varios argumentos desafían esta afirmación.
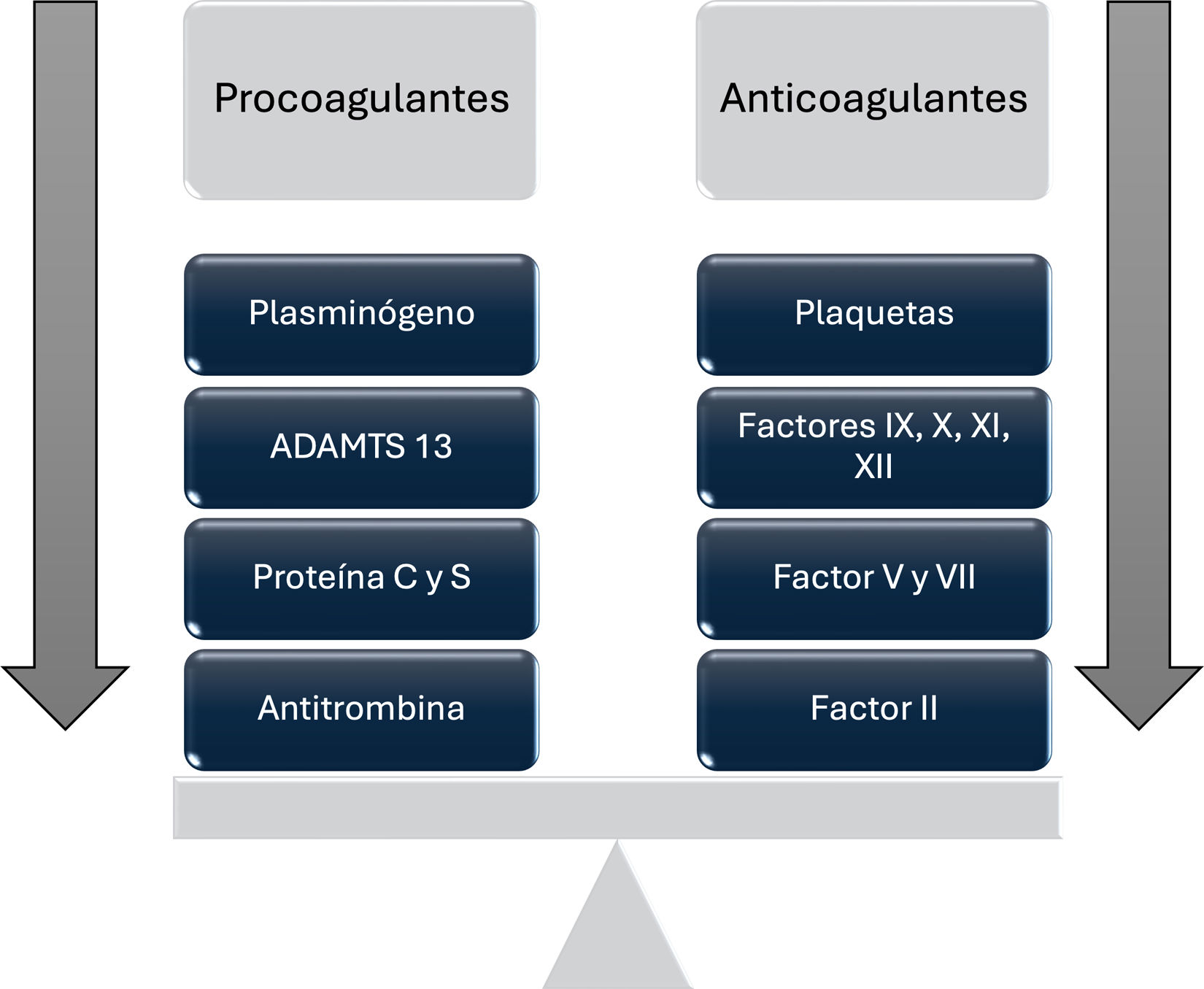
El equilibrio entre los factores procoagulantes y anticoagulantes en estos pacientes, se altera significativamente, creando un entorno hemostático complejo3,4, que afecta a las 2 vías de la cascada de la coagulación: la vía intrínseca y la vía extrínseca.
Tanto la hemostasia primaria como la secundaria están comprometidas por la disminución en la síntesis hepática de varios factores de coagulación —incluidos los factores II, V, VII, IX, X y XI—. A pesar de esta disminución, los niveles del factor de von Willebrand (FvW) y del factor VIII suelen estar aumentados, lo que contribuye a un estado procoagulante2.
Estos cambios pueden conducir a un estado en el que el riesgo de hemorragia o trombosis aumente según las circunstancias individuales2,4 dando origen al concepto de «coagulación reequilibrada», que sugiere que la disminución de los factores procoagulantes es compensada por una reducción concomitante de las proteínas anticoagulantes como proteína C, proteína S, antitrombina, cofactor II de la heparina y α2-macroglobulina, todas sintetizadas por el hígado y cuyos valores se encuentran disminuidos en los pacientes con enfermedad hepática5.
Este reequilibrio, además, se ve afectado, por la presencia de trombocitopenia y defectos en la función plaquetaria, que pueden ser compensados por el aumento del FvW (300% en los casos de cirrosis estable, 360% en la cirrosis aguda descompensada y hasta el 700% en situaciones de insuficiencia hepática aguda sobre crónica) y la disminución, de su regulador, ADAMTS13 (puede descender hasta el 90% de los valores normales), afectando al perfil general de coagulación2,6.
La trombocitopenia es multifactorial: en primer lugar, por secuestro esplénico (bazo congestivo en relación a la hipertensión portal); sin embargo, no todos los pacientes cirróticos con trombocitopenia presentan esplenomegalia, y la reducción de la presión portal no siempre la normaliza6; en segundo lugar, por el «hiperesplenismo», debido a un aumento de la actividad macrofágica inmunomediada para la eliminación plaquetaria, especialmente relevante en los pacientes con hepatitis C y cirrosis biliar primaria3. Por último, la producción hepática insuficiente de trombopoyetina (TPO), cuyos niveles varían según el estadio de la enfermedad. A todo esto, se suma; la supresión de la médula ósea por la terapia antiviral, el alcohol o la deficiencia de folato, que también contribuyen a la trombocitopenia de estos pacientes. Esta trombocitopenia, sin importar la causa o la gravedad de la enfermedad, es compensada con un aumento en la liberación de las plaquetas reticuladas (RePLT), que tienen mayor potencial protrobótico y procoagulante que las plaquetas maduras, llegando a alcanzar valores superiores al 2%, dato que parece predecir mayor riesgo de descompensación hepática7.
Las alteraciones de la función plaquetaria y el FvW son útiles para estratificar el pronóstico de la cirrosis, el incremento de la agregación plaquetaria se asocia a mayor riesgo de trombosis de la vena porta y de descompensaciones hepáticas8.
En relación con la fibrinólisis, todas las proteínas implicadas, son sintetizadas por el hígado, excepto el activador tisular del plasminógeno (tPA) y el inhibidor del activador del plasminógeno-1 (PAI-1). Los pacientes cirróticos presentan niveles reducidos de plasminógeno, inhibidor de plasmina, inhibidor de la fibrinólisis activable por trombina (TAFI) y del factor XIII tanto en la insuficiencia hepática aguda como crónica. En contraste, los niveles plasmáticos de las proteínas profibrinolíticas y las proteínas antifibrinolíticas a menudo están aumentados, probablemente debido a una mayor activación de las células endoteliales o una depuración reducida5, de este modo, pueden presentar tanto un estado de hiper como de hipofribrinólisis, siendo la sepsis una de las principales causas de este último9,10.
Estos cambios antitrombóticos «compensados» por alteraciones protrombóticas ocurren de forma simultánea dando lugar a un «nuevo» estado hemostático, caracterizado por un delicado reequilibrio que muestra fenómenos tanto de hipo como de hipercoagulabilidad (fig. 1), siendo extremadamente frágil y puede desestabilizarse por situaciones como infecciones, insuficiencia renal o episodios agudos de descompensación6,10,11.
A todo lo anteriormente reseñado, existen situaciones especiales que conllevan a un mayor riesgo trombótico y que podrían ser frecuentes en estos pacientes, como la presencia de patología tumoral (hepatocarcinoma), sedentarismo (ascitis, sarcopenia, encefalopatía), edad avanzada o niveles elevados de estrógenos.
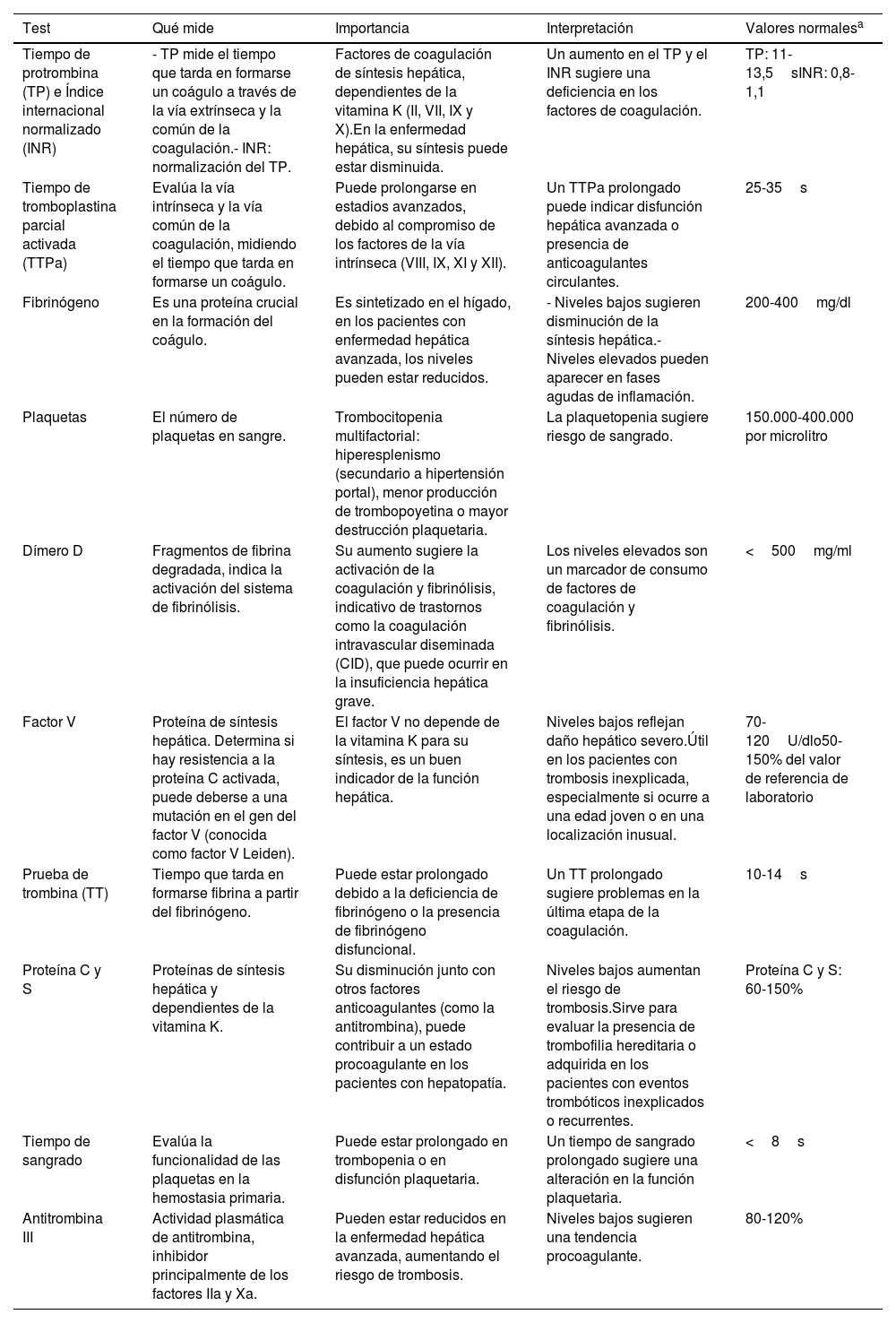
Pruebas de coagulaciónLos resultados de las pruebas de coagulación presentan variabilidad y están intrínsicamente relacionados con el grado de disfunción hepática. Los pacientes pueden desarrollar tanto un estado de hipocoagulabilidad como de hipercoagulabilidad12. Por ello, la constante medición y evaluación de la coagulación es esencial en el manejo clínico de estos pacientes, ya que el hígado juega un papel central en su síntesis y al estar comprometida su función, la capacidad del organismo para mantener una hemostasia adecuada puede verse afectada. Lo que hace necesaria la constante evaluación de la coagulación además de con los test clásicos (tabla 1) con pruebas avanzadas como los test viscoelásticos13.
Tests clásicos
| Test | Qué mide | Importancia | Interpretación | Valores normalesa |
|---|---|---|---|---|
| Tiempo de protrombina (TP) e Índice internacional normalizado (INR) | - TP mide el tiempo que tarda en formarse un coágulo a través de la vía extrínseca y la común de la coagulación.- INR: normalización del TP. | Factores de coagulación de síntesis hepática, dependientes de la vitamina K (II, VII, IX y X).En la enfermedad hepática, su síntesis puede estar disminuida. | Un aumento en el TP y el INR sugiere una deficiencia en los factores de coagulación. | TP: 11-13,5sINR: 0,8-1,1 |
| Tiempo de tromboplastina parcial activada (TTPa) | Evalúa la vía intrínseca y la vía común de la coagulación, midiendo el tiempo que tarda en formarse un coágulo. | Puede prolongarse en estadios avanzados, debido al compromiso de los factores de la vía intrínseca (VIII, IX, XI y XII). | Un TTPa prolongado puede indicar disfunción hepática avanzada o presencia de anticoagulantes circulantes. | 25-35s |
| Fibrinógeno | Es una proteína crucial en la formación del coágulo. | Es sintetizado en el hígado, en los pacientes con enfermedad hepática avanzada, los niveles pueden estar reducidos. | - Niveles bajos sugieren disminución de la síntesis hepática.- Niveles elevados pueden aparecer en fases agudas de inflamación. | 200-400mg/dl |
| Plaquetas | El número de plaquetas en sangre. | Trombocitopenia multifactorial: hiperesplenismo (secundario a hipertensión portal), menor producción de trombopoyetina o mayor destrucción plaquetaria. | La plaquetopenia sugiere riesgo de sangrado. | 150.000-400.000 por microlitro |
| Dímero D | Fragmentos de fibrina degradada, indica la activación del sistema de fibrinólisis. | Su aumento sugiere la activación de la coagulación y fibrinólisis, indicativo de trastornos como la coagulación intravascular diseminada (CID), que puede ocurrir en la insuficiencia hepática grave. | Los niveles elevados son un marcador de consumo de factores de coagulación y fibrinólisis. | <500mg/ml |
| Factor V | Proteína de síntesis hepática. Determina si hay resistencia a la proteína C activada, puede deberse a una mutación en el gen del factor V (conocida como factor V Leiden). | El factor V no depende de la vitamina K para su síntesis, es un buen indicador de la función hepática. | Niveles bajos reflejan daño hepático severo.Útil en los pacientes con trombosis inexplicada, especialmente si ocurre a una edad joven o en una localización inusual. | 70-120U/dlo50-150% del valor de referencia de laboratorio |
| Prueba de trombina (TT) | Tiempo que tarda en formarse fibrina a partir del fibrinógeno. | Puede estar prolongado debido a la deficiencia de fibrinógeno o la presencia de fibrinógeno disfuncional. | Un TT prolongado sugiere problemas en la última etapa de la coagulación. | 10-14s |
| Proteína C y S | Proteínas de síntesis hepática y dependientes de la vitamina K. | Su disminución junto con otros factores anticoagulantes (como la antitrombina), puede contribuir a un estado procoagulante en los pacientes con hepatopatía. | Niveles bajos aumentan el riesgo de trombosis.Sirve para evaluar la presencia de trombofilia hereditaria o adquirida en los pacientes con eventos trombóticos inexplicados o recurrentes. | Proteína C y S: 60-150% |
| Tiempo de sangrado | Evalúa la funcionalidad de las plaquetas en la hemostasia primaria. | Puede estar prolongado en trombopenia o en disfunción plaquetaria. | Un tiempo de sangrado prolongado sugiere una alteración en la función plaquetaria. | <8s |
| Antitrombina III | Actividad plasmática de antitrombina, inhibidor principalmente de los factores IIa y Xa. | Pueden estar reducidos en la enfermedad hepática avanzada, aumentando el riesgo de trombosis. | Niveles bajos sugieren una tendencia procoagulante. | 80-120% |
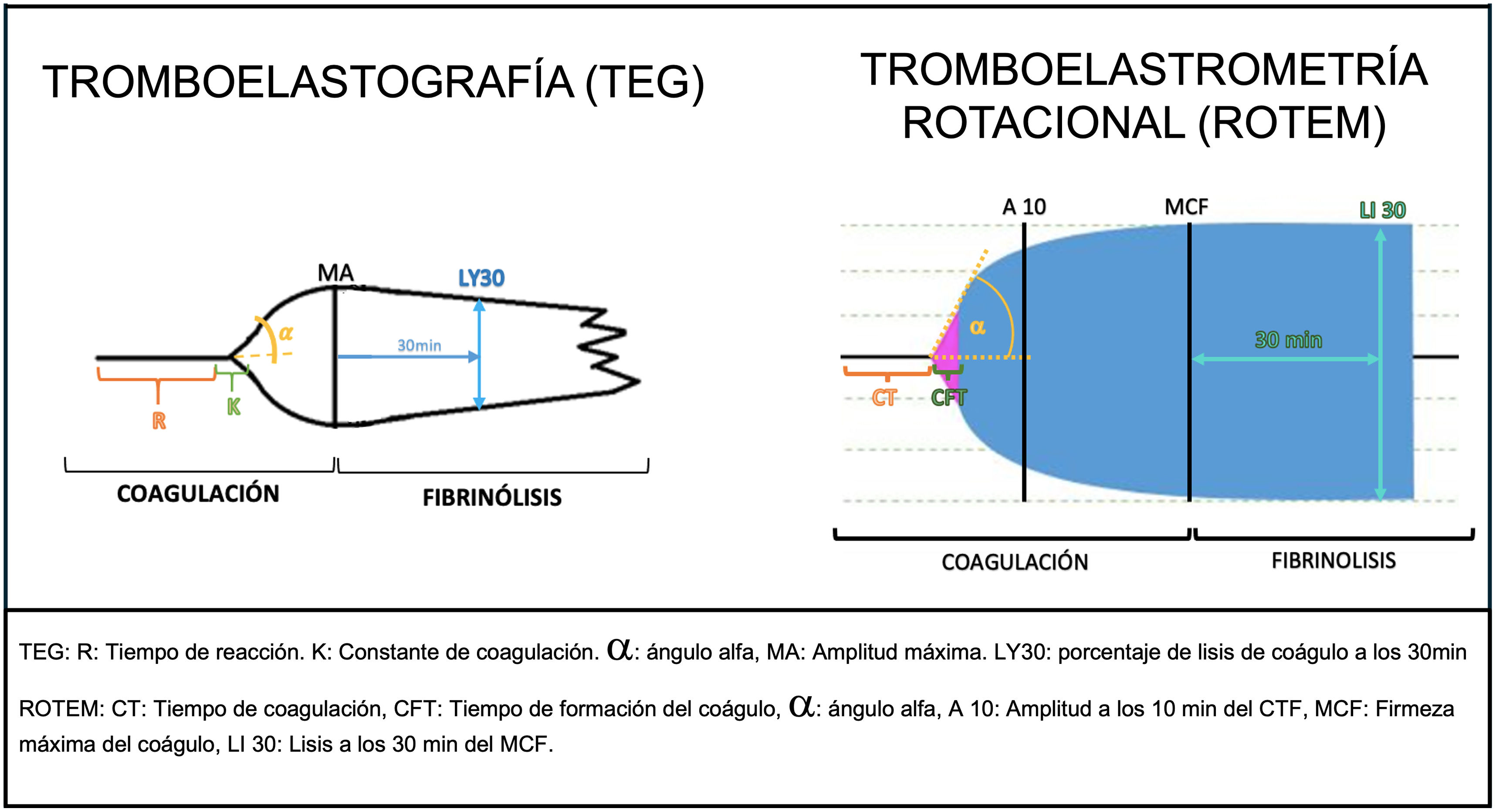
Los test viscoelásticos (VET): Tromboelastografía (TEG, por sus siglas en inglés) y Tromboelastometría rotacional (ROTEM, por sus siglas en inglés) son herramientas especializadas que proporcionan una visión más detallada y precisa del sistema hemostático y trombótico. Estos análisis son de particular utilidad cuando los test clásicos de coagulación no explican completamente el cuadro clínico del paciente. De hecho, una de sus principales ventajas es la posibilidad de integrar las pruebas de coagulación con la función plaquetaria, permitiendo dar una idea más global de la fisiología de la hemostasia. Son test dinámicos que permiten la medición de la formación y estabilidad del coágulo, así como la fibrinólisis, analizando los diferentes aspectos de la coagulación, la función plaquetaria y el sistema fibrinolítico. Su uso no es útil para predecir el sangrado ni disminuir la mortalidad de los pacientes cirróticos, pero su aplicación pre o perioperatoria, puede contribuir a la disminución de las necesidades transfusionales de plasma y plaquetas12,13.
El procedimiento consiste en introducir la muestra de sangre total en una cubeta con un pin cilíndrico en su interior y un procesador analizará los movimientos rotacionales entre ambos. La coagulación y la lisis generan cambios de torsión que son analizados por el procesador y reflejados en una gráfica (tabla 2, fig. 2 y material suplementario)14–16.
Tipos de test viscoelásticos, características y valores de referencia14–17,20
| Test viscoelástico | Qué mide | Interpretación | Valores normales | |
|---|---|---|---|---|
| TEGThromboelastographyMide la formación y estabilización del coágulo | R (tiempo de reacción) | Tiempo hasta que se forma el primer filamento de fibrina, amplitud de 2mm. | • Prolongado: deficiencia en la formación de fibrina o en la actividad plaquetaria, deficiencia de factores de coagulación o presencia de anticoagulantes.• Acortamiento: hipercoagulabilidad. | 4,5-7,5min |
| K (constante de coagulación) | Tiempo hasta que el coágulo alcanza una amplitud de 20mm. | • Prolongado: deficiencia en la formación del coágulo (problemas en la síntesis de fibrina).• Disminuido: hipercoagulabilidad. | 1-3,5min | |
| Ángulo (α) | Velocidad de formación del coágulo, que va desde R a hasta el punto en que la velocidad de formación frena e inicia la curva. | • Pequeño: formación lenta del coágulo, debido a deficiencias plaquetarias, fibrinógeno bajo o disfuncionante.• Ancho: velocidad rápida de formación de fibrina (hipercoagulación plaquetaria). | 50-80° | |
| A10 | Amplitud del coágulo a los 10min de R. | Igual que MA, pero más utilizado en el paciente agudo. | >50mm | |
| MA (amplitud máxima del coágulo) | Medida de la fuerza máxima del coágulo, representa principalmente la función plaquetaria. | • Delgado: indica un coágulo frágil. Se debe trombocitopenia o disfunción plaquetaria.• Ancho: hipercoagulabilidad. | 50-73mm | |
| LYS 30 | Porcentaje de disolución del coágulo a los 30min de alcanzada la amplitud máxima. | • Aumentado: hiperfibrinólisis.• Disminuido: hipofibrinólisis o estado protrombótico. | 15% | |
| ROTEM (Rotational Thromboelastometry)• Mide la viscosidad del coágulo a medida que se forma y estabiliza.• Usa un panel de reactivos que activan diferentes fases de la cascada de coagulación y evalúa como afecta la dinámica del coágulo en presencia de estos reactivos• Parámetros:∘ CT: tiempo de coagulación=R∘ CFT: tiempo de formación del coágulo=K∘ Ángulo (α)∘ A10: amplitud a los 10min de CFT∘ MCF: firmeza máxima del coágulo=MA∘ LI30: lisis a los 30min del MCF=LY30∘ ML: lisis máxima• Su uso combinado facilita el diagnóstico diferencial | EXTEM ▪ Evalúa vía extrínseca | ▪ Reactivo: factor tisular (FT). ▪ Similar TP. ▪ Evalúa la formación del coágulo activado por la vía extrínseca. | ▪ EXTEM prolongado: indica deficiencia en la vía extrínseca de la coagulación (p. ej., déficit de factor VII). | CT: 38-80s.A10: 43-65mmMCF: 50-75mmML<15% de MCF |
| INTEM ▪ Evalúa vía intrínseca, similar a TTPa | ▪ Reactivo: ácido elágico. ▪ Similar al TTPa. ▪ Evalúa la vía intrínseca de la coagulación. | ▪ INTEM prolongado: señala déficit en los factores de la vía intrínseca. | CT: 100-240s.A10: 44-66mm.MCF: 50-75mmML<15% de MCF | |
| FIBTEM ▪ Utiliza bloqueantes plaquetarios | ▪ Reactivo: FT+ inhibidor de plaquetas (citolicina o abciximab). ▪ Mide específicamente la contribución del fibrinógeno en la formación del coágulo. | ▪ FIBTEM bajo: sugiere deficiencia de fibrinógeno. | ▪ A10: 7-23mm ▪ MCF: 9-25mm | |
| APTEM | ▪ Reactivo: FT+ ácido tranexámico o aprotinina. ▪ Evalúa el efecto de la fibrinólisis. | ▪ Mejoría en los parámetros en APTEM comparando con el EXTEM son indicativos de hiperfibrinólisis. | ||
| HEPTEM ▪ Neutraliza la heparina | ▪ Reactivo: ácido elágico+ heparinasa. ▪ Detecta alteraciones de la coagulación debidas a la heparina. | HEPTEM prolongado: alteración en la formación del coágulo. Puede deberse a: ▪ déficit de fibrinógeno, ▪ disfunción plaquetaria, ▪ déficit de factores de coagulación. |
- •
No diagnostica alteraciones de la hemostasia por hipocalcemia, acidosis, déficit de von Willebrand, alteraciones en la proteína C y S o de la adhesión plaquetaria al endotelio15,17.
- •
No diagnostica las alteraciones de la coagulación debidas a la hipotermia.
- •
No analiza la microcirculación donde muy probablemente se inician las alteraciones hemostáticas17.
- •
Requiere de curva de aprendizaje para su realización e interpretación.
- •
Pueden realizarse tanto en laboratorio como a la cabecera del paciente, proporcionando rapidez e inmediatez en la realización de la prueba y obtención de resultados, lo que permite que la terapia trasfusional pueda iniciarse precozmente y dirigirse hacia trastornos específicos como la disminución de los factores de coagulación y la alteración funcional o cuantitativa plaquetaria.
- •
Utiliza sangre total.
- •
Ayuda a optimizar el uso de productos sanguíneos, disminuyendo los requerimientos de hemoderivados.
Se detalla en la literatura la utilidad de los test viscoelásticos en el paciente cirrótico con sangrado por varices esofágicas y se describe la siguiente secuencia para el uso en este escenario18–20.
- 1.
Evaluación inicial (ROTEM/TEG):
- •
Realizar ROTEM o TEG para evaluar la hemostasia en tiempo real.
- •
Se pueden realizar las pruebas de EXTEM, INTEM, FIBTEM, APTEM (ROTEM) o TEG completo.
- •
- 2.
Fases de la evaluación:
- •
Análisis de la formación del coágulo: EXTEM o TEG:
- ∘
R (tiempo de reacción):
- –
Prolongado: Déficit de factores de la coagulación.
- –
Causas: Enfermedad hepática crónica, déficit de vitamina K, heparina.
- –
- ∘
K (tiempo de formación) y ángulo α:
- –
Prolongado o α pequeño: Déficit de fibrinógeno o plaquetas.
- –
Causas: Disfunción hepática severa, trombopatía, hipofibrinogenemia.
- –
- ∘
- •
Evaluación de la estabilidad del coágulo (amplitud máxima [MA]):
- ∘
MA (amplitud máxima):
- –
Bajo: Coágulo débil (déficit de fibrinógeno o plaquetas).
- –
Causas: Hipofibrinogenemia o disfunción plaquetaria debido a la cirrosis hepática o coagulopatía asociada a la cirrosis.
- –
- ∘
- •
Evaluación de la fibrinólisis:
- ∘
APTEM:
- –
Se espera que en el APTEM no haya lisis (LY30 cercano al 0%) debido a que la fibrinólisis está inhibida.
- –
LY30 alto en APTEM puede indicar fibrinólisis residual, lo cual puede ocurrir debido a un síndrome de diseminación intravascular o sepsis.
- –
- ∘
- •
- 3.
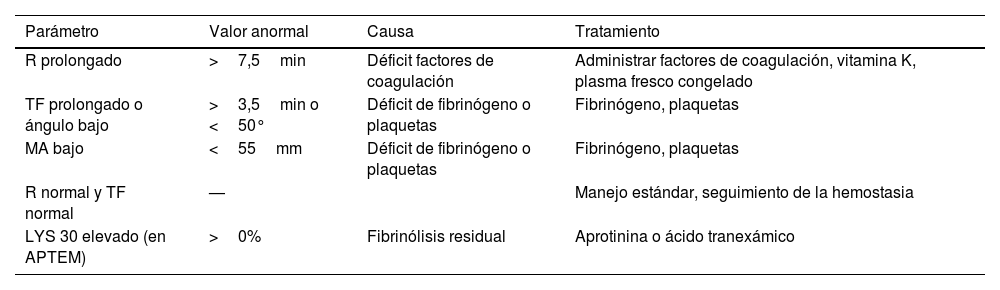
Manejo (tabla 3)
Tabla 3.Manejo del sangrado por varices en un paciente cirrótico18–20
Parámetro Valor anormal Causa Tratamiento R prolongado >7,5min Déficit factores de coagulación Administrar factores de coagulación, vitamina K, plasma fresco congelado TF prolongado o ángulo bajo >3,5min o <50° Déficit de fibrinógeno o plaquetas Fibrinógeno, plaquetas MA bajo <55mm Déficit de fibrinógeno o plaquetas Fibrinógeno, plaquetas R normal y TF normal — Manejo estándar, seguimiento de la hemostasia LYS 30 elevado (en APTEM) >0% Fibrinólisis residual Aprotinina o ácido tranexámico
En la hemorragia digestiva alta por varices esofágicas en los pacientes cirróticos la hiperfibrinólisis juega un papel importante, lo que justifica el uso de APTEM para evaluar la estabilidad del coágulo sin interferencia de esta.
El tratamiento puede incluir una combinación de transfusiones y fármacos para estabilizar la coagulación y prevenir la hemorragia recurrente como se describe en los siguientes apartados. Los test viscolásticos permiten guiar el tratamiento de manera más precisa, optimizando el uso de transfusiones según las necesidades del paciente.
Sangrado en los pacientes con hepatopatía crónica, recomendaciones para la prevención y el tratamientoSegún el escenario clínico, el riesgo de sangrado es distinto como se describe a continuación21:
- •
Pacientes con cirrosis estables sin descompensación: no se recomiendan realizar pruebas de coagulación previas a la mayoría de los procedimientos de bajo riesgo. Tampoco está indicado corregir el INR22 de forma profiláctica y rutinaria ya que no se ha demostrado una relación directa entre los valores de INR elevados y los episodios hemorrágicos. Dependiendo del riesgo asociado al procedimiento, podría ser necesaria la corrección de los niveles plaquetarios.
- •
Pacientes con cirrosis descompensada: presentan un estado de hiperfibrinólisis y coagulopatía por disfunción plaquetaria. Sin embargo, el factor clave en la aparición de sangrado, es el aumento de la hipertensión portal21. Por ello se requiere una estrategia transfusional restrictiva que incluya evitar el plasma fresco congelado y concentrados de hematíes.
- •
Pacientes sometidos a trasplante hepático: habitualmente suelen presentar un estado de hipercoagulabilidad generalmente debido a la exposición del factor tisular y a la recuperación progresiva de la síntesis hepática en el injerto hepático que incrementa de forma gradual los factores procoagulantes23, excepto en casos de sangrado ostensible en la cirugía, que contribuya a la coagulopatía de consumo o dilucional.
- •
Pacientes con fallo hepático agudo: pese a las alteraciones significativas en las pruebas clásicas de coagulación, estos pacientes, se caracterizan por un estado de hipercoagulabilidad. En general, los episodios hemorrágicos son infrecuentes en este contexto no siendo necesaria la corrección profiláctica de los parámetros de la coagulación24,25.
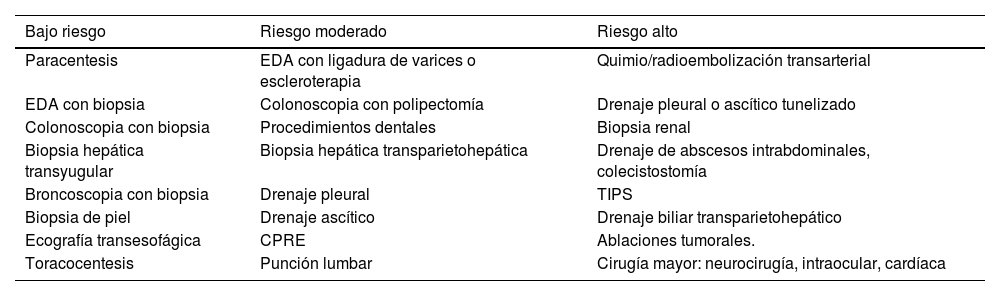
Otro elemento importante es la estratificación del riesgo de sangrado21 de los pacientes que se someten a procedimientos invasivos. Se consideran procedimientos de alto riesgo hemorrágico, si ocurre el sangrado en más del 1,5% de los procedimientos registrados. En la tabla 4 se estratifican los procedimientos más frecuentes en los pacientes críticos y hepatópatas. El uso profiláctico de hemoderivados no ha demostrado disminuir las complicaciones hemorrágicas de procedimientos invasivos, en especial, en los procedimientos clasificados como bajo riesgo25–31.
Estratificación del riesgo de sangrado de procedimientos habituales en los pacientes críticos y hepatópatas
| Bajo riesgo | Riesgo moderado | Riesgo alto |
|---|---|---|
| Paracentesis | EDA con ligadura de varices o escleroterapia | Quimio/radioembolización transarterial |
| EDA con biopsia | Colonoscopia con polipectomía | Drenaje pleural o ascítico tunelizado |
| Colonoscopia con biopsia | Procedimientos dentales | Biopsia renal |
| Biopsia hepática transyugular | Biopsia hepática transparietohepática | Drenaje de abscesos intrabdominales, colecistostomía |
| Broncoscopia con biopsia | Drenaje pleural | TIPS |
| Biopsia de piel | Drenaje ascítico | Drenaje biliar transparietohepático |
| Ecografía transesofágica | CPRE | Ablaciones tumorales. |
| Toracocentesis | Punción lumbar | Cirugía mayor: neurocirugía, intraocular, cardíaca |
En el caso de discrepancias se han estratificado como de riesgo moderado.
AGA: American Gastroenterology Association; AMG: Asociación Mexicana de Gastroenterología; BSH: British Society for Haematology; CPRE: colangiopancreatografía retrógada endoscópica; EASL: European Association for the Study of the Liver; EDA: endoscopia digestiva alta; ISTH: International Society on Thrombosis ad Haemostasis; SETH: Sociedad Española de Trasplante Hepático; SIR: Society of Interventional Radiology; TIPS: derivación portosistémica transyugular intrahepática.
Fuente: adaptado de SETH26, AMG21, AGA27, EASL28, BSH29, ISTH30 y SIR31.
En presencia de un sangrado activo o procedimiento de alto riesgo, es primordial mantener al paciente en condiciones óptimas, garantizando una temperatura corporal normotérmica (>36°C), un pH mayor a 7,35 y niveles de calcio iónico mayor a 1mmol/l33. Además, siempre que sea posible se recomienda realizar una valoración mediante pruebas viscoelásticas para guiar la optimización del proceso de la coagulación como se muestra en la tabla 3 y figura 2.
En orden de prioridad, las plaquetas, seguidas del fibrinógeno y en menor medida, los factores de coagulación son los elementos a optimizar, en especial para los pacientes con fallo hepático agudo24. Las estrategias restrictivas de transfusión han demostrado mejor desenlace en los escenarios de trasplante hepático, sangrado digestivo y sangrado por otras etiologías en los pacientes cirróticos25,28,30.
Sin embargo, dado que las pruebas viscoelásticas no están disponibles en todos los centros, a continuación, se citan valores de referencia de las pruebas clásicas descritos en la literatura, así como las recomendaciones terapéuticas en los pacientes con hepatopatia crónica sugeridas por distintas sociedades científicas y grupos de investigación21,25,26,29,30,32–36:
- •
Plaquetas: su transfusión está recomendada de manera profiláctica en los pacientes adultos hospitalizados con cifras <10×109/l37 según la guía de la EASL y de AABB28,36.
Para los pacientes hepatópatas sometidos a procedimientos de alto riesgo o en los que no es posible la hemostasia local, la transfusión de plaquetas o agonistas de la trombopoyetina no debe realizarse de forma rutinaria, pero puede individualizarse28. Los niveles objetivo varían entre las 20×109/l-50×109/l según el procedimiento (Tabla 1. material suplementario).
Durante el trasplante hepático, según el consenso SETH-SETH, se recomiendan niveles mayores a 30×109/l intraoperatorios y superiores a 50×109/l si existe sangrado activo26.
- •
Agonistas de la trombopoyetina (TPO-R): Avatrombopag y lusutrombopag son una buena alternativa a la transfusión de plaquetas, requieren entre 5 a 7 días para alcanzar el pico de plaquetas27, quedándose al margen para su uso en la patología aguda. No se recomienda su uso cuando el recuento plaquetario es superior a 50×109/l37 o cuando el sangrado puede tratarse mediante hemostasia local28. Los datos actuales provienen de estudios en los pacientes con cirrosis Child-Pugh estadio A y B; hay poca evidencia en pacientes en estadio C y en fallo hepático agudo sobre crónico38.
- •
Fibrinógeno: La guía de EASL 2022 desaconseja su corrección profiláctica de forma rutinaria (recomendación fuerte)28 y recomienda mantener niveles séricos de fibrinógeno >1,2g/dl mediante la administración de fibrinógeno sintético o crioprecipitados36 en caso de hemorragia o previo a un procedimiento invasivo de alto riesgo21. Según Budnick et al., la transfusión de crioprecipitados de manera profiláctica por niveles de fibrinógeno inferiores a 1,5g/dl no modificó el riesgo de sangrado o mortalidad37.
- •
INR: Se recomienda alcanzar un INR inferior a 2 solo en casos de sangrado activo, corrigiendo con concentrado de complejo de protrombina en vez de plasma fresco congelado (PFC)39, dado el aumento de la hipertensión portal por el gran volumen aportado durante las transfusiones (1,4mmHg por cada 100ml de PFC)40, que favorece los episodios de sangrado varicoso y de lechos quirúrgicos abdominales25,41,42. En los pacientes cirróticos sometidos a procedimientos invasivos, no se recomienda la corrección profiláctica del INR ya que no se relaciona con el sangrado28,38.
Respecto al uso del complejo de protrombina, se comercializan en presentaciones de 3 factores (II, IX y X) o 4 factores (II, VII, IX y X) asociados a la proteína C y S. La concentración de estos factores de coagulación, es 25 veces más que en el PFC, haciendo que se alcance una corrección del INR más rápida, su infusión completa lleva aproximadamente 10min28. En los pacientes cirróticos, donde el INR no es una medición precisa, y dado que la dosis se calcula en función del INR y el peso del paciente, hacen falta estudios para optimizar su dosis27. Un estudio in vitro demostró una respuesta procoagulante exagerada en los pacientes cirróticos tras su administración comparado con los pacientes sanos dada a la diferencia en la generación de trombina: 150% en la cirrosis descompensada, 270% en los pacientes en fallo hepático agudo sobre crónico y 97% en los pacientes sanos43.
- •
Hemoglobina: 7-8g/dl, no exceder 9g/dl para no aumentar hipertensión portal.
- •
Factor XIII: <50%, corregir ante la ausencia de otras alteraciones.
- •
Otros tratamientos:
- ∘
Ácido tranexámico: Pese a que su uso está ampliamente estudiado en el manejo del sangrado masivo en los pacientes politraumatizados y en la hemorragia posparto, en los pacientes cirróticos se desaconseja su uso rutinario28 basándose en el ensayo HALT-IT que incluyó pacientes con sangrado por varices esofágicas44 y demostró que no es efectivo para reducir la mortalidad a los 5 días con un riesgo relativo de 0,99, IC 95%: 0,82-1,8%. Según la guía EASL del 202228 en los pacientes cirróticos y con sangrado activo por várices, en los que se logra el control del sangrado con fármacos hipotensores portales y tratamiento endoscópico, no está indicada la corrección de las anomalías hemostáticas ni el uso del ácido tranexámico. Se debe considerar la administración terapéutica de ácido tranexámico si existe sospecha clínica de hiperfibrinólisis (coagulopatía sangrante con disminución de fibrinógeno) o existen cambios compatibles en la tromboelastografia26.
En el trasplante hepático, se recomienda su uso profiláctico en los pacientes con clase B o C de Child-Pugh26 en los que no se tenga acceso a pruebas viscoelásticas.
- ∘
Vitamina K: su administración rutinaria no mejora las cifras de INR45,46 debido a que el déficit de factores de coagulación se debe principalmente a una alteración de la función hepática, no a una carencia vitamínica.
- ∘
Desmopresina: Estimula la liberación desde el endotelio del FvW como mecanismo hemostático primario, dado que este factor suele estar elevado en la cirrosis, su administración carece de una base científica sólida, pero puede ser útil en los pacientes con insuficiencia renal concomitante27.
- ∘
Los pacientes cirróticos hospitalizados tienen un riesgo 2 veces mayor de enfermedad tromboembólica que los pacientes hospitalizados no cirróticos6, así como mayor incidencia de trombosis de la vena porta, variando desde el 0,6 hasta el 26% en los pacientes con enfermedad hepática crónica, lo que aumenta en función de la gravedad de la enfermedad6. Por lo tanto, los test de coagulación clásicos y un INR elevado no se correlaciona con una mayor tendencia al sangrado ni protegen frente al tromboembolismo venoso47.
La anticoagulación en los pacientes con cirrosis se evita en la práctica clínica habitual por la incertidumbre de inducir hemorragias graves, especialmente en aquellos pacientes con INR prolongado o trombocitopenia4,12. Sin embargo, este enfoque está cambiando a medida que se comprende mejor la fisiopatología del estado hemostático48. Las guías actuales de las principales sociedades de hepatología, como la American Association for the Study of Liver Diseases (AASLD) y la European Association for the Study of the Liver (EASL), reconocen la importancia de la tromboprofilaxis en los pacientes cirróticos hospitalizados con riesgo elevado de trombosis y bajo riesgo de sangrado4,28.
La EASL en su guía de práctica clínica del 202228 describe que el riesgo estimado de trombosis venosa profunda (TVP) y embolia pulmonar en los pacientes cirróticos es al menos, similar al de la población general, especialmente en la cohorte de esteatohepatitis no alcohólica (NASH), siendo esta un factor de riesgo independiente para el tromboembolismo venoso49. La prevalencia de TVP reportada fue del 1,2-7%50–52, varios estudios y metaanálisis describen un incremento en el riesgo relativo (RR) 1,7 veces de TVP, especialmente en relación con la falta de uso de tromboprofilaxis farmacológica53–56.
La EASL recomienda el uso de tromboprofilaxis en los pacientes cirróticos hospitalizados con cifras plaquetarias >50×109/l con heparina de bajo peso molecular (LMWH) como una práctica segura y sin incremento significativo de la tasa de sangrado28, así como en los pacientes en estadio Child-Pugh A y B. En pacientes Child-Pugh C al igual que en aquellos pacientes con cifras plaquetarias entre 20 y 50×109/l no hay evidencia suficiente acerca de su uso.
En el caso de la trombosis portal, según el VII consenso de Baveno57 se recomienda el inicio de la anticoagulación en pacientes cirróticos con diagnóstico (mediante eco Doppler, tomografía con contraste o angio-resonancia) de trombosis portal asintomática los 6 primeros meses ya sea con oclusión total o parcial (>50%) de la misma y con independencia de la extensión a la vena mesentérica superior así como en los pacientes sintomáticos y/o candidatos a trasplante hepático sin importar la extensión de la trombosis. En caso de diagnóstico por Doppler se recomienda diagnóstico de confirmación por tomografía con contraste o angio-resonancia44.
Se recomienda la infusión sistémica de heparina para el tratamiento de la trombosis de la vena porta, mesentérica y TVP sintomática, quedando por resolver el parámetro de laboratorio con el que se debe monitorizar su uso; se está evaluando entre los niveles de anti-Xa y el tiempo parcial de tromboplastina27.
ConclusionesEl paradigma de los pacientes hepatópatas ha cambiado, la creencia de que predomina un estado de hipocoagulabilidad ha dado paso al concepto de hemostasia reequilibrada, donde según los distintos escenarios en los que se encuentre el paciente, puede estar en un estado de hiper o hipocoagulabilidad. La utilidad de las pruebas de hemostasia convencionales es muy limitada y los test viscoelásticos pueden aportar una información más precisa. De forma general los pacientes hepatópatas no necesitan de corrección de su estado de coagulación salvo en casos de sangrado activo o procedimientos invasivos con alto riesgo de sangrado y son subsidiarios de recibir profilaxis farmacológica para eventos trombóticos de forma similar a la población general.
AutoríaTodos los autores participaron a partes iguales del desarrollo del manuscrito y aprobamos el manuscrito final.
FinanciaciónNo ha existido financiación para la realización de este manuscrito.
Declaración sobre el uso de la IA generativa y de las tecnologías asistidas por la IA en el proceso de redacciónNo se han utilizado herramientas de IA regenerativa en este manuscrito.
Conflicto de interesesLos autores de este manuscrito no tenemos ningún conflicto de interés respecto al tema de este artículo.
AgradecimientosAgradecemos a los coordinadores de los Grupos de Trabajo de Patología Digestiva Crítica Dr. David Toapanta y de Hemoterapia, Hematología y Oncología Crítica de la SEMICYUC Dr. Kapil Nanwani, su implicación para la realización este documento conjunto.