Las alteraciones del fosfato son frecuentes en los niños en estado crítico1, y se han relacionado con desnutrición, síndrome de realimentación2–4, nutrición parenteral (NP)5, diuréticos y fármacos vasoactivos1,4,6. Algunos estudios han encontrado asociación de la hipofosfatemia e hiperfosfatemia con la mortalidad, el estado de gravedad1,2 y la duración del ingreso en la unidad de cuidados intensivos pediátricos (UCIP)1,3.
Se realizó un estudio retrospectivo, unicéntrico, observacional, aprobado por el comité de ética e investigación. El objetivo del estudio fue analizar los factores relacionados y la repercusión de las alteraciones del fosfato en los niños ingresados en la UCIP.
Se incluyeron los pacientes en los que se realizó medición de los niveles de fosfato durante el ingreso en la UCIP en 12 meses. Se registraron la edad, el sexo, la fecha de ingreso y alta, los datos antropométricos, los antecedentes personales, las escalas de gravedad clínica y los valores de fosfato, calcio, creatinina, albúmina, parathormona (PTH), magnesio y lactato en sangre, en diferentes tiempos: T0: 1.° y 2.° día, T1: días 3 a 7, T2: días 8 a 14 y Talta; tratamiento con fosfato, fármacos, hemoderivados, técnicas de depuración extrarrenal (TDER), nutrición enteral o NP, ventilación mecánica invasiva (VMI) o no invasiva (VMNI), oxigenación por membrana extracorpórea (ECMO) y la mortalidad. El rango de fosfatemia normal fue entre 4 y 7mg/dl. Se emplearon el test de U de Mann-Whitney y la prueba de la mediana para las variables continuas, la prueba de Chi-cuadrado y la prueba exacta de Fisher para las categóricas y el coeficiente de correlación (ρ) de Pearson para el análisis de correlaciones. Se consideró significativa una p<0,05. Se realizó un análisis univariante, y posteriormente un análisis multivariante de regresión logística de los factores relacionados con las alteraciones del fosfato.
De los 370 ingresos en la UCIP, se incluyeron 232 pacientes, el 41,8% mujeres (tabla 1E del material adicional). La duración de ingreso en la UCIP fue de 3 días (RIQ: 2-9). Fallecieron 10 pacientes (4,3%). Existió una relación inversamente proporcional entre la edad y los niveles de fosfato sérico igual que ocurre en los niños sanos. Los pacientes quirúrgicos presentaron unos niveles de fosfato al ingreso superiores al resto (5,6 [4,7-6,8] frente a 4,4mg/dl [3,7-5,1]; p<0,001).
La fig. 1E del material adicional muestra la evolución de los valores de fosfato, calcio y creatinina, y los porcentajes de hipofosfatemia e hiperfosfatemia. En los pacientes quirúrgicos, los niveles del fosfato fueron más altos al ingreso disminuyendo posteriormente, hecho que no se observó en los pacientes médicos (fig. 2E del material adicional).
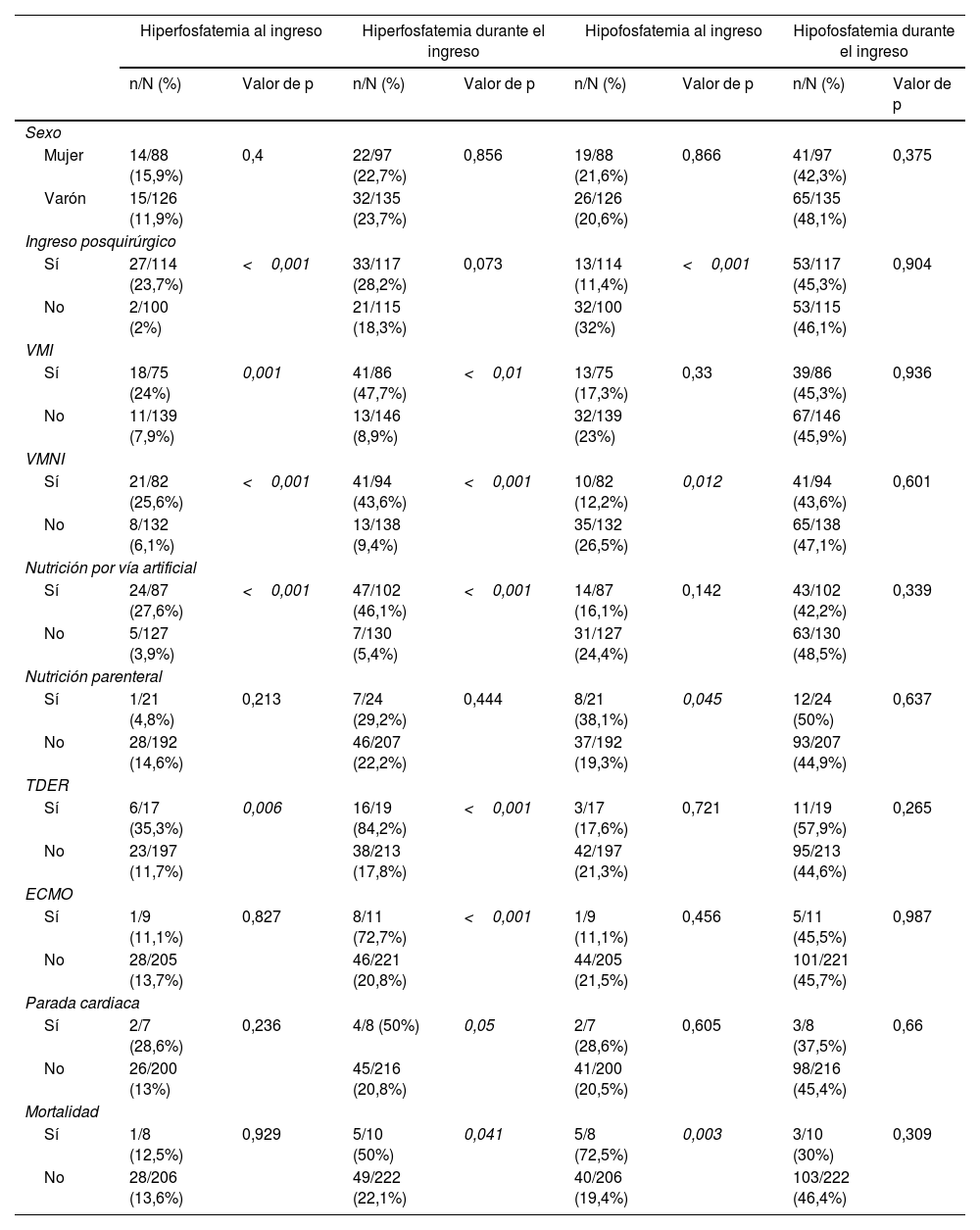
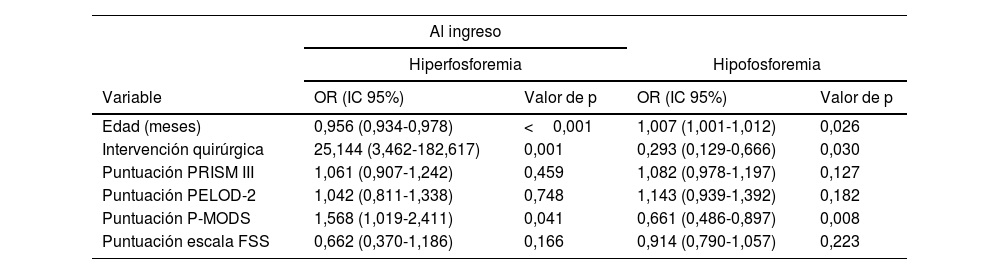
La tabla 1 recoge las variables asociadas con hiperfosfatemia e hipofosfatemia en el estudio univariante y la tabla 2 en el estudio multivariante.
Factores asociados con alteraciones de la fosforemia al ingreso y durante el ingreso en la UCIP
| Hiperfosfatemia al ingreso | Hiperfosfatemia durante el ingreso | Hipofosfatemia al ingreso | Hipofosfatemia durante el ingreso | |||||
|---|---|---|---|---|---|---|---|---|
| n/N (%) | Valor de p | n/N (%) | Valor de p | n/N (%) | Valor de p | n/N (%) | Valor de p | |
| Sexo | ||||||||
| Mujer | 14/88 (15,9%) | 0,4 | 22/97 (22,7%) | 0,856 | 19/88 (21,6%) | 0,866 | 41/97 (42,3%) | 0,375 |
| Varón | 15/126 (11,9%) | 32/135 (23,7%) | 26/126 (20,6%) | 65/135 (48,1%) | ||||
| Ingreso posquirúrgico | ||||||||
| Sí | 27/114 (23,7%) | <0,001 | 33/117 (28,2%) | 0,073 | 13/114 (11,4%) | <0,001 | 53/117 (45,3%) | 0,904 |
| No | 2/100 (2%) | 21/115 (18,3%) | 32/100 (32%) | 53/115 (46,1%) | ||||
| VMI | ||||||||
| Sí | 18/75 (24%) | 0,001 | 41/86 (47,7%) | <0,01 | 13/75 (17,3%) | 0,33 | 39/86 (45,3%) | 0,936 |
| No | 11/139 (7,9%) | 13/146 (8,9%) | 32/139 (23%) | 67/146 (45,9%) | ||||
| VMNI | ||||||||
| Sí | 21/82 (25,6%) | <0,001 | 41/94 (43,6%) | <0,001 | 10/82 (12,2%) | 0,012 | 41/94 (43,6%) | 0,601 |
| No | 8/132 (6,1%) | 13/138 (9,4%) | 35/132 (26,5%) | 65/138 (47,1%) | ||||
| Nutrición por vía artificial | ||||||||
| Sí | 24/87 (27,6%) | <0,001 | 47/102 (46,1%) | <0,001 | 14/87 (16,1%) | 0,142 | 43/102 (42,2%) | 0,339 |
| No | 5/127 (3,9%) | 7/130 (5,4%) | 31/127 (24,4%) | 63/130 (48,5%) | ||||
| Nutrición parenteral | ||||||||
| Sí | 1/21 (4,8%) | 0,213 | 7/24 (29,2%) | 0,444 | 8/21 (38,1%) | 0,045 | 12/24 (50%) | 0,637 |
| No | 28/192 (14,6%) | 46/207 (22,2%) | 37/192 (19,3%) | 93/207 (44,9%) | ||||
| TDER | ||||||||
| Sí | 6/17 (35,3%) | 0,006 | 16/19 (84,2%) | <0,001 | 3/17 (17,6%) | 0,721 | 11/19 (57,9%) | 0,265 |
| No | 23/197 (11,7%) | 38/213 (17,8%) | 42/197 (21,3%) | 95/213 (44,6%) | ||||
| ECMO | ||||||||
| Sí | 1/9 (11,1%) | 0,827 | 8/11 (72,7%) | <0,001 | 1/9 (11,1%) | 0,456 | 5/11 (45,5%) | 0,987 |
| No | 28/205 (13,7%) | 46/221 (20,8%) | 44/205 (21,5%) | 101/221 (45,7%) | ||||
| Parada cardiaca | ||||||||
| Sí | 2/7 (28,6%) | 0,236 | 4/8 (50%) | 0,05 | 2/7 (28,6%) | 0,605 | 3/8 (37,5%) | 0,66 |
| No | 26/200 (13%) | 45/216 (20,8%) | 41/200 (20,5%) | 98/216 (45,4%) | ||||
| Mortalidad | ||||||||
| Sí | 1/8 (12,5%) | 0,929 | 5/10 (50%) | 0,041 | 5/8 (72,5%) | 0,003 | 3/10 (30%) | 0,309 |
| No | 28/206 (13,6%) | 49/222 (22,1%) | 40/206 (19,4%) | 103/222 (46,4%) | ||||
ECMO: oxigenación por membrana extracorpórea; PC: parada cardiaca; TDER: terapia de depuración extrarrenal; UCIP: unidad de cuidados intensivos pediátricos; VMI: ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva.
Análisis multivariante de los factores relacionados con las alteraciones del fosfato al ingreso y durante el ingreso en la UCIP
| Al ingreso | ||||
|---|---|---|---|---|
| Hiperfosforemia | Hipofosforemia | |||
| Variable | OR (IC 95%) | Valor de p | OR (IC 95%) | Valor de p |
| Edad (meses) | 0,956 (0,934-0,978) | <0,001 | 1,007 (1,001-1,012) | 0,026 |
| Intervención quirúrgica | 25,144 (3,462-182,617) | 0,001 | 0,293 (0,129-0,666) | 0,030 |
| Puntuación PRISM III | 1,061 (0,907-1,242) | 0,459 | 1,082 (0,978-1,197) | 0,127 |
| Puntuación PELOD-2 | 1,042 (0,811-1,338) | 0,748 | 1,143 (0,939-1,392) | 0,182 |
| Puntuación P-MODS | 1,568 (1,019-2,411) | 0,041 | 0,661 (0,486-0,897) | 0,008 |
| Puntuación escala FSS | 0,662 (0,370-1,186) | 0,166 | 0,914 (0,790-1,057) | 0,223 |
| Durante el ingreso | ||||
|---|---|---|---|---|
| Hiperfosforemia | Hipofosforemia | |||
| Variable | OR (IC 95%) | Valor de p | OR (IC 95%) | Valor de p |
| Edad (meses) | 0,984 (0,974-0,993) | <0,001 | 1,008 (1,003-1,012) | 0,001 |
| Cirugía | 7,585 (2,466-23,334) | <0,001 | 0,981 (0,556-1,733) | 0,948 |
| Duración de ingreso | 1,026 (1,000-1,052) | 0,048 | 1,001 (0,988-1,015) | 0,840 |
| VMNI | 4,552 (1,572-13,178) | 0,005 | 0,873 (0,450-1,694) | 0,688 |
| Nutrición vía artificial | 4,381 (1,393-13,784) | 0,012 | 1,100 (0,531-2,276) | 0,798 |
| Nutrición parenteral | 0,109 (0,010-1,227) | 0,073 | 0,977 (0,364-2,623) | 0,963 |
| TDER | 38,973 (2,694-563,897) | 0,007 | 1,101 (0,292-4,153) | 0,887 |
IC 95%: intervalo de confianza del 95%; Nutrición vía artificial: SNG/STP/gastrostomía; OR: odds ratio; PELOD: Pediatric Logistic Organ Dysfunction; FSS: Functional Status Scale; P-MODS: Pediatric Multiple Organ Disfunction Score; PRISM-III: Pediatric Risk of Mortality; RIQ: rango intercuartílico; TDER: técnicas de depuración extrarrenal; UCIP: unidad de cuidados intensivos pediátricos; VMNI: ventilación mecánica no invasiva.
Los niños con hiperfosfatemia al ingreso y durante el mismo tenían menor edad y peso, y mayor puntuación en las escalas de gravedad y duración de estancia en la UCIP (tabla 1). Un 50% de los pacientes fallecidos desarrollaron hiperfosfatemia durante el ingreso frente a un 20,8% de los supervivientes (p=0,041).
La hiperfosfatemia fue más frecuente en los pacientes tratados con corticoides (33,3 frente al 19,8%; p=0,030), fármacos vasoactivos (36,5 frente al 10,5%; p<0,001), furosemida (39,2 frente al 6,4%; p<0,001), acetazolamida (50 frente al 22%; p=0,017), vitamina D (47,6 frente al 21,2%; p=0,006) y hierro (35 frente al 20,2%; p=0,043).
En el análisis multivariante la hiperfosfatemia al ingreso se relacionó con una menor edad, ingreso quirúrgico y mayor puntuación en la escala P-MODS. La hiperfosfatemia durante el ingreso se asoció a menor edad, ingreso quirúrgico, VMNI, nutrición artificial, TDER y mayor duración de ingreso, como se ha descrito en los adultos7 (tabla 2).
En los pacientes tratados con TDER, la fosfatemia disminuye si no se suplementan los líquidos de diálisis con fosfato8, pero nuestros pacientes recibieron suplementos de fosfato en los líquidos de TDER, y quizás por ello presentaron con mayor frecuencia hiperfosfatemia6.
La hiperfosfatemia fue más frecuente en los pacientes que precisaron ventilación mecánica, coincidiendo con lo referido en otros estudios, sin encontrar una razón fisiopatológica que explique esta asociación. Los pacientes con hiperfosfatemia presentaron mayores puntuaciones en las escalas de gravedad, lo que sugiere que podría ser un marcador de gravedad en los niños en estado crítico6,7,9.
HipofosfatemiaLa hipofosfatemia fue más frecuente que la hiperfosfatemia, lo que concuerda con lo descrito previamente6. Las principales causas de hipofosfatemia son la redistribución intracelular debida a alcalosis respiratoria, la disminución de aportes o la hemodilución al utilizar fluidos sin fosfato3.
Los pacientes médicos, los tratados con VMNI y NP y los que fallecieron presentaron con mayor frecuencia hipofosfatemia al ingreso en la UCIP. Los pacientes que presentaron hipofosfatemia en el momento del ingreso y durante el mismo tenían mayor edad y peso (tabla 1).
Algunos estudios han encontrado relación entre la hipofosfatemia y la duración de la ventilación mecánica1,6. En el estudio univariante existió relación entre la hipofosfatemia al ingreso con la VMNI, pero no en el multivariante. No encontramos relación de la hipofosfatemia con la NP, corticoides, furosemida, y fármacos vasoactivos, como han descrito otros autores1,10.
En el estudio univariante existió una asociación entre la hipofosfatemia al ingreso con la mortalidad (un 72,5% de los pacientes fallecidos presentaban hipofosfatemia al ingreso frente a un 19,4% de los supervivientes; p=0,003), aunque esta asociación no se mantuvo en el estudio multivariante.
En el análisis multivariante la hipofosfatemia al ingreso se relacionó con mayor edad, causa de ingreso médica y menor puntuación en la escala P-MODS. La hipofosfatemia durante el ingreso únicamente se asoció a una mayor edad (tabla 2).
Las principales limitaciones de nuestro estudio es que es retrospectivo y no permite establecer relaciones de causalidad, y un porcentaje de los pacientes no tuvieron determinación de fosfato, lo que puede sobreestimar la incidencia de las alteraciones.
Concluimos que las alteraciones del fosfato son frecuentes en los niños ingresados en la UCIP. La hiperfosfatemia fue más frecuente en los pacientes quirúrgicos, los más pequeños, los tratados con VMNI, con nutrición artificial y con TDER, y se asocia a una mayor duración de ingreso. La hipofosfatemia al ingreso y la hiperfosfatemia durante el ingreso fueron más frecuentes en los pacientes fallecidos sin poder establecer una relación de causalidad.
AutoríaTodos los autores han hecho contribuciones sustanciales en cada uno de los siguientes aspectos:
Nuria del Amo Carramiñana, Paula Lasarte Merino, Celia Pascual Alonso y Rafael González Cortés: la adquisición, el análisis y la interpretación de los datos, el borrador del artículo y la aprobación definitiva de la versión.
Jesús López-Herce: la concepción y el diseño del estudio, la adquisición, el análisis y la interpretación de los datos, el borrador del artículo, la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
Utilización de inteligencia artificialLos autores declaran que no han utilizado la inteligencia artificial en ninguna de las actividades del estudio ni en la redacción del manuscrito.
FinanciaciónLos autores no han recibido ninguna financiación para realizar este estudio.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
A los médicos y enfermeras del Servicio de Cuidados Intensivos Pediátricos del Hospital General Universitario Gregorio Marañón por su ayuda en la recogida de datos y en el tratamiento de los pacientes.