INTRODUCCIÓN
Los accidentes cerebrovasculares, particularmente la hemorragia subaracnoidea (HSA), se acompañan con frecuencia de alteraciones electrocardiográficas, que pueden ser muy variadas, y en ocasiones similares a las de la isquemia miocárdica. En algunos casos éstas tienen traducción ecocardiográfica e incluso hemodinámica1-3.
Generalmente dichas alteraciones son transitorias y se atribuyen a la acción local en la circulación miocárdica de sustancias neurohumorales, liberadas como consecuencia de la estimulación isquémica de determinadas áreas cerebrales, ya que en los diferentes estudios realizados con el objeto de identificar posibles sustratos anatómicos en correlación con los cambios eléctricos no se han puesto de manifiesto anomalías angiográficas en las arterias coronarias4,5.
El pronóstico de estos pacientes viene determinado básicamente por la lesión cerebral y en su tratamiento es fundamental la monitorización electrocardiográfica y hemodinámica6,7.
CASO CLÍNICO
Presentamos el caso de una paciente que sufrió una hemorragia subaracnoidea, secundaria a la rotura de un aneurisma cerebral en el polígono de Willis, acompañada de trastornos transitorios del electrocardiograma (ECG) y de la ecocardiografía.
La paciente era una mujer de 53 años con antecedentes de hipertensión arterial sin tratamiento, que presentaba cefalea brusca intensa con pérdida de conocimiento y caída al suelo; la primera valoración médica en su domicilio describió una presión arterial de 200/110 mmHg, coma con hemiparesia izquierda, con una puntuación en la escala de coma de Glasgow de 10 puntos y en la escala de Hunt y Hess de 4 puntos. Se trasladó al hospital, donde la situación neurológica se deterioró de forma progresiva hasta un coma profundo, de 4 puntos en la escala de Glasgow, por lo que se intubó y conectó a ventilación mecánica. A su ingreso en la UCI, bajo efectos de sedación (perfusión de midazolam a 0,1 mg/kg/h y fentanilo a 0,5 μg/kg/h), la presión arterial era de 160/95 mmHg.
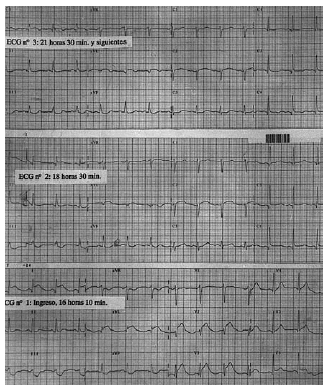
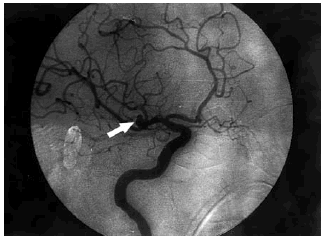
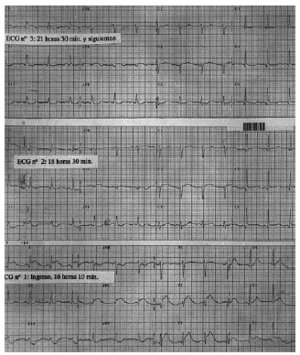
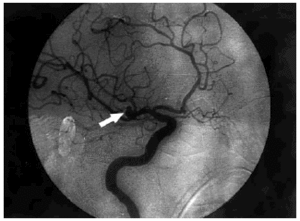
El ECG inicial, realizado en el servicio de urgencias, puso de manifiesto un ritmo sinusal de 80 lat/ min, con un QTc de 384 ms y datos de lesión subepicárdica anterior con elevación del ST más marcada en V2-3, I y aVL y descenso del ST en III y aVF (fig. 1, ECG 1). La tomografía axial computarizada (TAC) realizada a su ingreso objetivó una HSA de predominio en la cisura silviana derecha y en la arteriografía realizada a las 16 h se visualizó un aneurisma de 5 mm de diámetro en la bifurcación de la arteria silviana derecha (fig. 2).
Fig. 1. ECG 1: en el ingreso, ritmo sinusal a 80 lat/min, QTc de 384 ms y signos de lesión subepicárdica anterior. ECG 2: tras 2 h 20 min, se inicia la normalización del ST en cara anterolateral y el QTc se prolonga a 471 ms. ECG 3: 3 h después del segundo, persisten cambios en I y aVL, con un QTc de 494 ms.
Fig. 2. Arteriografía cerebral: aneurisma de 5 mm de diámetro (flecha) en la bifurcación de la arteria cerebral media derecha.
Dadas las alteraciones electrocardiográficas se realizó un estudio ecográfico transtorácico (una hora y 40 min desde su ingreso) donde se objetivó una ligera hipertrofia concéntrica ventricular izquierda e hipocinesia anterolateral y apical con función sistólica en el límite inferior de la normalidad (fracción de eyección [FE] del 50%). En el segundo ECG, realizado en la UCI 2 h y 20 min después del ya descrito, la elevación del ST de la cara anterolateral tendía a la normalidad, el descenso en la cara inferior disminuyó y el QTc se alarga a 471 ms; en un tercero, 3 h más tarde, el ritmo es sinusal, el ST únicamente permaneció elevado 1 mm en I y aVL con ondas T aplanadas de V1 a V5 e invertidas en V6, I y aVL y un QTc de 494 ms (fig. 1, ECG 2 y 3); los siguientes ECG fueron similares a este último. En un segundo estudio ecocardiográfico, realizado a las 18 h del primero, no se apreciaban anomalías segmentarias de la contractilidad ventricular izquierda y la función sistólica global estaba en el rango de la normalidad. La paciente se mantuvo hemodinámicamente estable y no presentó elevación enzimática por encima del rango normal, la creatinfosfocinasa (CPK) máxima fue de 265 U/l.
Además del soporte ventilatorio y la perfusión de analgesia y sedación, se inició tratamiento con nimodipino por vía intravenosa durante los primeros días pasando posteriormente a vía oral y profilaxis anticomicial con fenitoína.
La evolución de la paciente estuvo determinada por su lesión neurológica, a las 16 h se realizó embolización del saco aneurismático con oclusión completa del mismo y en el control arteriográfico final se observó una oclusión de las ramas temporal medial y superior, desarrollando en dicha localización un infarto cerebral isquémico. Durante la segunda semana, y con la paciente con terapia según el esquema "triple-H" (hipertensión, hipervolemia y hemodilución) y nimodipino, el control de Doppler cerebral evidenciaba vasospasmo moderado en el territorio de la arteria cerebral media derecha; se mantuvo dicho tratamiento ajustándolo en función de los datos obtenidos del Doppler cerebral, lográndose la resolución del mismo.
Al alta de cuidados intensivos la paciente presentaba hemiplejia izquierda, con un balance muscular de fuerza en miembro superior de 1/5 y en miembro inferior de 2/5 y tras 6 meses de rehabilitación la hemiparesia es de predominio braquial, con una fuerza en el miembro superior de 3/5 proximal y de 2/5 distal, y en el miembro inferior de 3/5 con marcha independiente.
COMENTARIOS
La presencia de alteraciones electrocardiográficas en el seno de accidentes cerebrovasculares, principalmente hemorragia subaracnoidea, y procedimientos neuroquirúrgicos han sido con frecuencia descritos en la bibliografía, anomalías que se pueden confundir con alteraciones eléctricas presentes en la enfermedad cardíaca isquémica como son cambios en la onda T, la más frecuentemente afectada, con aplanamiento, grandes ondas T positivas, pero principalmente como ondas anormalmente anchas, profundas y simétricas fuertemente sugestivas de isquemia; cambios isquémicos del segmento ST, prolongación del intervalo QT, ondas Q anómalas y grandes ondas U. Estos cambios son más evidentes en las derivaciones I, aVL y de V4 a V6, pero pueden ser difusos y son generalmente reversibles, desapareciendo casi siempre después de un tiempo1.
Si bien muchas veces estas alteraciones no tienen otra repercusión que la puramente eléctrica, en otras ocasiones se acompañan de traducción ecocardiográfica con anomalías de motilidad de los segmentos de la pared ventricular izquierda que varían desde ligera hipocinesia a importantes áreas de acinesia o discinesia con repercusión en la función global ventricular de forma transitoria. Varios estudios realizados comparando ambos elementos ponen de manifiesto que las alteraciones ecocardiográficas son más frecuentes en pacientes que presentan anomalías eléctricas frente a aquellos que no las tienen, y entre los primeros son mucho más evidentes en los que cursan con elevaciones del segmento ST, con ondas T invertidas y simétricas y con prolongación del intervalo QTc mayor de 440 ms2-4,6,8.
La disfunción contráctil miocárdica reversible (sttuning) puede ser el resultado de la isquemia asociada a arteriosclerosis coronaria o vasospasmo de una o más arterias coronarias; este mecanismo se ha postulado como posible mecanismo de la lesión cardíaca en la HSA pero nunca ha sido documentado. Así, Kono et al, en su estudio en pacientes con HSA y alteraciones electrocardiográficas (elevación del ST) y ecográficas a los que realizó coronariografía se encontró con arterias angiográficamente normales5. Szabo et al demuestran en un estudio de perfusión miocárdica con talio en pacientes con HSA anomalías de perfusión miocárdica con áreas de bajo flujo sanguíneo9. Mayer et al señalan que en aquellos pacientes con HSA y anomalías ecográficas de la motilidad con deterioro de la función ventricular tiene lugar una elevación enzimática de CPK con una fracción CK-MB que, si bien no alcanza valores para considerarlos en el rango de infarto, es en todos los casos mayor del 2%; por ello señala el infarto no transmural debido a compromiso de la microcirculación y aumento de las demandas miocárdicas como posible explicación a los hallazgos en estos pacientes2,4. El aumento de la liberación local de noradrenalina en las terminales nerviosas cardíacas como consecuencia de la estimulación isquémica de estructuras cerebrales que regulan el sistema nervioso autónomo, sobre todo el hipotálamo y la ínsula del córtex cerebral izquierdo tras HSA, se ha considerado como el origen del daño miocárdico, probablemente mediada por vasoconstricción de arterias coronarias intramurales (no valorables angiográficamente)5,7,9,10.
La mortalidad de los pacientes incluidos en los distintos estudios revisados fue secundaria a la lesión neurológica; por tanto, el principal factor pronóstico es el grado de lesión cerebral. Hay baja incidencia de arritmias sostenidas y no hay registrados episodios de asistolia ni de arritmias de riesgo vital; a pesar de la elevación de CPK y la presencia en algunos casos de edema de pulmón, no hubo fallecidos como resultado de causas cardíacas. Algunos autores señalan que en pacientes con gran afección neurológica el deterioro de la función ventricular y la reducción del índice cardíaco puede incrementar el riesgo de deterioro de la isquemia cerebral por vasospasmo2.
Un estudio multivariante puso de manifiesto que tanto la edad superior a 65 años como un grado en la escala de Hunt y Hess de al menos 3 son predictores de mortalidad; sin embargo, las alteraciones electrocardiográficas no alcanzaban significación estadística como índice de mayor mortalidad, si bien con una p de 0,08, lo que sugiere que un análisis con mayor número de enfermos podría tener valor predictivo7.
Aunque son necesarios nuevos estudios para confirmar la relación entre daño miocárdico y deterioro hemodinámico y determinar el tratamiento óptimo de la lesión cardíaca en el contexto de la HSA, parece clara la necesidad de monitorización electrocardiográfica y hemodinámica de estos pacientes y en muchos casos de un seguimiento ecocardiográfico.