Los análisis aleatorios de seguridad en tiempo real son una herramienta que ha sido creada como un método de traslación del conocimiento desde las fuentes de la evidencia científica hasta la cabecera del paciente. Ha demostrado ser útil en el entorno del paciente crítico, en términos de mejora de la seguridad en el proceso de cuidados al paciente crítico, transformando situaciones inseguras en seguras en el día a día, garantizando la adherencia a la evidencia científica. Paralelamente, por su diseño y metodología ha permitido disponer de indicadores de proceso que hará posible conocer cómo realizamos la atención a nuestros pacientes, la evolución en el tiempo (y el feedback periódico a los profesionales), el impacto de nuestras intervenciones y el benchmarking.
Real-time random safety audits constitute a tool designed to transfer knowledge from the sources of scientific evidence to the patient bedside. It has proven useful in critically ill patients, improving safety in the process of critical patient care, turning unsafe situations into safe ones in daily practice, and ensuring adherence to scientific evidence. In parallel, the design and methodology involved affords process indicators that will make it possible to know how we provide care for our patients, evolution over time (with regular feedback for professionals), the impact of our interventions, and benchmarking.
La Medicina Intensiva vive inmersa en un periodo de profunda transformación que requiere nuevos escenarios asistenciales, nuevas formas de mirar el entorno y nuevos roles. En este periodo de cambio, las unidades de cuidados intensivos (UCI) han dejado de ser exclusivamente el territorio de actuación de profesionales superespecializados para convertirse en espacios, más allá de los muros físicos, gobernados por la economía del conocimiento, base actual de la investigación y la docencia1. Sin embargo, esta renovación arrastra viejos problemas para los que no hemos encontrado solución. Uno de ellos es la gran brecha que separa la práctica clínica de la evidencia científica2.
Por otro lado, como profesionales de una de las especialidades esenciales del sistema sanitario, nuestra responsabilidad (individual y colectiva) debe abrazar la calidad asistencial como paradigma para conseguir los objetivos que la sociedad nos demanda. Los esfuerzos de concreción en este ámbito han permitido el desarrollo de modelos de excelencia ampliamente difundidos, por ejemplo el European Foundation for Quality Management (EFQM)3, que toma sus referencias en el liderazgo, la gestión por procesos, la satisfacción de los profesionales, el valor medido desde la perspectiva de los pacientes, los resultados ajustados a los medios, favorecer la creatividad y la innovación, desarrollar alianzas y propiciar la sostenibilidad del sistema4.
En este contexto, lanzar una invitación a enfrentarse a este cambio sin señalar una posición que ayude a afrontar el entorno propio de los periodos transicionales y, sobre todo, sin proponer las herramientas para canalizar el esfuerzo, es una actitud demagógica.
En cuanto a la posición, convendría reencontrarse con el concepto de trabajo en equipo: en el que los miembros interactúan, colaboran, y comparten conocimientos y recursos, lo que significa que son dependientes unos de otros para desarrollar sus tareas5. Ello requiere entrenamiento (por ejemplo, mediante ejercicios de simulación), potenciando la construcción de espacios de trabajo eficaces en los que tanto interviene la conciencia situacional6 y en los que es esencial una comunicación efectiva. Esta, en situaciones complejas (como la práctica clínica), requiere no limitarse a construir la estructura de un equipo, sino construir modelos mentales compartidos, condicionados por los conocimientos y la experiencia7,8.
Respecto a las herramientas, pueden ser de 2 tipos. Unas son transversales, como son los sistemas de información clínica (SIC). La experiencia con los SIC es creciente y los resultados asistenciales y organizativos que se desprenden de su utilización son prometedores9–11 pero, además, mejorarán la seguridad y el trabajo en equipo y consolidarán las bases de la nueva investigación clínica12,13. Otras herramientas son operativas y representan la palanca de la estrategia. Son aquellas herramientas que idealmente son efectivas en la complejidad, están introducidas de la mano de un liderazgo adaptativo, garantizan la adherencia de los usuarios a la mejor evidencia científica acompañando la ejecución de los procesos y facilitan una comunicación efectiva. En los últimos años se han incorporado en el ámbito sanitario diferentes herramientas derivadas de otras industrias con el objetivo de mejorar el trabajo en equipo, favorecer la comunicación efectiva entre los profesionales sanitarios y mejorar la seguridad del paciente. Algunas de ellas se han modificado e incluso rediseñado para adaptarlas a ambientes específicos. En la tabla 1 se definen las más utilizadas y que comparten algunos elementos entre sí14.
Herramientas para mejorar la comunicación y el trabajo en equipo
| Herramienta | Definición |
|---|---|
| Lista de verificación (checklist) | Herramienta que permite identificar si se han llevado a cabo determinados procedimientos estandarizados y/o se dispone de los equipos/recursos necesarios para llevar a cabo una actividad de forma segura |
| Objetivos diarios (daily goal sheet) | A través de listados de verificación se identifica el trabajo necesario para llevar al paciente al nivel siguiente de atención, consensuando los objetivos establecidos entre el equipo para un corto periodo de tiempo. Permite identificar los objetivos a todo el equipo |
| Sesiones informativas (briefings/debrifings) | Son reuniones cortas del equipo en las cuales se asignan los roles, se establecen expectativas y se intenta anticipar problemas. Puede orientarse a la identificación de situaciones de riesgo o eventos adversos. Las sesiones de debriefing son reuniones diseñadas para intercambiar información tras la actuación del equipo para valorar la efectividad del mismo y revisar las acciones |
| Reuniones de equipo (team huddles) | Reuniones cortas «ad hoc» que tienen como objetivo restablecer los planes ya en curso y ajustarlos y adaptarlos a la situación real en cada momento de forma dinámica |
| Traspaso de información (handoff) | Intercambio de información estructurada entre profesionales sanitarios, que se acompaña de la transferencia de responsabilidad que ocurre durante el cuidado continuado del paciente |
| STEP (S–status; T–team members; E–enviroment; P–progress) | Facilita la conciencia situacional y la monitorización cruzada de los otros miembros del equipo, con el objetivo de que los errores y situaciones de riesgo sean descubiertas de forma rápida y fácil. Establece objetivos y evalúa si el progreso hacia la consecución de los mismos está siendo adecuado |
Nuestro grupo ha trabajado en el diseño de una herramienta que, además de cumplir los requisitos de las herramientas operativas, tiene la virtud de aproximarse al profesional anunciando su ayuda en una de las áreas más prioritarias de la calidad asistencial, la seguridad clínica15. Así han nacido los análisis aleatorios de seguridad en tiempo real (AASTRE). Como veremos más adelante, los AASTRE pueden interaccionar con los SIC velando por la seguridad y la calidad de sus datos y además, por sí mismos, aportan información clínica relevante (indicadores de proceso)16.
Seguridad. Tipos de errores. Medidas proactivas o reactivasLa seguridad clínica arrastra una semántica que como profesionales nos intimida. Solo hace falta acercarse a los términos más elementales para sentir cierto desasosiego: error, incidente o evento adverso.
Cuando alguien piensa más de 5min seguidos sobre seguridad clínica descubre la esencia del problema: es escurridiza y resulta muy difícil medirla17. ¿Cómo sé que mi UCI es segura? ¿Cómo puedo conocer que en mi UCI nos estamos acercando a un umbral inseguro de riesgo? ¿Cómo puedo mejorar la seguridad de mi UCI?
Entre los errores, los de comisión (aplicar de forma incorrecta una acción prevista de la manera que se pretende o está indicada) son más visibles (por ejemplo, la administración de una dosis inapropiada de un fármaco por error de prescripción), son más fácilmente detectables, y suelen provocar mayor atención que los errores de omisión (no llevar a cabo una acción prevista de la manera que se pretende o está indicada). Estos últimos nos preocupan especialmente; son más insidiosos y más complejos de reconocer; pueden estar encubiertos y protegidos por hábitos y rutinas, y tienen su ejemplo más claro en la falta de adherencia en las guías de buena práctica clínica. Este hecho, paradójicamente, ocurre con más frecuencia en los pacientes más graves18 y ha sido mencionado como un problema sistémico de difícil abordaje19. No obstante, se han identificado barreras que pueden ayudarnos a plantear estrategias de afrontamiento: falta de liderazgo o recursos, temor a perder autonomía en las decisiones, desacuerdo con los resultados de las guías, aspectos organizativos o resistencia al cambio de los hábitos de trabajo20–23.
Las herramientas reactivas de análisis y mejora de la seguridad, como la notificación de incidentes o eventos adversos, de forma aislada no garantizan su efectividad, por 2 razones esencialmente24: 1) porque las notificaciones pueden presentar sesgos importantes, 2) porque en ocasiones no se sigue de un análisis pormenorizado, por personal entrenado y multidisciplinar (análisis causa raíz), y/o la información extraída no revierte en los profesionales (retroalimentación) a través de la generación de nuevo conocimiento o mejoras en el sistema; por ello existe el riesgo de que todo se vuelva a repetir. Paralelamente y de forma complementaria, disponemos de herramientas proactivas (análisis modal de fallos y efectos, por ejemplo) para analizar el sistema y facilitar una asistencia segura en el entorno del paciente crítico.
Nuestra propuesta es mixta. Combina aspectos de ambos tipos de herramientas. Pretende detectar el riesgo, aprovechar la oportunidad de aprender de los errores y ayudar a profundizar en el conocimiento, en la naturaleza de los errores de omisión25. AASTRE surge de la necesidad de cuantificar y medir lo que hacemos, de adaptar la forma de practicar la asistencia a la evidencia científica, y de mejorar la seguridad del paciente crítico (sobre todo a expensas de disminuir los errores de omisión). Esta herramienta ha sido creada como un método de traslación del conocimiento desde las fuentes de la evidencia científica hasta la cabecera del paciente cumpliendo paralelamente una doble función, ser un indicador de proceso (ver más adelante, proporción de mejora relacionada con los AASTRE [PMR-AASTRE]) y, secundariamente, ser un instrumento que ha permitido blindar nuestro entorno a través de la mejora de la cultura de seguridad. Así, los efectos de la herramienta que se plantean no son solo mejorar el pronóstico del paciente, sino además producir cambios en el equipo de trabajo y en la organización, lo que implica resultados a largo plazo.
Antecedentes: impacto de las rondas de seguridad y los listados de verificaciónLas rondas de seguridad han sido diseñadas para consolidar la cultura de seguridad en las instituciones sanitarias. Sin embargo, a pesar de sus efectos positivos, el hecho de que en las mismas intervengan profesionales ajenos a los servicios (p. ej. gestores y directivos) hace que en ocasiones sean percibidas con recelo por los clínicos, que anticipan una intención fiscalizadora. Además, en cuanto a los aspectos operativos, la frecuencia de su realización viene lastrada por su propia estructura26. En cuanto a los checklists, no existe evidencia publicada del impacto negativo27. En los trabajos publicados previamente, su efecto en la disminución de la mortalidad (como indicador de mayor relevancia) se ha objetivado casi exclusivamente en el entorno de la cirugía, en relación con el listado de verificación quirúrgica de la OMS. Haynes et al.28 evidenciaban una disminución de la mortalidad y de las complicaciones peroperatorias tras la implantación de un listado de verificación en 8 centros que representaban distintas áreas de la OMS, con diferentes realidades (circunstancias económicas, sistemas sanitarios, organización). El impacto traducía una mayor adherencia a 6 medidas seguras, que se evidenciaba mediante indicadores de proceso. Sin embargo, cuando se intentó reproducir en más de 100 hospitales canadienses los resultados no fueron los mismos, probablemente por problemas metodológicos, pero fundamentalmente se atribuyó a un inadecuado planteamiento, con baja implicación de los profesionales y con un inadecuado liderazgo29. Es un error pensar que una solución técnica (checklist) puede resolver un problema de adaptación (sociocultural). Simplificar la evidencia es necesario pero no suficiente para garantizar la traslación del conocimiento. Debe combinarse con una estrategia para mitigar las barreras (técnicas, sociológicas y psicológicas, incluso emocionales) a través de un adecuado liderazgo, formación, y entrenamiento y retorno de la información a los profesionales30.
En el entorno del paciente crítico el impacto de la utilización de listados de verificación sobre la mortalidad se ha comprobado de forma puntual. La mayoría de los estudios evalúan el efecto postintervención respecto a periodos previos a la misma. Así en el estudio de Weiss et al.31 se evidenció una disminución de la mortalidad y de la estancia media, así como una mejora en varios procesos con la introducción de un listado de verificación conducido por un profesional en una UCI (prompter). Este efecto no consiguió evidenciarse en otra UCI de características similares del mismo centro, en la que solo se había implementado el uso del checklist sin ser vehiculizado por un profesional. Estos resultados no han podido comprobarse en un estudio multicéntrico brasileño publicado recientemente32. En este último el rol del prompter no era a cabecera del paciente, sino únicamente de comprobación de la verificación de las medidas por parte del equipo; además, el número de pacientes incluidos por hospital era bajo y el periodo de estudio corto. Sí logró mostrar una mejora en el proceso de cuidados del paciente crítico, como han evidenciado otros estudios previos22,27,33–35.
La evaluación del impacto de las distintas herramientas propuestas en la literatura más reciente, además de medirse en mejora del proceso de cuidados, debería poder medirse mejoras en el trabajo en equipo, en la organización y en otros tipos de resultados en los pacientes.
Concepto y diseño de los análisis aleatorios de seguridad en tiempo realEs una herramienta de traslación del conocimiento dirigida a mejorar la seguridad de los pacientes, que permite identificar puntos de mejora para garantizar la adherencia a la buena práctica clínica, basada en la investigación científica de alto nivel y facilita modificar el proceso de atención al paciente crítico de acuerdo con la misma. Tiene las siguientes características: 1) es un listado de verificación o checklist de medidas seguras que se basan en la evidencia científica; 2) la aleatoriedad hace referencia a que en el momento de la aplicación se seleccionan por azar el 50% de las medidas seguras y el 50% de los pacientes ingresados en la UCI; 3) se aplica en tiempo real, durante la práctica clínica, a pie de cama requiriéndose la presencia (como mínimo) del médico responsable del paciente, su enfermera/o y el profesional que verifica (prompter); 4) el profesional que verifica debe ser un clínico con experiencia y necesita un mínimo de entrenamiento para el uso de la herramienta; 5) el tono en el que se realiza la verificación del listado debe estar lo más cercano posible al intercambio de impresiones clínicas entre los profesionales participantes, con ausencia de matices punitivos; y 6) no es una herramienta autoaplicable, ni debe utilizarse durante los pases conjuntos de guardia.
El primer paso para la creación de AASTRE fue la revisión exhaustiva de la evidencia científica. Los autores se preguntaron: Como profesional de la Medicina Intensiva, ¿cuántas medidas relacionadas con el cuidado de nuestros pacientes son de obligado cumplimiento porque están apoyadas en una evidencia científica suficientemente sólida? De este modo se identificaron 38 medidas. Las medidas, que fueron provistas de una definición y unos criterios de inclusión, fueron ordenadas en 10 bloques: 1) ventilación mecánica, 2) hemodinámica, 3) función renal/técnicas continúas de reemplazo renal, 4) analgesia/sedación, 5) tratamiento (1), 6) tratamiento (2), 7) dispositivos, catéteres y pruebas complementarias, 8) nutrición, 9) cuidados de enfermería y 10) estructura y otros. La estructuración del checklist se realizó siguiendo las recomendaciones aceptadas internacionalmente36.
Una vez identificadas las medidas iniciales se utilizó el método Delphi para alcanzar consenso entre un grupo de expertos37,38. Para la creación de este grupo se contactó con especialistas en Medicina Intensiva y enfermeras/os con experiencia contrastada en asistencia clínica e investigación de cada uno de los bloques. Finalmente participaron 21 expertos. Se consideró que 3 rondas serían suficientes para alcanzar un consenso adecuado. El consenso se buscó a través de la evaluación sobre la importancia y factibilidad de acuerdo con la opinión de cada una de las 38 variables39. Se tuvieron en cuenta las sugerencias de los expertos para la mejor definición de las variables, así como las propuestas de nuevas variables, hasta la versión final del checklist que contenía 37 medidas seguras distribuidas en 10 bloques en la tercera ronda40. A continuación profundizamos en 2 características fundamentales de AASTRE.
¿Qué aporta la aleatorización?Los checklists aleatorios han sido adaptados de la industria. Conceptualmente, el interés en esta forma de aplicación radica en la capacidad de comprobar puntos críticos de un sistema de trabajo complejo, sin evaluarlo en todo su conjunto, con la particularidad de que por el uso repetido de este tipo de herramientas proactivas se consigue elevar la atención, disminuyendo los errores globalmente en aquellos puntos críticos que se han identificado.
Esta metodología ha sido utilizada con éxito en el ámbito de los cuidados intensivos22,41 aunque no de una manera tan exhaustiva como la que nosotros planteamos. En nuestra experiencia, proponemos 2 tipos de aleatorizaciones: la de las medidas y la de los pacientes. Con esta fórmula se consiguió que la utilización de AASTRE no se asociara con una rutina: excepto los días asignados para las rondas ningún miembro del equipo sabía qué pacientes o medidas serían evaluadas.
¿Por qué un checklist que no es autoaplicable?Parece contradictorio. Si atendemos al gran número de referencias bibliográficas relacionadas con la utilidad de los checklists27,42,43, la solución más efectiva hubiera sido recurrir a un checklist que diariamente, por ejemplo, justo después de prescribir el tratamiento en nuestro SIC, apareciera automáticamente en forma de recordatorio en la pantalla de nuestro ordenador y que fuera necesario cumplimentarlo para que el tratamiento fuera visible. Nada más fácil y perfectamente alineado con las nuevas tecnologías44.
Lo cierto es que el problema es un poco más complejo. La comprobación de un listado de tareas no garantiza disminuir la distancia que existe entre el conocimiento que utilizamos en la asistencia diaria y el que realmente existe. Debemos considerar las barreras psicológicas, sociales y culturales (que incluyen hábitos, rutinas y mecanismos de defensa basados en nuestras experiencias) que nos impiden apoyarnos en la evidencia científica y que, probablemente por el mismo motivo, hacen ineficaz el trabajo colaborativo30. Por esta razón, en nuestra opinión, cualquier acción que tenga el propósito de modificar comportamientos o estrategias de afrontamiento de situaciones complejas, en ambientes con gran densidad de información y donde el resultado compartido (cocreado) sea visto como un valor añadido requerirá, aunque tengamos que entrenarnos para ello, la interacción directa entre profesionales. En un terreno más concreto, otros autores31 ya han descrito las ventajas de un listado de verificación dirigido por un profesional respecto a los autoaplicables mejorando, entre otros resultados, los días de ventilación mecánica y el uso de antibióticos. En nuestra experiencia, cuando en un box de paciente crítico se reúnen el profesional de enfermería, su médico responsable (acompañado del residente) y el prompter o profesional encargado de conducir el checklist, que actúa como un instrumento de trasmisión de conocimiento (no de examinador), se producen ese tipo de interacciones que son transformadoras. Nosotros hemos podido observar cómo el profesional de enfermería se siente partícipe de los aspectos esenciales del cuidado del paciente, para el residente representa una herramienta educacional y de adaptación a la filosofía de la unidad, para el adjunto (superada la primera extrañeza de comentar con un igual medidas esenciales de la práctica clínica) sirve como recordatorio de las medidas esenciales del tratamiento y, finalmente, para el conductor del checklist es una oportunidad única para profundizar en el conocimiento de los estilos individuales de la práctica asistencial de cada profesional. En este contexto, hemos visto con claridad que con la utilización de AASTRE se genera el ambiente propicio para la aplicación de otras herramientas complementarias de contrastada eficacia, como los objetivos diarios45.
Metodología de la implementación de análisis aleatorios de seguridad en tiempo realTan importantes son las medidas seguras contenidas en el listado de verificación como el modo en el que se desarrolla AASTRE.
Descripción del listado de verificaciónTeniendo en cuenta la experiencia acumulada y los resultados previos, por el beneficio obtenido con la utilización de los AASTRE en relación con la carga de trabajo que suponen, se recomienda su utilización 2 o 3 días a la semana. En cada ronda se seleccionan de forma aleatoria el 50% de bloques de variables y el 50% de pacientes ingresados a los que se les realizará la verificación de las medidas seguras. Se incluyen 37 medidas distribuidas en 10 bloques (fig. 1). Cada medida segura tiene una definición, unos criterios y una metodología de evaluación, que han sido previamente publicados por nuestro grupo40. Hablamos de paciente elegible cuando cumple los criterios que se han establecido para que cada medida segura sea evaluada. Si no cumple dichos criterios para que la medida sea evaluada, diremos que esta no es aplicable.
Rol y entrenamiento de los promptersLas rondas de seguridad en los AASTRE se realizan tras las rondas clínicas y requieren la presencia y participación de los profesionales responsables de la atención de cada paciente (médico, residente, enfermero/a). El prompter es el profesional (no directamente a cargo del paciente) que ha recibido formación y entrenamiento en la metodología de los AASTRE, y que es el responsable de conducir la verificación de las medidas seguras junto al equipo. En este sentido, la aceptación de los AASTRE ha sido buena, pudiendo introducirse fácilmente en la rutina diaria, al contrario de lo que ha ocurrido con otro tipo de listados de verificación22. Los motivos de esta mejor aceptación pueden deberse a la capacitación del profesional que conduce AASTRE, la aleatorización de los pacientes y las variables que proporciona un estado de expectación permanente y, finalmente, la ausencia absoluta de elementos punitivos40.
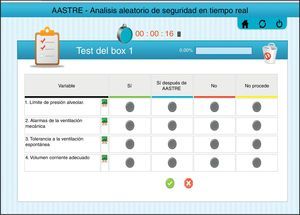
SistemáticaEn los AASTRE a la comprobación de la realización de cada medida segura la respuesta puede ser: 1) «Sí»: si lo descrito en el contenido de la variable se ha realizado previamente a la evaluación. 2) «Sí, después de la evaluación»: si lo descrito en la variable no se había realizado previamente a la evaluación y, por mediación de esta, se propicia un cambio en la actuación del equipo responsable. 3) «No»: si lo descrito en la variable no se ha realizado y no hay posibilidad de poder modificarlo. 4) «No procede»: la variable no se analizó en aquellos pacientes que no cumplían los criterios de inclusión detallados en cada medida.
A la variable para cuantificar los resultados de las rondas y su efecto se le denomina PMR-AASTRE:. Quedaría definida con la siguiente fórmula:
PMR-AASTRE=número de «Sí, después de la evaluación» *100/número de evaluaciones realizadas (total-«no procede»).
De esta manera cada vez que se recoge un «Sí, después de la evaluación» sabremos que AASTRE ha rectificado una actuación clínica y ha convertido una situación insegura en segura, adaptando la evidencia científica a la práctica clínica. Por su parte, PMR-AASTRE queda definido como un indicador de proceso de tal modo que puede existir un PMR-AASTRE para cada medida, un PMR-AASTRE-B (para cada bloque de medidas) y un PMR-AASTRE-G (global, para todo el conjunto de medidas).
Todas las respuestas se incluyen en una plataforma web (idealmente mediante tablet), a la cabecera del paciente, de manera que los resultados se pueden valorar en tiempo real y comparar su evolución a lo largo del tiempo y entre diferentes unidades. La figura 2 muestra una imagen de la web AASTRE® (concretamente el bloque de ventilación mecánica, y las diferentes posibles respuestas para las medidas seguras contenidas en el bloque). La herramienta incluye el cronómetro que permite medir el tiempo empleado en cada ronda de seguridad.
Análisis aleatorios de seguridad en tiempo real e impacto en la monitorización de la seguridad y la calidadLa medición de la seguridad es un gran reto por la falta de definiciones estandarizadas, por desconocer la incidencia exacta de los incidentes o eventos adversos y, especialmente, por la falta de herramientas para medir las variables relacionadas con el proceso16. Sin embargo hay algo más, las UCI son un modelo bien definido de organización intensiva en conocimiento. Este término se reserva para aquellas organizaciones en las que el conocimiento, la gestión del mismo y de los intangibles, suponen una fuente de creación de valor y uno de los cimientos más sólidos para innovar46. Medir la seguridad, por tanto, propiciaría la mejora de la práctica clínica, el incremento del conocimiento y generación de espacios para desarrollar nuevas oportunidades.
Nuestro grupo ha podido definir y comprobar que AASTRE es factible y es útil. Para llegar a estas conclusiones, después de crear la herramienta, realizamos un estudio piloto40, durante un mes, evaluando la factibilidad y utilidad. La primera variable fue definida como el número de veces que se completaba la evaluación respecto al número días que se proponía, y todos los días previstos en que se pudieron llevar a cabo las rondas. Este aspecto confirmaba la capacidad de los AASTRE de adaptarse a la rutina asistencial. La utilidad fue analizada a través del comportamiento del indicador de proceso PMR-AASTRE. En este estudio piloto se comprobó que en el 83,7% de las medidas hubo modificaciones tras las rondas. Pero lo más interesante fue que el PMR-AASTRE fue≥25% en algunas medidas. Un estudio multicéntrico posterior47 (durante 4 meses), confirmaba la utilidad de AASTRE en términos de modificar la práctica, transformando situaciones inseguras en seguras. El análisis multivariado mostró que los cambios en el proceso de atención se asociaba con la ratio enfermera/paciente y médico/paciente y con la gravedad de los pacientes. Se concluía que los AASTRE mejoran la adherencia a las guías de práctica clínica, siendo útiles sobre todo ante una mayor carga de trabajo para el personal y en los pacientes más graves. Pero lo más relevante de este segundo estudio fue que AASTRE provocaba una mayor proporción de cambios en el proceso de atención al paciente crítico en los centros que habían participado en el diseño inicial de la herramienta que en el resto de los centros participantes. Esto traducía la constante necesidad de formación, entrenamiento y el retorno de la información a los profesionales. Ello permitirá garantizar el compromiso del equipo y el buen uso de las herramientas48. Probablemente, la incorporación de bloques que permitan trazar procesos específicos y/o protocolos nuevos a nivel local contribuya a aumentar este compromiso de los profesionales.
En definitiva, PMR-AASTRE queda definido como un indicador de proceso, permite cuantificar cómo estamos realizando los procesos, el grado de adherencia a la evidencia científica, cuantificando la brecha entre las terapias o acciones indicadas de acuerdo con los hallazgos en la investigación clínica de alta calidad y las realmente utilizadas en la práctica. Tiene la capacidad de adaptarse a las necesidades locales y mejora la comunicación y el trabajo en equipo.
Análisis aleatorios de seguridad en tiempo real e información seguraTras haber podido mostrar el impacto en el proceso de cuidados y en la seguridad del paciente crítico, AASTRE parece listo para mejorar la seguridad de la información en las UCI.
Se ha apuntado que los SIC pueden dar respuesta a la necesidad de información para cuestiones tan relevantes como disponer de indicadores de calidad, que hagan posible la mejora continua de la calidad, la participación del profesional en la gestión (gestión clínica), y el benchmarking49. Asimismo, los SIC tienen un futuro prometedor como fuente de datos para la investigación clínica a través de análisis secundarios12. Debido a la ingente cantidad y tipo de información que se genera en la UCI, se considera un escenario ideal para aplicar la inteligencia artificial, en colaboración con los profesionales informáticos. Los modelos predictivos pueden representar un cambio profundo respecto al contraste de hipótesis clínicas. Si bien con anterioridad los ensayos clínicos eran determinantes en esta tarea, la potencialidad de estos modelos (en un análisis secundario de las bases de datos) cambia la perspectiva.
Todo ello requiere que, además de modelos informáticos complejos o sistemas avanzados de gestión de datos que garanticen la adquisición y la validación de los mismos, se garantice el compromiso de los profesionales del paciente crítico con la información segura y de calidad50,51. AASTRE puede contribuir a la formación y entrenamiento de nuestros equipos de trabajo a través de la verificación del almacenamiento correcto de los datos. Esto puede realizarse incluyendo un bloque de variables que asegure: 1) la integración de la información de otros sistemas departamentales del hospital, 2) la incorporación segura y continuada de los diferentes dispositivos de monitorización y de terapia de soporte vital de la UCI, y 3) la cumplimentación de los formularios y registros manuales por los profesionales responsables del paciente.
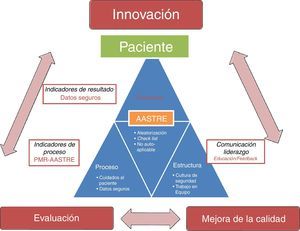
ConclusionesLas auditorías de seguridad son herramientas útiles en la mejora de la seguridad del paciente crítico, y, por tanto, en la mejora de su atención, contribuyendo de este modo a disminuir los errores, sobre todo los errores de omisión en relación con la falta de adherencia a la evidencia científica en la práctica clínica diaria. Además de favorecer así la traslación del conocimiento a través del retorno de la información inmediato a la cabecera del paciente, ha permitido disponer de indicadores de proceso que hará posible conocer cómo realizamos la atención a nuestros pacientes, la evolución en el tiempo (y el retorno de la información periódico a los profesionales), el impacto de nuestras intervenciones, y el benchmarking. Además, en un contexto de información segura, puede brindarnos un futuro con metodología innovadora para la investigación clínica. La figura 3 representa AASTRE, su objetivo principal (mejorar la calidad y la seguridad en el paciente crítico), sus características fundamentales, su impacto (en indicadores estructura, proceso y resultado) y su papel en la mejora continua de la calidad y en el futuro de la investigación clínica.
FinanciaciónEste estudio está financiado en parte por el Fondo de Investigación Sanitaria (Instituto de Salud Carlos III), proyecto PI11/02311.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.