Determinar si un valor de NGAL>150ng/ml es una buena prueba diagnóstica para detectar precozmente disfunción renal aguda (DRA) en el paciente crítico.
DiseñoEstudio prospectivo, observacional, de cohorte.
ÁmbitoUnidad de cuidados intensivos y de cirugía cardíaca del Servicio de Medicina Intensiva del Hospital Germans Trias i Pujol.
ParticipantesLos pacientes ingresados en el Servicio de Medicina Intensiva los días designados en el estudio.
IntervencionesAnálisis sanguíneo de la creatinina sérica determinada desde siete días antes del día de inicio del estudio, y diariamente durante cuatro semanas. Determinación de NGAL mediante prueba de orina, en muestra congelada, con el analizador ARCHITECT (Abbott diagnostics) por inmunoanálisis determinado el día de inicio del estudio y dos veces a la semana durante cuatro semanas, análisis de la estancia y mortalidad.
ResultadosSe obtuvieron 529 muestras de NGAL de 46 pacientes. El 37% de los pacientes presentaron un valor de NGAL>150ng/ml. La sensibilidad de la prueba para diagnosticar DRA fue del 69%, la especificidad fue del 75,7%. Sin embargo, el valor predictivo positivo fue del 53%, lo cual significa que el 47% de los pacientes con NGAL alto no desarrollaron DRA. Un NGAL>150mg/dL se asoció de manera significativa a un SOFA más alto y a una estancia más larga en UCI. La mortalidad de los pacientes con NGAL elevado fue del 58,8%.
ConclusionesUn NGAL>150ng/mL no parece ser una excelente prueba para detectar DRA en el paciente crítico pero si que se asocia con un peor pronóstico.
To determine if NGAL value exceeding 150ng/mL is a good diagnostic test for acute renal failure in critically ill patients.
DesignProspective, observational cohort.
SettingIntensive Care Unit and Cardiac Surgery Intensive Care Service at Hospital Germans Trias I Pujol.
ParticipantsPatients admitted to the Intensive Care department the Designated days in the studio.
InterventionsAnalysis of serum creatinine blood given from 7 days prior to the start of the study, and daily during 4 weeks and by determination of NGAL urine test in frozen sample, analyzer ARCHITECT (Abbott Diagnostics) determined by immunoassay the day baseline and 2 times a week for 4 weeks, analysis of the stay and mortality.
ResultsA total of 529 NGAL samples were obtained from 46 patients. 37% of patients had a value of NGAL>150ng/mL. The Sensivity of the test to diagnose acute renal failure was 69%, Specifity was 75,7%. However, the Positive Predictive Test Value was 53%, which means that 47% of patients with high NGAL did not develop AKI. A NGAL >150mg/dL was associated with a significantly higher SOFA and a longer stay in the ICU. The mortality of patients with elevated NGAL was 58.8%.
ConclusionsA NGAL>150ng/mL does not seem to be an excellent test for AKI in critically ill patients but is associated with a worse prognosis.
Los marcadores clásicos de función renal son la estimación del filtrado glomerular, el aclaramiento de creatinina, el aclaramiento de inulina, los valores de creatinina sérica, urea sérica y el nitrógeno ureico sanguíneo. El mejor índice global de función renal conocido es la estimación del filtrado glomerular pero existen grandes variaciones entre individuos sanos debidas a la edad, sexo y tamaño corporal. En nuestro ámbito el método más utilizado es la concentración plasmática de creatinina y el cálculo de su aclaramiento1.
En España, según el estudio FRAMI2, la incidencia de fracaso renal agudo (FRA) en la unidad de cuidados intensivos (UCI) es del 5,7%, definido FRA como creatinina >2mg/dL o diuresis <400mL/24h; la mortalidad asociada a FRA es del 42,3% y la recuperación de la función renal del 85,6% de los supervivientes, concluyendo que el FRA presenta una elevada mortalidad pero que la mayoría de los supervivientes recuperan la función renal. A lo largo de los años se ha intentado desarrollar terapias para prevenir o atenuar el FRA sin mucho éxito. Esto podría deberse a la incapacidad de detectar la insuficiencia renal aguda de una manera suficientemente precoz. Algunos autores como Uchino3 sugieren que la creatinina no es un marcador ideal de función renal. Los grupos de consenso como el Acute Dialysis Quality Initiative, el Acute Kidney Injury Network (AKIN) y la Sociedad Americana de Nefrología tienen como prioridad el desarrollo y validación de nuevos biomarcadores de la función renal4. Los avances tecnológicos han facilitado la detección de varios biomarcadores renales prometedores como la lipocalina asociada a la gelatinasa de neutrófilos (NGAL), la cistatina C, la proteína ácido-obligatoria grasa del hígado y la glucoproteína transmembrana KIM-1, entre los más destacados.
NGAL cumple con muchas de las características propuestas para los biomarcadores renales. Varios estudios describen que el epitelio renal expresa y secreta cantidades masivas de NGAL cuando es dañado por isquemia, nefrotoxinas o sepsis, tal y como se ha comprobado inicialmente en ratas y posteriormente en niños y adultos5–8. Pero el interés de NGAL estriba en su potencial capacidad de detectar el daño renal precozmente9–12. Hasta la actualidad los estudios encaminados a determinar el valor pronóstico de NGAL en la detección de la disfunción renal aguda (DRA) se han realizado en pacientes intervenidos de cirugía cardíaca o en pacientes pediátricos, y apenas existe información sobre pacientes ingresados en un servicio polivalente de medicina intensiva13–16.
Nuestro objetivo es determinar si un valor de NGAL>150ng/mL es una buena prueba diagnóstica para detectar precozmente DRA en el paciente crítico.
Pacientes y métodosEl trabajo se diseñó como un estudio prospectivo observacional. Participamos en un estudio multicéntrico español (COFRADE)17 que tenía como objetivo analizar la prevalencia de la DRA y el uso de tratamientos de reemplazo renal (TRR). Al recoger los datos para el estudio COFRADE se guardaron al mismo tiempo muestras de orina congelada en las que se analizó el NGAL. El estudio, aprobado por el Comité Ético de Investigación Clínica de nuestro hospital, ha consistido en medir el NGAL de todos estos pacientes ingresados en nuestro servicio de Medicina Intensiva del Hospital Universitario Germans Trias i Pujol de Badalona. Se realizaron dos cortes de prevalencia que se efectuaron el 22 de setiembre de 2009 y el 9 de marzo de 2010 y se determinó el NGAL 2 veces por semana durante un periodo de cuatro semanas. Las variables estudiadas fueron el género, el motivo de ingreso, los antecedentes personales, la edad, la talla y el peso. Se determinó la creatinina sérica basal y los valores de creatinina sérica de los siete días previos al día del corte, el mismo día del corte y diariamente durante cuatro semanas. El NGAL en orina se determinó el día de corte y dos veces por semana durante cuatro semanas. La determinación de NGAL se realizó mediante prueba de orina, en muestra congelada, con el analizador ARCHITECT (Abbott Diagnostics) por inmunoanálisis. Otras variables determinadas fueron los días de estancia en UCI, la estancia hospitalaria, la escala de severidad Acute Physiology and Chronic Health Evaluation (APACHE II)18, la escala de severidad Sepsis-related Organ Failure Assessment (SOFA)19, el FRA según escala de clasificación del grupo de trabajo AKIN20, y la mortalidad.
El análisis estadístico se realizó con el paquete estadístico SPSS para Windows.
Puesto que la DRA tiene multitud de definiciones y dada la necesidad y utilidad del empleo de criterios estandarizados para su diagnóstico en pacientes críticos21, hemos utilizado las definiciones de la escala AKIN considerando DRA a los pacientes que presentan un incremento en la creatinina sérica 1,5 a 2 veces del valor basal o un incremento de 0,3mg/dL sobre la creatinina sérica basal (AKIN 1). La determinación de la creatinina basal se basó en datos obtenidos de un valor conocido en los meses previos en 30 de los pacientes, y en los 16 pacientes restantes se utilizaron los datos de creatinina sérica recogidos en los 7 días previos a la fecha de corte.
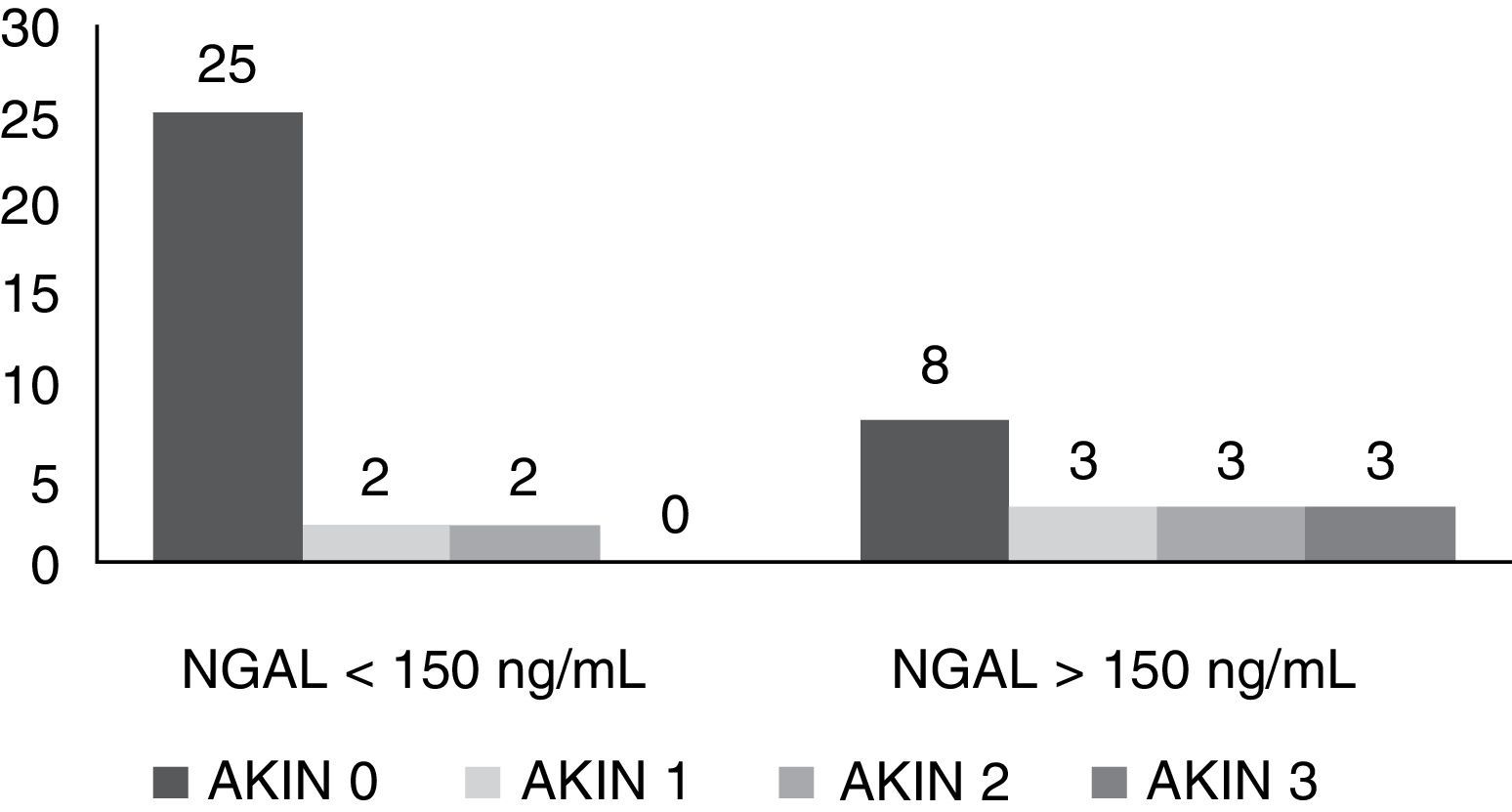
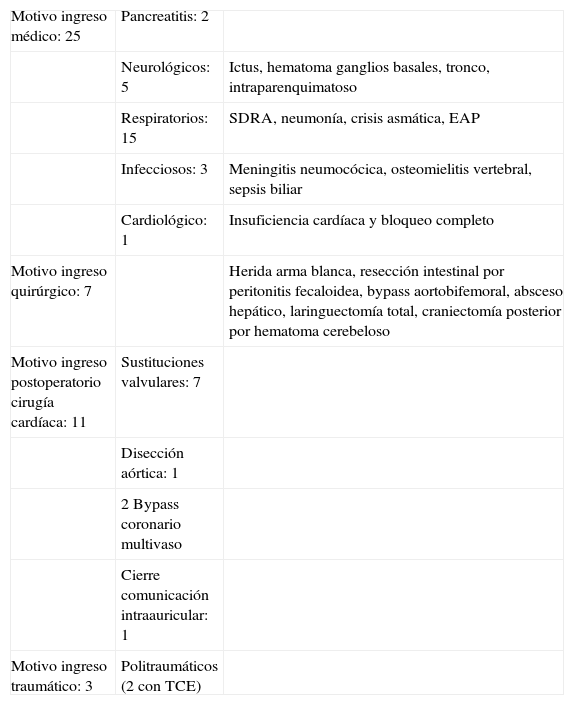
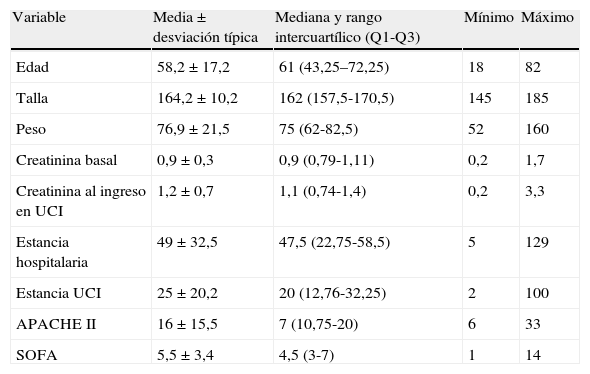
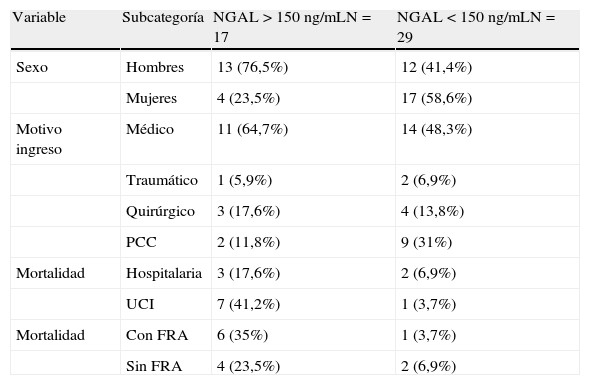
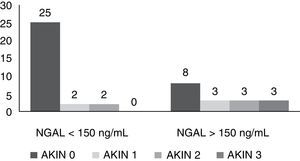
ResultadosSe incluyeron 46 pacientes después de completar los dos puntos de corte. De estos pacientes se obtuvieron 529 muestras de NGAL. El promedio de seguimiento fue de 10días, con un seguimiento mínimo de 24h y un máximo de 31días. El 54% eran hombres. La edad media fue de 58,2 años. La creatinina basal fue de 0,9mg/dL. La estancia hospitalaria fue de 47,5 días y la estancia en UCI fue de 20 días. El APACHE II medio fue de 16 y el SOFA medio de 5,5 resultados que incluyen a los pacientes operados de cirugía cardíaca. El motivo de ingreso fue de causa médica en un 54%, postoperatorio de cirugía cardíaca en un 24%, un 15% de causa quirúrgica y un 7% de causa traumatológica. En la tabla 1 se describen más detalladamente los motivos de ingreso. Se agruparon los pacientes según hubieran tenido un NGAL superior o inferior a 150ng/mL. En el grupo de NGAL>150ng/mL se registraron 17 pacientes (37%), la media de la creatinina basal fue de 1,05mg/dL y al ingreso en UCI fue de 1,4mg/dL. El SOFA fue de 7. La mediana de estancia hospitalaria fue de 52 días y la mediana de estancia en UCI fue de 32 días. Fallecieron 10 pacientes (58,8%), siete en la UCI y tres en planta de hospitalización. De estos 17 pacientes con NGAL>150ng/mL, ocho pacientes (47%) no tenían DRA (AKIN 0); de los nueve restantes, tres pacientes presentaron AKIN 1, tres pacientes presentaron AKIN 2 y otros tres AKIN 3.
Descripción detallada de los motivos de ingreso
| Motivo ingreso médico: 25 | Pancreatitis: 2 | |
| Neurológicos: 5 | Ictus, hematoma ganglios basales, tronco, intraparenquimatoso | |
| Respiratorios: 15 | SDRA, neumonía, crisis asmática, EAP | |
| Infecciosos: 3 | Meningitis neumocócica, osteomielitis vertebral, sepsis biliar | |
| Cardiológico: 1 | Insuficiencia cardíaca y bloqueo completo | |
| Motivo ingreso quirúrgico: 7 | Herida arma blanca, resección intestinal por peritonitis fecaloidea, bypass aortobifemoral, absceso hepático, laringuectomía total, craniectomía posterior por hematoma cerebeloso | |
| Motivo ingreso postoperatorio cirugía cardíaca: 11 | Sustituciones valvulares: 7 | |
| Disección aórtica: 1 | ||
| 2 Bypass coronario multivaso | ||
| Cierre comunicación intraauricular: 1 | ||
| Motivo ingreso traumático: 3 | Politraumáticos (2 con TCE) |
EAP: edema agudo de pulmón; SDRA: síndrome de distrés respiratorio agudo; TCE: traumatismo craneoencefálico.
En el grupo de NGAL<150ng/mL se registraron 29 pacientes. La media de la creatinina basal fue de 0,88mg/dL y la media de creatinina al ingreso en UCI fue de 1,13mg/dL. La media de SOFA fue de 4,5. La mediana de estancia hospitalaria fue de 32 días y la mediana de estancia en UCI fue de 17 días. Fallecieron solo tres pacientes (10,3%), uno en la UCI y dos en planta de hospitalización. De estos 29 pacientes con NGAL<150ng/mL únicamente cuatro hicieron DRA: 25 pacientes (86%) no habían presentado DRA (AKIN 0); dos pacientes en AKIN 1, dos pacientes en AKIN 2 y ninguno de ellos presentaba un estadio AKIN 3. Para poder comparar mejor los datos descriptivos de ambos grupos, estos se pueden ver en las tablas 2 y 3, así como en la Figura 1.
Descripción de las variables cuantitativas de la muestra
| Variable | Media±desviación típica | Mediana y rango intercuartílico (Q1-Q3) | Mínimo | Máximo |
| Edad | 58,2±17,2 | 61 (43,25–72,25) | 18 | 82 |
| Talla | 164,2±10,2 | 162 (157,5-170,5) | 145 | 185 |
| Peso | 76,9±21,5 | 75 (62-82,5) | 52 | 160 |
| Creatinina basal | 0,9±0,3 | 0,9 (0,79-1,11) | 0,2 | 1,7 |
| Creatinina al ingreso en UCI | 1,2±0,7 | 1,1 (0,74-1,4) | 0,2 | 3,3 |
| Estancia hospitalaria | 49±32,5 | 47,5 (22,75-58,5) | 5 | 129 |
| Estancia UCI | 25±20,2 | 20 (12,76-32,25) | 2 | 100 |
| APACHE II | 16±15,5 | 7 (10,75-20) | 6 | 33 |
| SOFA | 5,5±3,4 | 4,5 (3-7) | 1 | 14 |
APACHE II: Acute Physiology and Chronic Health Evaluation; SOFA: Sepsis-related Organ Failure Assessment; UCI: unidad de cuidados intensivos.
Descripción de variables cualitativas en relación con el valor de NGAL
| Variable | Subcategoría | NGAL>150ng/mLN=17 | NGAL<150ng/mLN=29 |
| Sexo | Hombres | 13 (76,5%) | 12 (41,4%) |
| Mujeres | 4 (23,5%) | 17 (58,6%) | |
| Motivo ingreso | Médico | 11 (64,7%) | 14 (48,3%) |
| Traumático | 1 (5,9%) | 2 (6,9%) | |
| Quirúrgico | 3 (17,6%) | 4 (13,8%) | |
| PCC | 2 (11,8%) | 9 (31%) | |
| Mortalidad | Hospitalaria | 3 (17,6%) | 2 (6,9%) |
| UCI | 7 (41,2%) | 1 (3,7%) | |
| Mortalidad | Con FRA | 6 (35%) | 1 (3,7%) |
| Sin FRA | 4 (23,5%) | 2 (6,9%) |
FRA: fracaso renal agudo; NGAL: lipocalina asociada a la gelatinasa de neutrófilos; PCC: postoperatorio de cirugía cardíaca; UCI: unidad de cuidados intensivos.
Durante el estudio dos pacientes presentaron FRA con necesidad de TRR; en ambos casos coincide el inicio de TRR con un aumento brusco de NGAL>11.000ng/mL, uno de ellos alcanzó la cifra de 126.804ng/mL. En ningún otro caso el NGAL tiene un valor tan elevado.
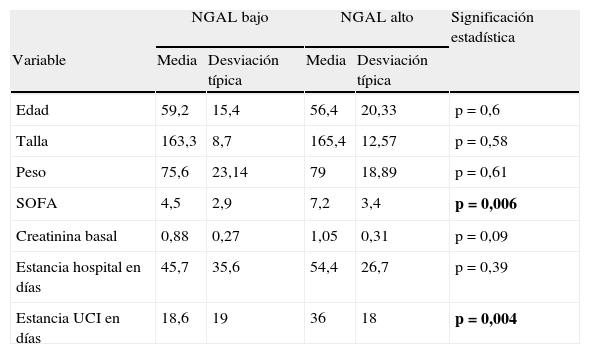
La mediana de NGAL fue de 51,6ng/mL con un valor de NGAL mínimo de 0,5ng/mL y un valor de NGAL máximo de 126.804ng/mL. En presencia de DRA, la probabilidad de tener un valor elevado de NGAL se duplicaba. Un valor elevado de NGAL se relacionaba con un grado AKIN más alto (p=0,0001). Al realizar el análisis estadístico de la asociación entre NGAL y las diferentes variables, un NGAL>150mg/dL se asoció de manera significativa a un SOFA más alto (p=0,006), una estancia más larga en UCI (p=0,004), un aumento en el valor de la creatinina sérica (p=0,024) pero con una fuerza de asociación baja (coeficiente de correlación de Pearson de 0,099) y con el género. Las mujeres presentaban con mayor frecuencia valores más bajos de NGAL (p=0,021). No hallamos relación estadísticamente significativa con el resto de las variables (tabla 4). La mortalidad de los pacientes con NGAL elevado fue del 58,8%. Del global de fallecidos el 77% tenía un NGAL elevado.
Descripción de variables cuantitativas en relación con el valor de NGAL
| NGAL bajo | NGAL alto | Significación estadística | |||
| Variable | Media | Desviación típica | Media | Desviación típica | |
| Edad | 59,2 | 15,4 | 56,4 | 20,33 | p=0,6 |
| Talla | 163,3 | 8,7 | 165,4 | 12,57 | p=0,58 |
| Peso | 75,6 | 23,14 | 79 | 18,89 | p=0,61 |
| SOFA | 4,5 | 2,9 | 7,2 | 3,4 | p=0,006 |
| Creatinina basal | 0,88 | 0,27 | 1,05 | 0,31 | p=0,09 |
| Estancia hospital en días | 45,7 | 35,6 | 54,4 | 26,7 | p=0,39 |
| Estancia UCI en días | 18,6 | 19 | 36 | 18 | p=0,004 |
NGAL: lipocalina asociada a la gelatinasa de neutrófilos; SOFA: Sepsis-related Organ Failure Assessment; UCI: unidad de cuidados intensivos.
Negrita: p <0,05.
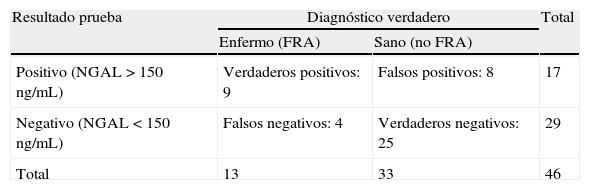
Para analizar si NGAL era una buena prueba diagnóstica de DRA, objetivo principal de nuestro estudio, calculamos la sensibilidad (S) (69%), la especificidad (E) (75,7%), el valor predictivo positivo (VPP) (53%) y el valor predictivo negativo (VPN) que fue del 86,2% (tabla 5).
Tabla de contingencia NGAL y fracaso renal agudo
| Resultado prueba | Diagnóstico verdadero | Total | |
| Enfermo (FRA) | Sano (no FRA) | ||
| Positivo (NGAL >150ng/mL) | Verdaderos positivos: 9 | Falsos positivos: 8 | 17 |
| Negativo (NGAL <150ng/mL) | Falsos negativos: 4 | Verdaderos negativos: 25 | 29 |
| Total | 13 | 33 | 46 |
FRA: fracaso renal agudo; NGAL: lipocalina asociada a la gelatinasa de neutrófilos.
Se define FRA como un incremento en la creatinina sérica de mínimo 1,5 a 2 veces el valor basal o un incremento en la creatinina sérica de 0,3mg/dL (AKIN 1 o superior).
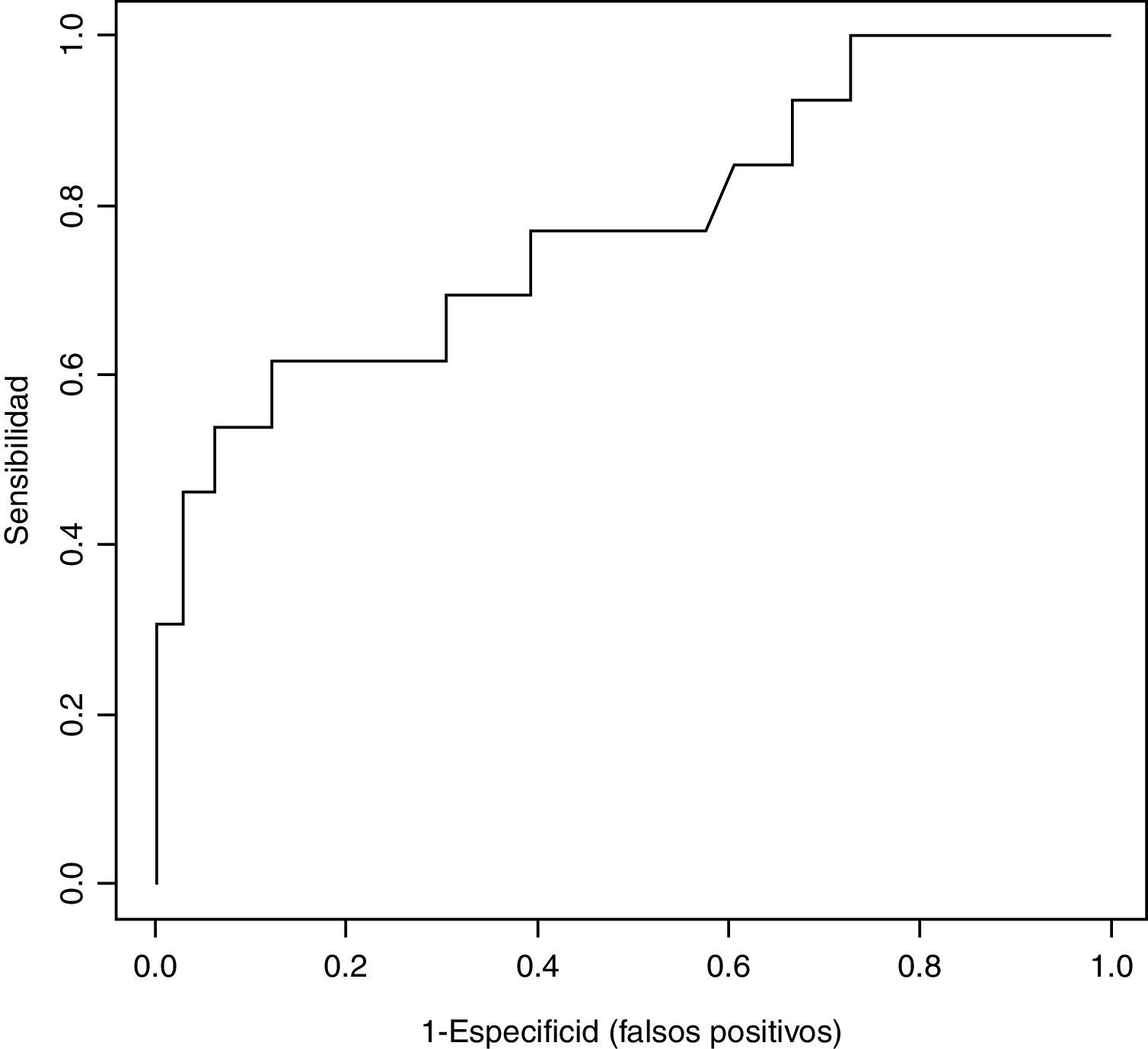
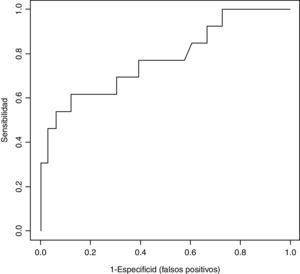
Para analizar el valor diagnóstico del NGAL como variable continua, para la detección de la DRA definida como AKIN>1 se midió el área bajo la curva ROC que fue de 0,775 (valores del IC95% 0,638-0,913) (figura 2).
En cuanto a la posible interferencia de procesos sépticos y/o síndrome de respuesta inflamatoria sistémica (SIRS) observamos que 6 pacientes presentaron sepsis/SIRS durante el estudio. En 5 pacientes coincide que el mismo día que presentan sepsis/SIRS con DRA elevan el NGAL y un paciente tiene el NGAL alto mientras dura el SIRS pero no presenta DRA.
Observamos que 9 pacientes habían presentado sepsis/SIRS al ingresar en UCI pero ya se había resuelto el día del corte. De estos, 5 pacientes tuvieron un NGAL bajo durante el estudio y no presentaron DRA, 3 pacientes tuvieron un NGAL alto desde el día de corte y durante el estudio y no presentaron DRA, y un paciente elevó el NGAL desde el día de corte y durante el estudio presentó DRA.
Para interpretar el valor de NGAL en el contexto evolutivo del FRA (fase inicio, extensión, mantenimiento y resolución) se analizó la creatinina sérica diaria de los pacientes desde 7 días antes del corte, el día del corte y diariamente durante 4 semanas. El NGAL se analizó el día de corte y posteriormente 2 veces a la semana durante 4 semanas.
Se observó que el día del corte 5 pacientes estaban en la fase de mantenimiento del FRA (80% con NGAL alto desde el día de corte y se mantuvo alto durante la evolución) y 3 pacientes estaban en la fase de resolución (33% con NGAL alto desde el día de corte hasta el alta).
A continuación se describen las características del subgrupo de pacientes que tienen determinaciones iniciales de NGAL<150ng/mL y que se elevan posteriormente, dando una idea del comportamiento del biomarcador en cuanto a la precocidad del NGAL respecto a la DRA. De los 17 pacientes con NGAL alto, 8 lo elevan durante el estudio. De estos, 3 pacientes no incrementan la creatinina en ningún momento, 3 pacientes tienen una elevación simultánea de creatinina y NGAL el mismo día, un paciente eleva primero la creatinina y después el NGAL y un paciente tiene elevación de creatinina sin relación temporal con el NGAL.
DiscusiónA la luz de los resultados del presente trabajo quedan unas cuantas dudas respecto del NGAL, por lo que se podría considerar plantear nuevos estudios que aclaren un poco mejor la naturaleza de este biomarcador y su interés e importancia en el paciente crítico.
En nuestro estudio hemos utilizado las definiciones de la escala AKIN para definir DRA. Esta definición surgió20 con el fin de estratificar la DRA de manera que entre todos «hablásemos el mismo idioma»y pudiésemos comparar distintos estudios publicados. El hecho de considerar el estadio AKIN 1 como DRA viene dado por la evidencia reciente de la importancia de que pequeños cambios en la creatinina pueden influir en el pronóstico de los pacientes, lo que sugiere que incluso cambios en la creatinina sérica de 0,3mg/dL (estadio AKIN 1) se asocian con un aumento de la mortalidad de los pacientes20,22–24, y, asimismo, por el hecho de que los estudios realizados sobre NGAL lo señalan como marcador precoz de disfunción renal.
El interés en diagnosticar la DRA precozmente es procurar minimizar la gravedad de la lesión renal y facilitar su recuperación a través de mejorar la optimización de la hemodinámica y de la volemia, y evitar el uso de nefrotóxicos en pacientes en riesgo de desarrollar DRA o en fases incipientes del mismo.
El biomarcador renal NGAL surgió como la nueva «troponina» dentro de la detección precoz de la DRA, pero nuestros resultados no son concluyentes al respecto. En la actualidad 2 nuevos biomarcadores (IGFBP7 y TIMP-2) han demostrado ser significativamente superiores a todos los biomarcadores descritos de DRA en un estudio observacional multicéntrico de pacientes críticos en riesgo de DRA25. Consideramos que los marcadores que ya empleamos en la práctica clínica habitual para el DRA, como la creatinina y pequeños incrementos de la misma, y mientras no se avance en el estudio de los nuevos biomarcadores, son de gran utilidad para diagnosticar de forma precoz la DRA y evaluar su seguimiento.
Para la determinación de la creatinina basal, la European Renal Best practice del año 20121 recomienda el uso de la primera creatinina sérica documentada en el ingreso actual en lugar de creatininas previas o de cálculos basados en el filtrado glomerular estimado. En nuestro estudio no se utilizaron fórmulas para estimar la creatinina basal.
Creemos que un punto fuerte del estudio es la homogeneidad en el procedimiento, que el seguimiento de los pacientes durante el estudio fue estricto y sin pérdida de datos.
Una de las limitaciones de las que puede adolecer nuestro estudio es la diferencia entre los distintos seguimientos de nuestros sujetos al incluir a pacientes de corta estancia como los postoperados de cirugía cardíaca (que a su vez puntúan muy poco en las escalas de gravedad SOFA y APACHE). Esta es una cuestión con la que lidian otros estudios cuyo objetivo es analizar la precocidad de NGAL en diagnosticar la DRA. Por este motivo, algunos estudios como el de Nickolas et al.26 optan por hacer una sola determinación de NGAL y analizan su relación con la DRA ya conocida. En nuestro caso, nos ha parecido interesante incluir una muestra de pacientes ya ingresados en la UCI que nos permitiera obtener información de pacientes críticos en diferentes fases de DRA y así poder analizar su relación con el biomarcador NGAL. Además, puesto que se incluyeron pacientes que estaban ingresados en la UCI polivalente en los días seleccionados para el día de corte y esos días venían determinados por la participación en el estudio multicéntrico COFRADE en el que se estaba participando, el estudio adolece de otras limitaciones: se trata de un estudio no aleatorizado con posible sesgo de supervivencia. Los casos observados pueden tener una mayor supervivencia y menos gravedad en las escalas de APACHE y SOFA, puesto que los fallecidos pueden haber muerto antes de entrar en el estudio. Este sesgo que alteraría los resultados referentes a la gravedad de los grupos estudiados se puede producir por el hecho de incluir a los pacientes en el estudio en un día de corte determinado y no incluirlos al ingreso en la UCI. Asimismo, podría justificar el hecho de no haber encontrado asociación entre NGAL y la mortalidad a pesar de que, en el presente estudio, de los 17 pacientes que presentaron un NGAL>150ng/mL, 10 fallecieron (58,8%), en cambio la mortalidad de los que presentaron NGAL bajo fue del 10,3%. En el metaanálisis de Haase et al. también se concluyó que NGAL podría predecir mortalidad13.
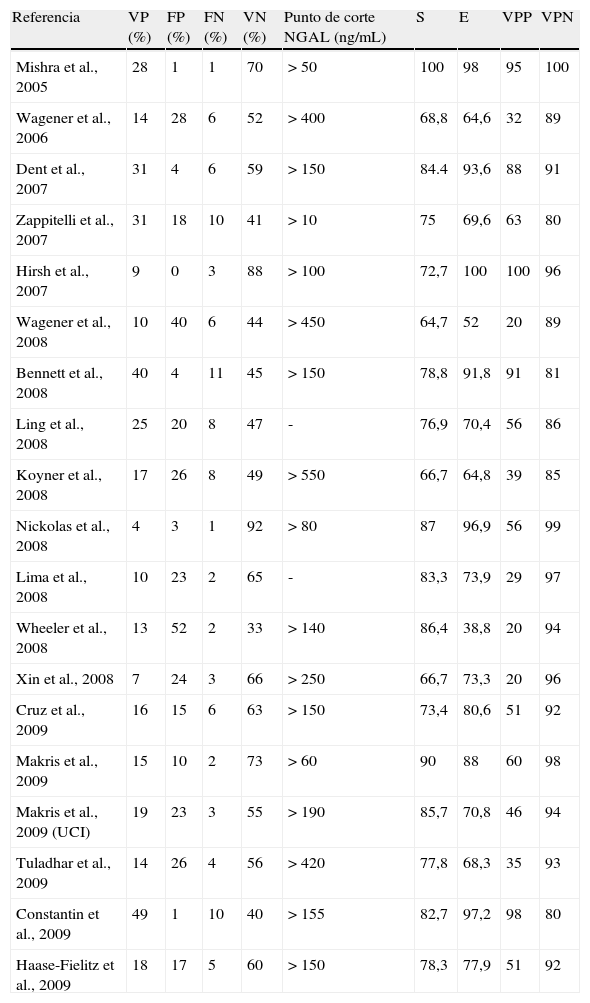
Un punto de discusión en la literatura, en el que todavía no existe consenso, es el punto de corte de NGAL utilizado. Así, en el metaanálisis realizado por Haase et al.13 podemos observar cómo los 19 estudios incluidos tienen puntos de corte de NGAL tan variables como >50 o >550ng/mL, lo cual supone un problema a la hora de escoger el mejor punto de corte. Al profundizar en el tema, los autores del metaanálisis apuntan que para obtener una S y E óptimas para predecir la DRA en cualquier contexto, el punto de corte se situaría entre 100 y 270ng/mL. Además, en los estudios en que se midió NGAL con plataformas como el ARCHITECH, el punto de corte utilizado fue NGAL>150ng/mL. En nuestro estudio se empleó la misma plataforma ARCHITECH y dado que el valor 150 se encontraba dentro del rango de 100 a 270ng/mL decidimos utilizar este punto de corte.
Para analizar la relación entre el NGAL y la función renal hemos abordado la cuestión desde diferentes ángulos. Por un lado observamos una asociación estadísticamente significativa entre el valor de NGAL y la creatinina sérica como variables continuas pero con poca fuerza de asociación; esto puede ser debido a que la muestra sea pequeña o a que existan otros factores no valorados que influyan en el valor de NGAL. Por otro lado, al analizar la relación entre el valor de NGAL dicotomizado (> o <150ng/mL) y los diferentes estadios AKIN vemos que existe una asociación estadísticamente significativa, de manera que un valor de NGAL>150ng/mL se relaciona con un estadio AKIN más elevado. Sin embargo, hallamos 8 pacientes con un valor de NGAL elevado que no presentaron DRA, ni en los 7 días previos al día de corte, ni durante el periodo del estudio. El valor de NGAL dicotomizado se asocia también de manera estadísticamente significativa con la DRA. De todos los pacientes que presentaron DRA el 69% tenían un NGAL elevado. Sin embargo, cabe destacar que los resultados obtenidos en cuanto al VPP nos indican que el NGAL no sería la mejor prueba diagnóstica para DRA, puesto que de todos los pacientes que tenían un NGAL elevado, el 47% no tenían DRA, y en todos estos casos estaríamos diagnosticando de DRA a personas que no van a elevar la cifra de creatinina en ningún momento del seguimiento. En cambio, sería una prueba que en el caso de determinar un valor de NGAL<150 descartaría la DRA.
Al realizar la curva ROC para analizar el valor diagnóstico del NGAL para la detección de la DRA obtuvimos un área bajo la curva ROC de 77,5%, lo que sugiere que el NGAL podría ser una buena prueba diagnóstica. Sin embargo, este relativamente elevado valor del área no se refleja en una S y una E muy elevadas, ya que la forma de la curva se aplana a valores medios del NGAL. Es decir, para valores extremos el NGAL podría ser una buena prueba diagnóstica, pero para valores medios se obtienen muchos falsos positivos, tal y como se puede observar en la figura 2. En nuestro estudio, el centro de la curva ROC está bastante alejado del extremo superior izquierdo del gráfico, lo cual nos lleva de nuevo al problema que hemos comentado anteriormente de la falta de consenso en el punto de corte de NGAL.
Nuestros resultados coinciden con los de varios estudios publicados (tabla 6). Observamos que en el metaanálisis13 19 estudios obtienen valores de S entre 64,7 y 78%, siendo el nuestro similar con un valor del 69%; 5 estudios obtienen valores de E entre el 70,4 y el 78%, siendo el nuestro similar con un valor del 75,7%; el valor de VPP >es muy variable y puede oscilar mucho según el estudio analizado entre 20 y 56%, siendo el nuestro similar con un valor del 53%; y el VPN coincide globalmente en todos los estudios que tiene valores muy altos desde el 80 al 100%, siendo el nuestro similar con un valor del 86,2%. Los autores interpretan los resultados desde un punto de vista diferente al nuestro y consideran que son unos resultados óptimos para un buen biomarcador. Nosotros, en cambio, hemos considerado que un VPP como los obtenidos en el metaanálisis y en nuestro estudio no son valores óptimos para considerarlo un buen biomarcador. Actualmente la European Renal Best practice1 reconoce que el beneficio adicional de los nuevos biomarcadores, como el NGAL, no ha sido demostrado y sigue siendo motivo de debate.
Resultados publicados en el metaanálisis de Haase et al.; sensibilidad y especificidad de NGAL para predecir FRA en cada estudio analizado
| Referencia | VP (%) | FP (%) | FN (%) | VN (%) | Punto de corte NGAL (ng/mL) | S | E | VPP | VPN |
| Mishra et al., 2005 | 28 | 1 | 1 | 70 | >50 | 100 | 98 | 95 | 100 |
| Wagener et al., 2006 | 14 | 28 | 6 | 52 | >400 | 68,8 | 64,6 | 32 | 89 |
| Dent et al., 2007 | 31 | 4 | 6 | 59 | >150 | 84.4 | 93,6 | 88 | 91 |
| Zappitelli et al., 2007 | 31 | 18 | 10 | 41 | >10 | 75 | 69,6 | 63 | 80 |
| Hirsh et al., 2007 | 9 | 0 | 3 | 88 | >100 | 72,7 | 100 | 100 | 96 |
| Wagener et al., 2008 | 10 | 40 | 6 | 44 | >450 | 64,7 | 52 | 20 | 89 |
| Bennett et al., 2008 | 40 | 4 | 11 | 45 | >150 | 78,8 | 91,8 | 91 | 81 |
| Ling et al., 2008 | 25 | 20 | 8 | 47 | - | 76,9 | 70,4 | 56 | 86 |
| Koyner et al., 2008 | 17 | 26 | 8 | 49 | >550 | 66,7 | 64,8 | 39 | 85 |
| Nickolas et al., 2008 | 4 | 3 | 1 | 92 | >80 | 87 | 96,9 | 56 | 99 |
| Lima et al., 2008 | 10 | 23 | 2 | 65 | - | 83,3 | 73,9 | 29 | 97 |
| Wheeler et al., 2008 | 13 | 52 | 2 | 33 | >140 | 86,4 | 38,8 | 20 | 94 |
| Xin et al., 2008 | 7 | 24 | 3 | 66 | >250 | 66,7 | 73,3 | 20 | 96 |
| Cruz et al., 2009 | 16 | 15 | 6 | 63 | >150 | 73,4 | 80,6 | 51 | 92 |
| Makris et al., 2009 | 15 | 10 | 2 | 73 | >60 | 90 | 88 | 60 | 98 |
| Makris et al., 2009 (UCI) | 19 | 23 | 3 | 55 | >190 | 85,7 | 70,8 | 46 | 94 |
| Tuladhar et al., 2009 | 14 | 26 | 4 | 56 | >420 | 77,8 | 68,3 | 35 | 93 |
| Constantin et al., 2009 | 49 | 1 | 10 | 40 | >155 | 82,7 | 97,2 | 98 | 80 |
| Haase-Fielitz et al., 2009 | 18 | 17 | 5 | 60 | >150 | 78,3 | 77,9 | 51 | 92 |
E: especificidad; FN: falso negativo; FP: falso positivo; NGAL: lipocalina asociada a la gelatinasa de neutrófilos; S: sensibilidad; VN: verdadero negativo; VP: verdadero positivo; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Fuente: Haase et al.13
Para explicarnos el hallazgo de un 17% de falsos positivos (FP), cavilamos que al haber utilizado como definición para DRA un incremento en la creatinina podríamos haber excluido a pacientes que por presentar malnutrición o miopatía de UCI con atrofia muscular podrían haber estado en situación de DRA sin haber podido elevar la creatinina3 y, en cambio, tener un NGAL alto. En nuestro estudio hallamos 9 pacientes con una creatinina≤0,5mg/dL que presentaban un NGAL elevado y que podrían considerarse dentro de este grupo que tal vez no habrían podido elevar la cifra de creatinina a lo largo del ingreso. No alcanzamos a estudiar más profundamente este pequeño grupo de pacientes, y para que estos pacientes no influyesen en los resultados globales del NGAL realizamos un análisis de asociación entre NGAL y creatinina excluyendo las determinaciones que tenían una creatinina≤0,5mg/dL sin que ello mejorase la S, la E ni el VPP de la prueba. Sin embargo, apuntamos la posible utilidad de estudiar más profundamente el papel del NGAL en la DRA de pacientes sin masa muscular que no son capaces de elevar la creatinina.
Otra posible explicación al alto porcentaje de FP podría ser la existencia de la ampliamente estudiada relación entre el proceso de sepsis/SIRS con los niveles del NGAL por la elevación de una isoforma de la lipocalina independiente de DRA27. Mårtensson et al. sugieren también que NGAL se eleva en sangre en respuesta a la infección bacteriana, así como por otras entidades causantes de inflamación28. Nos pareció interesante conocer los datos de los pacientes que presentaban sepsis, tal y como se describe en los resultados, aun y ser un subgrupo pequeño. Observamos que todos los pacientes que presentaron sepsis/SIRS durante el estudio elevaron el NGAL, pero solo uno no desarrolló DRA asociada a la sepsis, así que influirían muy poco en los FP. De todas maneras creemos que hacen falta más estudios que ensayen la naturaleza de NGAL, que clarifiquen su rol dentro de la fisiopatología renal y el papel que puede desempeñar en la inflamación, dado que el gen NGAL es un gen regulado por la inmunidad innata con su máxima expresión en el tejido renal29,30.
De otra parte, quedaría en el dintel dilucidar la asociación entre el género y el NGAL. Nos ha sorprendido que las mujeres de nuestra muestra tienen con más frecuencia unos valores de NGAL bajos. Nos parece interesante seguir profundizando en este aspecto, dado que no hemos encontrado ninguna explicación a este efecto por ahora.
Y finalmente, concluiremos que aunque un valor elevado de NGAL se asocia a un aumento en el valor de la creatinina sérica y a un grado AKIN más alto, un NGAL>150ng/mL no parece ser una excelente prueba para detectar DRA en el paciente crítico (47% de FP) pero sí se asocia con un peor pronóstico. Sería interesante profundizar e investigar más sobre la relación entre NGAL y sepsis, entre NGAL y el género, su papel en el diagnóstico de DRA en pacientes sin masa muscular, así como estudiar >la relación entre NGAL y la necesidad de tratamientos de reemplazo renal puesto que el escaso número de pacientes incluidos con TRR impidió su análisis.
Conflicto interesesLos autores declaran no tener ningún conflicto de intereses.
A los investigadores principales del estudio COFRADE. M.E. Herrera-Gutiérrez, G. Seller-Pérez, J. Maynar-Moliner y J.A. Sánchez-Izquierdo Riera