La monitorización hemodinámica nos permite obtener información sobre el funcionalismo cardiovascular del paciente crítico, por lo que constituye una pieza fundamental en la aproximación diagnóstica y en la guía terapéutica del paciente con hipoperfusión tisular. Desde la aparición del catéter de arteria pulmonar hasta el desarrollo reciente de tecnologías mínimamente invasivas, la monitorización hemodinámica se ha rodeado de interrogantes en cuanto a su utilidad y su impacto final sobre el pronóstico de nuestros pacientes. El Grupo de Trabajo de Cuidados Intensivos Cardiológicos y RCP (GTCIC y RCP) de la SEMICYUC ha impulsado recientemente la realización de la serie de «Puesta al día en monitorización hemodinámica» y ha querido además desarrollar unas recomendaciones que pretenden analizar cuestiones fundamentales en la valoración cardiovascular del paciente crítico, con la intención final de ser una herramienta útil para residentes, intensivistas y otros profesionales que afrontan el manejo diario de estos pacientes.
Hemodynamic monitoring offers valuable information on cardiovascular performance in the critically ill, and has become a fundamental tool in the diagnostic approach and in the therapy guidance of those patients presenting with tissue hypoperfusion. From introduction of the pulmonary artery catheter to the latest less invasive technologies, hemodynamic monitoring has been surrounded by many questions regarding its usefulness and its ultimate impact on patient prognosis. The Cardiological Intensive Care and CPR Working Group (GTCIC-RCP) of the Spanish Society of Intensive Care and Coronary Units (SEMICYUC) has recently impulsed the development of an updating series in hemodynamic monitoring. Now, a final series of recommendations are presented in order to analyze essential issues in hemodynamics, with the purpose of becoming a useful tool for residents and critical care practitioners involved in the daily management of critically ill patients.
El estudio de la función cardiovascular constituye un aspecto fundamental del cuidado del paciente crítico. La monitorización hemodinámica nos permite obtener información acerca de la fisiopatología cardiocirculatoria que nos ayudará a realizar el diagnóstico y a guiar la terapéutica en las situaciones de inestabilidad hemodinámica. El catéter de arteria pulmonar (CAP) ha sido la técnica más utilizada desde su introducción hace más de 40 años. Aunque su papel en el conocimiento más profundo de la función cardiovascular es indiscutible, su uso ha descendido debido a la controversia de sus indicaciones y sus limitaciones. Por este motivo, se ha intensificado la búsqueda de nuevos métodos de monitorización. Actualmente, el desarrollo tecnológico nos proporciona numerosos sistemas que exploran los aspectos más importantes de la hemodinámica (precarga, función ventricular, objetivos de la reanimación hemodinámica, etc.). Estos sistemas, al igual que el CAP, poseen ventajas y limitaciones que es necesario conocer antes de su aplicación en la práctica clínica1,2. La ecocardiografía, aunque no es propiamente un sistema de monitorización continua, ofrece información anatómica y funcional que puede ser enormemente útil en la valoración hemodinámica del paciente crítico3,4.
El Grupo de Trabajo de Cuidados Intensivos Cardiológicos y RCP (GTCIC y RCP) de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC) ha impulsado la realización de una serie de «Puesta al día en monitorización hemodinámica»5. Esta serie, compuesta de diversos capítulos dedicados a la revisión de sus aspectos más relevantes, ha sido publicada recientemente en esta revista. Por otro lado, el Grupo de Trabajo ha querido desarrollar y publicar estas recomendaciones sobre cuestiones específicas de la monitorización y reanimación hemodinámica basándose fundamentalmente en el contenido de estos capítulos y en la búsqueda bibliográfica consultada para su elaboración. El objetivo de estas recomendaciones es proporcionar una guía que sea útil en la práctica clínica. Las cuestiones específicas que se plantean son las siguientes: 1. ¿Cuáles son los objetivos de la reanimación hemodinámica? 2. ¿Cómo valoramos los factores que determinan el rendimiento cardíaco? 3. Monitorización hemodinámica básica inicial. Monitorización hemodinámica continua. ¿Cuándo y con qué? 4. ¿Cuál es el papel de la ecocardiografía en la reanimación hemodinámica? 5. ¿Cuál es la evidencia de la utilidad de la monitorización hemodinámica en el paciente crítico? Cada una de las 5 cuestiones fue respondida por un grupo formado por varios de los miembros participantes en la elaboración de las recomendaciones, todos ellos expertos en monitorización hemodinámica y/o ecocardiografía en el paciente crítico. El documento final fue discutido y consensuado posteriormente entre todos los participantes. Además, se remitió a los miembros del Grupo de Trabajo para su valoración y aprobación. El documento posee el aval científico de la SEMICYUC.
El nivel de recomendación y la calidad de la evidencia han sido asignados según los criterios definidos por el sistema GRADE6. El sistema clasifica la evidencia como alta (grado A), moderada (grado B), baja (grado C) y muy baja (grado D) de acuerdo a factores que incluyen, entre otros, la metodología de los estudios, la consistencia y la precisión de los resultados. El sistema GRADE clasifica las recomendaciones como fuertes (L1) o débiles (L2) en función de factores como el balance entre beneficios y riesgos, la calidad de la evidencia, los costes y el uso de recursos.
Definición del escenario. Tipo de pacientes y profesionales a los que van dirigidas las recomendacionesLas recomendaciones están dirigidas a los pacientes con hipoperfusión sistémica con independencia de las diferentes etiologías. Estas medidas son paralelas a las actuaciones específicas de cada patología (p. ej., drenaje del foco séptico, apertura del vaso coronario, fibrinólisis del tromboembolismo pulmonar). Las recomendaciones están dirigidas a todos los intensivistas, los residentes en formación y otros profesionales que sean responsables de la atención de pacientes críticos en su práctica diaria.
Cuestión 1. ¿Cuáles son los objetivos de la reanimación hemodinámica?Un primer paso obligado en la evaluación inicial del paciente crítico es determinar la idoneidad del estado de perfusión de los tejidos. La presencia y/o persistencia de disoxia celular va a ser un factor fundamental en el desarrollo de lesiones orgánicas, fracaso multiorgánico y, eventualmente, la muerte del individuo. Lo que habitualmente conocemos como inestabilidad hemodinámica suele referirse a la presencia de signos clínicos sugestivos de hipoperfusión (alteración del sensorio, pobre relleno capilar, etc.), y, sobre todo, a la presencia de hipotensión arterial. Ahora bien, en los últimos años la evidencia de que la presencia de hipoperfusión aun en ausencia de hipotensión y/o de estos signos clínicos, a lo que se denomina shock oculto o compensado, se asocia también a cifras significativamente elevadas de morbimortalidad7 ha llevado a un mayor esfuerzo por detectar dichas situaciones de hipoperfusión.
En el paciente crítico, hablaremos de shock, o insuficiencia cardiovascular, cuando tengamos evidencia de hipoperfusión tisular. La incapacidad para mantener la adecuada perfusión de los tejidos va a provocar un incremento en la extracción de oxígeno a nivel microcirculatorio, así como el inicio de las vías anaerobias a fin de mantener la respiración celular. Así, en nuestra práctica clínica, hablaremos de situación de shock cuando detectemos una disminución de las saturaciones venosas de oxígeno y/o una elevación del lactato sérico, más allá de la presencia o no de hipotensión arterial8.
Los principales determinantes de la llegada de oxígeno a los tejidos son (a) la presión de perfusión y (b) el transporte global de oxígeno. El proceso de reanimación hemodinámica, mediante la manipulación de estas variables de presión y flujo, buscará restaurar el equilibrio entre transporte (DO2) y consumo (VO2) de oxígeno a los tejidos, con la consiguiente reversión de la anaerobiosis. La corrección del estado de disoxia debería conseguirse cuanto antes, puesto que la duración del daño va a condicionar el mayor desarrollo de fracaso orgánico, con consecuencias directas sobre el pronóstico del individuo.
Presión arterialUtilizaremos la presión arterial media (PAM) como estimación de la presión de perfusión de los tejidos. Puesto que, a nivel fisiológico, la vasculatura pierde su capacidad de autorregulación a partir de valores de PAM inferiores a 60-65mmHg, la mayoría de los trabajos han propuesto un valor objetivo de PAM de 65mmHg. En pacientes sépticos, por ejemplo, un nivel de corte de PAM de 65mmHg durante las primeras 48h de ingreso demostró ser el que mejor discriminaba a los supervivientes y no-supervivientes9. Además, la consecución de niveles más elevados de PAM no ha mostrado superioridad en resultados. Cabe destacar que trabajos recientes con videomicroscopia capilar han evidenciado que la microcirculación de determinados pacientes sí podría beneficiarse de valores más elevados de PAM10, lo que sugiere la posibilidad de individualizar la PAM de acuerdo a su efecto sobre la microcirculación. Sin embargo, todavía no se dispone de estudios prospectivos que analicen el impacto en el pronóstico de la optimización individualizada de la PAM según parámetros microcirculatorios.
Se contemplan 2 situaciones especiales en cuanto al manejo de la PAM en la patología crítica aguda: (a) en las situaciones de hemorragia incontrolable en pacientes traumáticos, y (b) en los pacientes con traumatismo craneoencefálico grave sin hemorragia sistémica11. En la primera situación, se recomienda mantener niveles de PAM de 40mmHg hasta el control quirúrgico de la hemorragia. En cuanto a las situaciones de traumatismo craneoencefálico grave en las que exista deterioro neurológico y no tengamos evidencia de hemorragia sistémica, dado que desconocemos la presión de perfusión cerebral, se recomienda mantener niveles de PAM de 90mmHg. Una vez monitorizada la presión intracraneal, ajustaremos el nivel de PAM con el fin de asegurar la perfusión cerebral12.
Variables de transporte de oxígenoAdemás de asegurar la correcta presión de perfusión del tejido, deberemos adecuar el DO2 a las necesidades metabólicas. Para ello, perseguiremos incrementar el DO2. Aunque la reanimación hemodinámica se basa principalmente en la optimización de las variables de flujo (asegurando el contenido arterial de O2), como norma general, no perseguiremos unos valores predeterminados, sino más bien una adecuación de estas variables hasta llegar a la normalización de los parámetros que nos reflejan el equilibrio global de aporte-consumo de oxígeno. Así, descartada o corregida la hipoxemia arterial, no parece lógico pretender unos valores concretos de DO2, gasto cardíaco (GC) o hemoglobina, sino más bien su adecuación en función del estado global de oxigenación tisular.
Merece especial mención la reanimación de pacientes de alto riesgo quirúrgico. En esta población de pacientes existe evidencia suficiente para recomendar el uso de ciertos niveles de DO2 (>600ml O2/min/m2) como objetivo en la optimización hemodinámica tanto pre, como intra o postoperatoria13. Sin embargo, parece razonable afirmar que el uso de variables que nos informen del equilibrio entre DO2 y VO2 debería ofrecer ventajas sobre las variables de DO2 aisladas, para evitar tanto la infra como la suprarresucitación, con los problemas que cada una conlleva.
Marcadores globales de hipoperfusiónComo acabamos de exponer, más allá de la consecución de valores de DO2 o flujo predeterminados, la reanimación hemodinámica pretenderá la normalización de valores fisiológicos de marcadores de perfusión global del organismo. En la práctica clínica disponemos fundamentalmente de 2 variables extremadamente útiles para este fin: las saturaciones venosas de oxígeno y los niveles de lactato.
Saturaciones venosas de oxígenoLa saturación venosa mixta de oxígeno (SvO2), obtenida en la arteria pulmonar, probablemente representa el mejor indicador de la adecuación del DO2. En diversas situaciones de patología crítica, la saturación venosa central de oxígeno (SvcO2), obtenida en la aurícula derecha, ha demostrado una buena correlación con la SvO2 (aunque sobreestima en torno al 5%), así como un consistente paralelismo en sus cambios14. La reducción del GC y/o el aumento de las necesidades metabólicas se traducirán en un incremento compensador en la extracción de oxígeno, con el consiguiente descenso de las saturaciones venosas. Este descenso será precoz, pudiendo preceder incluso a la elevación del lactato sérico. La incorporación de las saturaciones venosas como objetivo metabólico final del proceso de reanimación ha demostrado su impacto beneficioso en el pronóstico de diferentes poblaciones de pacientes críticos15. Sin embargo, en determinadas situaciones de shock distributivo, la presencia de SvcO2 elevadas también se ha asociado a mayor mortalidad16. Este fenómeno vendría determinado por diferentes mecanismos, como fenómenos de shunt, flujo heterogéneo, o alteraciones en la extracción de oxígeno. Por tanto, es fundamental conocer las limitaciones de esta variable y, en el contexto clínico adecuado, disponer de otros parámetros que nos informen sobre el estado de perfusión tisular del individuo.
LactatoEn general, la elevación en la concentración de lactato en sangre indica la presencia de hipoxia tisular y metabolismo anaerobio. La magnitud de esta elevación en los niveles de lactato se ha correlacionado directamente con el pronóstico del paciente con patología crítica aguda17. En cuanto a su utilidad en la guía del proceso de reanimación, la monitorización del aclaramiento del lactato en respuesta a las intervenciones terapéuticas no se ha mostrado inferior a la resucitación guiada por SvcO218.
En situaciones de hipoxia tisular, además de la formación de lactato, se producirá también una elevación de aniones secundarios a la anaerobiosis, así como un defecto en el lavado de CO2 del organismo. Así, la determinación del exceso de base estándar y de la diferencia arteriovenosa de CO2 −P(v-a)CO2− puede ser de ayuda en la evaluación del estado global de oxigenación de los tejidos. Aunque la alteración en los valores iniciales de exceso de base estándar ha mostrado un valor pronóstico similar al del lactato, su evolución en el tiempo se ve afectada por múltiples factores diferentes a la hipoxia celular, por lo que no se recomienda su uso como parámetro independiente en la guía de la reanimación19. En cuanto a la P(v-a)CO2 (ya sea central o mixta), diferentes trabajos han correlacionado inversamente su valor a los valores de índice cardíaco. Niveles de P(v-a)CO2>6mmHg han demostrado ser útiles en la detección de hipoperfusión persistente a pesar de la normalización de la SvcO220, aunque su incorporación a algoritmos de resucitación todavía no se ha testado.
Marcadores de circulación regional y/o microcirculaciónA pesar de que en los últimos años existe una creciente evidencia del valor pronóstico de diferentes parámetros referentes a la microcirculación, a día de hoy no disponemos de estudios que evalúen la utilidad de dichos parámetros como objetivo del proceso de reanimación hemodinámica8. Así, aunque resulten altamente prometedoras, no podemos recomendar, en el momento actual, la incorporación de estas tecnologías a la práctica clínica como objetivo en la guía de la reversión del shock.
- 1.
Definiremos shock como aquella situación de riesgo vital en la que existe una alteración en el DO2y/o la capacidad para utilizar el oxígeno, dando lugar a disoxia tisular.
- 2.
La presencia de hipotensión arterial (PAM<65mmHg) no es necesaria para definir el estado de shock.
- 3.
Ante una situación clínica sugestiva, la alteración de un marcador de perfusión tisular (lactato y/o saturaciones venosas de oxígeno) será definitoria de shock, esté acompañada o no de hipotensión arterial.
- 1.
Las medidas de reanimación hemodinámica deben instaurarse de inmediato, y la consecución de los objetivos marcados debe darse de la forma más precoz posible (idealmente en las primeras 6h).(L1; B)
- 2.
El primer paso en la reanimación hemodinámica será la rápida consecución y el mantenimiento de unos valores mínimos de presión de perfusión de los tejidos, definida como PAM≥65mmHg. (L1; B)
- 3.
Una vez asegurada la presión de perfusión, buscaremos corregir la disoxia tisular, definido como restauración de valores normales de marcadores globales de hipoxia tisular: SvcO2≥70% (o SvO2≥65%) y/o la normalización de los niveles de lactato. (L1; A)
- 4.
La guía de la reanimación hemodinámica mediante la monitorización del aclaramiento de lactato no ha mostrado inferioridad frente a la monitorización de la SvcO2. (L1; B)
- 5.
En pacientes quirúrgicos de alto riesgo podríamos perseguir la optimización del DO2a valores≥600ml O2/min/m2para evitar la hipoperfusión tisular. (L1; A)
- 6.
En situaciones de SvcO2≥70%, un gradiente arteriovenoso de CO2elevado puede indicar persistencia de hipoperfusión de algunos territorios, por lo que se podría sugerir la optimización del DO2hasta valores de P(v-a)CO2<6mmHg. (L2; B)
- 7.
En el momento actual, el uso de tecnologías para la evaluación de la microcirculación o la circulación regional no se ha explorado en el proceso de resucitación, por lo que no se recomienda su incorporación rutinaria a la práctica clínica. (L1; B)
- 8.
La integración de los diferentes objetivos en algoritmos o bundles de reanimación precoz van a resultar en un mejor pronóstico de los pacientes tratados. (L1; A)
El GC es considerado un evaluador de la función cardíaca global. Nos proporciona además información sobre la causa del shock y del fallo orgánico por lo que representa un parámetro fundamental en la evaluación hemodinámica del paciente crítico. A pesar de todo, es necesario integrar el valor del GC con otras variables hemodinámicas (medidas de precarga, contractilidad, poscarga), signos biológicos y parámetros de oxigenación tisular para obtener una información completa que pueda guiar nuestras decisiones terapéuticas.
Existe poca evidencia científica que apoye una monitorización sistemática del GC en los pacientes críticos1,2,11,21,22. En muchas ocasiones, la situación de inestabilidad hemodinámica puede resolverse utilizando una valoración y monitorización más simple (exploración física, diuresis, presión arterial [PA], estimación de la precarga y parámetros de respuesta a volumen, etc.) sin necesidad de incrementar el grado de medidas o procedimientos. Sin embargo, algunos pacientes persisten con signos de hipoperfusión transcurridas las 3-6 primeras horas desde el inicio del tratamiento. En estos pacientes podría ser útil una monitorización más exhaustiva que pueda proporcionar información más detallada sobre la función cardiovascular y, por consiguiente, que permita entender el fracaso del tratamiento inicial y guiar de forma más adecuada las medidas de resucitación. Esta monitorización, que ha de incluir el GC, debería ser precoz una vez el paciente es refractario a las medidas iniciales2,23.
En los pacientes que presenten hipoxemia grave inicial y exista sospecha de fallo cardíaco o en pacientes con problemas cardiopulmonares complejos parece razonable monitorizar el GC en fases más precoces, ya que las medidas de resucitación inicial (expansión de volumen, aplicación de ventilación mecánica, etc.) pueden empeorar la función cardíaca y respiratoria. Por otro lado, en el shock cardiogénico, una correcta y precoz monitorización del GC tiene especial importancia no solo para el diagnóstico, sino para dirigir el posterior tratamiento1,2,21.
Por último, como ha sido comentado en el apartado previo, se ha demostrado que en pacientes con alto riesgo quirúrgico, una adecuada optimización del GC durante la intervención y en las horas inmediatamente posteriores incide de manera directa en su pronóstico13.
En la actualidad, disponemos de una gran variedad de métodos para monitorizar el GC con importantes diferencias entre ellos. En el capítulo dedicado a la estimación del GC de la serie de «Puesta al día en monitorización hemodinámica» se puede encontrar la información referente a los dispositivos disponibles23. Estos dispositivos pueden ser clasificados en función del grado de invasividad. Según esta clasificación, disponemos de sistemas invasivos (CAP), semiinvasivos (termodilución transpulmonar, litiodilución, análisis del contorno de la onda de pulso, Doppler esofágico, etc.) y no invasivos (ecografía, biorreactancia, tecnología Doppler, etc.).
El GC obtenido por termodilución con el CAP es considerado el método «gold standard» para la medición del GC desde su introducción en 197024,25. La mayoría de los métodos de estimación del GC han sido evaluados mediante la comparación con los datos obtenidos por termodilución con el CAP a pesar de que esta técnica tiene sus limitaciones y podría no ser el comparador de elección. El CAP permite además obtener parámetros hemodinámicos relevantes como la presión de arteria pulmonar (PAP), la presión de oclusión de arteria pulmonar (POAP) y parámetros de DO2 y VO2. Sin embargo, la utilización del CAP ha descendido debido su invasividad y al debate sobre sus posibles complicaciones y sus indicaciones25,26.
Entre los métodos semiinvasivos de estimación del GC se encuentran la termodilución transpulmonar, la litiodilución y el análisis de la onda de pulso.
La termodilución transpulmonar es una variante del método de termodilución en la cual la inyección del bolus de suero se realiza a través de un catéter venoso central y el cambio de temperatura es detectado por un sensor situado en una vía arterial (femoral o axilar), obteniéndose el GC mediante una ecuación modificada de la de Stewart-Hamilton. Su uso es discutido en casos de importantes variaciones térmicas a nivel corporal, uso de sistemas de depuración extracorpórea y shunts intracardíacos. Una variedad de estudios han validado este método en diferentes poblaciones de pacientes críticos2,23,27,28.
La litiodilución es una técnica basada en la utilización del cloruro de litio como trazador para el cálculo del GC. Para su calibración se inyecta un bolus de cloruro de litio en una vía venosa central o periférica y un electrodo situado en una vía arterial detecta la concentración de litio en sangre arterial, calculando el GC usando el área bajo la curva de concentración-tiempo. Su uso está contraindicado en pacientes en tratamiento con litio, con el uso de relajantes musculares no despolarizantes y en casos de shunts intracardíacos. Se ha demostrado también su utilidad en diferentes estudios realizados en unidades de cuidados intensivos (UCI) y en el ámbito quirúrgico29.
Muchos dispositivos ofrecen la posibilidad de obtener el GC de forma continua basado en el análisis del contorno de la onda de pulso arterial. Los sistemas disponibles en el mercado son: PiCCO® (Pulsion), PulseCO® (LiDCO), Modelflow® (TNO/BMI), Most Care® (Vygon) y FloTrac®/Vigileo (Edwards Lifesciences). Difieren en la forma de transformar la información proporcionada por la morfología de la PA en el volumen sistólico (VS) latido a latido, en los algoritmos utilizados por cada uno de ellos, en el modo de calibración (ya que algunos necesitan calibración manual y otros no), en el lugar de canalización arterial, en los parámetros analizados y en la exactitud con la que determinan el GC30–33. La mayor parte de ellos proporcionan al mismo tiempo información continua de múltiples variables de precarga, poscarga y contractilidad, y permiten también el cálculo del porcentaje de variación en la presión de pulso (VPP) o en la variación del volumen sistólico (VVS), utilizados para dirigir la fluidoterapia y analizar la respuesta a la misma. La mayor relevancia de estos dispositivos es que permiten obtener el GC de manera poco invasiva y continua. Además existen protocolos de resucitación basados en parámetros hemodinámicos obtenidos con estos sistemas que han demostrado disminuir la morbilidad del paciente posquirúrgico y crítico32,34. Su principal desventaja reside en que pierden precisión y fiabilidad en situaciones con cambios importantes de volemia y cambio de tono vascular, de especial importancia en los sistemas sin calibración externa.
El Doppler esofágico estima el flujo sanguíneo en aorta descendente y permite calcular el VS. Las limitaciones de esta técnica incluyen la dependencia del operador y la poca tolerancia de la sonda en pacientes no ventilados2,23,35. Hay que destacar que este sistema ha demostrado ser útil para la optimización de fluidos en pacientes quirúrgicos de alto riesgo (menor estancia hospitalaria y número de complicaciones postoperatorias).
Entre los métodos no invasivos destacan la biorreactancia, el Doppler transtorácico y la ecocardiografía.
La biorreactancia, utilizada por el sistema NICOM® (Cheetah Medical) está basada en el análisis del cambio de fase que se produce en la onda eléctrica de alta frecuencia que es emitida al tórax por los cambios en el volumen sanguíneo. Existen resultados prometedores en pacientes de cirugía cardíaca, pero no disponemos todavía de suficientes estudios acerca de su utilidad y fiabilidad en poblaciones más amplias de pacientes críticos2,23,36. El Doppler transtorácico consiste en la aplicación de una sonda Doppler ciega sobre diferentes áreas torácicas que nos permitan medir el flujo a diferentes niveles del sistema cardiovascular. Esta técnica posee una rápida curva de aprendizaje, sin necesidad de calibración, pero presenta la limitación de depender del operador. El sistema más utilizado y con mayor número de publicaciones que lo respalden es el monitor USCOM® (Pty Ltd). A pesar de sus supuestas ventajas, la literatura respecto a su uso comparativo con el CAP en cuidados intensivos es escasa2,23,37.
La ecocardiografía permite obtener el GC de forma no invasiva (ecocardiografía transtorácica, ETT) o mínimamente invasiva (ecocardiografía transesofágica, ETE) y ofrece además una amplia información hemodinámica. A pesar de sus múltiples aplicaciones y la rápida extensión de su utilización en la UCI, es preciso adquirir un entrenamiento adecuado para poder garantizar la calidad y fiabilidad de las medidas3,4.
La selección de un dispositivo u otro de estimación del GC está influida por diversos factores. Algunos de ellos están relacionados con el propio dispositivo como son sus ventajas y sus limitaciones. Otros factores pueden ser institucionales o estar relacionados con el paciente. Además, debería considerarse que una estimación por una técnica menos invasiva puede ser preferible si puede obtenerse más rápida y fácilmente, incluso si es ligeramente menos exacta, sobre todo en situaciones en las que se requiere una valoración rápida de la situación del paciente. Por otro lado, la comparabilidad de las técnicas para el seguimiento de los cambios y las tendencias del GC puede ser más relevante en la práctica clínica que el grado de concordancia de los valores absolutos. En muchos casos, la elección del dispositivo de monitorización hemodinámica depende no solo de la técnica de estimación del GC, sino que está relacionada con los parámetros adicionales que proporciona, la gravedad del paciente y la etiología del shock1,21,22. La indicación y el tipo de monitorización continua serán debatidos en otra sección de estas recomendaciones.
Estimación de la precarga y la respuesta cardiovascular al aporte de volumenLa expansión de volumen constituye la terapia de primera línea en la mayoría de las situaciones de inestabilidad hemodinámica a pesar de que solo el 50% de los pacientes ingresados en la UCI responden al aporte de fluidos incrementando su VS y su GC38–40. Datos recientes sugieren que una resucitación con administración de volumen precoz y «agresiva» puede limitar o revertir la hipoxia tisular, la progresión a fallo orgánico y mejorar el pronóstico15,41. Por otro lado, se ha encontrado una clara asociación entre el balance hídrico acumulado y la mortalidad en los pacientes críticos42. Estos hallazgos enfatizan la importancia de que los parámetros hemodinámicos propuestos para decidir la administración de volumen identifiquen a los pacientes que se beneficiarán del aporte de volumen incrementando su VS (paciente respondedor) y, al mismo tiempo, identifiquen a aquellos pacientes no respondedores para evitar un tratamiento inútil y potencialmente perjudicial.
Los parámetros tradicionalmente utilizados para decidir la administración de fluidos son los estimadores de precarga denominados parámetros estáticos: las presiones de llenado (presión venosa central [PVC] y POAP), los volúmenes y las áreas (volumen telediastólico global, volumen telediastólico del ventrículo derecho y área telediastólica del ventrículo izquierdo). La PVC y la POAP continúan empleándose en la práctica diaria como herramienta habitual a la hora de decidir cuándo administrar volumen, especialmente la PVC. En este sentido, un registro alemán recientemente publicado ha mostrado que más del 92% de intensivistas y anestesiólogos utilizan la PVC para monitorizar la resucitación de los pacientes postoperados de cirugía cardíaca43. Asimismo, las guías de la Surviving Sepsis Campaign44 recomiendan la utilización de la PVC dentro de un protocolo de resucitación precoz basado en los resultados del estudio de Rivers et al.15. Sin embargo, el fracaso de estos parámetros para predecir la respuesta a volumen se ha puesto de manifiesto en multitud de estudios40,45–47. No se ha encontrado una diferencia significativa en los valores basales de PVC o POAP en pacientes respondedores y no respondedores al aporte de volumen. Otros estimadores de precarga como el área telediastólica obtenida mediante ecocardiografía o los volúmenes obtenidos con CAP o PiCCO® tampoco han demostrado ser buenos predictores de la respuesta cardiovascular a la administración de volumen. A pesar de todo, se acepta que valores muy bajos de PVC o POAP (<5mm Hg) podrían predecir una respuesta positiva47. Las razones que explican que los parámetros estáticos no sean estimadores fiables de la respuesta al volumen incluyen consideraciones técnicas de medición y la posibilidad de una estimación inadecuada de las presiones transmurales por efecto de la PEEP, la hipertensión abdominal o la alteración de la distensibilidad ventricular. Además, desde un punto de vista puramente fisiológico, el conocimiento de un valor concreto de precarga no permite conocer la reserva de precarga de un ventrículo debido, por un lado, a que la curva de Frank-Starling o curva de función ventricular es curvilínea (parte ascendente: dependencia de precarga, y parte plana: independencia de precarga) y, por otro, a que no existe una única curva de función ventricular sino una familia de curvas que relacionan la precarga y el VS en función de los cambios en la poscarga o la función contráctil. Por este motivo, para un valor determinado de precarga, el incremento del VS dependerá de la parte de la curva de Frank-Starling en la que trabajan ambos ventrículos.
Recientemente se ha propuesto la utilización de parámetros dinámicos basados en una evaluación hemodinámica «funcional». El principio de este método consiste en inducir un cambio reversible y transitorio en la precarga cardíaca y observar los efectos producidos en el VS o en el GC. Los parámetros dinámicos más ampliamente estudiados en pacientes sometidos a ventilación mecánica son los obtenidos del análisis de los cambios en el VS y la PA durante un ciclo respiratorio mecánico, basándose en la interacción corazón-pulmón38,39,47–51. El efecto hemodinámico principal del aumento de la presión intratorácica es el descenso del retorno venoso y la eyección ventricular derecha, lo que puede originar un descenso de la precarga y del VS del ventrículo izquierdo. La magnitud de los cambios respiratorios del VS dependerá de la posición de ambos ventrículos en la curva de función ventricular. Así, cuando ambos ventrículos operan en la parte ascendente de la curva (zona de dependencia de precarga), un cambio en la precarga inducida por la presión positiva intratorácica originará un cambio significativo en el VS y en la presión de pulso (ya que esta es directamente proporcional al VS). Se ha encontrado en múltiples estudios que un valor de VPP≥13% [(presión de pulso máxima−presión de pulso mínima)/(presión de pulso máxima+presión de pulso mínima)/2×100] y de VVS≥10% [(VSmáximo–VSmínimo)/(VSmáximo+VSmínimo)/2×100] predicen la respuesta al aporte de volumen con alta sensibilidad y especificidad en distintas poblaciones de pacientes críticos. Además, se ha demostrado reiteradamente que los parámetros dinámicos son mejores predictores que los estáticos. En este sentido, una revisión sistemática reciente (29 estudios y 685 pacientes incluidos) sobre la capacidad predictiva de parámetros dinámicos derivados de la curva de PA mostró que las áreas bajo la curva (ROC) para la VPP y la VVS fueron 0,94 y 0,84 respectivamente, mientras que las áreas de los parámetros estáticos fueron 0,55 para la PVC; 0,56 para el volumen telediastólico global indexado y 0,64 para el área telediastólica del ventrículo izquierdo50. Otros métodos basados en el mismo concepto fisiológico como la variación de la velocidad del flujo aórtico mediante Doppler esofágico y la variación del pico de velocidad o de la integral velocidad-tiempo del flujo aórtico determinado con ecocardiografía también son útiles en la predicción de la respuesta al volumen. Incluso se ha propuesto el análisis de la amplitud de la señal pletismográfica de la pulsioximetría y el índice de variabilidad pletismográfica52–55. Asimismo, otros índices basados en la interacción corazón-pulmón, como la variación de la vena cava superior e inferior, han sido validados como predictores fiables y precisos en pacientes sometidos a ventilación mecánica56,57.
A pesar de la utilidad indiscutible de estos parámetros en la evaluación de la respuesta al volumen, es importante conocer sus limitaciones. En primer lugar, el paciente debe estar en ventilación mecánica controlada sin actividad respiratoria espontánea. Por otro lado, estos parámetros no están validados en presencia de arritmias cardíacas y su valor predictivo es menor en pacientes ventilados con volúmenes corrientes por debajo de 8ml/kg48,58.
La maniobra de elevar las piernas también puede ser útil en la predicción de la respuesta a la administración de volumen. La elevación de las piernas con un ángulo de 45° sobre el plano de la cama durante al menos 1min reproduce, de una manera reversible, los efectos cardiovasculares de un aporte de volumen de 300ml. La respuesta hemodinámica a esta maniobra, considerada más como un test que como un tratamiento, puede utilizarse en pacientes sometidos a ventilación mecánica y con respiración espontánea. Su capacidad predictiva ha sido demostrada también en pacientes con arritmias. Un aumento del VS>10-12% estimado con ecocardiografía, sistema PiCCO®, Doppler esofágico u otros dispositivos durante la maniobra permite predecir un incremento del VS>15% tras la administración de volumen con una elevada sensibilidad y especificidad. Un reciente metaanálisis que incluye los resultados de 8 estudios confirma el excelente valor de la maniobra de elevar las piernas para predecir la respuesta a volumen en pacientes críticos con un área bajo la curva (ROC) de 0,9559,60.
En la población de pacientes con respiración espontánea, existen algunos artículos publicados con diferentes maniobras que podrían tener utilidad clínica aunque faltan estudios confirmatorios: la variación de presión de pulso arterial durante una maniobra de Valsalva, la variación de la PA con una maniobra de oclusión teleespiratoria y la variación de presión de aurícula derecha40.
Por último, la evaluación de la respuesta a la administración de una determinada cantidad de volumen en el GC (fluid challenge) ha sido utilizada durante muchos años en la práctica clínica para valorar la eficacia y la seguridad de la reposición volémica. Esta maniobra debería utilizarse en los casos en los que no son valorables ninguno de los parámetros predictores descritos61.
¿Cómo evaluamos la contractilidad y la poscarga en los pacientes críticos?La contractilidad puede ser definida como la capacidad del corazón para generar trabajo externo con independencia de las condiciones de carga. La disfunción cardíaca está principalmente originada por un fallo de bomba ventricular que no proporciona suficiente energía hidráulica para mantener una circulación efectiva. La mayoría de los índices evaluadores de la contractilidad disponibles a nivel experimental o clínico son parcialmente dependientes de la precarga o de la poscarga, lo que puede dificultar su evaluación. La pendiente de la relación presión-volumen ventricular al final de la sístole, denominada elastancia telesistólica (Ees), es considerada como el índice de referencia de contractilidad debido a su relativa independencia de las condiciones de carga y su sensibilidad a los cambios de inotropismo. La generación de datos completos sistólicos y diastólicos precisa instrumentación invasiva del ventrículo izquierdo para la estimación simultánea de medidas de presión y volumen lo que dificulta su determinación62–65, aunque la ecocardiografía podría facilitar parcialmente la obtención de la Ees a pie de cama de manera no invasiva. Sin embargo, no es posible la determinación de la Ees en los pacientes inestables mediante la oclusión de la vena cava inferior y la administración de fármacos vasodilatadores o vasoactivos, puesto que la alteración de la pre y poscarga podría desencadenar una situación de riesgo vital. Se han propuesto algunos métodos para la obtención de la Ees mediante la estimación de un solo latido cardíaco, sin necesidad de modificar las condiciones de carga, pero no existe suficiente evidencia clínica en pacientes críticos para aplicar estos métodos sistemáticamente66.
El parámetro más utilizado tradicionalmente en la UCI para valorar la función ventricular es el GC. Sin embargo, hay que recordar que este parámetro hemodinámico depende de la contractilidad pero también de la precarga y la poscarga. La utilización conjunta del GC y las presiones de llenado (PVC, POAP) permite obtener unos patrones hemodinámicos que pueden ser muy útiles en la práctica clínica. De esta manera, la insuficiencia cardíaca izquierda grave se caracterizaría por un GC bajo y una POAP elevada. El ejemplo más característico de utilidad de estos patrones es la clasificación de Forrester del infarto agudo de miocardio67. No obstante, los datos obtenidos mediante la combinación del GC y las presiones de llenado no nos proporcionan información suficiente para conocer los mecanismos (alteración de la distensibilidad ventricular, disminución de contractilidad, incremento de poscarga…) responsables de los hallazgos clínicos y hemodinámicos del paciente. Otro parámetro utilizado clásicamente en la UCI para la evaluación de la contractilidad a pie de cama es el trabajo sistólico (SW, del inglés stroke work) definido como el producto del VS y la diferencia entre la PAM y la POAP. Este índice también depende de la precarga, pero es independiente de la poscarga por lo que el hallazgo de un SW bajo podría identificar una disminución de la función contráctil en situaciones en las que la reposición volémica haya sido adecuada. Numerosos estudios en el campo de la insuficiencia cardíaca, la cardiopatía isquémica y la sepsis han usado este parámetro como indicador de alteración de la contractilidad y se ha relacionado incluso con el pronóstico de los pacientes64,68.
El corazón puede ser considerado como una bomba mecánica capaz de generar energía hidráulica. En consecuencia, la capacidad de bomba puede expresarse como potencia cardíaca (CP, del inglés cardiac power), definida como el producto del flujo y la presión generados por el corazón. Por lo tanto, la CP es el producto del GC y la PAM determinados simultáneamente. La CP no está influida significativamente por la poscarga pero sí que puede variar con los cambios de precarga. Por este motivo, debería asegurarse que el corazón del paciente no sea dependiente de precarga antes de afirmar que su CP, y por lo tanto su función de bomba, están disminuidas. La CP máxima tras estimulación farmacológica o ejercicio se ha utilizado en los últimos años para evaluar a los pacientes con fallo cardíaco agudo y crónico. En este sentido, diversos estudios han demostrado que la CP máxima alcanzada es un predictor más potente de la evolución de pacientes con insuficiencia cardíaca crónica que el VO2, el GC y la fracción de eyección del ventrículo izquierdo (FEVI)69. Estos resultados han sido confirmados en pacientes críticos en situación de shock cardiogénico. Tan y Littler70 encontraron que la evaluación hemodinámica de la reserva cardíaca (diferencia entre CP máxima y CP basal) mediante estimulación con dobutamina claramente separaba a los pacientes supervivientes de los no supervivientes. Los pacientes con CP máxima menor de 1W (valor normal basal para un adulto sano) o índice SW menor de 0,25j/m2 fallecieron mientras que todos aquellos con valores más elevados sobrevivieron durante un período superior a un año. Una confirmación posterior del valor pronóstico de la CP ha sido publicada recientemente en la misma población de pacientes71. Por el momento, no hay datos publicados en poblaciones más amplias de pacientes críticos.
La ecocardiografía posee un papel clave en la evaluación de la contractilidad puesto que nos permite obtener múltiples parámetros que pueden ser útiles en la UCI para su estimación. La FEVI es el parámetro más frecuentemente utilizado para evaluar la contractilidad en pacientes con enfermedad cardíaca3,72,73. La FEVI es considerada fundamental en pacientes con insuficiencia cardíaca no solo a causa de su importancia pronóstica (a más baja FEVI, peor supervivencia) sino también porque la mayoría de los estudios seleccionan a los pacientes basándose en su FEVI72. En el momento de su interpretación y evaluación en pacientes críticos deberíamos tener en cuenta que es también dependiente de la precarga, la frecuencia cardíaca y, fundamentalmente, de la poscarga. Esta dependencia sería especialmente significativa en las situaciones con un incremento o una disminución importante de la poscarga como ocurre en la sepsis. Además, la ecocardiografía nos ofrece otros parámetros de demostrada utilidad en la evaluación de la contractilidad como son el índice de Tei, el dP/dt máx, el desplazamiento sistólico del anillo tricuspídeo y la velocidad máxima de la onda S del Doppler tisular mitral o tricuspídeo, los cuales tienen mayor o menor sensibilidad a los cambios de inotropismo y a las condiciones de carga74.
En la actualidad, los nuevos sistemas de monitorización proporcionan otros parámetros estimadores de la contractilidad como el índice de función cardíaca y la fracción de eyección global obtenidos mediante termodilución transpulmonar, pero no existen todavía estudios suficientes para recomendar su uso rutinario. Incluso, la medición de los péptidos natriuréticos podría tener un papel en la evaluación no invasiva tanto de la disfunción ventricular como de la evaluación de las presiones de llenado del ventrículo izquierdo aunque los datos disponibles no son todavía concluyentes64.
La poscarga, definida como la «carga» o la oposición que el corazón debe vencer para expulsar el volumen sistólico, es un determinante importante del GC para unas condiciones determinadas de contractilidad y precarga. Aunque la presión aórtica constituye uno de los mayores componentes de la poscarga ventricular, todavía se debate qué parámetro es su estimador más correcto. Una forma de valoración podría ser a través de la estimación del estrés de la pared sistólica ventricular según la ecuación de Laplace. La ecocardiografía puede facilitar la determinación de este parámetro.
La estimación de la poscarga en la UCI se ha realizado tradicionalmente, a pesar de sus limitaciones, mediante la determinación de las resistencias vasculares sistémicas y pulmonares utilizando el CAP. El desarrollo tecnológico actual nos permite disponer de otros dispositivos, incluida la ecografía, que permiten obtener este parámetro de un modo menos invasivo.
Se ha propuesto que la ratio entre la VPP y la VVS, denominada elastancia dinámica por Monge Garcia et al.75, podría ayudar en la estimación del tono vascular y, en consecuencia, ser utilizada en algoritmos de reanimación hemodinámica aunque todavía no existen suficientes estudios confirmatorios63,64,75,76.
En conclusión, la tecnología disponible actualmente nos permite la combinación de diferentes técnicas de monitorización hemodinámica que aportan una información o un enfoque distinto sobre el mismo problema y nos ayudan a evaluar de una manera más precisa las alteraciones de la contractilidad y la poscarga que pueden estar presentes en los pacientes críticos.
- 1.
No se recomienda la monitorización rutinaria y sistemática del GC en los pacientes con inestabilidad hemodinámica. (L1; B)
- 1.
Las medidas de precarga, como las presiones intravasculares (PVC o POAP), los volúmenes o las áreas, no permiten predecir con fiabilidad la respuesta al aporte de volumen (L1; B) aunque valores bajos de precarga (PVC, POAP<5mmHg) pueden asociarse a una respuesta positiva a la administración de volumen. (L2; C)
- 2.
La VVS o sus parámetros derivados (variación de presión de pulso, variación del flujo aórtico, variación del pico de velocidad del flujo aórtico, etc.) han demostrado ser buenos predictores de la respuesta a volumen en pacientes críticos en ventilación mecánica controlada, sin esfuerzos respiratorios espontáneos, con ritmo sinusal (L1; A). La variación respiratoria del diámetro de la vena cava inferior y el índice de colapsabilidad de la vena cava superior permiten predecir la respuesta al volumen en la misma población de pacientes. (L1; B)
- 3.
La maniobra de elevación pasiva de las piernas (medida mediante contorno de pulso, ecocardiografía o Doppler esofágico) identifica con gran fiabilidad a los pacientes que responden a la administración de fluidos. La capacidad predictiva de esta maniobra no se afecta en casos de fibrilación auricular, volúmenes corrientes bajos o respiración espontánea. (L1; B)
- 4.
En las situaciones clínicas en las que los parámetros predictores estáticos y dinámicos no puedan ser utilizados, se recomienda la realización de una prueba de administración de volumen (fluid challenge). (L1; C)
- 1.
La FEVI estimada por ecocardiografía, a pesar de su relativa dependencia de las condiciones de carga, es el parámetro fundamental de estimación de la contractilidad en la práctica clínica. (L1; C)
- 2.
Los parámetros obtenidos mediante el CAP (SW, resistencia vascular, GC y presiones de llenado, entre otros) y otros parámetros ecocardiográficos son útiles en la estimación de la contractilidad/poscarga a pie de cama. (L2; B)
- 3.
La información obtenida con los nuevos sistemas de monitorización y con la medición de los péptidos natriuréticos podría proporcionarnos una valoración de la contractilidad pero faltan estudios confirmatorios. (L2; C)
La monitorización hemodinámica pretende ser el soporte y la guía de todo el proceso de optimización del aporte de O2 a los tejidos, basándose en la premisa de que la detección, el conocimiento y la comprensión de las alteraciones fisiopatológicas de los procesos de la enfermedad crítica deberían traducirse en un mejor tratamiento y una mayor recuperación del paciente. Es importante incidir en que ningún sistema de monitorización hemodinámica puede mejorar el pronóstico por sí mismo. Las condiciones que deben cumplirse para que se obtenga un beneficio clínico son: 1) los datos obtenidos del sistema de monitorización deben ser lo suficientemente exactos para ser capaces de influir en la toma de decisiones terapéuticas, 2) los datos deben ser clínicamente relevantes para el paciente, y 3) el tratamiento instaurado, guiado por la interpretación de los datos obtenidos, debe repercutir favorablemente en el pronóstico del paciente.
Cabe puntualizar que, en el proceso de monitorización hemodinámica, podemos obtener variables de 2 categorías fundamentales: (a) las que podrán definirse como objetivos del proceso de reanimación y (b) las que consideraremos herramientas de evaluación hemodinámica, potencialmente útiles en la toma de decisiones. Las primeras serían las ya mencionadas previamente en estas recomendaciones, como la PAM, el lactato y las saturaciones venosas de oxígeno8. Ejemplo de las segundas serían todas las variables que exploran la dependencia de precarga, como la VPP y la VVS, y que también se analizan con mayor detalle en estas recomendaciones40. La combinación de estos 2 tipos de variables nos permite crear algoritmos o sistematizar la actuación en el proceso de reanimación hemodinámica, con la intención final de obtener una mayor y más rápida recuperación, como demostró Rivers en su protocolo de EGDT15. Finalmente, tal y como ocurre con todos los algoritmos, la buena comprensión de las bases fisiopatológicas que lo sustentan, así como las limitaciones e inconvenientes de las variables usadas, permitirá al clínico un mejor manejo del proceso de reanimación hemodinámica.
Monitorización básica inicialLa atención inicial al paciente en situación de shock comprende una anamnesis y una exploración física adecuadas, junto con la monitorización electrocardiográfica (frecuencia cardíaca y ECG) y pulsioximétrica (SpO2), no solo para orientar la posibilidad de existencia de la situación de insuficiencia cardiovascular, sino como complementos necesarios en el diagnóstico del cuadro clínico.
En cuanto a la monitorización hemodinámica básica inicial de un paciente con patología aguda potencialmente crítica, esta vendrá determinada por la propia definición de shock8. Así pues, será fundamental la medición de la PA y de, al menos, una variable que nos informe del estado de oxigenación global de los tejidos, como el láctico sérico o la SvcO2. La importancia de la monitorización de la PAM como indicador de la presión de perfusión de los tejidos ya se ha debatido ampliamente con anterioridad en otro apartado. Diversos trabajos han demostrado que el tiempo de hipotensión en las primeras horas de shock tiene un efecto acumulativo en el desarrollo de fracasos orgánicos9, lo que argumentaría la necesidad de una medición frecuente y precisa de la PA. Paralelamente, la medición de la PA mediante sistemas no invasivos pierde precisión en las situaciones de shock. Así pues, parecería razonable abogar por la medición invasiva y continua de la PA en el paciente crítico. De todas formas, la monitorización de la PA podría ser no invasiva en fases iniciales durante su estancia en planta de hospitalización o en urgencias.
La detección clínica de la situación de hipoperfusión tisular (con o sin hipotensión arterial) va a conllevar la necesidad de realizar intervenciones dirigidas a mejorar el DO2. En este proceso de reversión de la disoxia, o reanimación hemodinámica, el primer paso siempre comprende la necesidad de optimizar la volemia. Por todo ello, además de las mencionadas variables objetivo, será recomendable monitorizar de inicio algún parámetro de estimación de la dependencia de precarga que nos ayude a tomar decisiones en la resucitación inicial. Sin embargo, las posibilidades de las que disponemos en el momento inicial de la monitorización son limitadas, fundamentalmente si el paciente no está ingresado en una UCI. Además de una anamnesis y una exploración clínica que sugieran hipovolemia, la medición de la PVC mediante la inserción de un catéter venoso con extremo distal en la aurícula derecha o vena cava superior va a ser el principal parámetro que nos pueda aportar información sobre el estado de volemia a pesar de su limitado poder predictivo de la respuesta al aporte de volumen. Más que un parámetro específico sobre el estado de la volemia, o de dependencia de precarga, podríamos entender la PVC como un marcador de mínima volemia circulante. Así, valores extremadamente bajos de PVC probablemente se asocien a una volemia insuficiente, pero valores elevados de PVC son totalmente inespecíficos en la predicción de respuesta al aporte de volumen39. A pesar de todas sus limitaciones, en diferentes trabajos multicéntricos, una reposición inicial de volumen con unos límites de seguridad de PVC de 8mmHg (12mmHg en el caso de pacientes bajo ventilación mecánica), en el marco de un paquete de medidas o bundle, se ha asociado a mejoría en el pronóstico15,44. Además, si disponemos de un catéter arterial invasivo, podríamos utilizar la VPP como estimador de respuesta al aporte de volumen en pacientes ventilados mecánicamente y en ritmo sinusal.
La ecocardiografía tiene actualmente un papel relevante en el diagnóstico precoz y en el manejo terapéutico de los pacientes con inestabilidad hemodinámica como se comentará en el siguiente apartado de estas recomendaciones3,77.
Monitorización hemodinámica continua. ¿Cuándo y con qué?Generalmente, un manejo inicial adecuado basado en los datos obtenidos de la historia clínica, la exploración física y de una monitorización básica podría ser suficiente para la obtención de un desenlace favorable. Sin embargo, en algunos pacientes, a pesar de una resucitación inicial adecuada, podría producirse una situación de shock persistente o aparecer nuevas complicaciones relacionadas con el proceso inicial o con las intervenciones terapéuticas adoptadas. Como ya se había mencionado previamente en el apartado de estimación del GC, en aquellos pacientes con insuficiente respuesta a las medidas aplicadas durante las primeras 3-6h o en pacientes con fracasos orgánicos y/o comorbilidades susceptibles de interferir o empeorar durante la reanimación en los cuales podríamos precisar un mayor conocimiento de la fisiopatología del proceso, nos plantearemos un mayor grado de monitorización hemodinámica continua que nos permita optimizar nuestras intervenciones, cuantificar sus efectos y evitar complicaciones derivadas de los tratamientos aplicados1,2,21–23.
La monitorización hemodinámica continua debería proporcionarnos información acerca del GC y sus determinantes: precarga/dependencia de precarga, contractilidad y poscarga. Así pues, junto a la monitorización de las variables objetivo, ya sean la PAM y saturaciones venosas de O2 y/o el aclaramiento de lactato, un proceso de reanimación intensivo requerirá de las tecnologías que permitan evaluar de forma continua estos parámetros para conseguir su correcta adecuación. La monitorización de las variables objetivo seguirá siendo fundamental, puesto que son las que marcarán el final del proceso de reanimación. Será necesaria la medición de estas variables de forma repetida, después de las intervenciones terapéuticas, hasta su normalización mantenida en el tiempo.
Además de factores propios del paciente, en el momento de escoger qué sistema de monitorización vamos a utilizar, deberemos tener en cuenta otros factores, como son las tecnologías disponibles en nuestro centro, la experiencia del equipo con cada sistema, el lugar donde se va a llevar a cabo la monitorización y el proceso de reanimación (urgencias, UCI, quirófano, etc.) así como el coste-efectividad. El sistema de monitorización hemodinámica ideal debería ser simple, seguro, relativamente versátil, fácil de usar, operador-independiente, coste-efectivo, fiable, preciso y debería proporcionar variables relevantes que nos aporten información capaz de dirigir la terapia21,22. En la actualidad, ningún sistema disponible cumple todas estas condiciones. Unos principios que pueden ayudarnos a elegir el sistema de monitorización hemodinámica continua son los siguientes:
- -
La monitorización ha demostrado ser particularmente útil en las fases precoces de la reanimación hemodinámica y es menos útil cuando el fallo orgánico está establecido.
- -
Aunque es preferible un sistema menos invasivo, no siempre es posible debido a que en situaciones complejas necesitamos una información completa, precisa y fiable que no siempre proporcionan los sistemas menos invasivos.
- -
Los sistemas no invasivos podrían usarse en planta de hospitalización o servicios de urgencias para confirmar un diagnóstico preliminar, ver la evolución en pacientes de menos riesgo o para monitorización previa al ingreso en la UCI. Su uso no está recomendado, por el momento, para el paciente más crítico. En general, a mayor gravedad y complejidad del paciente, mayor necesidad de tratamiento intensivo y precisión en las medidas realizadas, premisas que van ligadas, en la actualidad, a mayor invasividad en los sistemas utilizados21.
- -
Es importante la monitorización de los cambios hemodinámicos en períodos cortos de tiempo (p. ej., administración de volumen o fármacos inotrópicos). Además, la monitorización continua de las variables hemodinámicas y la estimación del GC latido a latido puede ser de mayor utilidad1.
- -
El CAP puede ser útil para el manejo de condiciones circulatorias complejas en las que se considera de especial importancia el conocimiento de la PAP, POAP y parámetros de oxigenación tisular (p. ej., fallo derecho e izquierdo agudo, hipertensión pulmonar, weaning difícil, pacientes sometidos a cirugía cardíaca o pendientes de trasplante cardíaco)1,21,78
- -
Las técnicas de dilución transpulmonar que determinan los volúmenes intratorácicos y el agua extravascular pulmonar se pueden considerar de elección para guiar el manejo hemodinámico y la aplicación de ventilación mecánica en pacientes con lesión pulmonar aguda o síndrome de distrés respiratorio agudo. En estos casos, el CAP podría también ser utilizado2.
- -
Los sistemas que obtienen el GC mediante el análisis de la onda de pulso estarían indicados en el área quirúrgica, en situaciones de shock séptico o en otros escenarios clínicos sin complicaciones graves respiratorias. Los dispositivos sin calibración externa pierden fiabilidad si se producen alteraciones importantes del tono vascular2,21.
- 1.
Exploración física completa, incluyendo ECG y SpO2. (L1; C)
- 2.
Medición inicial y frecuente de la PA (preferiblemente de manera invasiva) en pacientes con un cuadro clínico sugestivo de insuficiencia cardiovascular. (L1; C)
- 3.
Medición inicial de un marcador metabólico de equilibrio DO2/VO2, fundamentalmente el lactato sérico. (L1; A)
- 4.
Medición repetida de un marcador metabólico de equilibrio DO2/VO2, lactato sérico o saturaciones venosas de O2, durante el proceso de resucitación. (L1; A)
- 5.
En el manejo inicial del shock, y en ausencia de otras variables de valoración de dependencia de precarga y/o GC, la monitorización de la PVC puede ser de utilidad en la toma de decisiones. (L1; B)
- 1.
Se recomienda la medición repetida de un marcador metabólico de equilibrio DO2/VO2, lactato sérico o saturaciones venosas de O2, durante el proceso de resucitación. (L1; A)
- 2.
Se recomienda la monitorización hemodinámica continua en los pacientes que persistan con signos de hipoperfusión tisular transcurridas las 3-6 primeras horas del inicio del tratamiento y/o en aquellos pacientes en los que se quiera profundizar en la fisiopatología del proceso. (L1; B)
- 3.
El CAP estaría indicado en situaciones complejas circulatorias en las que se considera de especial importancia el conocimiento de la PAP, POAP y parámetros de oxigenación tisular. (L1; C)
- 4.
Los sistemas no invasivos no están recomendados actualmente para monitorización hemodinámica de pacientes críticamente enfermos en la UCI. Estos dispositivos quedarían reservados para pacientes con menor gravedad y/o para aquellos pacientes ingresados en áreas de hospitalización o urgencias. (L2; C)
La ecocardiografía constituye una herramienta útil en la evaluación de la función cardiovascular del paciente crítico debido a que nos proporciona imágenes en tiempo real, a pie de cama y de una manera no invasiva (ETT) o mínimamente invasiva (ETE). La información obtenida por el examen ecocardiográfico es interpretada e inmediatamente integrada en la valoración global del paciente. La principal indicación de la ecocardiografía en UCI es el estudio de la función cardiocirculatoria en el shock puesto que nos permite obtener información acerca de su etiología y puede ser de gran utilidad como guía y monitorización del tratamiento instaurado3,77. Las últimas guías cardiológicas americanas sobre el uso de la ecocardiografía consideran que esta técnica tiene una indicación A (uso apropiado: el test es generalmente aceptable y es un procedimiento razonable para esa indicación) en situaciones de hipotensión o inestabilidad hemodinámica79. Además, las guías sobre el fallo cardíaco agudo y crónico recomiendan la ETT para la evaluación de la estructura y función cardíaca, realizar el diagnóstico, ayudar en la planificación y monitorización del tratamiento, así como para obtener información pronóstica (recomendación I C)73.
A pesar de que no existen estudios aleatorizados que analicen el impacto en el tratamiento y en el pronóstico de la ecocardiografía en el paciente crítico, varios estudios realizados en la UCI han encontrado que la información obtenida por ETE o ETT conduce a cambios en el manejo terapéutico y diagnóstico en el 30-60% de los pacientes80. Esta técnica permite además descartar anomalías estructurales como valvulopatías y la obstrucción al tracto de salida del ventrículo izquierdo que no pueden ser detectadas mediante otro tipo de monitorización hemodinámica. La mayoría de los pacientes críticos pueden ser estudiados satisfactoriamente con ETT como consecuencia de los avances tecnológicos aplicados para mejorar la calidad de los ultrasonidos (segundo armónico, adquisición digital, etc.). Sin embargo, la ETE es preferible en situaciones en las que puede existir dificultad para la adquisición de imágenes óptimas como pueden ser la aplicación de ventilación mecánica con presión positiva, la presencia de edemas y la obesidad entre otras. Además, la ETE debería considerarse de elección en las siguientes situaciones: disección aórtica, endocarditis, trombos intracavitarios, estudio de aorta torácica y de prótesis valvulares.
La incorporación creciente de la ecografía en la UCI ha provocado que numerosas sociedades nacionales de cuidados intensivos en todo el mundo estén impulsando el aprendizaje de esta técnica, proponiéndose, por un lado, una formación básica en ecocardiografía para todos los intensivistas dirigida a objetivos («goal-directed»), es decir, enfocada a resolver cuestiones específicas de la medicina crítica y, por otro, una formación avanzada que deberían lograr solo intensivistas con un interés específico en profundizar en el conocimiento de la ecocardiografía. Se han publicado las declaraciones conjuntas de las sociedades americana y francesa acerca de las competencias en ultrasonografía en UCI4. En estas recomendaciones se recogen las habilidades y competencias requeridas para los diferentes niveles de conocimiento en ecocardiografía y en otras técnicas de ultrasonidos en UCI como son la ecografía torácica, abdominal y vascular. Asimismo, la European Society of Intensive Care Medicine junto a representantes de otras sociedades han propuesto recientemente unos requerimientos de formación estándar en ecografía81.
En referencia al nivel básico, se enfatiza la necesidad de que el examen ecocardiográfico sea cualitativo, dinámico y dirigido a objetivos. Este debería incluir la evaluación básica de la función ventricular izquierda y del ventrículo derecho, así como la valoración del taponamiento cardíaco, la estimación de la respuesta a volumen y la regurgitación valvular masiva. La evaluación estaría dirigida a contestar un número limitado de cuestiones específicas de las situaciones de inestabilidad hemodinámica (¿la función del ventrículo izquierdo es normal?, ¿el ventrículo derecho está dilatado?, ¿cómo es la función del ventrículo derecho?, ¿existen signos ecocardiográficos de taponamiento cardíaco?, ¿hay signos de hipovolemia grave?, ¿existe una valvulopatía severa?). La información más completa y detallada formaría parte de un nivel avanzado de ecocardiografía. Las competencias de este nivel avanzado en la UCI hacen énfasis en el conocimiento específico de aspectos relacionados con la valoración hemodinámica del paciente crítico como son los índices de respuesta a volumen, las presiones de llenado, el GC, el impacto de la ventilación mecánica en la función del ventrículo derecho, etc.
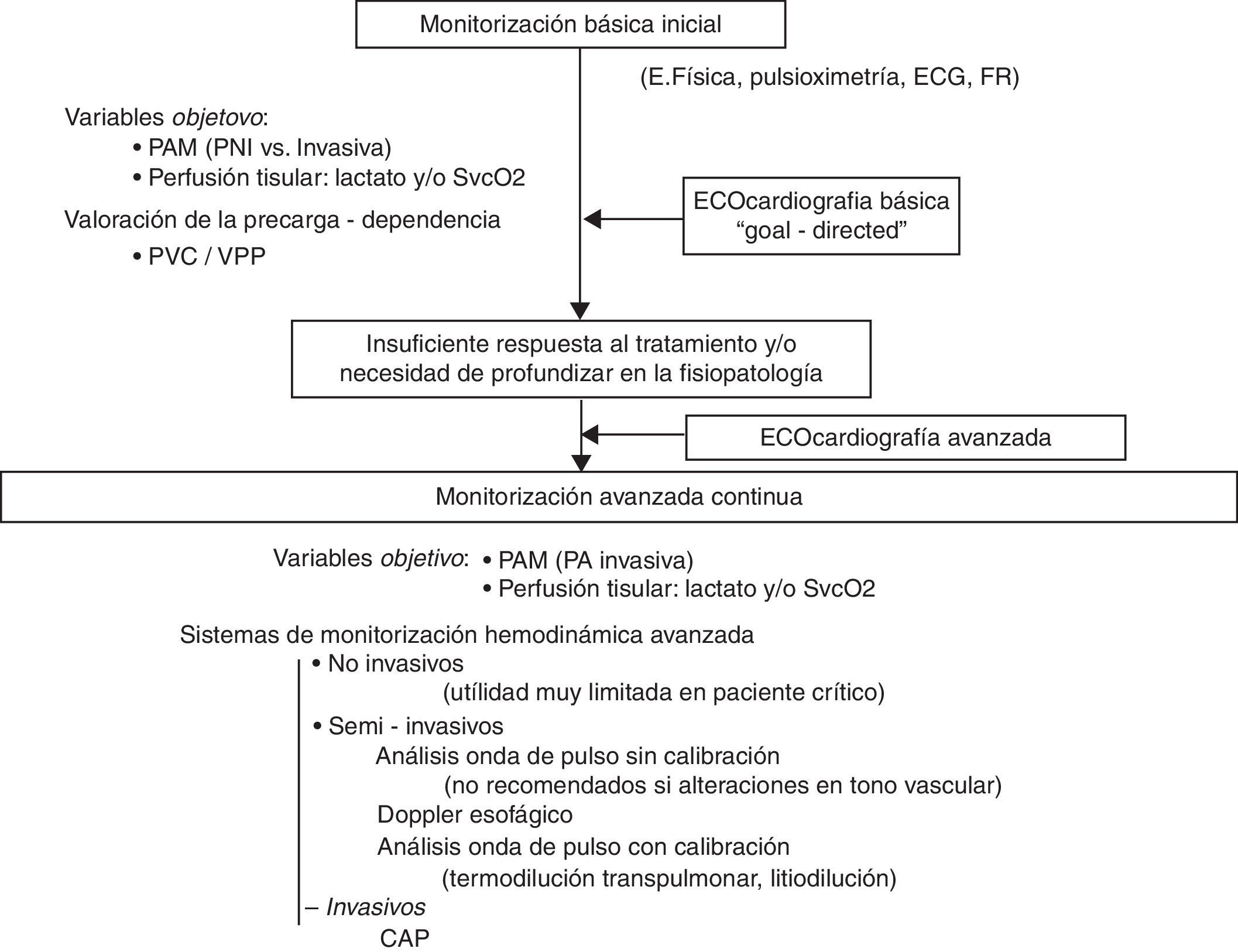
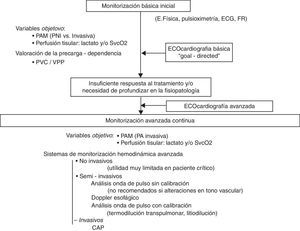
La ecocardiografía básica debería realizarse en la fase de valoración inicial del shock puesto que permite detectar de manera rápida los cuadros característicos causantes de shock: fallo ventricular izquierdo grave, fallo ventricular derecho generalmente secundario a tromboembolismo pulmonar, taponamiento cardíaco, insuficiencia valvular masiva e hipovolemia. En este momento de la evaluación, antes de instaurar cualquier terapéutica (medicamentosa o quirúrgica), la rentabilidad diagnóstica es máxima. Posteriormente, debería realizarse un examen ecocardiográfico más completo ante la presencia de una insuficiente respuesta terapéutica o si se necesita profundizar en la fisiopatología del proceso. Esta exploración más exhaustiva requiere un conocimiento de ecocardiografía avanzada que pueda garantizar una información fiable, detallada y más profunda sobre aspectos de función cardiovascular relevantes en el manejo hemodinámico del paciente crítico. La realización de exámenes ecocardiográficos, de manera discontinua pero repetida, contribuye a profundizar en la valoración hemodinámica, así como a evaluar y guiar el tratamiento. Por otro lado, la ultrasonografía general es también una herramienta muy útil en la valoración global del paciente en shock y puede ayudar a identificar un origen no cardiogénico del estado de inestabilidad hemodinámica. Evidentemente, la información obtenida por ecografía siempre debe ir ligada a otros elementos de la valoración clínica del paciente crítico como son la historia y el examen clínicos, las pruebas de imagen y de laboratorio así como la información obtenida con otros sistemas de monitorización hemodinámica (fig. 1)3,4,77.
- 1.
En la fase inicial de evaluación del shock, la ecocardiografía básica es una herramienta extremadamente útil para obtener información sobre su etiología y puede ser de gran ayuda como guía y monitorización del tratamiento instaurado. (L1; B)
- 2.
En las situaciones de shock en las que haya una insuficiente respuesta terapéutica o se necesite profundizar en la fisiopatología del proceso, debería realizarse una ecocardiografía de nivel avanzado. (L1; B)
Algoritmo de evaluación de la función cardiovascular y monitorización hemodinámica en las situaciones de shock.
CAP: catéter de arteria pulmonar; ECG: electrocardiograma; FR: frecuencia respiratoria; PA: presión arterial; PAM: presión arterial media; PNI: presión no invasiva; PVC: presión venosa central; SvcO2: saturación venosa central de oxígeno; VPP: variación de presión de pulso.
Como ya hemos apuntado previamente, la monitorización hemodinámica parte de la premisa de que la detección y el tratamiento de las alteraciones fisiopatológicas de los procesos de la enfermedad crítica deberían traducirse en un mejor pronóstico del paciente. A pesar de la lógica que se desprende de esta afirmación, el concepto «monitorización hemodinámica» ha estado sujeto a inacabables discusiones debido a la falta de trabajos que demuestren que la monitorización, per se, mejora el pronóstico de los pacientes. Dicho planteamiento podría ser equívoco, ya que el uso de determinadas variables, como las saturaciones venosas de oxígeno, en algoritmos de reanimación cardiovascular sí ha demostrado su impacto beneficioso sobre el pronóstico de diferentes patologías. El ejemplo más evidente lo encontramos en trabajos recientes en pacientes sépticos, como el de Rivers et al.15, en el que la reanimación guiada por objetivos hemodinámicos previamente definidos demostró un gran impacto sobre la supervivencia de estos pacientes.
Por otra parte, demostrar el valor pronóstico aislado de muchas variables hemodinámicas de las que disponemos va a resultar muy complejo. Este sería el caso, por ejemplo, de la VPP y/o del VVS como predictores de la respuesta a la administración de volumen en determinados pacientes. A pesar de su innegable sentido fisiológico, y de haber demostrado de forma concluyente su superioridad frente a las presiones de llenado cardíacas, la falta de trabajos aleatorizados demostrando específicamente que el uso aislado de una de estas variables dinámicas se asocia de forma directa a mejor pronóstico ha propiciado su exclusión de dichas variables en las diferentes recomendaciones y guías de manejo, manteniéndose sin embargo las ya mencionadas presiones de llenado cardíacas.
Por lo tanto, el impacto que la monitorización hemodinámica va a tener sobre nuestros pacientes no solo dependerá de la fiabilidad de los sistemas utilizados, sino también del conocimiento de sus limitaciones, así como de la comprensión de las bases fisiológicas e interpretación de las variables obtenidas. La correcta utilización de estas variables, ya sea como objetivo o como herramienta en la toma de decisiones, será en última instancia la que determine el impacto beneficioso sobre la evolución del paciente. El razonamiento sería, pues, que la monitorización hemodinámica solo se traducirá en una mejoría en el pronóstico cuando vaya asociada a un tratamiento que sí haya demostrado beneficio82.
Conflicto de interesesAna Ochagavía y Javier Maynar. Honorarios por conferencias, consultores (Pulsion) Ignacio Monge. Honorarios por conferencias, consultor (Edwards).