INTRODUCCIÓN
En los pacientes de la unidad de cuidados intensivos (UCI) es frecuente la aparición de fracaso renal agudo1. Éste forma parte con frecuencia del síndrome de disfunción multiorgánica (SDMO), por lo que suele asociarse a una elevada mortalidad2. En los últimos 20 años ha cambiado mucho el tratamiento de estos pacientes, desde que en 1977 Kramer3 describió la técnica de hemofiltración arteriovenosa continua y, posteriormente, Geronemous y Schneider4 describieron la hemodiafiltración arteriovenosa continua. En los años sucesivos, la técnica se ha ido perfeccionando5, especialmente con la aparición de la técnica venovenosa que incorpora un sistema de bomba que mantiene el flujo de sangre6. Esta técnica continua de sustitución renal (TCSR) se ha convertido en la terapia de elección, frente a la hemodiálisis intermitente, en el fracaso renal agudo de los pacientes críticos7, debido fundamentalmente a su buena tolerancia hemodinámica, pero también a otras ventajas, como la de facilitar el manejo de fluidoterapia, etc.8. Este procedimiento, independientemente de sus beneficios clínicos, está todavía sujeto a muchas controversias, como su utilidad en el tratamiento de la sepsis y el shock séptico9,10, o cuál es el volumen de ultrafiltración más adecuado11, pero ese tipo de consideraciones escapa al objetivo de este trabajo.
En este artículo queremos aportar nuestra experiencia en el uso de TCSR en pacientes críticos con fracaso renal agudo, analizando los factores de riesgo y la evolución, con especial incidencia en la supervivencia y en aquellos factores que pudieron influir en ella.
PACIENTES Y MÉTODOS
Pacientes
Se realizó un estudio retrospectivo, observacional y descriptivo sobre todos los pacientes críticos con fracaso renal agudo que necesitaron el uso de TCSR. Se consideraron todos los pacientes ingresados consecutivamente en la UCI de un hospital de nivel 2, en el período comprendido entre el 1-1-1996 y el 31-12-2000. Del total de pacientes ingresados, sólo se aplicaron TCSR en 73 casos. Fueron desestimados para la aplicación de TCSR aquellos pacientes con enfermedad neoplásica avanzada, en situación de shock refractario a dosis altas de fármacos vasoactivos o aquellos con una situación basal previa de muy mala calidad de vida evaluada por el índice de Katz12, pero dejando la decisión definitiva al médico encargado de la asistencia clínica directa del enfermo, salvo que éste pudiera decidir por sí mismo.
Métodos
Se consideró la existencia de fracaso renal agudo por la presencia de oliguria de menos de 400 ml en las 24 h anteriores, o bien se encontró un aumento de creatinina en plasma por encima de 2 mg/dl en pacientes con cifras previas normales. La insuficiencia renal crónica fue definida por la presencia de cifras de creatinina plasmática superiores a 2 mg/dl en determinaciones analíticas conocidas anteriores al ingreso. Los criterios de sepsis fueron los de Bone13, y el SDMO se definió según la conferencia de consenso americana publicada en 199214.
Se recogieron los datos demográficos, así como dos marcadores de gravedad al ingreso en UCI: el APACHE II15 y el SAPS II16. Los enfermos fueron tratados en una primera época con la técnica arteriovenosa (AV) y, posteriormente, una vez que se dispuso del material adecuado, el tratamiento se hizo con el sistema venovenoso (VV). Esos datos fueron recogidos junto con los días de uso de TCSR, el número de filtros utilizados y la media en horas de la duración de dichos filtros. Como factores de riesgo para el fracaso renal agudo se valoró el uso de ventilación mecánica invasiva (VM) y ventilación mecánica no invasiva (VMNI) previas al desarrollo del cuadro clínico, la presencia de sepsis, la presencia de hipotensión (definida como presión arterial sistólica menor de 90 mmHg, pese a la presencia de una fluidoterapia enérgica y/o necesidad de fármacos vasoactivos), el uso de aminoglucósidos y la existencia de insuficiencia renal crónica previa. Otros datos anteriores a la aplicación de la TCSR fueron los días de ingreso hospitalario previo al ingreso en UCI, los días de estancia en UCI sin necesidad de TCSR, los días desde la elevación de la creatinina plasmática por encima de 2 mg/dl hasta la iniciación de la técnica de sustitución, la diuresis residual (entendida como el volumen de orina en mililitros en las 8 h previas al procedimiento), y las cifras de urea y creatinina en plasma anteriores a la TCSR. Los datos evolutivos recogidos fueron los días de VM, los días de estancia en UCI, los días de estancia hospitalaria, el porcentaje de fallecimientos tanto en UCI como en el período hospitalario completo, y la mortalidad esperada según el índice SAPS II y el Standard Mortality Ratio (SMR), que compara ésta con la mortalidad encontrada16. Asimismo, se determinó el valor del SOFA (sepsis-related organ failure assessment) máximo como medidor de la gravedad del SDMO17 en el período previo a la técnica de sustitución y en el período posterior al inicio de ésta, que comprende el inicio de la técnica de depuración hasta el alta de UCI.
La TCSR, tanto AV como VV, se realizó utilizando filtros Multiflow 60 de HOSPAL® con membrana biocompatible AN69 con 0,6 m2 de área, mediante un dializador BSM-32 de HOSPAL®. Se utilizó Dialisán® (HOSPAL®) como líquido de diálisis. En todos los casos se utilizó la modalidad de hemodiafiltración continua. El flujo de líquido de diálisis inicial fue de 999 ml/h en todos los casos, si bien en 3 casos se llegó hasta 1.500 ml/h. Se utilizó heparina sódica en el circuito para mantener un tiempo parcial de tromboplastina activada de 2-3 veces el valor control. La reposición de volumen fue hecha con solución salina al 0,9% o con solución de Ringer lactato según el criterio del clínico encargado de cada caso. Éste también decidió el volumen de reposición basándose en la tolerancia hemodinámica y en las necesidades de fluidoterapia de cada paciente, así como en los controles analíticos de la función renal y el grado de hidratación.
En cuanto al análisis estadístico, las variables continuas se expresaron como media y desviación estándar (DE), y las variables categóricas como porcentajes. El análisis de la relación entre dos variables cualitativas se realizó mediante la prueba de la *2 o la prueba exacta de Fisher. La prueba de Kolmogorov-Smirnov fue utilizada para identificar variables con distribución normal. En este supuesto, se realizaba la comparación de medias usando la prueba de la t de Student para datos independientes, mientras que se aplicó el test de comparación de medias de datos apareados de cada paciente antes y después del tratamiento. Las variables sin variancia homogénea y distribución normal fueron comparadas mediante una prueba no paramétrica (Mann-Whitney). Para valorar las variables respecto al tiempo se utilizó el método de Kaplan-Meier y las comparaciones de las curvas mediante la prueba de rangos logarítmicos. Todos los análisis fueron bilaterales, y fueron considerados como significativos los valores de p ¾ 0,05. Por último, se realizó un análisis multivariante mediante regresión logística, para valorar los factores relacionados con la mortalidad. La mortalidad hospitalaria se consideró la variable dependiente, y las independientes fueron consideradas aquellas que presentaban un valor p ¾ 0,10 en el análisis univariante. Para el análisis estadístico se utilizó el paquete informático SPSS versión 10.0.
RESULTADOS
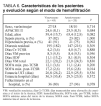
Un total de 73 pacientes con fracaso renal agudo en el seno del SDMO fueron tratados con TCSR. La edad media fue de 62 (15) años (17-79), siendo varones 45 pacientes (62%) y mujeres 28 (38%). El APACHE II al ingreso en UCI presentó una media de 24 (8) (3-49), y el SAPS II de 65 (16) (29-98). Del total de enfermos 37 (51%) eran médicos, 29 (40%) eran quirúrgicos y 7 (10%) eran traumatizados.
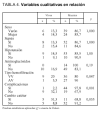
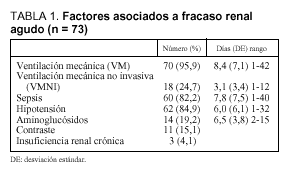
Entre los datos que analizamos como factores de riesgo para fracaso renal agudo, encontramos que 70 de los 73 pacientes estudiados habían precisado VM una media de 8,4 días antes de iniciar la TCSR, 60 (82%) fueron diagnosticados de sepsis, 62 (85%) sufrieron hipotensión que se mantuvo una media de 6 días (rango, 1-32), 14 (19%) fueron tratados con aminoglucósidos durante aproximadamente 6,5 (3,8) días (rango, 2-15 días), mientras que a 11 (15%) se les administró un contraste radiológico, y 3 pacientes (4%) padecían insuficiencia renal crónica (tabla 1).
Otras características de interés que estudiamos, previas a las TCSR, se resumen en la tabla 2. Destacan los días de estancia hospitalaria anteriores al ingreso en UCI, 7,2 (12,6); los días de ingreso en UCI hasta el momento de la aplicación de TCSR, 8,8 (8,0); los días en que se mantiene elevada la creatinina plasmática por encima de 2 mg/dl previamente a la aplicación de la técnica de sustitución renal, 4,1 (5,0); la diuresis residual (ml) en las 8 h previas a la técnica, 177 (196), y los valores medios de creatinina y urea plasmáticas, 2,7 (1,0) mg/dl y 157 (61) mg/dl, respectivamente.
La hemodiafiltración se realizó en una primera fase de forma AV en un total de 28 pacientes (38%) y, posteriormente, en la modalidad VV en 45 enfermos (62%). En el conjunto de todos ellos la TCSR se aplicó durante 9,9 (11,7) (1-49) días, utilizándose un número de filtros medio de 8,6 (11,9) (1-60), con una duración media en horas para cada filtro de 46 (30) (1-183). El flujo de sangre utilizado en la hemodiafiltración venovenosa continua fue de 120 ml/min. El volumen de ultrafiltrado obtenido medio fue de 230 ml/h, con una DE de 356 ml/h.
Respecto a la evolución de los pacientes, observamos una duración de la VM de 21,7 (21,7) (1-100) días, una estancia media en UCI de 25,3 (25,8) (2-136) días, una estancia hospitalaria de 33,5 (30,5) (2-166) y una mortalidad en UCI equivalente a la hospitalaria del 86%. La mortalidad esperada según el SAPS II fue del 77%. Ello nos da un SMR de 1,12. Estos datos evolutivos se especifican en la tabla 3.
Del análisis univariante para las variables cualitativas (tabla 4), destaca la presencia de complicaciones relacionadas con la técnica (p = 0,001), los cambios de catéter (p = 0,035) y el uso de la modalidad arteriovenosa frente a la venovenosa (p = 0,047) como relacionados con una mayor mortalidad. Así, la técnica AV presentó una mortalidad del 96%, mientras que la VV tuvo una mortalidad del 80%. En la figura 1 se comparan las complicaciones que aparecen entre los pacientes sometidos a la variedad AV frente a la VV, y pese a mayor número de complicaciones en el grupo AV, no hubo diferencia estadística (p = 0,28).
Figura 1. Complicaciones según tipo de TCSR (n = 73; *2 = 1,47; p = 0,22).
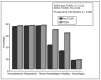
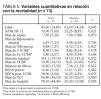
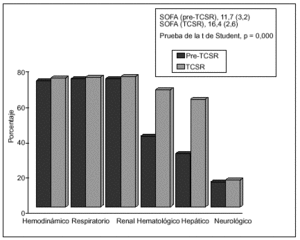
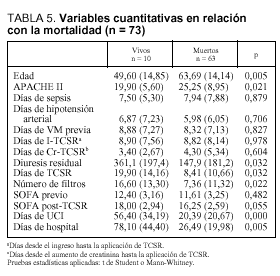
Por lo que respecta a las variables cuantitativas (tabla 5), se relacionan con mayor mortalidad tanto la mayor edad (p = 0,005) como el valor medio mayor del APACHE II (p = 0,021) y también la menor diuresis residual en las 8 h previas a la aplicación de la hemodiafiltración (p = 0,032). Dentro del grupo de variables cuantitativas se relacionaron con una mayor mortalidad, de forma estadísticamente significativa, un menor número de días con TCSR (p = 0,032), un menor número de filtros utilizados (p = 0,022), una menor duración de su estancia en UCI (p = 0,000) y una menor duración de su estancia hospitalaria (p = 0,005). Respecto al SOFA, medidor de la gravedad del SDMO, en la figura 2 observamos cómo es mayor en el período posterior al inicio de la TCSR, sobre todo a expensas de la valoración hepática y hematológica.
Figura 2. Desarrollo y gravedad del SDMO (n = 73). Porcentaje de pacientes con afección de los diferentes órganos según SOFA, antes y durante la TCSR.
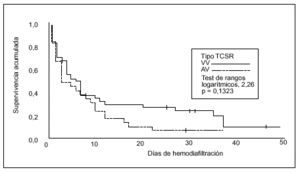
La supervivencia en el tiempo comparando ambas técnicas se expresa en la figura 3. En cuanto al análisis multivariante, el modelo de regresión logística sólo demostró una relación entre la mayor mortalidad y la aparición de complicaciones relacionadas con la técnica, con una odds ratio (OR) de 2,0 y un intervalo de confianza (IC) del 95% de 1,763-250,0 (p = 0,016). También en el modelo de regresión logística la diuresis residual se relacionó con una mayor supervivencia (OR = 0,995; IC del 95%, 0,990-0,999; p = 0,028).
Figura 3. Supervivencia según el tipo de técnica (n = 73).
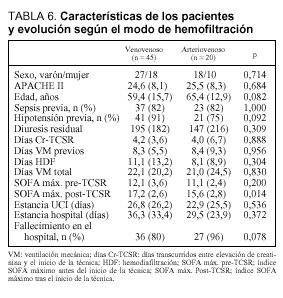
Los pacientes que fueron sometidos a una TCSR de tipo venovenoso eran similares a los que la recibieron de forma arteriovenosa (tabla 6). No había diferencias en el sexo (p = 0,714), el APACHE II (p = 0,684), la edad (p = 0,082), en la proporción de pacientes con antecedentes de sepsis (82% en ambos grupos) e hipotensión previa (91 y 75%, respectivamente). Además, la duración de la ventilacion mecánica previa al inicio de la técnica, los días transcurridos entre la elevación de la creatinina y el inicio de la depuración extrarrenal, así como el volumen residual, no difirieron de forma significativa. Aunque había una puntuación ligeramente mayor en el índice SOFA máximo que presentaban los pacientes antes de iniciar la técnica en el grupo venovenoso con respecto al arteriovenoso (12,1 fremte a 11,1; p = 0,200), ésta se hacía significativa tras instaurar la técnica (17,2 frente a 15,6; p = 0,014). Finalmente, ni la estancia en UCI (26,8 frente a 22,9 días) ni en hospital (36,3 frente a 29,5 días) difirieron de forma significativa.
DISCUSIÓN
El fracaso renal agudo en el paciente crítico siempre ha tenido una elevada mortalidad. En estas circunstancias el enfermo presenta habitualmente una gran inestabilidad hemodinámica. Hasta la aparición de estos métodos de tratamiento era muy difícil el tratamiento de este cuadro clínico. Tal vez, hoy día, nos enfrentamos a un tipo de enfermo que hace unos años simplemente era inviable. Basta analizar los marcadores de gravedad que hemos reseñado, con un APACHE II medio de 24 (8) y un SAPS II medio de 65 (16), para colegir que se trata de enfermos de mucha gravedad. En la serie incluimos una primera fase con utilización de la técnica AV, y una fase posterior con técnica VV, observando una mortalidad inferior en el segundo período que es significativa estadísticamente por análisis univariante pero no por análisis multivariante. Hay varias consideraciones que pueden explicar este punto. La primera es el hecho de que manejamos un grupo reducido de pacientes para observar diferencias en cuanto a la mortalidad, de forma que un grupo mayor debería demostrar esa diferencia si, tal como aparece publicado en la bibliografía médica, la técnica VV goza de mayores ventajas. Esa suposición se debe matizar considerando que la experiencia acumulada y la propia "curva de aprendizaje" nos han permitido obtener mejores resultados de la técnica con el paso del tiempo. Cuando aplicamos el método AV, los peores resultados pueden explicarse no sólo por el propio método sino también por una menor experiencia. En cualquier caso, la serie ofrece una mortalidad elevada18, con unas tasas superiores a las esperadas por SAPS II, con un SMR de 1,12. Nuestra interpretación es que, probablemente, este índice no refleja bien la mortalidad en enfermos muy graves. En nuestra experiencia clínica, la mortalidad en ausencia de TCSR sería en los enfermos que hemos valorado superior al 90%. De hecho, el SOFA, que nos mide la gravedad del SDMO, es muy elevado en los pacientes en el período previo a la aplicación de TCSR. Lo sorprendente es que este índice es aún más alto en el período posterior al inicio de TCSR. La elevación de esta escala se puede explicar por la aparición o el agravamiento de la trombopenia. La disminución del número de plaquetas se ha relacionado con el empleo de estas técnicas y con la administracion de heparina sódica, y también con la evolución del SDMO19. Además, el mantenimiento de la gravedad en el tiempo lleva asociado a un mayor riesgo de complicaciones como las que derivan en la elevación de la bilirrubina sérica.
En los estudios que se han hecho de forma prospectiva, investigando las variables que se relacionan con la mortalidad, destaca la heterogeneidad de los pacientes estudiados. No obstante, de ellos se desprenden una serie de variables que han sido rela cionadas con la mortalidad. Destacan: edad2,18,20, oliguria2,18,20,21, VM20,21 e hipotensión20,22. En nuestra serie, el análisis multivariante sólo demuestra una relación con la mortalidad, la presencia o no de complicaciones relacionadas con la técnica y la diuresis residual, de manera que ésta supone una mayor tendencia a la supervivencia. Estas consideraciones nos llevarían a plantear la conveniencia de una aplicación precoz de la técnica. Llama la atención que tanto la sepsis como la hipotensión o la VM no se relacionan con la mortalidad, probablemente por su alta incidencia. Otros factores, como la edad y el APACHE II, se relacionan con la mortalidad hospitalaria en el análisis univariante pero no en el multivariante. Por último, hay una serie de variables, como el tiempo de mantenimiento en situación de hemodiafiltración continua, el número de filtros utilizados y el tiempo de estancia en UCI y en el hospital, que se relacionan de forma estadísticamente significativa con la mortalidad (en el análisis univariante). Todos estos factores indican un mayor tiempo de estancia en los enfermos que sobreviven, que podría interpretarse como que aquellos que no responden lo hacen precozmente, y aquellos que sí responden necesitan un tiempo prolongado para la recuperación de la necrosis tubular aguda.
La realización de las TCSR puede llevarse a cabo mediante la utilización de la presión arterial del paciente, cateterizando una vía arterial o, por el contrario, pueden usarse máquinas que utilicen un mecanismo extractor de sangre, a través de un catéter en una vena de grueso calibre. Obviamente esta última modalidad, con un control de la extracción sanguínea más preciso y una mejor monitorización del tratamiento, debería ir acompañada de una mejoría en la evolución final de los pacientes. En nuestra casuística, sin embargo, siendo ambos grupos de pacientes similares, no se observaron diferencias significativas en la estancia ni en la mortalidad, aunque esta tendió a disminuir en los pacientes con técnica venovenosa. Esta ausencia de beneficio podría explicarse por el pequeño tamaño de la muestra.
Teniendo en cuenta las limitaciones del estudio, sobre todo en razón del reducido número de pacientes recogidos, hemos querido transmitir nuestra experiencia sobre el tema. Creemos que estas TCSR son útiles en enfermos críticos con SDMO que hace unos pocos años eran prácticamente intratables sin el aporte de estos métodos. Es indudable que la mortalidad sigue siendo muy alta, pero la experiencia acumulada y el avance técnico probablemente permitirán una mejoría en los resultados. Dicha experiencia posiblemente nos servirá para ajustar mejor los factores pronósticos. En nuestra serie la ausencia de complicaciones relacionadas con la técnica y el mantenimiento de una diuresis residual suponen un mejor pronóstico, pero es posible que otros factores deban ser considerados, con un tamaño de muestra más numeroso.