El pronóstico de los pacientes con valvulopatías empeora gravemente cuando éstas comienzan a ser sintomáticas: la presencia de síncope, angina o insuficiencia cardíaca en pacientes con estenosis aórtica supone una supervivencia media menor de dos o tres años, la presencia de angina o insuficiencia cardíaca conlleva una mortalidad mayor del 10%-20% al año en pacientes con insuficiencia aórtica; y la presencia de síntomas de insuficiencia cardíaca en pacientes con estenosis o insuficiencia mitral, se asocia con una supervivencia media menor de tres años 1 . Afortunadamente, la sustitución valvular ha supuesto un aumento significativo de la supervivencia y una mejoría de la capacidad de esfuerzo 2 . En series de casos de principios de los años 90 se observaron supervivencias a 11 años de 38%-43%, similares para los portadores de prótesis biológicas y mecánicas 3 .
Sin embargo, la incidencia de complicaciones de las válvulas cardíacas protésicas se sitúa globalmente en torno al 3%-5% paciente-año, y pueden ser de muy diversos tipos:
1) Fallos estructurales con fugas periprotésicas presentes en el 18-48 % de pacientes 4,5 , que aun siendo mayoritariamente de carácter leve, pueden presentarse como insuficiencia valvular grave, y son más frecuentes en las prótesis biológicas 3 .
2) Obstrucción valvular, fundamentalmente por trombo, oscilando la incidencia anual de trombosis protésica entre un 0,1% y 5,7%, y resultando más frecuente en el caso de válvula mitral y anticoagulación subterapéutica 6 .
3) Embolización sistémica, con una tasa anual de eventos cerebrovasculares del 0,7%-1% en pacientes anticoagulados, del 2,2% en pacientes antiagregados con aspirina, y un 4% en pacientes sin tratamiento 7 .
4) Episodios de sangrado en relación al uso de anticoagulación oral, cuya necesidad es mayor en las prótesis mecánicas por ser más trombogénicas 3 .
5) Endocarditis, que es más frecuente en prótesis en posición mitral y se asocia con una elevada mortalidad sobre todo si aparece en los primeros 60 días tras la intervención 8 .
6) Hemólisis significativa o anemia hemolítica.
OBSERVACIÓN CLÍNICAHombre de 64 años con una doble lesión mitral e insuficiencia aórtica de origen reumático, al que se le había implantado una prótesis mitral biológica 14 años antes. En dos ecocardiografías realizadas en los últimos dos años se encontraron los siguientes hallazgos: prótesis mitral con cambios degenerativos, área valvular 1,8 cm 2 sin regurgitación, regurgitación y estenosis aórticas moderadas (gradiente máximo 67 mmHg), buena función ventricular izquierda sin dilatación, diámetro de aurícula izquierda 47 mm, ausencia de signos de hipertensión pulmonar. El paciente recibía tratamiento con acenocumarol.
El paciente ingresó en nuestro hospital al referir hematuria con expulsión de coágulos en los últimos 10 días. A la exploración presentaba subictericia conjuntival. La analítica de sangre y orina mostró los siguientes resultados (valores normales entre paréntesis): hematocrito 30%, reticulocitos 31,4% (0,5-3), esquistocitosis 23%, haptoglobina 10 mg/dl (50-220), hemoglobina libre en plasma 102 mg/dl (1-5), hemoglobina libre en orina 65,5 mg/dl, bilirrubina 2,67 mg/dl (0,3-1), LDH 17.872 UI/l (200450). Un escrutinio inicial de anticuerpos irregulares fue negativo, y los escrutinios posteriores resultaron positivos para un anticuerpo frío (anti I). La prueba de antiglobulina (Coombs) directa fue negativa. La cistoscopia mostró una pequeña neoformación en la cúpula vesical que fue extirpada mediante resección transuretral el día 24 desde su ingreso, resultando ser un carcinoma papilar grado I. Ante la persistencia de la hematuria se realizó una nueva cistoscopia que no mostró alteraciones. También se descartó una hematuria de origen glomerular y se realizó una tomografía axial computarizada de tórax, abdomen y pelvis sin que se encontraran hallazgos patológicos.
Ante la sospecha de anemia hemolítica autoinmune se inició tratamiento con prednisona (60 mg/día) transcurridos 29 días desde el ingreso en el hospital. Se produjeron durante estos días varios episodios de angor coincidiendo con hipotensión arterial, sin alteración de marcadores de necrosis miocárdica, lesión subendocárdica inferolateral y fibrilación auricular en el electrocardiograma (ECG), que cedieron con tratamiento médico. También se observaron signos de insuficiencia cardíaca ligera.
En el día 57 de evolución, una prueba de antiglobulina directa resultó positiva para IgG+C3d con aloanticuerpo anti Fab, así como el escrutinio de anticuerpos irregulares para anticuerpos fríos. Puesto que esto parecía apoyar el diagnóstico de anemia hemolítica autoinmune, se añadió al tratamiento inmunoglobulinas (30 g/día durante 5 días) el día 59 sin obtenerse mejoría clínica en los siguientes días. El aspirado y la biopsia de médula ósea realizados el día 62 mostraron una hiperplasia eritroblástica secundaria a la anemia hemolítica con componente microangiopático. Se decidió hacer plasmaféresis y el paciente ingresó en la Unidad de Cuidados Intensivos (UCI) para vigilancia hemodinámica el día 71 de su ingreso hospitalario.
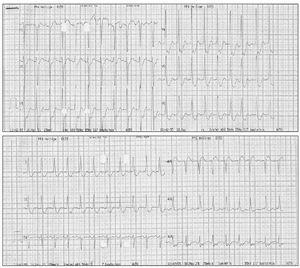
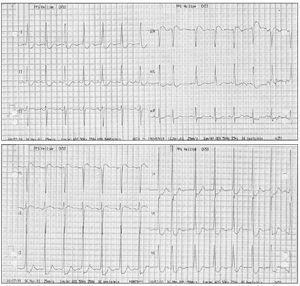
En los primeros minutos de la sesión de plasmaféresis se produjo hipotensión arterial y reapareció la angina, mostrando el ECG una gran lesión subendocárdica en la cara anterior (fig. 1). La angina desapareció tras finalizar la técnica y administrar meperidina, pero ante la persistencia de la hipotensión arterial se inició infusión de dopamina y dobutamina reapareciendo la angina con taquicardia sinusal. Al interrumpir las catecolaminas y expandir la volemia, la angina cedió y descendió la lesión subendocárdica (fig. 2). No se realizaron posteriores sesiones de plasmaféresis dada la mala tolerancia clínica. La ecocardiografía transtorácica mostró una prótesis biológica mitral no obstructiva con regurgitación grave periprotésica, aurícula izquierda dilatada (48 mm diámetro), válvula aórtica degenerativa calcificada con estenosis grave (gradiente 96/67 mmHg) y regurgitación grave (9 mm anchura del jet ), ventrículo izquierdo hipertrófico no dilatado con buena función sistólica, insuficiencia tricúspide ligera.
Las determinaciones posteriores de antiglobulina directa resultaron negativas. A lo largo de su estancia hospitalaria se transfundieron 24 unidades de concentrados de hematíes.
La progresión de la valvulopatía aórtica y la aparición de insuficiencia grave de la prótesis mitral se consideraron una indicación quirúrgica intrínseca, independientemente de su contribución al proceso hemolítico. El cateterismo cardíaco no mostró lesiones coronarias significativas. Finalmente se intervino el día 99 retirándose la válvula mitral protésica estenótica y la válvula aórtica nativa e implantándose una prótesis St Jude Medical 25 y otra Omnicarbon 21 respectivamente. La evolución posterior del enfermo fue favorable, desapareciendo la hematuria definitivamente pocas horas tras la intervención. La insuficiencia cardíaca mejoró progresivamente, en el ECG desapareció la lesión subendocárdica y el paciente pudo ser dado de alta a su domicilio tras 113 días de ingreso hospitalario.
DISCUSIÓNLa destrucción anormal de hematíes puede deberse a dos mecanismos:
Figura 1. Electrocardiograma durante la plasmaféresis, con mucha mayor lesión subepicárdica, coincidiendo con angor .
1) Defectos intrínsecos de los hematíes que los vuelve frágiles, como pueden ser defectos enzimáticos, alteraciones en la función de la membrana celular, o presencia de hemoglobinas anormales (anemia hemolítica intracorpuscular).
2) Hematíes normales que son destruidos por alteraciones extrínsecas a ellos, como pueden ser agentes tóxicos, factores mecánicos, anticuerpos que se unen a antígenos eritrocíticos y los destruyen,o secuestro de hematíes en el bazo (anemia hemolítica extracorpuscular) 9 .
Los hematíes se pueden destruir dentro de los vasos sanguíneos o fuera de ellos en las células del sistema reticuloendotelial. La hemólisis intravascular libera la hemoglobina eritrocitaria que se une con la haptoglobina sintetizada por los hepatocitos. En una hemólisis intensa la liberación de hemoglobina excede la capacidad de síntesis hepática de haptoglobina, de modo que los valores de haptoglobina libre en plasma disminuyen. El remanente de hemoglobina liberado, no unido a haptoglobina, queda libre en el plasma; y parte de aquella se excreta con la orina dando positiva la prueba de sangre en orina, con la particularidad de que hay hemoglobina en orina pero no se ven hematíes en el sedimento. Si la hemoglobinuria es intensa, la orina aparecerá coloreada de rojo, marrón o negruzco. Otra parte de la hemoglobina filtrada es captada por las células tubulares y metabolizada a hemosiderina y ferritina. Estas células se descaman y se eliminan con la orina y se aprecian en el sedimento coloreándolo con el azul de Prusia que tiñe el pigmento férrico. Los hematíes poseen gran cantidad de lacticodeshidrogenasa (LDH) en el citoplasma y cuando son destruidos masivamente, liberan la enzima, lo que eleva sus valores en el plasma 9,10 .
En la hemólisis extravascular los hematíes anormales son secuestrados en los capilares sinusoides del bazo e hígado y fagocitados por los macrófagos donde se los destruye. En este tipo de hemólisis, la haptoglobina y la LDH son normales o sus valores están levemente alterados. El hem liberado de la hemoglobina en el macrófago es catabolizado a bilirrubina (predominantemente indirecta).
Figura 2. Electrocardiograma al finalizar la plasmaféresis que era similar a los registros obtenidos en situación basal.
Cualquiera que sea el sitio de hemólisis, la anemia estimula la secreción de eritropoyetina y se produce hiperfunción eritropoyética que se traduce en un aumento de la liberación de reticulocitos a la sangre circulante con la consiguiente reticulocitosis.
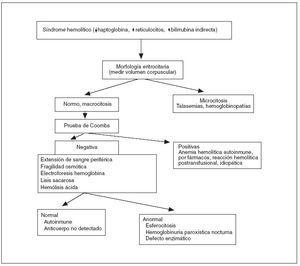
La realización de la prueba de Coombs y de una extensión de sangre periférica son la base del diagnóstico diferencial de la anemia hemolítica 10 (fig. 3). En las anemias hemolíticas autoinmunes la destrucción celular ocurre por la producción de anticuerpos que se unen a la membrana del hematíe con activación del complemento, que la dañan llevando a su ruptura con liberación del contenido celular. Dichos anticuerpos pueden ser investigados por la prueba de Coombs. En la reacción directa se buscan anticuerpos adheridos a los hematíes, en la reacción indirecta se buscan anticuerpos en el plasma sanguíneo del paciente, no adheridos a los eritrocitos. La creación de anticuerpos antieritrocitarios puede suceder en enfermedades autoinmunes como el lupus eritematoso diseminado, neoplasias, infecciones, y uso de determinadas drogas. La prueba de la antiglobulina directa (Coombs directo) tiene sus limitaciones 11 . Se han descrito falsos negativos por varias causas (lavado inadecuado de los eritrocitos, lectura diferida de la prueba, interpretación negativa en las pruebas débilmente positivas, centrifugación o concentración inadecuadas de eritrocitos, etc.), así como falsos positivos: fármacos (penicilina, ampicilina, cefalosporinas, captopril, insulina, indometacina, levodopa, quinidina, etc.), aglutinación de los hematíes antes del lavado y adición al suero de antiglobulina humana, excesiva centrifugación, contaminantes presentes en los tubos de vidrio, presencia de crioaglutininas activadoras del complemento de aparición natural, fijación del complemento a las células extraídas de líneas de infusión gruesas usadas para administrar dextrosa, eritrocitos extraídos en tubos que contienen gel de silicona pueden tener fijación del complemento espuria. Incluso en algunos pacientes con hemólisis de origen cardíaco se ha encontrado un Coombs directo falsamente positivo de origen desconocido 9 .
Figura 3. Algoritmo de diagnóstico de la anemia hemolítica.
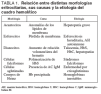
TABLA 1. Relación entre distintas morfologías eritrocitarias, sus causas y la etiología del cuadro hemolítico
La extensión de sangre periférica informa sobre la morfología eritrocitaria que en muchas ocasiones es diagnóstica del proceso causante de la hemólisis(tabla 1). En las anemias hemolíticas mecánicas existe alteración de los vasos sanguíneos pequeños o presencia de una prótesis valvular cardíaca o vascular. La característica de este tipo de anemia hemolíticas microangiopáticas como consecuencia de la formación de múltiples microtrombos que crean irregularidad y anfractuosidades en los vasos contra las que chocan los hematíes. Esto último es lo que ocurre en la coagulación intravascular diseminada, en la púrpura trombocitopénica trombótica y en presencia de determinadas neoplasias 12 .
El caso que exponemos presentaba, desde el momento del ingreso en el hospital, signos de anemia hemolítica vascular (disminución de la haptoglobina, aumento de la hemoglobina libre en sangre y en orina, aumento de la LDH) de probable origen mecánico (presencia de esquistocitosis y antecedente de prótesis valvular). Sin embargo, al poco tiempo del ingreso se diagnosticó una patología tumoral que, como ya se ha indicado anteriormente, podría ser causa de la anemia hemolítica; posteriormente, la positividad de una prueba de Coombs apuntó hacia un probable origen autoinmune. El hecho de que el cuadro de anemia hemolítica persistiera a pesar de la extirpación del tumor, el tratamiento con corticoides, inmunoglobulinas o plasmaféresis y, sin embargo, se resolviera tras la corrección de la valvulopatía, permitió el diagnóstico ex juvantibus de anemia hemolítica secundaria a fuga paravalvular de la prótesis mitral. Aunque el retraso en el diagnóstico adecuado pudo ser debido al diagnóstico del tumor y a la positividad de la prueba de Coombs, ante una anemia hemolítica en un paciente portador de prótesis valvular cardíaca, hay que realizar un ecocardiograma para descartar fuga paravalvular, y en el caso que presentamos esta prueba no se realizó en una fase precoz del cuadro clínico.
En series grandes se ha documentado una incidencia apreciable de hemólisis subclínica: 26% de pacientes con prótesis mecánica y 5% con prótesis biológica 13 . En cambio, la hemólisis sintomática asociada a prótesis válvular es menos frecuente, entre el 5% y 15% y se encuentran en la literatura pequeñas series de casos clínicos 14,15 . Ante la presencia de hemólisis fulminante tras reemplazo de válvula mitral se debe sospechar fuga periprotésica. Pequeñas regurgitaciones pueden producir hemólisis importantes 16 . Se han descrito con ecocardiografía Doppler alteraciones del flujo regurgitante mitral que producen hemólisis clínica 17-19 : aceleración rápida (paso a través de dehiscencia paraanular de pequeño diámetro), jets de fragmentación (cuerdas tendinosas rotas, material de sutura desprendido) y de colisión. La deceleración lenta y los jets libres no se asocian a hemólisis importante. Un jet de origen central produce anemia hemolítica menos frecuentemente que uno lateral o paraanular. También se ha relacionado la presencia de hemólisis con mayores puntuaciones electrocardiográficas de hipertrofia ventricular izquierda, con la velocidad máxima de eyección y llenado, y con un estadio funcional para la disnea más avanzado, y de forma inversa con la fracción de eyección 20 .
La hemólisis es más frecuente en pacientes con prótesis mecánicas 15 , prótesis con válvulas bidisco (bileaflet) y de tipo bola-jaula (ball-cage) , con prótesis mitrales, y con dos prótesis, mitral y aórtica.
Hay casos de anemia hemolítica en pacientes con bioprótesis que en ausencia de otras causas evidentes pueden explicarse por disfunción protésica. Incluso hay casos de hemólisis grave con curación tras colocación de nuevas prótesis pero sin demostrarse fuga paravalvular ni disfunción protésica. Todo ello ilustra la complejidad del problema en ocasiones.
El recambio protésico está indicado cuando existe una hemólisis enérgica por fuga perivalvular. Otros tratamientos alternativos útiles en hemólisis leves-moderadas son la eritropoyetina (reduce el consumo de hematíes y produce cierta regresión de la hemocromatosis por la hemólisis mantenida) 21 y la reducción de la postcarga con inhibidores de la enzima conversora de la angiotensina y bloqueadores beta.
AGRADECIMIENTOSLos autores de esta Nota clínica queremos agradecer al doctor Juan Bonastre Mora, jefe de sección de la UCI del Hospital La Fe, su ayuda en la revisión del manuscrito.
Correspondencia: M.A. García García . Avda. Dr. Peset Aleixandre, 81, puerta 21. 46009 Valencia. Correo electrónico: mangelymangeles@terra.es
Manuscrito aceptado el 26-V-2004.