Editado por: Federico Gordo - Medicina Intensiva del Hospital Universitario del Henares (Coslada-Madrid)
Última actualización: Octubre 2023
Más datosEl rápido incremento en las resistencias a los antibióticos entre los bacilos gram negativos (BGN), especialmente en cepas de enterobacterias, P. aeruginosa y A. baumannii, con elevados patrones de resistencia, plantea una enorme amenaza para los sistemas de salud en todo el mundo.
En la última década diferentes antibióticos han sido desarrollados contra patrones de resistencia, algunos de los cuales combinan un β-lactámico junto con un inhibidor de β-lactamasa, mientras que otros utilizan inhibidores no β-lactámicos. La mayoría de ellos presenta una adecuada actividad in vitro sobre varias β-lactamasas de clase A, C y D de Ambler. Sin embargo, combinaciones como ceftazidime/avibactam, ceftolozano/tazobactam y meropenem/vaborbactam no presentan actividad contra metalo-β-lactamasas. Nuevas combinaciones como aztreonan/AVI, cefepime/zidebactam, o modernas cefalosporinas como cefiderocol, presentan eficacia contra casi la totalidad de las metalo-β-lactamasas. Aunque algunas de estas combinaciones ya están aprobadas y en fase de comercialización, muchas de ellas aún deben definir su lugar dentro del tratamiento de microorganismos con resistencia elevada a través de estudios clínicos.
The rapid increase in antibiotic (ATB) resistance among Gram-negative bacilli(BGN), especially in strains of Enterobacteriaceae, Pseudomonas aeruginosa, and Acinetobacter baumannii, with high resistance patterns (XDR), poses a huge threat to health systems worldwide.
In the last decade, different ATBs have been developed against XDR, some of which combine a lactam β along with a β-lactamase inhibitor, while others use non-β-lactam inhibitors. Most of them have adequate “in vitro” activity on several β-lactamases of class A, C and D of Ambler. However, combinations such as Ceftazidime/avibactam, Ceftolozane/Tazobactam and Meropenem/vaborbactam have no activity against metallo-β-lactamases(MβL). New combinations such as Aztreonan/AVI, Cefepime/Zidebactam, or new cephalosporins such as Cefiderocol, have efficacy against MβL enzymes. Although some of these combinations are already approved and in the commercialization phase, many of them have yet to define their place within the treatment of microorganisms with high resistance through clinical studies.
La resistencia antimicrobiana es una realidad, y una constante preocupación para los profesionales sanitarios ante la falta de disponibilidad de nuevas moléculas para el tratamiento de microorganismos con elevada resistencia1–3. Este problema se ha visto potenciado por la virulenta pandemia causada por el síndrome respiratorio grave agudo por el coronavirus tipo 2, que ha dado lugar a la COVID-19, la cual ha generado, hasta el momento de escribir esta revisión, más de 350 millones de contagios, con algo más de 5 millones de fallecidos en todo el mundo. Esta situación no solo ha creado una crisis del sistema sanitario mundial, sino que ha condicionado un incremento incontrolado de las superinfecciones en los pacientes con COVID-19, con un elevado y posible sobreuso de antibióticos (ATB). Según datos del registro ENVIN-HELICS (https://hws.vhebron.net/envin-helics/) la densidad de incidencia de neumonía asociada a la ventilación mecánica (NAV) se incrementó desde algo más de 5 episodios/1.000 días de ventilación mecánica (VM) en 2019 hasta 11,5 episodios/1.000 días de VM durante la pandemia (2020) y el uso de ATB en pacientes ingresados en unidades de cuidados intensivos (UCI) creció desde un 61% (2019) hasta más del 90% durante la pandemia (2020). Paralelamente, el aislamiento de bacilos gram negativos (BGN) multirresistentes se incrementó algo más del 40% en general, pero si se consideran los BGN con carbapenemasa positiva la incidencia observada se duplicó respecto del 2019 desde el 0,8% hasta el 1,66% en general y, especialmente, se triplicó la adquisición de estos dentro de la UCI, desde 0,35% hasta 1,33% en 2020.
Aunque la definición de resistencia bacteriana se ha modificado en los últimos años podemos considerar que se definen 3 tipos de resistencia microbiana: 1) multirresistencia (multidrug-resistant [MDR]), definida como resistencia al menos a un agente en 3 o más familias de ATB; 2) resistencia extendida (extensive drugs resistance [XDR]), definida como resistencia a por lo menos un ATB en todas las familias, excepto en una o 2 de ellas; y 3) resistencia global (pan-drugs resistance [PDR]), definida como la resistencia a todos los ATB. Recientemente se ha reconocido una nueva categoría denominada microorganismos de difícil tratamiento (difficult-to-treat resistance DTR), definida como elevada resistencia a ATB de primera línea de tratamiento4,5. De forma independiente a las cuestiones semánticas, las infecciones causadas por microorganismos resistentes se asocian a una disminución en la calidad de vida, a un incremento en los costes en salud, a la necesidad de utilizar ATB más costosos o reutilizar «viejos» ATB con un elevado perfil de toxicidad y, evidentemente, a una mayor mortalidad6,7.
Para complicar aún más el panorama los programas de desarrollo de nuevos agentes ATB están condicionados por un fuerte desincentivo para las empresas, ya que el retorno de la inversión en el desarrollo de ATB es sensiblemente menor respecto de otros medicamentos para enfermedades crónicas o el cáncer8,9. Si se considera la mortalidad observada y el impacto económico relacionado con el tratamiento, el grupo de microorganismos denominados «ES[KC]APE» (E: Enterococcus faecium, S: Staphylococcus aureus o también Stenotrophomonas maltophilia, K: Klebsiella pneumoniae o recientemente C: Clostridioides difficile, A: Acinetobacter baumannii, P: Pseudomonas aeruginosa, E: Enterobacter spp., o recientemente Enterobacteriaceae) representan el desafío clínico más importante en la actualidad10,11. Para contrarrestar este escenario adverso la Federación Europea de Industrias y Asociaciones Farmacéuticas se asoció con la Unión Europea para establecer la mayor asociación público-privada para el desarrollo de la iniciativa de medicamentos innovadores bajo el programa «Nuevos medicamentos para bichos malos» (New Drugs for Bad Bugs), el cual fomenta desde el desarrollo de nuevos antibióticos y la investigación clínica, hasta la remodelación del uso de antibióticos, con la esperanza de catalizar la aprobación de nuevos antibióticos12.
El objetivo de esta revisión es conocer aspectos de interés clínico de los nuevos ATB y sus combinaciones para el tratamiento de BGN resistentes. Para ello, se ha realizado una búsqueda en Pubmed/Medline desde 2012-2021 con las palabras clave: intensive care, critical care, nosocomial pneumonia, hospital acquired pneumonia, healthcare associated/acquired pneumonia, ventilator acquired pneumonia, en combinación con novel antibiotics/antimicrobials, ceftazidime/avibactam, ceftolozane/tazobactam, imipenem/relebactam, meropenem/vaborbactam, cefepime/zidebactam, aztreonem/avibactam, cefiderocol. La revisión incluye los resultados de estudios aleatorizados, metaanálisis, estudios observacionales de calidad, revisiones sistemáticas o narrativas, guías internacionales y opiniones de expertos. Debido a la extensión limitada de esta revisión no pueden ser incluidos todos los ATB en desarrollo, y se han elegido aquellos comercializados o próximos a su aprobación y con especial indicación en la infección respiratoria.
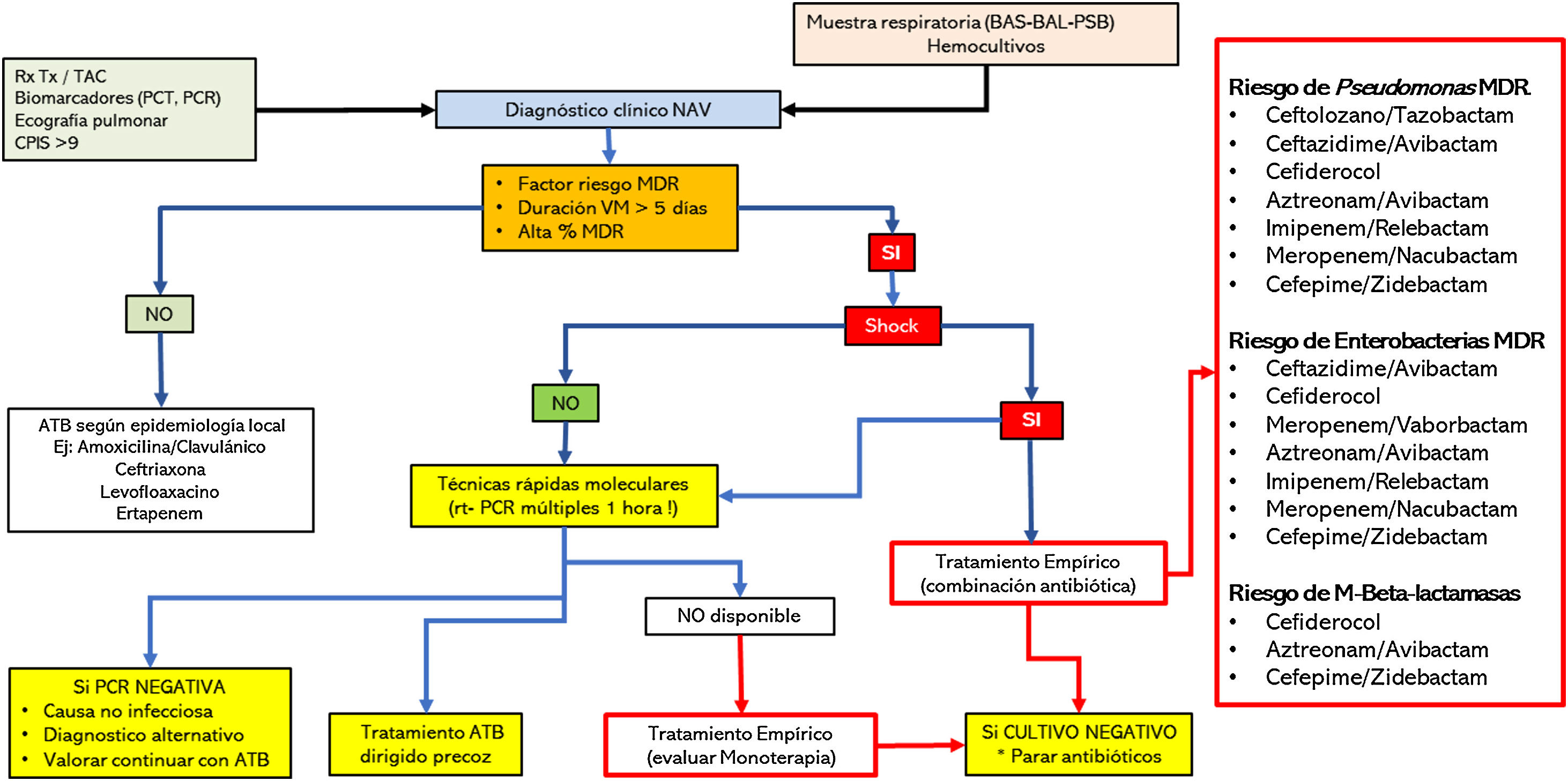
β-Lactámicos+inhibidor de β-lactamasasCeftazidima/avibactam (CAZ/AVI)CAZ es una cefalosporina de tercera generación con actividad contra Pseudomonas spp. combinada con un inhibidor no β-lactámico semisintético de β-lactamasas (AVI), que ha sido ya comercializado y aprobado para el tratamiento de las infecciones graves por BGN13. La combinación con AVI restaura la efectividad de la CAZ sobre bacterias productoras de β-lactamasas (BLEE, AmpC y CPE) como enterobacterias y Pseudomonas aeruginosa (fig. 1). El AVI junto a la CAZ reduce la concentración inhibitoria mínima (CIM50 y CIM90) contra P. aeruginosa, posiblemente debido a la inactivación de AmpC. Sin embargo, los mecanismos adicionales de resistencia que presenta Pseudomonas spp., como alteraciones de porinas, metalo-β-lactamasas (MBL), bombas de eflujo y OXA β-lactamasas, entre otros, condiciona que la efectividad de este ATB se evidencie con mayor intensidad en enterobacterias. CAZ/AVI evidencia una elevada eficacia contra enterobacterias MDR y XDR respecto de sus comparadores, como meropenem (MERO) o piperacilina/tazobactam (PTZ)14. En una reciente revisión sistemática de Soriano et al.15sobre 1.926 pacientes tratados con CAZ/AVI (solo o en combinación) y 1.114 pacientes como comparadores/controles, los autores observaron una evolución favorable asociada a CAZ/AVI en pacientes con infecciones graves por BGN. Las infecciones más comunes de los pacientes fueron neumonía, bacteriemia e infección de piel y partes blandas (IPPB). Es interesante hacer hincapié en que 1.718 enterobacterias presentaron resistencia a carbapenem o producción de carbapenemasas y 150 P. aeruginosa tenían MDR y XDR dentro de los pacientes tratados. La mayoría de las publicaciones incluidas en la revisión comunicaron una evolución más favorable para CAZ/AVI (curación clínica entre el 45% al 100%) y estadísticamente superior respecto de los ATB comparadores. Por otra parte, los autores puntualizan que las resistencias ocurrieron de forma infrecuente, y generalmente en Klebsiella pneumoniae productora de carbapenemasa (KPC). Los autores concluyen que la revisión brinda una adecuada calidad de evidencia para el uso de CAZ/AVI en el tratamiento de los pacientes hospitalizados con enterobacterias productoras de carbapenemasas y MDR P. aeruginosa.
Acción de los nuevos antimicrobianos aislados o en combinación sobre las diferentes betalactamasas.
X no activo, √ activo. Actividad variable: 1 para P. aeruginosa, 2 para enterobacterias.
ATZ/AVI: aztreonam/avibactam; CAZ/AVI: caftazidime/avibactam; CFD: cefiderocol; CFP/TBB: cefepime/taniborbactam; CFP/ETZ: cefepime /enmetazobactam; CFP/ZDB: cefepime/zidebactam; CTZ/TAZ: ceftolozano/tazobactam; IMI/CIL/REL: Imipenem/cliastatina/relebactam; MERO/NACU: meropenem/nacubactam; MERO/VABO: meropenem/vaborbactam.
En resumen, CAZ/AVI inhibe las β-lactamasas de clase A y C de Ambler y algunas enzimas de la clase D, incluyendo β-lactamasas de amplio espectro (BLEE), carbapenemasas KPC y OXA-48 y enzimas AmpC. CAZ/AVI no inhibe las enzimas de la clase B (metalo-β-lactamasas) y no es capaz de inhibir muchas enzimas de clase D. En la tabla 1 se pueden apreciar las características comparativas entre CAZ/AVI y otras combinaciones.
Características diferenciales de las principales combinaciones comercializadas
| Características | CAZ/AVI | CTZ/TAZ | MERO/VABO | IMI/CIL/REL | CFD |
|---|---|---|---|---|---|
| Vida media (h) | 1,5-3,0 | 1,0-2,6 | 1,0-1,9 | 1,1-1.8 | 2-2,7 |
| Unión a proteínas (%) | 5-22 | 16-30 | 2-33 | 20-22 | 58 |
| Vol. distribución (l) | 19-28 | 12-19 | 19-29 | 19-22 | 16 |
| Penetración pulmonar (AUC ELF/AUC plasma) | 0,31/0,35 | 0,44-0,48 | 0,58-0,3 | 0,43-0,44 | 0,1 |
| Eliminación | Renal | Renal | Renal | Renal | Renal |
| Indicaciones | |||||
| BGN con limitadas opciones de tratamientoa | Sí | No | Sí | Sí | Sí |
| IIAa complicada | Sí | Sí | Sí | Sí | No |
| NNa | Sí | Sí | Sí | Sí | Sí |
| Bacteriemia secundariaa | Sí | No | Sí | Sí | No |
| Administración | 2g/0,5g c/8h | 2g/1g c/8h | 2g/2g c/8h | 0,5g/0,5g/0,25c/6h | 2g c/8h |
| Duración infusión(h) | 2 | 1 | 3 | 1 | 3 |
| Ajuste por función renal hiperfiltrante | No | No | No | No | Sí (>120) 2g c/6h |
| Ajuste por AKI (CrCL corte en mL/min) | Sí (<50) | Sí (<50) | Sí (>40) | Sí (<90) | Sí (<90) |
| 30-50=1 g/0,25g c/8hb | 30-50=1g/0,5g c/8ha | 39-20=1g/1g c/8hc | 90-60=400/400/200 c/6hd | 90-60=2g c/8he | |
| 15-29=0,75g/0,1875g c/12hb | 15-29=0,5g/0,25g c/8ha | 10-19=1g/1g c/12hc | 59-30=300/300/150 c/6hd | 59-30=1,5g c/8he | |
| HD=0,75g/0,1875g c/24-48hb | HD=1,5g/0,75g en cargaa+300mg/150mg c/8h post-HD | HD=0,5 g/0,5g c/12hc | 29-15=200/200/100 c/6hd | 29-15=1g c/8he | |
| DH=200/200/100 post-HDd | HD=0,75g c/12he | ||||
| Ajuste en hepatopatía | No | No | No | No | No |
CAZ/AVI: ceftazidime/avibactam; CFD: cefiderocol; CTZ/TAZ: ceftolozano/tazobactam; IMI/CLI/REL: imipenem/cilastatina/relebactam; MERO/VABO: meropenem/vaborbactam.
El CTZ es otra cefalosporina de amplio espectro ya comercializada y administrada en combinación con un inhibidor de β-lactamasa (TAZ). El CTZ se diferencia de otras cefalosporinas por sus cadenas laterales en posición 3 y 7 con un anillo bicíclico β-lactámico/dihidrothiazina. El anillo en posición 7 brinda actividad contra los BGN, mientras que el anillo en posición 3 aumenta la estabilidad contra AmpC y previene la hidrólisis por microorganismos como P. aeruginosa16. La combinación con TAZ disminuye la CIM50-90 de microorganismos que producen β-lactamasas de clase A y C como Escherichia coli, Klebsiella pneumoniae, Enterobacter spp. y Serratia spp. y ejerce su actividad uniéndose irreversiblemente a las β-lactamasas y sometiéndose a una hidrólisis lenta. Las β-lactamasas de espectro estrecho, como TEM-1, TEM-2, SHC-1 y OXA-1 tienen poco efecto sobre la actividad de CTZ/TAZ (fig. 1). Por otra parte, las BLEE, TEM3-9, SHV-2-4, OXA-2 y CTX-M-3–18 reducen la actividad del fármaco, pero aún puede seguir siendo eficaz. En una revisión de estudios de fase 3 de CTZ/TAZ en infección complicada del tracto urinario e infección intraabdominal (IIA) causadas por E. coli y K. pneumoniae productoras de BLEE, el 82% de los 159 patógenos se consideraron susceptibles y el 97,4% se curaron clínicamente17.
El CTZ/TAZ mantiene su actividad frente a bacterias productoras de bombas de eflujo (MexXY, MexAB), además se ha demostrado que mantiene su actividad contra varias cepas de P. aeruginosa con PDR, XDR y MDR perfil de resistencia que modifican su PBP (proteínas de unión a penicilina)16–18. Sin embargo, CTZ/TAZ no tiene actividad contra carbapenemasas o metalo-β-lactamasas, tampoco tiene acción sobre Stenotrophomonas spp. y Acinetobacter spp. (fig. 1). El estudio central sobre el uso de CTZ/TAZ en neumonía nosocomial incluyendo NAV19 concluyó sobre la no inferioridad respecto del comparador (MERO) con un subgrupo de pacientes que podrían tener una mejor evolución, especialmente ante la presencia de P. aeruginosa MDR y XDR, por lo cual actualmente CTZ/TAZ a altas dosis es una opción para el tratamiento de NAV causado por microorganismos resistentes, especialmente P. aeruginosa, motivo por el cual en una reciente revisión sobre el tratamiento de la neumonía nosocomial20, en un reciente consenso de expertos20, CTZ/TAZ fue incluido como la primera opción de tratamiento para la NAV con elevado riesgo de P. aeruginosa con algún perfil de resistencia dentro del algoritmo «PANNUCI». En la tabla 1 se pueden observar las características diferenciales entre CTZ/TAZ y otras modernas combinaciones.
Es importante destacar que, aunque a diferencia de otras cefalosporinas CFT/TAZ ha demostrado una gran estabilidad contra AmpC, la utilización clínica de este agente ha evidenciado a aparición de resistencias durante el tratamiento relacionada con mutaciones de AmpC21–23. El porcentaje de resistencia a CTZ/TAZ durante su administración es variable, desde un 3% hasta un 14%, y se espera que el desarrollo de la resistencia durante el tratamiento ocurra con mayor probabilidad en los aislados de MDR y XDR, muchos de los cuales ya presentan una de las mutaciones requeridas (que conduce a la sobreexpresión de AmpC). Cuando esta resistencia a CTZ/TAZ aparece en general se restaura la susceptibilidad para meropenem y PTZ, fármacos que pueden entonces utilizarse en el tratamiento21.
Carbapenem+inhibidor β-lactamasasMeropenem/vaborbactam (MERO/VABO)El desarrollo de nuevas combinaciones basadas en «viejos» carbapenémicos, junto con nuevos inhibidores de β-lactamasas activos sobre las carbapenemasas, es una de las más promisorias estrategias para el tratamiento de las enterobacterias resistentes a carbapenem (CRE).
MERO/VABO es la combinación de un carbapenémico (MERO) del grupo 2, con un nuevo inhibidor de la β-lactamasa a base de ácido borónico cíclico (VABO) aprobado y comercializado para el tratamiento de la ITU complicada, infección intraabdominal y neumonía nosocomial, incluyendo NAV causada por BGN con opciones limitadas de tratamiento. El VABO, debido a su perfil de inhibición de la β-lactamasa, incrementa el espectro de actividad de MERO a cepas de enterobacterias que producen carbapenemasas del tipo KPC y carbapenemasas de clase A24,25. Estas cepas de enterobacterias son típicamente resistentes a otros carbapenem, a otros β-lactámicos y, además, pueden ser resistentes a ATB no β-lactámicos debido a mutaciones cromosómicas y plásmidos26. Diferentes publicaciones han informado de una actividad de MERO/VABO contra enterobacterias productoras de KPC superior al 99%24,26,27. MERO/VABO es activo también contra cepas mutantes de KPC, las cuales son resistentes a CAZ/AVI (KPC-8, KPC-31) y es capaz de reducir la CIM de cepas con susceptibilidad reducida al MERO por producción de BLEE o AmpC (fig. 1). Por otro, MERO/VABO no es efectivo sobre carbapenemasas de clase B y D. Lamentablemente, la actividad contra Pseudomonas aeruginosa y Acinetobacter spp. de MERO/VABO es similar a la MERO solo, esto es, porque la resistencia a MERO está mediada por mecanismos que no son afectados por VABO, como permeabilidad de la membrana, desregulación de bombas de eflujo y producción de β-lactamasas de clase B y D.
El segundo estudio aleatorizado de fase 3 (TANGO II)28, que evaluó la efectividad de MERO/VABO respecto de la mejor terapia disponible (MTD) en pacientes con diferentes infecciones graves (incluida NAV) con sospecha de enterobacterias resistentes a carbapenem, fue suspendido prematuramente con solo la inclusión de 77 pacientes por razones éticas de eficacia. Aunque esto disminuye notablemente el poder del estudio, se observó una mejoría en la curación clínica (59% vs. 26%) y microbiológica (65% vs. 40%) para los pacientes tratados con MERO/VABO respecto de MTD. Específicamente, en el subgrupo de NAV se evidenció una reducción significativa de la mortalidad a los 28 días (22% vs. 44%) respecto de MTD. Con sus limitaciones relacionadas con el poder del estudio, TANGO II sugiere que MERO/VABO es una adecuada opción para el tratamiento de enterobacterias productoras de carbapenemasas. En la tabla 1 se pueden observar las características diferenciales de MERO/VABO respecto de otras nuevas combinaciones.
Imipenem/relebactam/cilastatin (IMI/REL/CIL)IMI/REL/CIL es una combinación de un clásico carbapenem (IMI), junto a un inhibidor renal de la dehidropeptidasa-i (CIL) y a un moderno inhibidor de β-lactamasa (REL), que ha sido aprobado de forma reciente en la Unión Europea para el tratamiento de neumonía nosocomial, NAV, ITU complicadas e IIA en adultos con limitadas alternativas de tratamiento29,30.
REL inhibe las β-lactamasas de clases A y C, y además las cefaloporinasas producidas por Pseudomonas spp. Sin embargo, REL no es activo sobre las MBL de la clase B o β-lactamasas de clase D (fig. 1).
La adición de REL provoca una disminución marcada en la CIM50-90 de IMI sobre enterobacterias productoras de BLEE y KPC, así también sobre cepas de P. aeruginosa resistentes a IMI29,31,32. Además, IMI o REL no están sujetos a mecanismos de eflujo bacteriano; esta característica le brinda una ventaja comparativa sobre otros ATB que se ven afectados por cepas que expresan bombas de eflujo29,32.
Aunque el perfil de actividad in vitro de IMI/CIL/REL sobre cepas de P. aeruginosa resistentes a carbapenem es similar al CAZ/AVI, IMI/CIL/REL mantiene una elevada actividad contra P. aeruginosa que desarrolla resistencia a CAZ/AVI y CTZ/TAZ33, por lo cual es una opción adecuada para el tratamiento de rescate en infecciones graves.
IMI/CIL/REL resultó ser no inferior al comparador PTZ para el objetivo primario de mortalidad a los 28 días por cualquier causa en el estudio aleatorizado RESTORE-IMI 234. Sin embargo, en el análisis predefinido por subgrupos de pacientes con VM o con APACHE II mayor de 15 puntos, IMI/CIL/REL presentó una menor mortalidad respecto del comparador.
Aunque aún no comercializado en nuestro país, el posicionamiento de esta combinación está aún por determinar respecto de otras opciones disponibles con similares características (tabla 1); la evidencia disponible sugiere que IMI/CIL/REL es una adecuada y bien tolerada opción de tratamiento para pacientes graves (APACHE>15) o en VM afectados de infecciones graves causadas por BGN resistentes a carbapenémicos.
Meropenem/nacubactam (MERO/NACU)El NACU es un inhibidor de β–lactamasa no β–lactámico que se administra junto con MERO para el tratamiento de las infecciones por BGN. El NACU ha demostrado su actividad frente a β-lactamasas de clase A y C y en menor medida sobre la clase D35,36.
El NACU aisladamente posee actividad antibacteriana por unión a la PBP2 de varias enterobacterias, por lo cual administrado en combinación con MERO su efectividad se incrementa por la unión con otras PBP. Esta eficacia se observa sobre enterobacterias productoras de BLEE, AmpC, KPC, MBL y OXA-48, así como sobre cepas de P. aeruginosa con producción de AmpC (desreprimidas) o BLEE de clase A tipo PER o VEB37,38 (fig. 1). El perfil de PK de NACU es similar a otros inhibidores y la concentración plasmática y excreción acumulativa urinaria es similar al MERO, por lo cual la dosificación de MERO/NACU en la disfunción renal se ajusta a lo establecido para la administración de MERO de forma individual. Estas propiedades hacen de MERO/NACU un excelente candidato para futuras investigaciones clínicas con microorganismos de difícil tratamiento.
Monobactámicos+inhibidor de β-lactamasasAztreonem/avibactam (AZT/AVI)El AZT es un clásico ATB β-lactámico con un solo anillo (monobactámico), activo contra BGN aerobios, pero inactivo contra microorganismos gram positivos. Su uso ha estado muy limitado en el pasado por la frecuente presencia de microorganismos productores de BLEE y AmpC. Contrariamente, las MBL que hidrolizan todos los β-lactámicos no afectan a los monobactámicos como ATZ y esta característica ha permitido su utilización en algunas cepas productoras de MBL39,40. Sin embargo, como es frecuente la presencia de otros factores de resistencia como producción de β-lactamasas de clase A o AmpC, ATZ solo permite su utilización en uno de cada 3 pacientes con MBL. La adición de AVI, un inhibidor no β-lactámico de β-lactamasas que ya fue descrito previamente, restituye a AZT la capacidad de actuar con cepas de que expresan MBL como VIM (Verona-integron-encoded BML), imipenemasas (IMPasa) y NDM (New Delhi MBL) junto con KPC u otras carbapenemasas tipo-OXA41. El ATZ/AVI fue más activo que MERO, amicacina y CAZ/AVI al inhibir en casi su totalidad las cepas de enterobacterias con producción dual de carbapenemasas (fig. 1). Sin embargo, otro estudio evidenció que AZT/AVI fue activo para todas las cepas de BGN productoras de carbapenemasas, excepto para NDM-1 y NDM-7 producidas por cepas de E. coli de Singapur41–44. Su espectro de sobre todas las clases de β-lactamasas confiere a AZT/AVI un lugar prioritario en las UCI con elevada tasa de MBL. La dosis adecuada en la disfunción renal aún no ha sido establecida. Diferentes estudios de fase 1 (https://www.withpower.com/trial/phase-1-Renal-Insufficiency-7-2020-bffb2/https://www.clincosm.com/trial/renal-insufficiency-saint-paul-aztreonam-avibactam) podrán brindar esta información próximamente.
Cefalosporinas/inhibidor de β-lactamasasCefepime/zidebactam (CFP/ZDB)El CFP es una conocida cefalosporina de cuarta generación que ejerce su actividad por la unión a la PBP3 y también a la PBP1 de microorganismos gram positivos y gram negativos, incluyendo P. aeruginosa. La AmpC tiene baja afinidad por CFP, por lo cual CFP mantiene su actividad frente a enterobacterias con AmpC desreprimidas. Sin embargo, el CFP puede ser hidrolizado por algunas β-lactamasas de clase A, incluyendo la BLEE, KPC, así como MBL (clase B) y algunas de clase D (OXA)45.
Por su parte ZDB es un ATB no β-lactámico con un modo de acción dual, que involucra una elevada y selectiva afinidad con la PBP 2 de BGN junto a la inhibición de β-lactamasas46,47. El ZDB le confiere al CFP un gran potencial de acción contra enterobacterias, P. aeruginosa y Acinetobacter baumannii MDR productoras de carbapenemasas y para aquellas cepas de P. aeruginosa que presentan múltiples mecanismos de resistencia, incluyendo la combinación de estimulación de bombas de eflujo con una disminución en las porinas o una superproducción de AmpC45,48,49 (fig. 1). Es importante destacar el marcado efecto sobre las cepas productores de carbapenemasas de clase D y sobre cepas productoras de MBL, incluyendo VIM, IMP y NDM, así como sobre P. aeruginosa con sobreexpresión de AmpC y MBL (VIM y IMI)50.
El posicionamiento de CFP/ZDB necesita ser determinado aún con datos clínicos de uso, por lo cual dependerá del punto de corte asignado para realizar la comparación con otros modernos ATB. Hasta entonces, y según los resultados in vitro, podría ser parte fundamental del tratamiento en pacientes con MDR enterobacterias y P. aeruginosa productoras de BLEE y MBL51.
Cefepime/taniborbactam (CFP/TBB)El TBB es un nuevo inhibidor de β-lactamasa a base de boronato cíclico que carece de actividad antibacteriana, pero es un potente inhibidor in vitro de la actividad de las BLEE y MBL48. ElTBB confiere al CFP actividad contra microorganismos de difícil tratamiento incluyendo enterobacteriales y P. aeruginosa resistente a MERO, productoras de BLEE, AmpC, OXA, KPC y MBL incluyendo VIM y NDM52-54 (fig. 1). Aunque su efecto in vitro es muy atractivo, los estudios clínicos (CERTAIN-1 en ITU y CERTAIN -2 en NAV) están aún por desarrollarse, tras lo cual se deberá posicionar a TBB respecto de los modernos inhibidores de MBL.
Cefepime/enmetazobactam (CFP/ETZ)El ETZ es una sulfona de ácido penicilinánico y un moderno inhibidor de β-lactamasas, especialmente contra BLEE (TEM, SHV, CTX). La combinación con CFP le confiere una actividad in vitro comparable con MERO, pero superior a PTZ contra enterobacterias productoras de BLEE55,56. Estudios in vitro también demuestran que CFP/ETZ es efectivo contra cepas de enterobacterias productoras de β-lactamasas de clase A, C y D57,58 (fig. 1). Faltan aún datos clínicos sobre su efectividad en NAV comparada con otras nuevas combinaciones para poder posicionarlo clínicamente.
Nuevas cefalosporinasCefiderocol (CFD)El CFD es una nueva cefalosporina siderófora comercializada desde 2020 con un doble mecanismo de acción; además de la difusión pasiva de CFD por los canales de porina de la membrana externa, CFD puede unirse al hierro libre extracelular a través de su cadena lateral siderófora. Las bacterias secretan naturalmente sideróforos para permitir la absorción de hierro férrico del entorno huésped, por lo cual CFD se une al hierro férrico libre y, en consecuencia, utiliza la absorción bacteriana de los sideróforos para penetrar en la bacteria, un mecanismo conocido como «caballo de Troya»59,60. Por otro lado, CFD se une a las PFP, especialmente a la PFP3, inhibiendo la síntesis de la pared celular de peptidoglicano de la bacteria, lo que da lugar a lisis y muerte celular.
CFD es activo contra todos los BGN clínicamente relevantes, como enterobacterales, P. aeruginosa, Acinetobacter spp. y también Stenotrophomonas maltophilia, pero inefectivo contra cocos gram positivos (CGP) o anaerobios61–63 (fig. 1). Las dosis recomendadas y características comparativas se aprecian en la tabla 1. Después de una dosis de CFD la vida media del fármaco es similar a otros β-lactámicos (2-2,7horas), con un volumen de distribución de 16-18l. Sin embargo, la unión a proteínas es sustancialmente mayor (58%) respecto de CTZ (11-21%) y CAZ (21%)64, y es excretado inalterado principalmente por la orina (60-90%). Su efecto es tiempo dependiente (%T>CIM) y se ha observado la eliminación de más del 60% después de una sesión habitual de hemodiálisis. La penetración en el pulmón es buena, y en pacientes con ventilación mecánica con NAV la relación fluido alveolar (ELF)/plasma libre estimada fue de 0,21 al final de la perfusión de 2g en 60minutos y de 0,55 2horas después del final de la perfusión. La penetración en ELF fue similar entre sujetos sanos y pacientes ventilados, pero con una diminución por debajo de la CIM para los microorganismos más frecuentes a partir de las 6horas, por lo cual la dosificación debe estar entre 4-6horas para mantener un %T>CIM mayor de 50% entre el intervalo de dosis.
El estudio APEKS-NP65 evaluó en 300 pacientes con neumonía nosocomial, incluyendo NAV, la no inferioridad de CFD respecto de MERO administrados en infusión extendida de 3horas, y aunque esta forma de administración es fuera de guía, es el uso habitual de MERO. No se observaron diferencias en la mortalidad a los 14 días (12,4% vs. 11,6%), ni en la frecuencia de curación clínica (65% vs. 67%) o erradicación microbiológica (41% vs. 42%) respectivamente para CFD y MERO. Finalmente, el estudio CREDIBLE-CR fue complementario a los anteriores, ya que estudió el CFD vs. la MTD para el tratamiento de las infecciones por BGN resistentes a carbapenem. El estudio incluyó 150 pacientes (67 con NN) y no se observaron diferencias en la cura clínica (43% vs. 43%) o erradicación microbiológica (30% vs. 29%) en general. Llamativamente, la mortalidad evidenció una tendencia mayor en CFD (34%) respecto de MTD (18%, p=0,057), aunque ninguna de las muertes fue atribuida a CFD. Dado el amplio espectro de acción sobre todas la BLEE, incluidas MBL, CFD es un ATB que debe estar disponible en aquellas UCI con elevada frecuencia de BGN de difícil tratamiento.
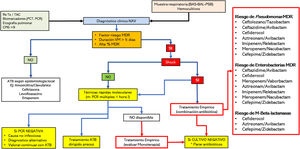
Consideraciones clínicas del uso de nuevos antimicrobianos en ambientes de multirresistenciaUso adecuado de los nuevos antimicrobianosLa decisión de usar o reservar los nuevos ATB es una cuestión difícil de afrontar. Esta pregunta no puede interpretarse adecuadamente si no la ponemos en un adecuado contexto global que incluye la epidemiología local, las características del enfermo en particular, el foco de infección a tratar y, por supuesto, la implementación de programas de optimización de antimicrobianos y políticas de tratamiento establecidas por protocolos consensuados66. Además, para facilitar la utilización adecuada de los nuevos antimicrobianos resulta imprescindible, a nuestro modo de ver, una adecuada y precoz información de microbiología. En este aspecto las modernas técnicas de diagnóstico microbiológico precoz mediante PCR múltiple67 permiten un tratamiento dirigido y precoz, evitando el sobreuso de los antimicrobianos y disminuyendo la presión de selección de la unidad. Reservar los nuevos antimicrobianos y administrar combinaciones alternativas de viejos antibióticos, que pueden contemplar un efecto menor o una mayor incidencia de efectos secundarios, no parece la opción más adecuada si disponemos de técnicas rápidas que permitan descartar la presencia de microorganismos multirresistentes en elmomento de elegir el tratamiento empírico o dirigido precoz. En la figura 2 sugerimos un algoritmo de diagnóstico y tratamiento para la neumonía asociada al ventilador que puede ser útil para adaptarlo en cada UCI según la epidemiología local.
Algoritmo de diagnóstico y posicionamiento de los nuevos antimicrobianos para el tratamiento de la neumonía (NAV) asociada a ventilación mecánica (VM).
ATB: antibiótico; BAL: lavado broncoalveolar; BAS: aspirado bronquial; CPIS: escala de valoración clínica de la infección pulmonar; MDR: microorganismos multirresistentes; PCT: procalcitonina; PCR: proteína C Reactiva; PSB: cepillo protegido; rt-PCR: reacción en cadena de la polimerasa; Rx Tx: radiografía de tórax; SIRS: síndrome de respuesta inflamatoria sistémica; TAC: tomografía axial computarizada.
La perfusión continua o extendida de antibióticos β-lactámicos ha demostrado que mejora las condiciones PK/PD de estos, al maximizar el tiempo que la concentración plasmática se mantiene por encima de la CIM e incrementa la eficacia. Basándonos en estas consideraciones, las modernas combinaciones de β-lactámicos junto a un inhibidor deberían comportarse de forma similar. Existen escasas experiencias publicadas sobre el uso de los nuevos antimicrobianos en perfusión extendida. Un reciente estudio68 evidenció que la dosificación habitual de 2g c/8horas de CTZ/TAZ fue adecuada para obtener niveles plasmáticos sobre CIM (ƒT>MIC) en más de un 90% del tiempo, cuando se consideraron microorganismos con una CIM<6mg/l. Sin embargo, solamente la administración prolongada (4horas) o la infusión continua de CTZ/TAZ alcanzaron los objetivos de niveles plasmáticos en más del 90% de los casos si la MIC de los microorganismos fue≥6mg/l68. Por su parte, el tratamiento con infusión extendida de 4horas de CAZ/AVI obtuvo una curación clínica del 80% y microbiológica del 90%69. En dicho estudio los autores utilizaron en 10 pacientes con infecciones graves por Pseudomonas aeruginosa y Klebsiella pneumoniae una dosis diaria de 10g de CAZ/AVI, obteniendo niveles plasmáticos de 63,6mg/l, lo cual se correlacionó con altos niveles de la relación niveles plasmáticos/CIM (mediana de 13mg/l) sin evidencias de alteraciones neurológicas ni toxicidad hematológica.
La necesidad de mantener niveles elevados de antimicrobianos en plasma de forma constante es una situación especialmente relevante en los pacientes críticos, por lo cual, y tal como lo estamos haciendo con otros β-lactámicos, recomendamos la administración extendida de CTZ/TAZ, especialmente en pacientes en ventilación mecánica o con incremento de la depuración de creatinina.
ConclusionesLa rápida diseminación de cepas productoras de β-lactamasas de espectro extendido, y en especial de MBL, generalmente asociadas a la presencia de enterobacterias o P. aeruginosa, ha condicionado una crisis muy seria en los sistemas sanitarios.
Tanto el incremento en la movilidad de la población, así como, la alta prevalencia de aparición de resistencia mediada por plásmidos, o la elevada colonización intestinal por BGN-MDR, contribuyen a esta elevada e incontrolada diseminación de la resistencia en todo el mundo.
La importancia clínica de estas infecciones está relacionada con su elevada mortalidad, especialmente debido a que las cepas productoras de MBL son habitualmente resistentes a todos los β-lactámicos, incluyendo las nuevas combinaciones entre β-lactámicos o carbapenémicos con inhibidores de β-lactamasas. En este grave contexto el desarrollo de nuevas combinaciones con modernos y más potentes inhibidores de β-lactamasas pueden restaurar la sensibilidad de ATB clásicos a estos microorganismos de difícil tratamiento. El posicionamiento clínico de cada uno de ellos está pendiente de los resultados de su aplicación en estudios clínicos con pacientes críticos, o del uso compasivo ante el fracaso de los mejores tratamientos disponibles.
FinanciaciónNo hay financiación para este manuscrito.
Conflicto de interesesAlejandro Rodríguez ha recibido honorarios por participación en actividades docentes por parte de PFIZER, MSD, GILEAD, THERMOFISHER, ROCHE y BIOMEREUX.
El resto de los autores no presenta conflicto de intereses que declarar.