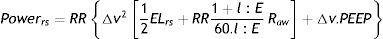Evaluar la asociación entre la fracción del espacio muerto (VD/VT) medida por capnografía de tiempo, el volumen minuto corregido (VMC) y la razón ventilatoria (RV) con los desenlaces clínicos en pacientes con COVID-19 que requirieron ventilación mecánica invasiva (VMI).
DiseñoEstudio observacional de una cohorte histórica en el ámbito de un hospital universitario en Medellín (Colombia).
ParticipantesPacientes mayores de 15 años con diagnóstico confirmado de COVID-19 que fueron admitidos en la UCI y necesitaron VMI. Intervenciones: medición de VD/VT, VMC y RV en pacientes con COVID-19.
Variables de interés principalesVD/VT, VMC, RV, datos demográficos, índices de oxigenación y parámetros ventilatorios.
ResultadosDurante el período de estudio se analizaron 1.047 pacientes con COVID-19 en VMI, de los cuales fallecieron 446 (42%). En los fallecidos se observó una mayor prevalencia de edad avanzada y obesidad, un índice de Charlson más elevado, mayor APACHE II y SOFA, así como un aumento en el VD/VT (0,27 en vivos y 0,31 en fallecidos) y del volumen minuto en el primer día de VMI. El análisis multivariado mostró una asociación independiente con la mortalidad hospitalaria, mayor VD/VT (HR: 1,24; IC 95%: 1,003-1,525; p=0,046), edad (HR: 1,024; IC 95%: 1,014-1,034; p<0,001) y SOFA al inicio (HR: 1,036; IC 95%: 1,001-1,07; p=0,017).
ConclusionesLa VD/VT mostró una asociación con la mortalidad en pacientes con SDRA por COVID-19 en VMI. Estos hallazgos indican que la medición de la VD/VT puede servir como marcador de gravedad de la enfermedad.
To assess the association between dead space fraction (VD/VT) measured through time capnography, corrected minute volume (CMV), and ventilation ratio (VR) with clinical outcomes in COVID-19 patients requiring invasive mechanical ventilation.
DesignObservational study of a historical cohort in an university hospital in Medellin, Colombia.
ParticipantsPatients aged 15 and above with confirmed COVID-19 diagnosis admitted to the ICU requiring mechanical ventilation; interventions: measurement of VD/VT, CMV, and VR in COVID-19 patients.
Main variables of interestVD/VT, CMV, VR, demographic data, oxygenation index, and ventilatory parameters.
ResultsDuring the study period, 1,047 COVID-19 patients on mechanical ventilation were analyzed, of whom 446 (42%) died. Deceased patients exhibited a higher prevalence of advanced age and obesity, elevated Charlson index, higher APACHE II and SOFA scores, as well as an increase in VD/VT ratio (0.27 in survivors and 0.31 in deceased) and minute ventilation volume on the first day of mechanical ventilation. Multivariate analysis revealed independent associations with in-hospital mortality, higher VD/VT (HR: 1.24; 95% CI: 1.003-1.525; P=0.046), age (HR: 1.024; 95% CI: 1.014-1.034; P<0.001), and SOFA score at onset (HR: 1.036; 95% CI: 1.001-1.07; P=0.017).
ConclusionsVD/VT demonstrated an association with mortality in COVID-19 ARDS patients on mechanical ventilation. These findings suggest that VD/VT measurement may serve as a severity marker for the disease.
La infección por SARS-CoV-2 fue descrita inicialmente en Wuhan (China) en diciembre de 2019 y declarada como pandemia en marzo de 2020. Si bien la mayoría de los casos son asintomáticos o presentan síntomas leves, el 5% pueden presentar una forma grave y requerir ingreso en la unidad de cuidados intensivos (UCI), en general, por falla respiratoria progresiva secundaria a síndrome de dificultad respiratoria aguda (SDRA), enfermedad con una alta mortalidad1-3.
El SDRA se caracterizada por inflamación, incremento en la permeabilidad vascular y pérdida del tejido pulmonar aireado4. En pacientes con SDRA, el daño alveolar y la alteración vascular pueden aumentar el espacio muerto (VD) (alvéolos bien ventilados y mal perfundidos)2, que se ha asociado con mal pronóstico5,6.
El espacio muerto puede ser estimado con la medición de la fracción del espacio muerto (VD/VT) por medio de la ecuación de Bohr modificada o la de Enghoff: (VD/VT fisiológico=PaCO2-PECO2/PaCO2)7, donde PaCO2 es la presión de CO2 obtenida de gases arteriales y PECO2 es un estimado de la presión exhalada de CO2 obtenida de la capnografía volumétrica. Sin embargo, la disponibilidad de esta última no siempre está garantizada en las UCI8. Afortunadamente, algunos estudios han demostrado una correlación significativa entre la medición de VD/VT mediante capnografía volumétrica y la capnografía de tiempo, que es más común en entornos clínicos9.
Además del VD/VT, existen otras medidas subrogadas del espacio muerto, como el volumen minuto corregido (VMC)10 y la razón ventilatoria (RV)11, las cuales también se han asociado con mortalidad en SDRA10.
En VMC, VE es la medición de la ventilación minuto (VM) en l/min, la PaCO2 es obtenida de los gases arteriales, el valor ideal de PaCO2 es 40mmHg. En RV, el VE predicho se obtiene de multiplicar la VM en ml/min por 100, el peso corporal predicho y la PaCO2 predicha, que corresponde a 37,5mmHg.
El objetivo de este estudio fue evaluar, en una cohorte de pacientes con COVID-19 que necesitaron ventilación mecánica invasiva (VMI), la asociación entre la VD/VT medida con capnografía de tiempo, el VMC y la RV, con desenlaces clínicos.
Pacientes y métodosEste estudio observacional de cohorte histórica se realizó en un hospital universitario en la ciudad de Medellín entre marzo de 2020 y junio de 2021. Se incluyó a pacientes mayores de 15 años, con diagnóstico confirmado por COVID-19, admitidos en la UCI en VMI. Se excluyeron los pacientes que requirieron VMI por menos de 48 h, pacientes sin al menos una medición de presión arterial de CO2 (PaCO2) y CO2 espirado (PECO2), pacientes remitidos a otra institución y pacientes que no autorizaron el uso de sus datos, según la ley estatutaria 1581 de 2012 (de 17 de octubre) de protección de datos personales.
A la cohorte se le hizo medición del VD/VT, VMC y RV. La hipótesis del presente estudio es que la relación VD/VT está asociada con la mortalidad. Para el tamaño muestral, se incluyeron todos los pacientes que cumplían con los criterios en el período de estudio. No se realizó muestreo, dado que se incluyó todo el marco muestral, no obstante, se realizó un cálculo de la estimación del poder post hoc para un tamaño de muestra de 1.047 pacientes, con un α de 0,05 y un HR de 1,24; el estimado fue 0,93.
Se recogieron los datos de la historia clínica electrónica en un formulario diseñado en la base de datos REDCAP del hospital. Se recolectaron variables demográficas, como edad, sexo, peso, APACHE-II al ingreso; variables ventilatorias, como la presión positiva al final de la espiración (PEEP) inicial, presión meseta, presión de conducción, volumen corriente (VT), necesidad de ventilación en prono, VMC y RV medidas al inicio de la ventilación mecánica, la VD/VT definida como la ventilación que no participa en el intercambio gaseoso y que fue medida el primer día de la VMI utilizando la ecuación de Enghoff7 a partir de las variables medidas de la capnografía de tiempo. Esta última, si bien no cuantifica directamente la cantidad total de CO2 exhalado y, por ende, no brinda una medida absoluta de la producción de CO2, es bastante más accesible que su contraparte, la capnografía volumétrica, que, a pesar de ofrecer información más precisa sobre la producción total de CO2, resulta menos práctica en términos de accesibilidad y aplicación directa.
Además, se tomaron variables de desenlace, como mortalidad en el hospital, días libres de UCI y del ventilador a 28 días.
Se utilizó un adaptador capnógrafo de tiempo Nihon Kohden®, sensor CO2 Mainstream Capnomed marca Nihon Kohden® REF: CMZ70 (sensor EtCO2 y adaptador de vía aérea).
Se armonizó la forma en que se midió el VD/VT para el control de sesgos.
Análisis estadísticoSe llevó a cabo un análisis descriptivo para las variables categóricas, utilizando frecuencias absolutas y relativas. Las variables cuantitativas se presentaron con la media y la desviación estándar (DE) o con la mediana P (50) y el rango intercuartílico P (25-75), según su distribución normal o no, respectivamente, determinada con la prueba de Shapiro-Wilk.
La variable continua de la VD/VT no fue categorizada para no perder capacidad discriminativa.
Los datos descriptivos se presentaron según el estado vital al egreso hospitalario (vivo/muerto) y los 2grupos se compararon mediante la prueba de U Mann Whitney o la t de Student para variables continuas y la prueba χ2 o exacta de Fisher para las variables categóricas.
Se estimó la diferencia de medianas con la prueba de rangos de Wilcoxon por tener una distribución no normal para las variables independientes (edad, APACHE-II, SOFA, índice Charlson, PAFI antes de la intubación, VT, frecuencia respiratoria, VM, PEEP y días de estancia) entre los pacientes con VD/VT inicial baja y alta.
Se realizó análisis multivariable del tipo de regresión de Cox, donde la variable dependiente era el estado vital al egreso hospitalario (vivo/muerto), el fracaso era la muerte hospitalaria y el censurado a la izquierda era el que egresaba vivo del hospital.
Las variables independientes fueron el factor de riesgo de exposición y la VD/VT. Las otras variables que se incluyeron en el modelo fueron las previamente identificadas en la literatura médica1,6,12,13.
No hubo datos perdidos y, por lo tanto, no fue necesario la imputación de datos.
A modo exploratorio, se calculó la capacidad discriminatoria del modelo con curva ROC para predecir el desenlace.
También se hizo una estimación post hoc de la potencia que tuvo el estudio para encontrar una diferencia de medias del espacio muerto y la supervivencia.
Todos los análisis fueron realizados con Stata/ICTM (Stata Co., College Station, TX, EE. UU.), Microsoft Windows® versión 16.
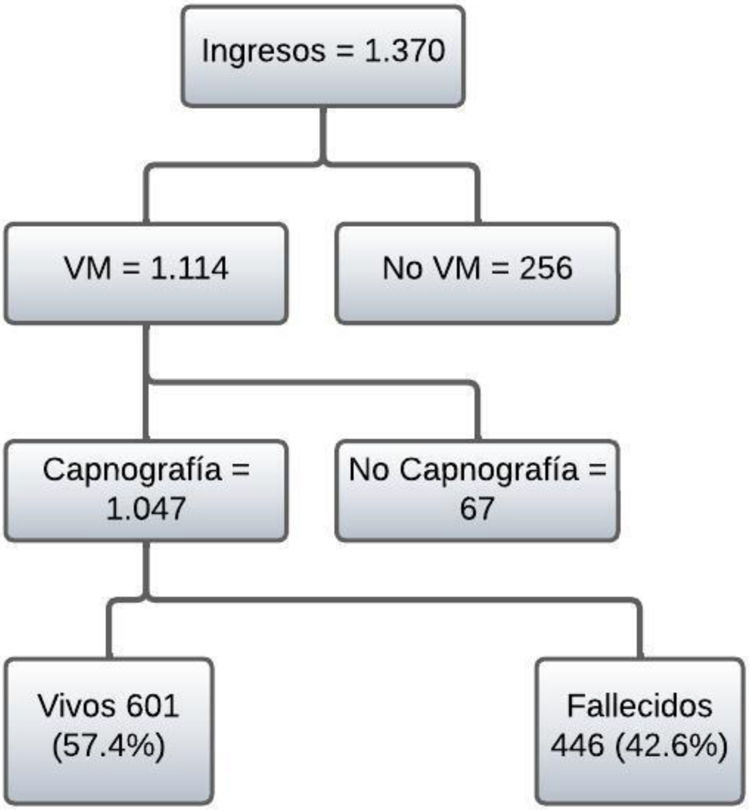
ResultadosDurante el período de estudio, que abarcó desde el 7 de marzo de 2020 hasta el 19 de agosto de 2022, ingresaron a la UCI un total de 1.370 pacientes con diagnóstico confirmado de COVID-19. De estos, 1.114 necesitaron VMI y a 1.047 se les midió la PECO2 a través de la capnografía de tiempo. De los 1.047 pacientes ingresados, fallecieron 446 (42%) en el hospital (fig. 1).
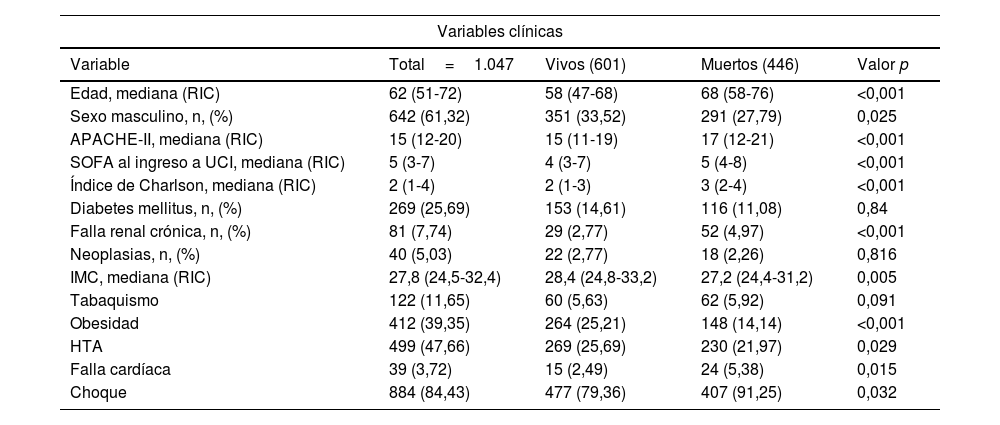
El análisis bivariante se aprecia en la tabla 1. La exploración de la relación del VD/VT como variable numérica y supervivencia tuvo una distribución no normal. En los pacientes vivos la distribución (mediana y rangos intercuartílicos 25-75) fue 0,27 (0,2-0,35), mientras que en los fallecidos fue 0,31 (0,21-0,4; p=0,0003). Así mismo, un mayor VM medido el primer día de VMI estuvo presente entre los pacientes fallecidos, tal y como se observa en la tabla 2.
Características demográficas, clínicas y ventilatorias el primer día de ventilación mecánica en pacientes con SDRA por COVID-19
| Variables clínicas | ||||
|---|---|---|---|---|
| Variable | Total=1.047 | Vivos (601) | Muertos (446) | Valor p |
| Edad, mediana (RIC) | 62 (51-72) | 58 (47-68) | 68 (58-76) | <0,001 |
| Sexo masculino, n, (%) | 642 (61,32) | 351 (33,52) | 291 (27,79) | 0,025 |
| APACHE-II, mediana (RIC) | 15 (12-20) | 15 (11-19) | 17 (12-21) | <0,001 |
| SOFA al ingreso a UCI, mediana (RIC) | 5 (3-7) | 4 (3-7) | 5 (4-8) | <0,001 |
| Índice de Charlson, mediana (RIC) | 2 (1-4) | 2 (1-3) | 3 (2-4) | <0,001 |
| Diabetes mellitus, n, (%) | 269 (25,69) | 153 (14,61) | 116 (11,08) | 0,84 |
| Falla renal crónica, n, (%) | 81 (7,74) | 29 (2,77) | 52 (4,97) | <0,001 |
| Neoplasias, n, (%) | 40 (5,03) | 22 (2,77) | 18 (2,26) | 0,816 |
| IMC, mediana (RIC) | 27,8 (24,5-32,4) | 28,4 (24,8-33,2) | 27,2 (24,4-31,2) | 0,005 |
| Tabaquismo | 122 (11,65) | 60 (5,63) | 62 (5,92) | 0,091 |
| Obesidad | 412 (39,35) | 264 (25,21) | 148 (14,14) | <0,001 |
| HTA | 499 (47,66) | 269 (25,69) | 230 (21,97) | 0,029 |
| Falla cardíaca | 39 (3,72) | 15 (2,49) | 24 (5,38) | 0,015 |
| Choque | 884 (84,43) | 477 (79,36) | 407 (91,25) | 0,032 |
| Variables ventilatorias | ||||
|---|---|---|---|---|
| Variable | Total=1.047 | Vivos (601) | Muertos (446) | Valor p |
| VD/VT inicial, mediana (RIC) | 0,28 (0,21-0,37) | 0,27 (0,2-0,35) | 0,31 (0,21-0,4) | <0,001 |
| VMC, mediana (RIC) | 11,7 (9,4-15) | 11,5 (9,4-14,7) | 11,9 (9,4-15,3) | 0,218 |
| RV, mediana (RIC) | 2,1 (1,7-2,7) | 2 (1,7-2,6) | 2,1 (1,7-2,8) | 0,532 |
| FR inicial, mediana (RIC) | 27 (22-28) | 25 (22-28) | 25 (22-28) | 0,592 |
| VM inicial, mediana (RIC) | 11,7 (9,4-15) | 10,95 (9-13,5) | 12,7 (9,9-16,5) | <0,001 |
| Pplat inicial, mediana (RIC) | 27 (25-29 | 27 (25-28) | 27 (25-29) | 0,077 |
| PEEP inicial, mediana (RIC) | 12 (12-14) | 12 (12-14) | 12 (12-14) | 0,02 |
| Presión de conducción inicial, mediana (RIC) | 14 (12-16) | 14 (12-16) | 14 (12-16) | 0,002 |
| PAFI antes de intubar, mediana (RIC) | 78 (65-100) | 78 (65-106) | 77,5 (63-98) | 0,099 |
| PCO2 | 45 (38-53) | 44 (37-52) | 45 (38-55) | 0,14 |
| Pronación, n (%) | 871 (83,19) | 490 (81,5) | 381 (85,42) | 0,096 |
FR: frecuencia respiratoria; HTA: hipertensión arterial; IMC: índice de masa corporal; PAFI: índice de oxigenación PaO2/FiO2; PEEP: presión positiva al final de la espiración; Pplat: presión plateau o presión meseta; RIC: rango intercuartílico; RV: razón ventilatoria; VD/VT: fracción de espacio muerto; VMC: volumen minuto corregido; VT: volumen tidal o corriente.
Análisis multivariable tipo regresión de Cox
| Mortalidad al egreso del hospital | |||
|---|---|---|---|
| Variable | HR | IC 95% | Valor p |
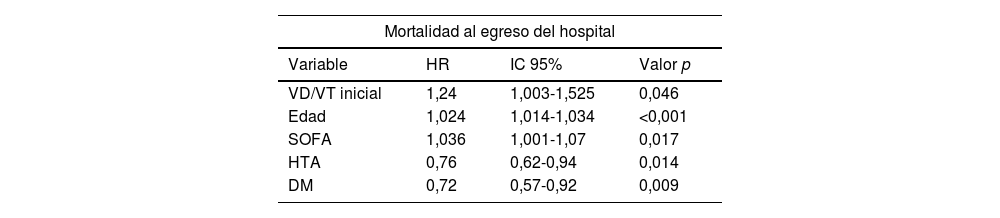
| VD/VT inicial | 1,24 | 1,003-1,525 | 0,046 |
| Edad | 1,024 | 1,014-1,034 | <0,001 |
| SOFA | 1,036 | 1,001-1,07 | 0,017 |
| HTA | 0,76 | 0,62-0,94 | 0,014 |
| DM | 0,72 | 0,57-0,92 | 0,009 |
Las variables del modelo son las clínicamente relevantes de acuerdo con la revisión de la literatura y las que tuvieron una asociación con la supervivencia con un valor p ≤ 0,1.
DM: diabetes mellitus; HTA: hipertensión arterial; VD/VT: fracción de espacio muerto.
En cuanto a los desenlaces clínicos, los días libres de ventilación mecánica y de UCI al día 28 fueron de 12 (p<0,001) y de 7 (p<0,001), respectivamente.
El análisis multivariado del tipo regresión de Cox incluyó las siguientes variables: VD/VT inicial, edad, sexo, IMC, APACHE II, índice de Charlson, SOFA, insuficiencia renal crónica, choque, tabaquismo, obesidad, hipertensión arterial, diabetes mellitus, PAFI antes de intubación, presión meseta inicial y PEEP inicial. Las variables que demostraron estar significativamente asociadas se muestran en la tabla 2.
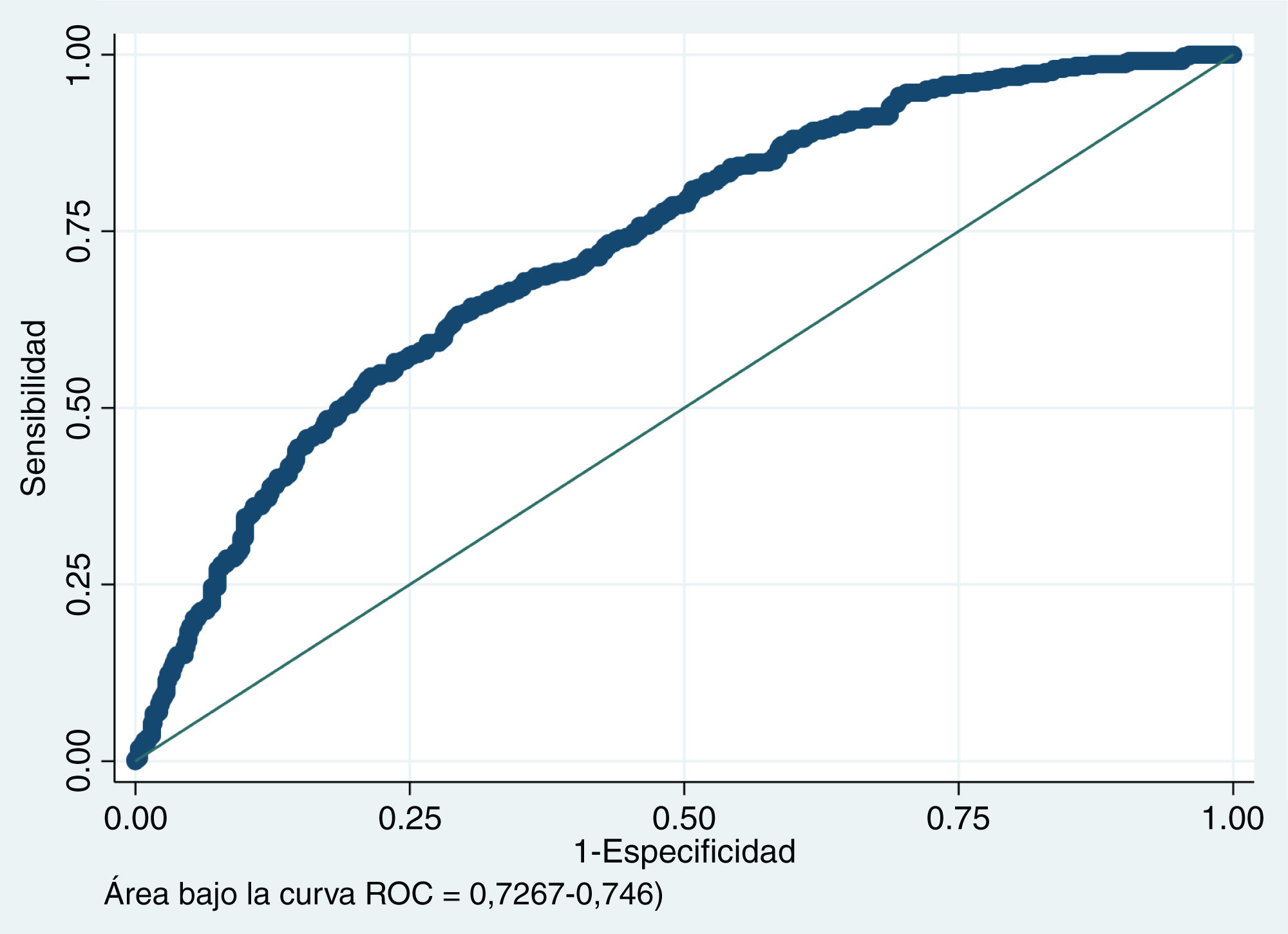
En una curva ROC del desempeño pronóstico del modelo sobre su capacidad discriminatoria para fallecer, el resultado fue 0,72, tal y como se muestra en la figura 2.
DiscusiónLa VD/VT inicial, así como la edad mayor y el SOFA inicial, se asociaron con una mayor mortalidad hospitalaria en los pacientes con SDRA por COVID-19 que requirieron VMI. De tal forma, que el VD/VT medido al inicio de la VMI fue diferente entre las 2cohortes (0,27 vs. 0,31; p<0,001) (HR: 1,24; IC 95%: 1,003-1,525; p=0,046), lo cual indica que la relación VD/VT puede ser un indicador importante de la gravedad y los desenlaces clínicos en pacientes con SDRA por COVID-19 en VMI.
En la cohorte con mayor mortalidad había pacientes más viejos, con mayor puntaje de gravedad por APACHE II y tenían más disfunción orgánica y un mayor índice de Charlson, hallazgos similares a los encontrados en diferentes estudios observaciones en Estados Unidos14-16. De la misma forma, en la cohorte de fallecidos, se encontró un mayor VD/VT y volumen minuto inicial, datos similares a los encontrados por Xia et al.5, quienes investigaron la presencia de cambios fisiopatológicos en fases tardías de SDRA grave en pacientes con COVID-19 y que relacionaron con heterogenidad regional en la ventilación/perfusión7, pérdida de la regulación de la perfusión pulmonar y la vasoconstricción hipóxica17, microtrombosis pulmonar18 o con un aumento del espacio muerto anatómico debido a cambios pulmonares estructurales5.
Kallet et al.19, en una cohorte de 59 pacientes con SDRA de diferentes causas, encontraron que una VD/VT>0,6 estaba presente en todos los pacientes que fallecieron, mientras que, entre los sobrevivientes, generalmente la VD/VT estuvo entre 0,46 y 0,53. Por tanto, ellos establecieron una VD/VT de 0,55 como valor pronóstico.
A pesar de que en esta investigación se encontró una media de VD/VT de 0,27 entre los vivos y de 0,31 entre los muertos, concordante con otros trabajos18,19, el valor fue mucho menor, lo cual puede deberse a que se recogió la VD/VT al inicio de la VMI y no se tomaron registros sucesivos, como hicieron Kallet et al.19, lo cual pudo evidenciar un mayor compromiso ventilatorio a lo largo del tiempo.
En un metaanálisis, Jayasimhan et al.12 encontraron que el espacio muerto estaba vinculado de manera autónoma con la mortalidad en pacientes con SDRA, independientemente de su etiología. Nuckton et al.18, en un estudio prospectivo observacional con 179 pacientes intubados con SDRA, encontraron una VD/VT, calculada según la adaptación de Enghoff de la ecuación de Bohr, significativamente más alta en los pacientes fallecidos (0,63±0,10 vs. 0,54±0,09; p<0,001), siguiendo la línea de los resultados encontrados en esta investigación. De manera similar, Kallet et al.20, en un estudio retrospectivo basado en capnografía volumétrica al inicio del diagnóstico del SDRA, demostraron una asociación entre la VD/VT y la mortalidad en pacientes con SDRA moderado y grave, con un aumento del 22% en la mortalidad por cada incremento de 0,05 en la VD/VT.
En esta investigación no se hallaron diferencias significativas al comparar la RV y el VMC entre los 2grupos, lo cual se podría atribuir a la posible disonancia temporal entre la toma de los gases y el registro de los datos ventilatorios.
En el análisis multivariado, la edad, el SOFA inicial, así como un mayor VD/VT, se asociaron de forma independiente con aumento de la mortalidad en este grupo de pacientes, lo que concuerda con la literatura existente14,15. Aunque en el análisis univariado la hipertensión arterial mostró una asociación con la mortalidad, en el análisis multivariado se reveló como un factor protector. Este hallazgo puede deberse a la participación del sistema enzimático renina-angiotensina (RAS) con la disfunción endotelial, la tormenta de citocinas inflamatorias y el estado protrombótico observado en casos graves de COVID-19, lo cual podría modularse con el uso crónico de RASi21.
Aunque la evidencia respalda la medición del espacio muerto en la práctica de cuidado crítico, su aplicación en la cabecera del paciente es limitada debido a la falta de elementos de medición, como capnógrafos o capnografía volumétrica en muchas unidades22, así como a la dificultad para interpretar fisiológicamente esta información y a la carencia de estudios rigurosos desde el punto de vista metodológico que respalden mejores desenlaces con estrategias terapéuticas encaminadas a disminuir el espacio muerto23. En cirugía cardíaca24, la medición del espacio muerto ofrece información valiosa sobre la función pulmonar y facilita el monitoreo del reclutamiento pulmonar y el ajuste de la PEEP, evitando la sobredistensión regional22,25. También puede ayudar a identificar a pacientes que podrían beneficiarse de intervenciones específicas, como la remoción extracorpórea de CO225.
Este estudio tiene varias fortalezas, como la inclusión de un gran número de pacientes, que si bien tenían como diagnóstico principal SDRA por COVID-19, la evidencia12,19 respalda la asociación entre espacio muerto y mortalidad en diversos tipos de SDRA, incluyendo el causado por COVID-19. Además, se empleó una estrategia de medición ampliamente disponible en la mayoría de las unidades, lo que facilita su implementación en la práctica diaria.
La investigación también tiene algunas limitaciones. Se realizó en un solo centro, lo cual podría comprometer la generalización de los resultados, aunque estos son consistentes con lo encontrado en la literatura18,26. Aunque la fórmula ideal de calcular el espacio muerto es la de la capnografía volumétrica, en la práctica no se utiliza, lo cual hace que nuestros resultados sean más aplicables en el día a día. Si bien el enfoque de Enghoff para el cálculo de la VD/VT puede estar contaminado por grandes fracciones de shunt presentes en el SDRA, esta variable nos permite evaluar globalmente la eficiencia pulmonar del intercambio gaseoso8 y existe evidencia de este cálculo con desenlaces. Por último, al ser un estudio retrospectivo, pueden existir potenciales problemas de calidad y precisión de los datos, como la disonancia temporal entre la toma de gases y el registro de datos ventilatorios. Algunos factores, como procedimientos de enfermería, fisioterapia y ajustes de ventilación, pueden afectar a la precisión de los datos al aumentar la producción de CO2 en más del 20% durante hasta 45 min27. La falta de control sobre las variables de confusión se minimiza con el análisis multivariable y, al incluirse la cohorte completa de pacientes, se pudo minimizar el sesgo de selección. Por estas limitaciones se hace evidente la necesidad de estudios prospectivos para enriquecer el conocimiento acerca de las variables relacionadas con la ventilación en SDRA.
Pese a esta evidencia, si guiar el tratamiento del SDRA con el objetivo de reducir la ventilación del espacio muerto mejora los desenlaces clínicos aún es materia de investigación y no podría ser concluido en nuestro trabajo de investigación.
En conclusión, la VD/VT medida a través de datos tomados de la capnografía de tiempo se asoció de manera independiente con la mortalidad en pacientes con SDRA por COVID-19, lo cual puede dar más herramientas a los médicos que atienden este tipo de pacientes y sirve para establecer nuevas hipótesis de investigación.
Contribución de los autoresConceptualización y diseño del estudio: Carlos Carvajal, Nelson Giraldo, Andrés David de la Hoz, Carlos Vidal, Hemel Pacheco, David Fernández, Laura González, Silvia Romero, Silvia Vergara, Juan Bolívar, Juliana Correa, Jorge Donado, Alejandro Narváez, Carlos Cadavid, Gisela de la Rosa.
Metodología: Carlos Carvajal, Nelson Giraldo, Andrés David de la Hoz, Gisela de la Rosa.
Análisis formal y recogida de la información: Carlos Carvajal, Nelson Giraldo, Carlos Vidal, Hemel Pacheco, David Fernández, Laura González, Silvia Romero, Silvia Vergara, Juan Bolívar, Juliana Correa, Alejandro Narváez, Carlos Cadavid.
Redacción del manuscrito original: Carlos Carvajal, Nelson Giraldo, Andrés David de la Hoz, Carlos Vidal, Hemel Pacheco, David Fernández, Laura González, Silvia Romero, Silvia Vergara, Juan Bolívar, Juliana Correa, Jorge Donado, Alejandro Narváez, Carlos Cadavid, Gisela de la Rosa.
Revisión del manuscrito y edición: Carlos Carvajal, Nelson Giraldo, Andrés David de la Hoz, Carlos Vidal, Hemel Pacheco, David Fernández, Laura González, Silvia Romero, Silvia Vergara, Juan Bolívar, Juliana Correa, Jorge Donado, Alejandro Narváez, Carlos Cadavid, Gisela de la Rosa.
Supervisión: Carlos Carvajal, Nelson Giraldo, Jorge Donado, Alejandro Narváez, Gisela de la Rosa.
FinanciaciónNo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.