Evaluar la mortalidad y diversos factores clínicos derivados del desarrollo de neumotórax (NTX) y/o neumomediastino (NMD) atraumáticos en pacientes críticos como consecuencia de la debilidad pulmonar asociada a la COVID-19 (DPAC).
DiseñoRevisión sistemática con metaanálisis.
ÁmbitoUnidad de cuidados intensivos (UCI).
ParticipantesInvestigaciones originales en las que se evaluase a pacientes, con o sin necesidad de ventilación mecánica invasiva (VMI), con diagnóstico de COVID-19 que hubiesen desarrollado NTX o NMD atraumáticos al ingreso o durante su estancia hospitalaria.
IntervencionesSe obtuvieron los datos de interés de cada artículo que fueron analizados y evaluados por la Escala Newcastle-Ottawa. El riesgo de las variables de interés principales se evaluó por los datos derivados de los estudios que incluyeron a pacientes que desarrollaron NTX o NMD atraumáticos.
Variables de interés principalesMortalidad, estancia media en la UCI y PaO2/FiO2 media en el momento diagnóstico.
ResultadosSe recogieron datos de 12 estudios longitudinales. En el metaanálisis se incluyeron datos de un total de 4.901 pacientes, entre los cuales 1.629 presentaron un episodio de NTX y 253 de NMD atraumáticos. A pesar de encontrar asociaciones significativamente fuertes, la alta heterogeneidad entre los estudios hace que la interpretación de los resultados deba hacerse con cautela.
ConclusionesLa mortalidad de los pacientes con COVID-19 fue mayor en los que desarrollaron NTX y/o NMD atraumáticos con respecto a los que no lo hicieron. La media del índice PaO2/FiO2 fue menor en los pacientes que desarrollaron NTX y/o NMD atraumáticos. Proponemos agrupar bajo el término DPAC estos casos.
To assess mortality and different clinical factors derived from the development of atraumatic pneumothorax (PNX) and/or pneumomediastinum (PNMD) in critically ill patients as a consequence of COVID-19-associated lung weakness (CALW).
DesignSystematic review with meta-analysis.
SettingIntensive care unit (ICU).
ParticipantsOriginal research evaluating patients, with or without the need for protective invasive mechanical ventilation (IMV), with a diagnosis of COVID-19 who had developed atraumatic PNX or PNMD on admission or during their hospital stay.
InterventionsData of interest were obtained from each article and analysed and assessed by the Newcastle-Ottawa Scale. The risk of the variables of interest was assessed by data derived from studies including patients who developed atraumatic PNX or PNMD.
Main variables of interestMortality, mean ICU length of stay and mean PaO2/FiO2 at diagnosis.
ResultsData were collected from 12 longitudinal studies. Data from a total of 4,901 patients were included in the meta-analysis. A total of 1,629 patients had an episode of atraumatic PNX and 253 patients had an episode of atraumatic PNMD. Despite finding significantly strong associations, the high heterogeneity between studies means that interpretation of the results should be made with caution.
ConclusionsMortality of COVID-19 patients was higher in those who developed atraumatic PNX and/or PNMD compared to those who did not. The mean PaO2/FiO2 index was lower in patients who developed atraumatic PNX and/or PNMD. We propose to group these cases under the term CAPD.
La ventilación mecánica (VM) se ha convertido en un recurso básico en las unidades de cuidados intensivos (UCI) actuales. Sin embargo, su uso no está exento de riesgos. Las lesiones que se asocian a la VM pueden aparecer de novo o contribuir a la perpetuación o empeoramiento de lesiones torácicas preexistentes, que suponen un compromiso cardiopulmonar. Entre dichas enfermedades destaca el síndrome de distrés respiratorio del adulto (SDRA). Este cuadro sindrómico da lugar a una disminución importante de la complianza pulmonar, y esto predispone a una mayor tendencia a sufrir barotrauma, utilizando incluso VM con parámetros protectores. Precisamente, uno de los mayores avances en las últimas décadas en el campo de la VM ha sido el incremento del conocimiento y el control de las complicaciones que asocia esta técnica1–3.
Durante la pandemia por la COVID-19 se ha observado un aumento del número de casos de neumotórax (NTX) y neumomediastino (NMD) atraumáticos en pacientes infectados por SARS-CoV-2 que supera las tasas esperables de aparición de esta complicación en la UCI4. Es difícil saber si este aumento de incidencia se debe realmente a una complicación de la infección por SARS-CoV-2, a un mayor rendimiento diagnóstico de las pruebas solicitadas o a otras causas relacionadas con la sobrecarga asistencial en las UCI (manejo de VM por personal menos experto, mayor número de pacientes asignado a cada médico, etc.). Algunos estudios parecen indicar que la infección por SARS-CoV-2 aumenta per se el riesgo de desarrollar NTX espontáneo5,6. Dicho virus respiratorio podría ser el responsable de la debilidad pulmonar que desarrollan estos pacientes y que los expone al desarrollo de NTX y/o NMD, tanto espontáneos como asociados a barotrauma, incluso cuando se emplea VM no invasiva o VM invasiva con parámetros ventilatorios protectores. Por tanto, el objetivo de esta revisión fue evaluar la mortalidad y diversos factores clínicos derivados del desarrollo de NTX, NMD y/o neumopericardio (NPC) atraumáticos, incluyendo los casos espontáneos (pacientes sin VM) y aquellos posiblemente asociados a barotrauma (pacientes sometidos a VM no invasiva o VMI), en pacientes críticos como consecuencia de la debilidad pulmonar asociada a la COVID-19 (DPAC).
MétodosBúsqueda de literaturaSe realizó una revisión sistemática de la literatura científica disponible de acuerdo con las recomendaciones de las guías Preferred Reporting Items for Systematic Reviews and Meta-analyses (PRISMA)7. El protocolo de nuestro estudio se registró y publicó en el International Prospective Register of Systematic Reviews: CRD42022359045.
Se realizó una búsqueda en las bases de datos Medline, Web of Science Core Collection (Thomson Reuters) y Scopus (Elsevier) hasta el 1 de agosto de 2022. La estrategia de búsqueda se realizó combinando los términos MeSH y operadores booleanos apropiados como ((Pneumothorax) AND (COVID-19)) OR ((pneumomediastinum) AND (COVID-19)) OR ((barotrauma [MeSH Terms]) AND (SARS COV-2[MeSH Terms])). Además, la búsqueda se completó examinando las referencias de los artículos incluidos para aumentar la sensibilidad de la búsqueda.
Criterios de selección de estudiosLa búsqueda se limitó a investigación original, incluidos los estudios observacionales (diseño de cohortes o de casos y controles), a los idiomas inglés o español y a los trabajos que fueran de acceso libre. Se excluyeron otros tipos de artículos, como informes de casos, cartas de investigación o actas de congresos.
Los requisitos de elegibilidad de los estudios eran que los pacientes que se incluyesen fuesen mayores de edad, con un diagnóstico de laboratorio de COVID-19 mediante reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) y con una presentación clínica que abarcase NTX atraumático, NMD o NPC bien en su presentación inicial o durante el tratamiento de la neumonía por SARS-CoV-2. Por tanto, y siguiendo el acrónimo PICOS, la población (P) incluyó a pacientes con COVID-19, la intervención o exposición (I) fue la presentación clínica de NTX y/o NMD, la comparación (C) fue la ausencia de presentación clínica como NTX y/o NMD, el resultado (O) fue la mortalidad y el diseño de estudio (S) fueron estudios longitudinales8.
Resultado principal y evaluación de la calidadEl resultado primario de interés fue la mortalidad estratificada en función del evento acontecido. Los resultados secundarios de interés fueron los factores de riesgo precipitantes del NTX y/o NMD y el impacto de estos en términos de duración de la estancia en la UCI.
La evaluación de la calidad de los estudios incluidos se realizó mediante la Escala de Newcastle-Ottawa (Newcastle-Ottawa Score, NOS) de 9 estrellas9 por los 3 primeros autores independientemente. Se evaluó el riesgo de sesgo en relación con la selección, la comparabilidad y los resultados. Se consideró de alta calidad (bajo riesgo de sesgo) a los estudios que obtuvieron 8 o 9 puntos; de calidad media (riesgo de sesgo medio) a los estudios que obtuvieron 6 o 7 puntos y de baja calidad (alto riesgo de sesgo) a los estudios que obtuvieron 5 puntos o menos.
Extracción y síntesis de datosLa extracción de datos fue realizada por los 3 primeros autores independientemente para garantizar el cumplimiento de las guías PRISMA. Se utilizó un formulario estandarizado predefinido que recogía la información de interés de los estudios seleccionados. Los datos incluidos en dicho formulario fueron los siguientes:
- a)
Nombre del primer autor.
- b)
Tipo de diseño del estudio.
- c)
Año de publicación.
- d)
País de realización.
- e)
Edad de la población estudiada.
- f)
Sexo.
- g)
Comorbilidades asociadas en el momento del diagnóstico.
- h)
Tipo de evento: NTX, NMD o NPC.
- i)
Tipo de soporte ventilatorio: ninguno, oxigenoterapia de bajo flujo convencional, ONAF, VMNI o VMI.
- j)
Parámetro relacionado con el intercambio gaseoso, como la PaO2/FiO2.
- k)
Repercusión clínica valorada por la mortalidad hospitalaria.
Las variables cuantitativas se expresaron como odds ratio (OR) y diferencias de medias (DM) con intervalos de confianza (IC) del 95%. Se aplicó el método de ponderación de la varianza inversa, con un modelo de efectos aleatorios, y se analizó la heterogeneidad mediante el estadístico I2 con valores de corte convencionales para la heterogeneidad alta (>75%), moderada (50-75%) y baja (<50%), y la prueba Q de Cochran, con un nivel de significación fijado en p<0,20. Se realizaron pruebas de 2 colas con valores significativos fijados en p<0,05. Todos los análisis estadísticos se realizaron con el programa informático Cochrane Review Manager 3.0. Además, se realizó el test de Egger para analizar la sensibilidad del riesgo de sesgo a través del software estadístico Stata V.15 (Stata Corp, College Station, TX, EE. UU.).
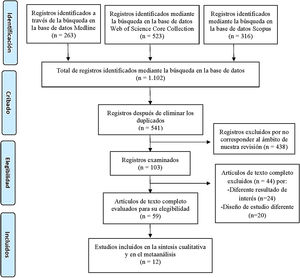
ResultadosEstudios incluidos y diagrama de flujoLa estrategia de búsqueda planteada arrojó un total de 1.102 artículos publicados. La identificación de los registros duplicados y su posterior exclusión redujo a 541 los artículos para el cribado. Tras el proceso de cribado y elegibilidad, únicamente se incluyeron 12 estudios en esta revisión que cumplieron los criterios de inclusión10–21. El resumen del proceso de selección de artículos se muestra en la figura 1.
Diagrama de flujo del proceso de selección de los estudios incluidos en esta revisión sistemática, según las directrices PRISMA7.
Los 12 estudios incluidos recogían datos de un total de 4.901 pacientes. La distribución geográfica de los estudios encontrados fue variada: 4 (33,33%) trabajos fueron realizados en el continente americano (exclusivamente en Estados Unidos), 3 (25%) estudios en el europeo, 4 (33,33%) en Medio Oriente y uno (8,33%) en el continente asiático. La mayoría de los pacientes incluidos en los artículos recogidos fueron hombres, representando un 62,34% del total (n=3.060). Las comorbilidades más frecuentemente encontradas al ingreso de los pacientes recogidos en los diferentes estudios fueron diabetes mellitus (72,27% del total de los estudios incluidos), hipertensión arterial (68,18%), EPOC (59,09%), enfermedad renal crónica (45,45%), enfermedad coronaria (45,45%) y cáncer (31,81%). Todos los trabajos recogieron la aparición de NTX entre la población evaluada, a excepción de 2 de ellos20,21. El desarrollo de NMD se observó en 9 de los estudios incluidos (75%) y el de NPC en 2 de ellos (16,66%). La tabla 1 recoge las características principales de los estudios seleccionados.
Principales características de los estudios seleccionados
| Estudio. Año | País | N | Edada | Sexo: n (%) | Comorbilidades: n (%) | Soporte ventilatorio: n (%) | Evento | Tiempo en UCIa |
|---|---|---|---|---|---|---|---|---|
| Estudios de cohortes | ||||||||
| Taha et al.11, 2022 | EE. UU. | 334 | 61±14 | H: 188 (56)M: 148 (44) | EPOC: 75 (22); Asma: 34 (10); HTA: 266 (79); DM:2 00 (60); EC: 67 (20); ICC: 68 (20); Ictus: 49 (14); ERC: 56 (16); EA: 18 (5) | ONAF: 7 (2,1); VMNI: 28 (8,4); VMI: 299 (89,5) | NTX | 23 (3-100) |
| Paul et al.12, 2021 | India | 45 | 53,3±14,9 | H: 37 (82,2)M: 8 (17,7) | DM: 17 (65,3); HTA: 11 (42,3); EC: 5 (19,2); Hipotiroidismo: 2 (7,6); Cáncer: 5 (19,2); ERC: 2 (7,6); hipertrigliceridemia: 1 (3,8); EPOC/asma: 1 (3,8) | ONAF: 8 (17,8); VMNI: 10 (22,2); VMI: 7 (15,5); O2 convencional: 16 (35,6); ninguno: 4 (8,9) | NTX. NMD | IND |
| Özdemir et al.13, 2021 | Turquía | 427 | 59,9±16,1 | H: 288 (67,4)M: 139 (32,6) | IND | VMNI: 73 (17,1); VMI: 354 (82,1) | NTX. NMD | IND |
| Gazivoda et al.14, 2021 | EE. UU. | 281 | IND | H: 192 (68,3)M: 89 (31,7) | Arritmia: 26 (9,3); Asma: 22 (7,8); EC: 48 (17,1); EPOC: 17 (6); DM: 147 (52,3); hiperlipidemia: 102 (36,3); HTA: 169 (60,1) | VMI: 281 (100) | NTX | 15 (5-22,5) |
| Guven et al.15, 2021 | Turquía | 75 | 60±17,9 | H: 51 (68)M: 24(32) | EC. HTA. DM | VMI: 75 (100) | NTX | 36,0±16,4 |
| Belletti et al.10, 2021 | Italia | 116 | IND | H: 98 (84,5)M: 18 (15,5) | Arritmias: 7 (6); Ictus: 6 (5,2); HTA: 52 (44,8); asma: 4 (3,5); EPOC: 2 (1,7); problema neurológico crónico: 3 (2,6); ERC: 7 (6); DMII: 19 (16,4); Cáncer: 4 (3,5) | VMI: 116 (100) | NTX. NMD | 28 (14,5-51) |
| Ozsoy et al.16, 2021 | Turquía | 70 | 59,15±13,85 | H: 32 (45,7)M: 38 (54,3) | HTA: 37 (52,9); DM: 29 (41,4); Asma: 17 (24,3); EPOC: 2 (2,9); ERC: 7 (10); Cáncer: 10 (14,3); EC: 5 (7,1) | No VM: 56 (80); VM: 14 (20) | NTX. NMD | IND |
| Elsaaran et al.17, 2021 | Kuwait | 343 | IND | H: 70 (65,4)M: 37 (34,6) | IND | VMNI: 64 (18,8); VMI: 279 (81,2) | NTX. NMD. NPC | 14,9±7,8 |
| Jones et al.18, 2020 | Reino Unido | 83 | IND | H: 61 (73,5%)M: 22 (26,5%) | Asma: 10 (12,8); Enfermedad del tejido conectivo: 4 (4,8) | VMNI: 34 (41); VMI: 49 (59) | NTX. NMD | IND |
| Kahn et al.19, 2021 | EE. UU. | 75 | IND | H: 55 (73,3%)M: 20 (26,7%) | HTA: 36 (48); DM 2: 43 (57,3); EPOC: 1 (1,3); Asma: 2 (2,7); ERC: 14 (18,7); Cirrosis: 3 (4); Cáncer: 4 (5,3) | No VMI: 36 (48); VMI: 39 (52) | NTX. NMD. NPC | 17 (15-30,5) |
| Lemmers et al.20, 2020 | Italia | 332 | IND | H: 239 (72%)M: 93 (28%) | DM: 73 (22); HTA: 186 (56); EPOC: 26 (7,8) | VMI: 332 (100) | NMD | 9 (5-18) |
| Estudio de casos y controles | ||||||||
| Reis et al.21, 2022 | EE. UU. | 174 | 61±14 | H: 112 (64,4%)M: 62 (35,6%) | EPOC: 14 (8); ERC: 26 (14,9); asma: 27 (15,5); HTA:107 (61,5); ICC: 11 (6,3); DM: 78 (44,8); obesidad: 70 (40,2) | IND | NMD | IND |
DM: diabetes mellitus; EA: enfermedad autoinmune; EC: enfermedad coronaria; EPI: enfermedad pulmonar intersticial; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; H: hombres; HTA: hipertensión arterial; ICC: insuficiencia cardíaca crónica; IND: información no disponible; M: mujeres; N: número de sujetos; NMD: neumomediastino; NPC: neumopericardio; NTX: neumotórax; ONAF: oxígeno nasal a alto flujo; UCI: unidad de cuidados intensivos; VM: ventilación mecánica; VMI: ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva.
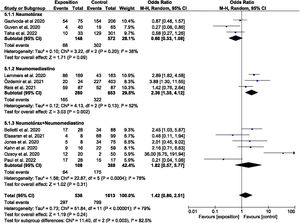
El análisis cuantitativo se dividió en varios subgrupos. La odds ratio para los estudios que evaluaron la mortalidad de NTX, NMD y NTX+NMD atraumáticos se muestra en la figura 2. El análisis agrupado resultó en una OR de 1,42 (IC 95%: 0,80-2,51), con heterogeneidad alta (I2=79,00%; p<0,00001), pero hubo diferencias entre los subgrupos evaluados. El subgrupo que evaluó la mortalidad del NMD arrojó una OR=2,36 (IC 95%: 1,35-4,12), aunque el índice de heterogeneidad I2 tuvo un valor del 52% mostrando una heterogeneidad estadísticamente significativa (p=0,13). Por otro lado, se evaluó la mortalidad estratificando en función de la región geográfica donde se desarrollaron los estudios (Europa occidental+EE. UU. frente a otros), como se puede observar en la figura 1 del material suplementario. La OR fue 1,51 (IC 95%: 0,92-2,49) para los países de Europa occidental+EE. UU. frente a la OR de 1,42 (IC 95%: 0,22-7,33) del resto de países. Aun así cabe destacar la elevada heterogeneidad que se continuó encontrando (I2=79,00%; p<0,00001).
La diferencia de medias de la PaO2/FiO2 fue –43,16mmHg (IC 95%: –56,40 a –29,92) con un bajo índice de heterogeneidad (I2=26%; p=0,25). Estos resultados indican que la media del grupo de pacientes que desarrollaron NTX y/o NMD atraumáticos fue menor en comparación con el grupo que no desarrolló el evento a estudio. En concreto, la diferencia es mayor en el subgrupo que desarrolló NMD con una diferencia de medias estimada en –45,89 (IC 95%: –70,45 a –21,33), pero con un alto índice de heterogeneidad (I2=52%; p=0,12). Sin embargo, en el caso del desarrollo del NTX las diferencias de medias estimadas fueron similares a las del subgrupo anterior, pero el índice de heterogeneidad mostrado fue bajo (I2=0%; p=0,68), como se puede apreciar en la figura 3. Es importante destacar la cautela con la que se han de interpretar estos estudios debido al limitado tamaño muestral y la cantidad de estudios incluidos en este diagrama de bosque.
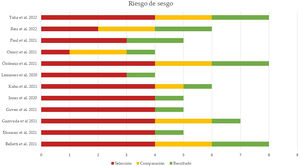
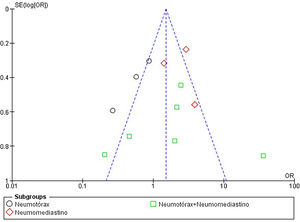
Evaluación del riesgo de sesgos y de publicaciónLa calidad de los estudios incluidos en el metaanálisis fue evaluada en función del riesgo de sesgo de selección, de comparación y de resultado, como indica la NOS. La puntuación media de todos los estudios fue 5,91 (mediana 5,5, rango 4-8). El 50% de los estudios (n=6) tuvo un alto riesgo de sesgo (puntuación igual o menor a 5), un cuarto de los estudios (n=3) presentó un riesgo de sesgo moderado (puntuación entre 6 y 7) y el 25% restante (n=3) mostró un bajo riesgo de sesgo (puntuación entre 8 y 9). La figura 4 resume los principales resultados de la evaluación del riesgo de sesgo, que se puede consultar más detalladamente en la figura 2 del material suplementario. El sesgo de publicación del riesgo de mortalidad en pacientes con NTX y/o NMD atraumáticos se representó en un diagrama de embudo, como se muestra en la figura 5. La silueta del gráfico no mostró sesgos significativos. Esto se comprobó con la realización del test de Egger para el efecto de estudios pequeños, que no fue estadísticamente significativo (p=0,700), como se muestra en la figura 3 del material suplementario.
Este metaanálisis recoge y combina la información disponible acerca de la asociación de desarrollar NTX, NMD o NPC atraumáticos, ya sean espontáneos en pacientes no conectados a VM o atribuibles a barotrauma en aquellos sometidos a VM, en algunos grupos de pacientes ingresados por COVID-19 en UCI. A pesar de que nuestros resultados parecen indicar una asociación positiva con la mortalidad intrahospitalaria, las estimaciones de resumen deben tomarse con precaución por la alta heterogeneidad mostrada y la elevada cantidad de estudios con calidad metodológica baja-media.
Debilidad pulmonar asociada a la COVID-19, ¿una entidad por definir?Las epidemias de coronavirus informadas con anterioridad, SARS en China en 2002, mostraron asociación entre la presentación clínica de neumonía y el desarrollo de NTX y NMD22. Algunos virus de la familia del SARS presentan un mecanismo de entrada celular a través de la proteína convertidora de angiotensina ii (ECA II)23. Los neumocitos son células con abundantes receptores ECA II, aunque no son las únicas de nuestro organismo. Por ejemplo, el tubo digestivo es otro órgano que presenta abundantes receptores de ECA II y se han estudiado diferentes estrategias terapéuticas dirigidas a estas moléculas para algunas enfermedades, como la diabetes mellitus tipo 2 o la enfermedad de Crohn24. Así mismo, se han descrito casos de neumoperitoneo espontáneo en pacientes graves con COVID-196.
La respuesta frente al virus por parte del hospedador se basa en una liberación prolongada de citoquinas proinflamatorias y anticuerpos dirigidos contra este microorganismo intracelular y que, como consecuencia de este ataque inmunológico, acaba dañando la pared alveolar. La función de los macrófagos perialveolares justifica la condensación radiológica y la imposibilidad de un intercambio gaseoso adecuado que precipita un descenso en el índice PaO2/FiO2 y el desarrollo del SDRA25. Esta rotura alveolar ha sido propuesta como la base fisiopatológica del NTX y NMD espontáneo en pacientes no ventilados. En cambio, el NTX asociado a barotrauma se produce por el llamado efecto Macklin. Este efecto justifica la disección que produce el aire intrapulmonar del intersticio broncopulmonar hacia el hilio pulmonar, ya en el mediastino26. Ambas entidades clínicas son emergencias médicas que requieren una rápida actuación clínica. El manejo mayoritario de estos eventos se realiza a través de la inserción de un catéter de drenaje torácico con apoyo ventilatorio con una PEEP lo más baja posible27. Estos autores también consideran la VILI (ventilator-induced lung injury) como un posible mecanismo causal y proponen algunas actuaciones preventivas para paliar su desarrollo, como que el volumen corriente y el esfuerzo respiratorio sea limitado, que los niveles de PEEP se ajusten a cada paciente de una manera óptima y que se haga un esfuerzo en discernir qué pacientes verdaderamente necesitan ser intubados y ventilados mecánicamente.
Por otro lado, cabe destacar que la realización de TC ha sido esencial en el diagnóstico de la mayoría de los estudios informados en la literatura28,29. La disyuntiva acerca de si verdaderamente se debe a una complicación propia de esta enfermedad o a un mejor rendimiento diagnóstico de las pruebas solicitadas llevó a Knox et al.5 a realizar un estudio multicéntrico donde evaluaban los casos de NTX y NMD prepandémicos en comparación con los ocurridos durante la pandemia en una gran cohorte de pacientes críticos. Sus datos arrojaron que verdaderamente existe un mayor riesgo de desarrollar NTX atraumáticos como complicación de la infección por COVID-19. Estos resultados van en la misma línea que los obtenidos por nuestro estudio, aunque con un menor riesgo y un IC más limitado.
Se ha demostrado que la infección por COVID-19 produce un debilitamiento pulmonar que puede estar asociado al desarrollo de NTX y NMD de manera atraumática30. La identificación de dichos eventos como atraumáticos podría hacer más homogéneos los estudios realizados sobre un mismo evento. Este motivo nos mueve a proponer la identificación de una nueva entidad clínica bajo el nombre de debilidad pulmonar asociada a COVID-19 (DPAC).
Limitaciones y aplicabilidad de los resultadosNuestro estudio tiene varias limitaciones. En primer lugar, la alta heterogeneidad de los estudios incluidos hace que los resultados obtenidos se tengan que interpretar con cautela. Esta heterogeneidad se ha basado en la variabilidad en el diseño y la medio-baja calidad de la mayoría de los estudios. A esto se suma el alto riesgo de sesgo en el adecuado seguimiento del estudio con diseño de casos y controles para valorar la mortalidad en el metaanálisis. A pesar de que la inclusión de este estudio aumentó la sensibilidad de la búsqueda y minimizó un posible sesgo de publicación, puede dificultar la interpretación de este análisis21. Por otro lado, y desde una perspectiva metodológica, no se contactó con autores de trabajos previos para conocer en profundidad diferentes aspectos de los datos publicados y acerca de posibles estudios aun sin publicar, ya que no se incluyó artículos procedentes de la literatura gris. Además, la estrategia de búsqueda es posible que no haya alcanzado unos niveles óptimos de sensibilidad y especificidad debido a que la búsqueda por conglomerados de otros estudios identificados arrojó varios estudios que no habíamos identificado en la búsqueda bibliográfica.
Como puntos fuertes este estudio establece la necesidad de identificar como entidad clínica la DPAC, ya que podría mejorar la homogeneidad de futuros estudios y aportar un mayor consenso en el manejo del paciente crítico, además de establecer diferencias entre la identificación de factores de confusión y factores que verdaderamente puedan intervenir o pronosticar el desarrollo de los eventos descritos en este estudio. Finalmente, las secuelas generales derivadas de la COVID-19 han sido clínicamente relevantes31,32. Este motivo haría interesante conocer las posibles secuelas de los pacientes recuperados de estos eventos a largo plazo.
ConclusionesLa mortalidad de los pacientes con COVID-19 fue mayor en los que desarrollaron NTX y/o NMD atraumáticos con respecto a los que no lo hicieron. La media del índice PaO2/FiO2 fue menor en los pacientes con COVID-19 que desarrollaron NTX y/o NMD atraumáticos. Proponemos la necesidad de agrupar bajo el término de debilidad pulmonar asociada a COVID-19 (DPAC) los casos de NTX y NMD atraumáticos en pacientes con COVID-19 que no estuvieran ventilados o que recibieran una ventilación a bajas presiones (VT menor o igual de 6-8ml/kg de peso).
Contribución de los autoresConceptualización y diseño del estudio: Pablo Redruello-Guerrero, Mario Rivera-Izquierdo y Antonio Cárdenas Cruz; metodología: Pablo Redruello-Guerrero, Antonio Jesús Láinez Ramos-Bossini, Ana Carrasco Cáliz, Alejandro Romero-Linares y Mario Rivera-Izquierdo; análisis formal y recogida de la información: Pablo Redruello-Guerrero, Marta Ruiz del Pino y Carmen Jiménez-Gutiérrez; redacción del manuscrito original: Pablo Redruello-Guerrero, Marta Ruiz del Pino, Carmen Jiménez-Gutiérrez, Paula Jiménez-Gutiérrez y Antonio Jesús Láinez Ramos-Bossini; revisión del manuscrito y edición: Pablo Redruello-Guerrero, Marta Ruiz del Pino, Carmen Jiménez-Gutiérrez, Paula Jiménez-Gutiérrez, Antonio Jesús Láinez Ramos-Bossini, Ana Carrasco Cáliz, Alejandro Romero-Linares y Mario Rivera-Izquierdo; supervisión: Antonio Cárdenas Cruz, Mario Rivera-Izquierdo y Antonio Jesús Láinez Ramos-Bossini. Todos los autores han leído y aceptado la versión publicada del manuscrito.
FinanciaciónFinanciación de la tasa de acceso abierto: Universidad de Granada/CBUA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses que declarar.
Agradecemos la apuesta que hace el Departamento de Medicina de la Universidad de Granada en fomentar, estimular e incentivar la iniciación en la investigación clínica de sus estudiantes de grado.