Los objetivos principales son describir la práctica de la ventilación mecánica en un periodo de 18 años en México y estimar los cambios en la mortalidad de los pacientes críticos con ventilación mecánica invasiva (VMI).
DiseñoSubanálisis retrospectivo de un estudio prospectivo y observacional en 1998, 2004, 2010 y 2016.
ÁmbitoUnidades de Cuidados Intensivos (UCI) de México.
ParticipantesPacientes adultos que ingresaron consecutivamente en la UCI, durante un mes y que recibieron VMI durante más de 12 h o ventilación mecánica no invasiva durante más de una hora. El seguimiento se realizó hasta 28 días después de la inclusión.
IntervencionesNinguna.
Variables de interésEdad, sexo, gravedad al ingreso estimada por el SAPS II, parámetros de la gasometría arterial diaria, variables de tratamiento y complicaciones, fecha y estado al alta de la UCI y del hospital.
ResultadosSe incluyó a 959 pacientes en 81 UCI. El volumen corriente (VC) ha disminuido significativamente tanto en pacientes con criterios de SDRA (de 8,5ml/kg de peso estimado en 1998 a 6ml/kg en 2016; p < 0,001) como en enfermos sin SDRA (de 9ml/kg de peso estimado en 1998 a 6ml/kg en 2016; p < 0,001). La estrategia ventilatoria protectora (definida como VC < 6 ml/kg o < 8ml/kg y una presión meseta <30 cmH2O) fue: 19% en 1998, 44% en 2004, 58% en 2010 y 75% en 2016 (p < 0,001). La mortalidad ajustada en UCI a lo largo de los 4 periodos fue: en 2004, oportunidad relativa (OR) 1,05 (IC 95%: 0,73-1,72; p = 0,764); en 2010, OR 1,68 (IC 95%: 1,13-2,48; p = 0,009); en 2016, OR 0,85 (IC 95%: 0,60-1,20; p = 0,368).
ConclusionesLa práctica clínica de la VMI en las UCI de México se ha modificado a lo largo de un periodo de 18 años. El cambio más significativo es la estrategia ventilatoria basada en VC bajos. Estos cambios no se han asociado a cambios significativos en la mortalidad.
The main study objectives were to describe the practice of mechanical ventilation over an 18-year period in Mexico, and estimate changes in mortality among critical patients subjected to invasive mechanical ventilation (IMV).
DesignA retrospective subanalysis of a prospective observational study conducted in 1998, 2004, 2010 and 2016 was carried out.
SettingIntensive Care Units (ICUs) in Mexico.
ParticipantsAdult patients consecutively enrolled in the ICU during one month and who underwent IMV for more than 12hours or noninvasive mechanical ventilation for more than one hour. Follow-up was performed up to a maximum of 28 days after inclusion.
InterventionsNone.
Principal variables of interestAge, sex, severity upon admission as estimated by SAPS II, parameters of daily arterial blood gases, treatment and complication variables, date and status at discharge from the ICU and from hospital.
ResultsA total of 959 patients were included in 81 ICUs. Tidal volume (vt) decreased significantly both in patients with acute respiratory distress syndrome (ARDS) criteria (estimated 8.5ml/kg b.w. in 1998 to 6ml/kg in 2016; P<0.001) and in patients without ARDS (estimated 9ml/kg b.w. in 1998 to 6ml/kg in 2016; P<0.001). The ventilatory protective strategy (defined as vt < 6ml/kg or < 8ml/kg and a plateau pressure < 30cmH2O) was: 19% in 1998, 44% in 2004, 58% in 2010 and 75% in 2016 (P<0.001). The adjusted mortality rate in ICU over the 4 periods was: in 2004, odds ratio (OR) 1.05 (95% confidence interval, 95%CI: 0.73-1.72; P=0.764); in 2010, OR 1.68 (95%CI: 1.13-2.48; P=0.009); in 2016, OR 0.85 (95%CI: 0.60-1.20; P=0.368).
ConclusionsThe clinical practice of IMV in Mexican ICUs has been modified over a period of 18 years. The most significant change is the ventilatory strategy based on low vt. These changes have not been associated with significant changes in mortality.
En las últimas décadas se han realizado numerosos ensayos clínicos en los pacientes ingresados en las unidades de cuidados intensivos (UCI) con el objetivo de prevenir o de reducir la lesión pulmonar asociada al ventilador —uso de ventilación no invasiva1 (VNI), ventilación protectora del pulmón2,3, ajuste de la presión positiva al final de la espiración (PEEP)4, posición decúbito prono5, uso de bloqueantes neuromusculares6— y de disminuir la duración de la ventilación mecánica —uso adecuado de sedantes7,8 y la identificación precoz del momento de iniciar la desconexión de la ventilación mecánica—9. Algunas de estas intervenciones, que inicialmente se centraron en el tratamiento de pacientes con síndrome de distrés respiratorio agudo (SDRA), ahora parecen aplicables a todos los pacientes con ventilación mecánica10. El posible impacto clínico de los resultados de esas investigaciones en un ámbito concreto, como puede ser un país, está poco descrito.
Los objetivos de nuestro análisis fueron: 1) describir la evolución de la práctica clínica de la ventilación mecánica en México, 2) estimar si los cambios observados han seguido la evidencia científica actual y 3) estimar si la mortalidad ha cambiado a lo largo del tiempo.
Material y métodosEstudio de tipo subanálisis retrospectivo de los pacientes admitidos en las unidades de cuidados intensivos (UCI) de México participantes en 4 estudios prospectivos, observacionales de no intervención e internacionales de ventilación mecánica realizados en 199811, 200412, 201013 y 2016. Todos ellos han sido estudios prospectivos y observacionales de los pacientes ingresados durante un mes y que recibieron ventilación mecánica invasiva durante más de 12 h o VNI durante más de una hora. El seguimiento de los pacientes incluidos fue durante el tiempo de ventilación mecánica hasta un máximo de 28 después de la inclusión.
En todos los pacientes se registraron las siguientes variables: edad, sexo, gravedad al ingreso estimada por el SAPS II, gasometría arterial diaria, variables asociadas con el tratamiento (parámetros ventilatorios, sedación, bloqueantes neuromusculares) y complicaciones (SDRA, sepsis, neumonía asociada con el ventilador, fracaso cardiovascular, fracaso renal, fracaso hepático, fracaso hematológico), fecha y estado al alta de la UCI y del hospital.
El protocolo y las definiciones utilizadas se muestran como previamente se ha publicado13. Solo el investigador de cada UCI conocía las características del estudio para tratar de no influir en las prácticas diarias (listado de investigadores en el anexo). El estudio fue aprobado por el comité ético de cada institución participante y la necesidad de consentimiento informado se aplicó de acuerdo con las regulaciones locales. El estudio se ha ejecutado de acuerdo con las normas Strengthening the Reporting of Observational Studies in Epidemiology para estudios observacionales de cohortes14.
El objetivo de este análisis es evaluar si los cambios observados desde el primer estudio en 1998 hasta el último estudio en 2016 se han ajustado a las siguientes hipótesis surgidas de los ensayos clínicos publicados en las últimas décadas: a) aumento del uso de VNI, tanto en enfermos con enfermedad pulmonar crónica como en enfermos con insuficiencia respiratoria aguda hipoxémica; b) aumento en enfermos con SDRA de la aplicación de una estrategia de ventilación protectora definida como volúmenes tidal bajos o ajustados para mantener una presión meseta baja y uso de PEEP alta; c) evaluar si la ventilación protectora se aplica también a enfermos sin criterios de SDRA; d) evaluar cambios en la desconexión de la ventilación mecánica, como la frecuencia de uso de presión de soporte vs. prueba de respiración espontánea con tubo en T, tanto en el primer intento de desconexión como en la desconexión en enfermos con weaning difícil-prolongado y e) describir la práctica de la traqueotomía en la UCI a lo largo del tiempo. Finalmente, se evalúa si algunos de estos cambios han influido en la evolución de la mortalidad.
Análisis estadísticoSe describen las variables continuas como media (desviación estándar) o mediana (P25, P75) y las cualitativas como la frecuencia absoluta y relativa de cada uno de los valores de las variables. Se utilizó el test exacto de Fisher bilateral para las variables dicotómicas cuando el valor esperado de una celda era menor de 5. Se compararon las variables mediante los análisis univariados de ANOVA o el test de chi-cuadrado, según lo apropiado. El nivel de significación estadística fue una p < 0,05.
Para estimar los cambios en la mortalidad en el día 28 tras el inicio de la ventilación mecánica se realizó un análisis logístico multivariado y ajustado por las variables basales, los parámetros ventilatorios y las complicaciones ocurridas durante la ventilación mecánica, incluyéndose las variables con nivel de significación menor de 0,05. El riesgo de mortalidad hospitalaria se expresó como odds ratio (OR) e intervalo de confianza al 95% (IC 95%).
Para el análisis de los datos se utilizó Stata/SE 14.0 para Windows (Stata Corporation College Station, Texas, EE. UU.).
ResultadosCaracterísticas generales y desenlacesSe incluyó a 959 pacientes (408 pacientes en 1998, 119 pacientes en 2004, 132 pacientes en 2010 y 300 pacientes en 2016) admitidos en 81 UCI (se incluyeron 37, 5, 15 y 42 UCI mexicanas, en 1998, 2004, en 2010 y en 2016, respectivamente) y ninguna de ellas participó en los 4 estudios. Las características a la inclusión y los desenlaces se muestran en la tabla 1.
Características basales y desenlaces de los pacientes incluidos en los 4 estudios
| 1998 (N = 408) | 2004 (N = 119) | 2010 (N = 132) | 2016 (N = 300) | p | |
|---|---|---|---|---|---|
| Edad en años, media (DE) | 53 (16) | 54 (19) | 51 (21) | 48 (20,5) | 0,001 |
| Sexo, hombre, n (%) | 242 (60) | 79 (66) | 79 (59) | 198 (66) | 0,029 |
| SAPS II, puntos, media (DE) | 53 (17) | 43 (16) | 36 (17) | 47 (18) | <0,001 |
| Motivo de inicio de ventilación mecánica, n (%) | |||||
| EPOC | 24 (6) | 9 (8) | 10 (8) | 3 (1) | 0,002 |
| Asma | 4 (1) | - | - | 1 (0,3) | 0,365 |
| EPC no EPOC | - | 3 (2,5) | 1 (1) | 2 (1) | 0,023 |
| SDRA | 12 (3) | 8 (7) | 10 (8) | 11 (4) | 0,630 |
| Postoperatorio | 192 (47) | 16 (13) | 29 (22) | 47 (16) | <0,001 |
| Edema agudo de pulmón | 38 (9) | 3 (2,5) | 8 (6) | 14 (5) | 0,018 |
| Aspiración | 15 (4) | 2 (2) | 1 (1) | 4 (1) | 0,098 |
| Neumonía | 30 (7) | 9 (8) | 11 (8) | 30 (10) | 0,063 |
| Sepsis | 14 (3) | 17 (14) | 13 (10) | 38 (13) | <0,001 |
| Trauma | 74 (18) | 5 (4) | 6 (4,5) | 21 (7) | <0,001 |
| Parada cardiaca | - | 3 (2,5) | 2 (1,7) | 9 (3,2) | 0,010 |
| Enfermedad neurocrítica | 19 (5) | 34 (29) | 30 (23) | 100 (33) | <0,001 |
| Enfermedad neuromuscular | 4 (1) | 3 (2,5) | - | 6 (2) | 0,020 |
| Otras causas | 46 (11) | 7 (6) | 11 (8) | 14 (5) | 0,012 |
| Desenlaces | |||||
| Duración de la ventilación mecánica, días, mediana (P25, P75) | 3 (2, 4) | 6 (4, 9) | 6 (4, 9) | 5 (3, 8) | <0,001 |
| Días de la estancia en UCI, mediana (P25, P75) | 4 (3, 6) | 7 (4, 11) | 8 (5, 14) | 7 (4, 11,5) | <0,001 |
| Días de estancia en hospital, mediana (P25, P75) | 12 (8, 20) | 13 (7, 19) | 17 (10, 30) | 17 (8, 30) | <0,001 |
| Mortalidad en UCI, n (%) | 62 (15) | 31 (26) | 26 (20) | 65 (22) | 0,027 |
| Mortalidad día 28, n (%) | 67 (16) | 34 (29) | 30 (23) | 67 (22) | 0,019 |
| Mortalidad hospital, n (%) | 68 (18) | 38 (32,5) | 32 (30,5) | 85 (36) | <0,001 |
EPC: enfermedad pulmonar crónica; EPOC: enfermedad pulmonar obstructiva crónica; SAPS II: Simplified Acute Physiology Score; SDRA: síndrome de distrés respiratorio agudo.
Los principales cambios en las características de los enfermos desde el primer estudio han sido que se han ido incluyendo enfermos ligeramente más jóvenes, lo cual es posible que sea el motivo para que la estimación de la gravedad, calculada con el SAPS II, haya disminuido levemente. Pero lo más relevante es el cambio en el motivo de inicio de la ventilación mecánica. Así, mientras que en 1998 los motivos principales fueron enfermos con insuficiencia respiratoria aguda postoperatoria y traumatismo, a lo largo de la evolución se observa como la enfermedad más frecuente es la infecciosa (neumonía y sepsis) y, sobre todo, la enfermedad neurológica, que en 2016 supone un tercio de los pacientes incluidos.
Cambios en la práctica clínicaVentilación no invasivaEn la tabla 2 se muestra la evolución de la aplicación de la VNI. Se observa una baja incidencia en el uso de la VNI, sin grandes cambios a lo largo del tiempo. Excepto en el primer estudio, el fracaso en su aplicación fue muy alto, con una elevada mortalidad de los enfermos que requieren intubación tras un periodo de VNI.
Evolución en el uso de la ventilación no invasiva
| 1998 N = 34 | 2004 N = 3 | 2010 N = 12 | 2016 N = 15 | p | |
|---|---|---|---|---|---|
| Porcentaje de uso de VNI | 8 | 2 | 9 | 5 | 0,045 |
| Edad, años, media (DE) | 57 (19) | 75 (4) | 67 (17) | 59 (21) | <0,001 |
| SAPS II, puntos, media (DE) | 51 (22) | 43 (3) | 55 (14) | 40 (18) | <0,001 |
| Motivo para inicio de VNI | |||||
| Enfermedad pulmonar crónicaa | 9/28(32) | 2/12(17) | 5/11(45) | 1/6 (17) | <0,001 |
| Insuficiencia respiratoria aguda | 22/357 (6) | 1/70 (1) | 7/91 (8) | 14/188 (7) | <0,001 |
| Fracaso VNI | 6 (18) | 3 (100) | 5 (42) | 9 (60) | 0,002 |
| Mortalidad global | 5 (15) | 0 | 2 (17) | 4 (27) | 0,739 |
| Mortalidad fracaso | 2 / 6 (33) | 0 / 3(0) | 2 / 5 (40) | 4/9 | 0,723 |
| Mortalidad éxito | 3/28 (11) | - | 0/7 (0) | 0/6 (0) | 1,000 |
DE: desviación estándar; SAPS II: Simplified Acute Physiology Score; VNI: ventilación no invasiva.
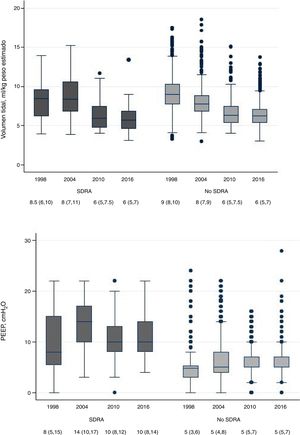
En la figura 1 se muestra la evolución del volumen tidal y de la PEEP establecidos en enfermos con criterios de SDRA y sin criterios de SDRA.
Evolución del volumen tidal (gráfica superior) y de la presión positiva al final de la espiración (PEEP) (gráfica inferior) en los enfermos con criterios de síndrome de distrés respiratorio agudo (SDRA) y sin criterios de SDRA durante los 4 periodos de estudio. La gráfica de cajas expresa la mediana (línea central de la caja) con los percentiles 25 y 75 (bordes inferior y superior de la caja), los rangos y los valores atípicos (puntos) de las variables durante todos los días de ventilación mecánica.
En general, se observa una tendencia a ventilar con volúmenes tidal más bajos tanto en enfermos con criterios de SDRA (desde 8,5ml/kg de peso estimado en 1998 hasta 6ml/kg en 2016; p < 0,001) y en enfermos sin SDRA (desde 9ml/kg en 1998 hasta 6ml/kg en 2016; p < 0,001). En lo que se refiere a la PEEP programada, se observan cambios clínicamente menos relevantes (en enfermos con SDRA se aumenta desde una mediana de 8 cmH2O, en 1998, hasta 10 cmH2O en 2016, mientras que en enfermos sin SDRA la mediana se mantiene en niveles similares).
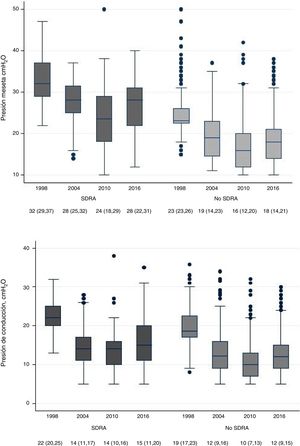
En la figura 2 se muestran los cambios observados en la presión meseta y en la presión de conducción (driving pressure) como consecuencia de los ajustes realizados en los volúmenes tidal y en la PEEP. Así mismo, esos cambios han inducido diferencias en el porcentaje de días de ventilación mecánica en los que se estableció una estrategia ventilatoria protectora (definida como volumen tidal menor de 6ml/kg o un volumen tidal menor de 8ml/kg y una presión meseta o presión pico menor de 30 cmH2O): 19% en 1998, 44% en 2004, 58% en 2010 y 75% en 2016 (p < 0,001).
Evolución de la presión meseta (gráfica superior) y de la presión de conducción (driving pressure) en los enfermos con criterios de síndrome de distrés respiratorio agudo (SDRA) y sin criterios de SDRA durante los 4 periodos de estudio. La gráfica de cajas expresa la mediana (línea central de la caja) con los percentiles 25 y 75 (bordes inferior y superior de la caja), los rangos y los valores atípicos (puntos) de las variables durante todos los días de ventilación mecánica.
En la tabla 3 se resumen las características de los enfermos que fueron desconectados de la ventilación mecánica y extubados de forma programada, los métodos de desconexión y los desenlaces relacionados con la desconexión.
Evolución de la desconexión de la ventilación mecánica
| 1998 N = 255 | 2004 N = 74 | 2010 N = 60 | 2016 N = 193 | p | |
|---|---|---|---|---|---|
| Porcentaje de enfermos que llegan a la desconexión de la ventilación mecánica | 62 | 62 | 45 | 64 | 0,002 |
| Edad, años, media (DE) | 52 (15) | 53 (19) | 49 (20) | 48 (21) | <0,001 |
| SAPS II, puntos, media (DE) | 50 (17) | 40 (15) | 33 (16) | 44 (18) | <0,001 |
| Días de ventilación mecánica antes de la desconexión, mediana (P25, P75) | 3 (2,4) | 6 (3,9) | 5 (3,7) | 4 (3,7) | <0,001 |
| Método para el primer intento de desconexión, % | <0,001 | ||||
| Prueba de respiración espontánea en % | 58 | 54 | 85 | 30 | |
| Reducción gradual del soporte respiratorio en % | 42 | 46 | 15 | 70 | |
| Fracaso en el primer intento, n (%) | 48 (19) | 51 (69) | 10 (17) | 47 (24) | <0,001 |
| Método para la desconexión en enfermos que fracasan primer intento en % | <0,001 | ||||
| Prueba de respiración espontánea | 31 | 16 | 70 | 30 | |
| Reducción gradual del soporte respiratorio | 69 | 84 | 30 | 70 | |
| Días de desconexión en enfermos con desconexión difícil-prolongada | 4 (2,7) | 6 (5,9) | 7(6,10) | 6 (4,8) | <0,001 |
| Tiempo de ventilación dedicado a la desconexión en % | 45 | 35 | 32 | 33 | <0,001 |
| Reintubación en las primeras 48 h tras extubación, n (%) | 12 (5) | 5 (7) | 7 (12) | 16 (8) | 0,177 |
SAPS II: Simplified Acute Physiology Score; DE: desviación estándar.
Se observa una gran variación a lo largo del tiempo en el modo de inicio de la desconexión mecánica, con un incremento significativo de la reducción gradual del soporte ventilatorio, básicamente presión de soporte, en la última cohorte. También se observa gran variación en el porcentaje de enfermos que pueden ser extubados en el primer intento. Exceptuando el del 2010, en el resto de los estudios se observa una predilección por la reducción gradual del soporte ventilatorio para la desconexión de los enfermos con desconexión difícil-prolongada. Dentro de este grupo, aunque es predominante la presión de soporte (del 21% en 1998 al 42% en 2016), destaca que la modalidad ventilación obligatoria intermitente sincronizada (SIMV, sinchronized intermitent mandatory ventilation), con o sin presión de soporte, se utilizó en un 38% de los enfermos en 1998 y en un 26% de los enfermos en 2016.
La proporción de traqueotomía a lo largo del tiempo ha sido: 4% en 1998, 12% en 2004, 18% en 2010 y 13% en 2016 (p < 0,001). El tiempo hasta traqueotomía fue: mediana de 11 días (P25: 5, P75: 20) en 1998; 11,5 días (10, 17) en 2004, 15 días (8,18) en 2010 y 9 días (5, 12) en 2016 (p < 0,001). Excluyendo el estudio de 1998, en el que no se registró el método de traqueotomía, en el resto la mayoría fueron quirúrgicas: 71% en 2004, 83% en 2010 y 79% en 2016 (p = 0,652).
Cambios en la mortalidadEn la tabla 4 se muestra la evolución de la mortalidad bruta y ajustada al día 28 desde el inicio de la ventilación mecánica. Exceptuando el incremento de la mortalidad bruta observada en la cohorte de 2004, en el resto de los estudios se observa un descenso leve hasta el 2016. Tras el ajuste para las variables asociadas a la mortalidad, no se observan cambios significativos en la evolución de la mortalidad desde 2004 hasta 2016.
Evolución del riesgo de mortalidad al día 28
| % | Mortalidad bruta | p | Mortalidad ajustadaa | p | |
|---|---|---|---|---|---|
| Odds ratio, IC 95% | Odds ratio, IC 95% | ||||
| 1998 | 16 | 1 (referencia) | 1 (referencia) | ||
| 2004 | 29 | 2,03 (1,26 a 3,27) | 0,003 | 1,05 (0,73 a 1,52) | 0,764 |
| 2010 | 23 | 1,49 (0,92 a 2,43) | 0,102 | 1,68 (1,13 a 2,48) | 0,009 |
| 2016 | 22 | 1,46 (1,00 a 2,13) | 0,048 | 0,85 (0,60 a 1,20) | 0,368 |
Ajuste por: edad, SAPS II, motivo de ventilación mecánica, variables asociadas al tratamiento (sedación, bloqueantes neuromusculares, parámetros ventilatorios), complicaciones durante la ventilación mecánica (SDRA, sepsis, neumonía, fracaso cardiovascular, fracaso renal, fracaso hepático, fracaso hematológico) y días de ventilación mecánica.
IC: intervalo de confianza; SDRA: síndrome de distrés respiratorio agudo.
La práctica de la ventilación mecánica en las UCI en México participantes en 4estudios internacionales de ventilación mecánica realizados entre 1998 y 201611-13 ha cambiado a lo largo del tiempo, de acuerdo con la evidencia científica existente. El mayor cambio observado es la disminución del volumen tidal programado. Aunque hay una tendencia a una disminución de la mortalidad, no se observan diferencias significativas del primer al último estudio.
Un hallazgo significativo que podría justificar, parcialmente, la ausencia de cambios importantes en la mortalidad observada son las diferencias en las características de los enfermos incluidos en los 4estudios, sobre todo en el motivo de inicio de la ventilación mecánica. Se ha pasado de una preponderancia de enfermos con insuficiencia respiratoria postoperatoria y enfermos con traumatismo observada en 1998 a que, en 2016, uno de cada 3enfermos incluidos presentara enfermedad neurológica. Este aspecto, tanto la población incluida en nuestro estudio como la evolución de las enfermedades más frecuentes, es comparable a otras series publicadas, incluyendo enfermos de un país concreto15-21 o de varias zonas geográficas11,22,23.
Es destacable la baja incidencia de enfermos con exacerbación de la enfermedad pulmonar obstructiva crónica (EPOC). Aunque en este caso la situación en las unidades mexicanas es similar a lo que ocurre en el ámbito internacional. En el resto de los países participantes en los estudios internacionales de ventilación mecánica11-14 este tipo de enfermedad se ha reducido desde el 10% hasta el 7% a lo largo de 18 años. Este hallazgo parece estar justificado por la baja incidencia de EPOC en México, como se observa en el estudio PLATINO24. En este estudio, realizado en una población general con edad igual o superior a 40 años, el porcentaje de pacientes con criterios clínicos de EPOC en la ciudad de México fue un 7,8%, casi la mitad de la encontrada en otras 4capitales sudamericanas incluidas en el estudio. Los factores invocados por los autores para justificar estos hallazgos son la altitud de Ciudad de México (la mayoría de las UCI participantes en nuestro estudio se ubican en esta ciudad) y los aspectos étnicos, pero son hipótesis que requieren un mayor análisis.
La investigación sobre ventilación mecánica de las 2últimas décadas ha ido modificando la práctica clínica habitual12, pero todavía hay una gran heterogeneidad25.
Uno de los cambios sería una mayor utilización de la VNI como primer intento de soporte ventilatorio. Aunque, por el momento, hay pocos estudios que hayan evaluado esta evolución, en un estudio francés se observa un aumento de un 16% en 1997 a un 24% en el 20111. En nuestro estudio, partiendo de un uso bajo de VNI, se observa una disminución. Una posible justificación está en el case-mix de nuestra población: porcentaje bajo de enfermos con EPOC y con insuficiencia cardiaca, en los que la VNI tiene su principal indicación, y alto porcentaje de pacientes con enfermedad neurológica, en los que la VNI no ha demostrado ningún beneficio. Por otra parte, la mayoría de los hospitales participantes en el estudio pertenecen al sector público, donde la presión asistencial es muy alta y es mucho mayor la demanda de camas en la UCI, lo que conlleva un déficit constante de estas camas. Esta dificultad para ingresar a los pacientes en la UCI ha motivado el desarrollo de la VNI en el área de urgencias y en algunas salas del hospital, como neumología y medicina interna.
Probablemente, el mayor cambio inducido por la investigación clínica es la denominada estrategia de ventilación protectora del pulmón, consistente en la ventilación con volúmenes tidal bajos (menor de 6ml/kg de peso ideal) y PEEP alta con el objetivo de mantener una presión meseta menor de 30 cmH2O. Esta estrategia, inicialmente indicada para enfermos con SDRA2,3, se ha extendido a la población general de enfermos con ventilación mecánica10. En general, en los estudios epidemiológicos de ventilación mecánica publicados se observa una disminución progresiva del volumen tidal programado. En los estudios realizados en los primeros años de este siglo15,16,18,22 el volumen tidal estaba entre 8 y 10ml/kg. En estudios publicados más recientemente19,26, se ha observado una disminución progresiva hasta volúmenes tidal menores de 8ml/kg, pero mayores de 6ml/kg aunque manteniendo una presión meseta en los límites de seguridad. En nuestro estudio, la evolución ha sido similar tanto en enfermos con criterios de SDRA como en enfermos sin este síndrome: ha ido descendiendo el volumen tidal programado hasta llegar a una mediana de 6ml/kg en el año 2016.
La adherencia menor a las recomendaciones la muestra el nivel de PEEP programada, que se mantiene en todos los estudios analizados en niveles inferiores a 10 cmH2O. En nuestra serie, sí que se observa un cambio significativo en los enfermos con SDRA, en los que se ha alcanzado una mediana de 10 cmH2O en la última cohorte incluida. Estos cambios han permitido que la presión de conducción (driving pressure) haya disminuido hasta niveles que se han asociado con un aumento en la supervivencia de los enfermos con SDRA27.
Otro aspecto de la ventilación mecánica que ha cambiado significativamente en los últimos 20 años es la desconexión28. Los cambios se pueden resumir en la identificación precoz de los enfermos que pueden ser liberados de la ventilación mecánica, la realización de una prueba para evaluar la tolerancia a la ventilación espontánea y, en enfermos con desconexión difícil o prolongada, la desconexión con una prueba diaria de ventilación espontánea29 o reducción gradual de la presión de soporte30. A pesar de que todos estos cambios están bien apoyados por la evidencia científica, también hay una gran variedad en la práctica clínica.
En una encuesta31 realizada a 1.144 especialistas en medicina intensiva de 6 zonas geográficas diferentes (Canadá, India, Reino Unido, Europa, Australia/Nueva Zelanda y Estados Unidos de América) se reporta que la identificación diaria de los enfermos que cumplen criterios para iniciar la desconexión se realiza entre un 70% y un 96%, la presión de soporte es el modo preferido para la primera prueba de respiración espontánea (entre un 57% y un 72% frente a 9-59% que prefieren el tubo en T) y para la desconexión de los enfermos con desconexión difícil/prolongada (31-72% de los encuestados). En nuestro estudio, observamos cambios clínicamente significativos, algunos de los cuales coinciden con los resultados reportados en esa encuesta. Así, a lo largo del tiempo se observa una preferencia por el uso de la presión de soporte tanto para la primera prueba de respiración espontánea como para la desconexión difícil. Un dato relevante es la alta utilización de la SIMV (con o sin presión de soporte) para la desconexión (26% de los enfermos en 2016 fueron desconectados con este método) a pesar de que los ensayos clínicos muestran que este modo es el menos recomendable29,30. En la encuesta previamente referida31 se describe que la SIMV es raramente utilizada como método de desconexión, aunque hay regiones (India, Australia/Nueva Zelanda) donde el porcentaje se acerca a lo observado en nuestro estudio.
La mortalidad registrada en nuestra serie fue menor de lo observado en estudios epidemiológicos similares18,32, probablemente por diferencias en las poblaciones incluidas. La ausencia de una disminución significativa de la mortalidad a lo largo del periodo de estudio podría justificarse por la mortalidad relativamente baja en el periodo 1998 (15%), por lo que los cambios en las características basales de la población incluida, durante los periodos de los estudios, pudieran contrarrestar el posible beneficio de los cambios observados en la práctica de la ventilación mecánica, como puede ser la estrategia de ventilación protectora. De hecho, a partir del periodo del 2004 hay un descenso no significativo de la mortalidad que se acentúa hasta el 2016 y que podría coincidir con el progresivo aumento de la estrategia de ventilación protectora.
Nuestro estudio presenta varias limitaciones, que deberían ser consideradas cuando se interpreten los datos. Por ejemplo, el diferente tamaño muestral incluido en cada cohorte puede generar imprecisión en algunas comparaciones y estimaciones. Además, las unidades participantes no fueron las mismas en todos los estudios, lo cual implica que podría haber un factor asociado a la variabilidad en la práctica clínica que no ha sido posible estimar.
En conclusión, la práctica clínica de la ventilación mecánica en las UCI de México se ha modificado a lo largo de un periodo de 18 años. El cambio más significativo es la adopción de una estrategia ventilatoria basada en volúmenes tidal bajos para mantener una presión meseta segura. Estos cambios no se han asociado a cambios significativos en la mortalidad, la cual debe estar asociada, además de a la ventilación mecánica, a factores no evaluados en nuestro estudio.
Autoría/colaboradoresMCM, JE, AVG, UC, MP, IP, JRS y EM fueron los coordinadores del estudio internacional de ventilación mecánica en México durante los diferentes periodos y participaron en la inclusión de los participantes y han colaborado en la redacción del manuscrito. AM, OP, FFV colaboraron con el diseño y análisis estadístico del estudio y participaron en la redacción del manuscrito. MCM, FFV, OP y AE colaboraron en el asesoramiento intelectual del estudio y participaron en su diseño, la adquisición de datos, el análisis de la base de datos, así como en la redacción de la versión final del manuscrito.
FinanciaciónNinguna.
Conflicto de interesesNinguno que declarar.
A todos los investigadores locales de cada UCI participante de México por parte del VENTILA Group.
F. Aguilera Almazán (Hospital General Regional n° 1, Chihuahua), M. Benítez Cortázar (Hospital Universitario de Puebla, Puebla), R. Carrillo Speare (Hospital PEMEX Sur, México DF), R. Castaño (Hospital de Cardiología del CNM, México DF), R. Corral (Hospital Excel, Tijuana, Baja California), D. N. D́Ector Lira (Hospital Metropolitano, México DF), G. Díaz Polanco (Hospital de Traumatología, Magdalena de las Salinas, México DF), J. J. Elizalde (Hospital ABC, México DF), R. Envila Fisher (Hospital Morelos, Chihuahua), G. Franco (Hospital General de México, México DF), P. García Balbuena (Hospital General Fernando Quiroz, México DF), O. Gayoso Cruz (Hospital Regional Adolfo Pérez Mateos, México), L. Green (Instituto Nacional de Cancerología, México DF), J. O. Herrera Hoyos (Centro Médico Las Américas, Mérida), J. Hinojosa (Hospital Angel Leaño, Guadalajara), J. Huerta (Clínica Londres, México DF), V. A. Juárez (Hospital Santelena, México DF), M. Loera (Hospital General de Durango, Durango), C. López Alzate (Clínica del Mar, Mazatlan), E. López Mora (Instituto de Cardiología, México DF), S. Martínez Caro (Hospital Hidalgo Aguascalientes, Aguascalientes), R. Méndez Reyes (Hospital Regional 10 de Octubre, México DF), M. Mendoza (Hospital General de la Villa, México DF), O. Narváez Porras (Instituto Nacional de Enfermedades Respiratorias, México DF), E. Ortiz (Hospital General Irapuata, Guanajuato), A. Padua (Hospital General Torreón, Coahuila), M. Poblano (Hospital Juárez. México DF), V. Pureco Reyes (Hospital Regional 20 Noviembre, México DF), W. Querevalum (Hospital Central Cruz Mexicana, México DF), A. Quesada (Hospital Ntra. Sra. de la Salud, San Luis Potosí), A. Ramírez Rivera (Hospital de Enfermedades Cardiovasculares y del Tórax, IMSS, Monterrey), A. Tamariz (Hospital Clínica Centro, Chihuahua), A. Tamariz (Hospital Central Universitario, Chihuahua), A. Vargas (Hospital General de Pachuca, Pachuca), C. Vázquez (Hospital General Celaya, Guanajuato).
Investigadores en el segundo estudio (2004)
J. J. Elizalde (Hospital ABC, México DF), P. Cerda (Centro Médico de Las Américas, Mérida) R. Mercado (Hospital Universitario de Monterrey, Monterrey), J. Albe Castañón (Instituto Mexicano del Seguro Social HECMNS XXI, México DF).
Investigadores en el tercer estudio (2010)
A. J. Villagómez Ortiz (Hospital Regional 1.° de Octubre ISSTE, México DF), C. Cruz Lozano (Hospital Regional de PEMEX, México DF), Z. Maycotte Luna (Hospital Ángeles de las Lomas, México DF), F. López Bacal (Hospital Regional de Zona 1 del IMSS, México DF), J. J. Elizalde (Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, México DF), G. Cueto Robledo (Hospital General de México, México DF), M. A. Treviño Salinas (Hospital Universitario de Nuevo León Dr. Eleuterio González, Nuevo León), R. Martínez Zubieta (Hospital Español de México, Miguel Hidalgo), C. Olvera-Guzmán y Marco Montes de Oca (Centro Médico ABC, México DF), S. A. Ñamendys-Silva (Instituto Nacional de Cancerología, México DF), J. S. Martínez Cano (Centenario Hospital Miguel Hidalgo, Aguacalientes), J. A. Baltazar Torres (Umea Hospital de Especialidades, Dr. Antonio Fraga Mouret, México DF), G. Morales Muñoz (Hospital Regional de Alta Especialidad de la Mujer, Villahermosa), A. Villa Delgado (Hospital Mérida Yucatán, Mérida), J. Ladape Martínez (Hospital Juárez de México, México DF).
Investigadores en el cuarto estudio (2016)
A. Ortega Pérez (Centro Médico Lic. Adolfo López Mateos, Toluca), A. Chávez Morales (Hospital General de México Dr. Eduardo Liceaga, México DF), A. García Luna (Hospital Ángeles, León), A. Rugiero Cabrera (Hospital ABC Santa Fe, México DF), A. Rugerio Cabrera (Hospital ABC Observatorio, México DF), Á. A. Pérez-Calatayud (Hospital General de México Dr. Eduardo Liceaga, México DF), A. Arellano (Hospital Regional de Alta Especialidad, Ixtapaluca), A. Velasco Gutiérrez (Hospital La Victoria, Cancún), A. J. Longino Gómez, Antonio Tamariz Becerra Álvarez Calderón (Hospital Ángeles, Chihuahua), R. Álvarez Calderón Christus Mugerza (Hospital Betania, Puebla), C. I. Reynoso Estrella (Hospital Civil de Guadalajara, Guadalajara) D. Déctor-Lira Espindola-Cruz (Centro Médico Dalinde, México DF), D. Gutiérrez-Zárate (Hospital Español, México DF), D. Esmeralda (Hospital Central Universitario, Chihuahua), E. D. Anica Malagón (Hospital General de México Dr. Eduardo Liceaga, México DF), E. Monares Zepeda (Hospital San Ángel Inn, Universidad, México DF), E. Deloya (Hospital de Alta Especialidad San Juan del Rio, Querétaro), E. Manzo Palacios (Hospital Metropolitano, México DF), F. de Jesús Montelongo (Hospital General Ecatepec Las Américas, México DF), F. J. Flores Mejía, M. Ramírez Cervantes (Hospital General de Zona n.° 1, IMSS, Tepic Nayarit), G. Camarena Alejo (Hospital ABC Santa Fe, México DF), G. Vázquez de Anda (Centro Médico Nacional Siglo XXI, México DF), H. Vázquez (Hospital General de Zona n.° 1 del IMSS, La Paz), C. Larios Luna (Hospital de Especialidades del CMM Manuel Ávila Camacho del IMSS, Puebla), G. Morales Muñoz (Hospital Regional de Alta Especialidad de la Mujer, Villahermosa), S. E. Zamora (Hospital Juárez de México, México DF), G. Magaña Solano (Instituto Nacional de Neurología y Neurocirugía MVS, México DF), J. I. Sánchez González (Unidad Médica Alta Especialidad UMAE 34 IMSS, Monterrey), J. Rosendo Sánchez Medina (Hospital Regional de Ciudad Madero PEMEX, Tamaulipas), J. J. Zaragoza (Hospital Ángeles Acoxpa), J. A. Buensuseso Alfaro (Hospital Costamed Playa del Carmen, Quintana Roo), J. C. Dávila Fernández (Hospital General Zona n.° 1, IMSS, Oaxaca), J. C. Mijangos-Méndez (Hospital Civil de Guadalajara, Guadalajara), M. Martínez Medina (Hospital General de Zona n.° 5 IMSS, Nogales), M. Chacón Gómez (INR, CENIAQ, México DF), M. V. Calyeca Sánchez (Centro de Especialidades Médicas UCI Polivalente, Veracruz), J. J. Martínez Soria (Hospital General Irapuato, Irapuato, Guanajuato), R. Méndez Reyes (Hospital Regional 1.° de Octubre ISSSTE, México DF), R. J. García Graullera (Hospital Galenia, Cancún), R. Rosas (PEMEX, Villahermosa), S. Sanjuana Gómez Flores (Hospital Rubén Leñero, México DF), S. Reyes Inurrigarro (Hospital General de Cholula, Puebla), S. Reyes Inurrigarro (UMAE Hospital de Traumatología y Ortopedia, Puebla), S. A. Ñamendys-Silva (Instituto Nacional de Cancerología, México DF), S. A. Ñamendy-Silva (Fundación Clínica Médica Sur, México DF), L. A. Sánchez Hurtado (Hospital de Especialidades Dr. Antonio Fraga Mouret Centro Médico Nacional La Raza, México DF), L. L. Villegas Castellanos (Hospital General Ajusco Medio, México DF), L. Zalatiel Maycotte (Hospital Texcoco, Texcoco), A. Estrada Gutiérrez (Hospital General de la Mujer SSM, Michocan), M. A. León (Hospital de Especialidades CMN S. XXI, IMSS, México DF).