Editado por: el Dr. Juan Antonio Llompart Pou
Médico especialista en Medicina Intensiva, Doctor en Ciencias de la Salud por la Universitat Illes Balears. Servicio de Medicina Intensiva, UCI Trauma y Neurocríticos, Hospital Universitari Son Espases. Palma, España.
Última actualización: Diciembre 2025
Más datosEl control de la temperatura corporal se ha utilizado en pacientes con daño cerebral agudo ocasionado por distintas enfermedades como daño hipóxico-isquémico posparada cardiaca, accidente cerebro vascular isquémico agudo y traumatismo craneoencefálico grave. Sin embargo, la evidencia actual ofrece resultados poco consistentes y a menudo contradictorios en cuanto al beneficio clínico de esta estrategia terapéutica sobre la mortalidad y los resultados funcionales. Las guías actuales han centrado su atención fundamentalmente en la prevención activa y el tratamiento de la fiebre, mientras que la hipotermia terapéutica (HT) ha caído en desuso, aun cuando persisten dudas sobre su efectividad de acuerdo con el modo de aplicación y la adecuada selección de pacientes. En esta revisión narrativa se presenta la evidencia clínica más relevante sobre los efectos de la HT en pacientes con daño neurológico agudo, así como de los conceptos fisiopatológicos en los que se fundamenta su uso.
Temperature management has been used in patients with acute brain injury resulting from different conditions, such as post-cardiac arrest hypoxic-ischaemic insult, acute ischaemic stroke, and severe traumatic brain injury. However, current evidence offers inconsistent and often contradictory results regarding the clinical benefit of this therapeutic strategy on mortality and functional outcomes. Current guidelines have focused mainly on active prevention and treatment of fever, while therapeutic hypothermia (TH) has fallen into disuse, although doubts persist as to its effectiveness according to the method of application and appropriate patient selection. This narrative review presents the most relevant clinical evidence on the effects of TH in patients with acute neurological damage, and the pathophysiological concepts supporting its use.
Las alteraciones de la temperatura en pacientes neurocríticos son frecuentes y tienen un efecto deletéreo sobre el metabolismo cerebral provocando o agravando lesiones neuronales1–3. El control de la temperatura corporal central a un nivel específico puede ser utilizado para inducir hipotermia o para evitar la fiebre, y se ha utilizado en varias situaciones como daño hipóxico-isquémico posparada, accidente cerebrovascular isquémico agudo (ACVA) y traumatismo craneoencefálico (TCE) grave, en un intento de reducir el daño neurológico y mejorar los resultados funcionales. Sin embargo, la evidencia es limitada y difícil de interpretar, dada la variedad de métodos de enfriamiento utilizados, diferentes temperaturas objetivo y la heterogeneidad de los grupos de pacientes.
En la presente revisión narrativa se detallan los conceptos fisiopatológicos en los que se fundamenta el uso de la hipotermia terapéutica (HT), y se resume la evidencia más relevante sobre el impacto clínico del control de la temperatura en pacientes con daño cerebral agudo.
Mecanismos de daño neurológicoUna cascada de acontecimientos y procesos destructivos dependientes de la temperatura, que se acentúan con la fiebre (>37,5°C) y se mitigan con la hipotermia leve/moderada (31-35°C), comienza a nivel celular en los minutos u horas siguientes a una lesión inicial. La lesión puede ser isquémica o traumática. La isquemia puede ser inducida por el cese del flujo sanguíneo cerebral tras un paro cardiaco, la obstrucción de un vaso sanguíneo, por presión/edema o por otros mecanismos4.
Lesión neurológica primariaA nivel celular, la disminución del aporte de oxígeno cerebral se manifiesta como una reducción del metabolismo aeróbico neuronal, lo que provoca una reducción de la producción celular del sustrato de alta energía adenosín trifosfato (ATP). El agotamiento de ATP produce una disfunción de la bomba de intercambio iónico Na+/K+ dependiente de ATP, lo que conduce a una entrada masiva de sodio y agua en la célula, y edema citotóxico intracelular. La salida de potasio y la despolarización de la membrana lleva a la apertura de los canales de Ca++ sensibles al voltaje y la entrada de Ca++ intracelular. Además, en la microvasculatura se produce disfunción endotelial que conduce a una mayor permeabilidad de la barrera hematoencefálica, la formación de edema cerebral vasogénico, la formación de microtrombos y la limitación del flujo sanguíneo cerebral con exacerbación de la isquemia celular5,6.
Lesión neurológica secundariaLa reperfusión del lecho cerebrovascular isquémico desencadena una serie de mecanismos que conducen a una lesión cerebral secundaria. El aumento de Ca++ intracelular causado por la lesión primaria conduce a la liberación de glutamato, un neurotransmisor excitatorio que se une a receptores de la membrana celular y provoca una mayor entrada de Ca++ intracelular. La acumulación de Ca++ intracelular activa enzimas líticas como la caspasa, las proteasas y las fosfolipasas; y, provoca una disfunción mitocondrial con la liberación de proteínas proapoptóticas y especies reactivas de oxígeno. Como resultado se produce un daño neuronal adicional, y un fallo energético, lo que conduce a la apoptosis y la muerte celular.
Otra consecuencia de la lesión por reperfusión es la activación del sistema inmunitario innato que provoca una respuesta inflamatoria. Los macrófagos residentes, denominados microglía, y los monocitos circulantes que se adhieren a las células endoteliales de la microvasculatura cerebral e infiltran el tejido neuronal, se activan y segregan citocinas proinflamatorias. También se produce la activación de la cascada del complemento, que propaga aún más la lesión inflamatoria5,6.
Papel de la hipotermia sobre los mecanismos de daño neurológicoLos efectos protectores de la hipotermia se basan fundamentalmente en su capacidad para reducir el consumo metabólico cerebral de oxígeno y glucosa. El metabolismo cerebral disminuye de 6 a 10% por cada 1°C de reducción de temperatura corporal. Sin embargo, la reducción de la tasa metabólica es solo uno de los muchos mecanismos de neuroprotección de la hipotermia. La hipotermia atenúa el daño celular por apoptosis, mediante inhibición de la enzima caspasa, prevención de la disfunción mitocondrial, disminución de la sobrecarga de los neurotransmisores excitadores, y modificación de la concentración intracelular de iones. También disminuye la respuesta neuroinflamatoria, reduciendo la liberación de mediadores proinflamatorios, la activación del complemento, la producción de radicales libres y de óxido nítrico. Esto permite estabilizar las alteraciones de la barrera hemato/encefálica y de las membranas celulares, y reducir la permeabilidad vascular (aumentada por el daño endotelial mediado por óxido nítrico), por lo que disminuye la formación de edema cerebral y la hipertensión intracraneal. Finalmente, la hipotermia también disminuye la liberación local de agentes vasoconstrictores (endotelina y tromboxano A2) y la activación de la cascada de la coagulación, que pueden generar hipoperfusión y formación de microtrombos en áreas cerebrales lesionadas4–6.
Aplicación de la hipotermia terapéuticaLa hipotermia inducida puede dividirse en tres fases distintas: inducción, mantenimiento y recalentamiento. En la fase de inducción el objetivo es reducir la temperatura al objetivo lo más rápidamente posible. En la fase de mantenimiento se debe controlar estrictamente la temperatura central, con fluctuaciones mínimas o nulas (máximo de 0,2 a 0,5°C). En la fase de recalentamiento es preciso lograr un calentamiento lento y controlado, de 0,2 a 0,5°C por hora para pacientes en parada cardiaca, y de 0,1 a 0,2°C por hora para pacientes con daño neurológico por otra causa. Tras la fase de recalentamiento se debe mantener una normotermia estricta, dado que la fiebre se asocia con desenlaces desfavorables en todos los tipos de lesiones neurológicas7–9 (material adicional).
En las últimas décadas, se han desarrollado diversos sistemas de refrigeración con el fin de lograr una inducción más rápida y un mantenimiento más fiable de la temperatura. El dispositivo ideal debe alcanzar rápidamente la temperatura deseada, permitir un mantenimiento preciso y un recalentamiento lento y controlado, así como evitar la fiebre postenfriamiento.
Existen diversos métodos para inducir la hipotermia. Los sistemas tradicionales, como la exposición cutánea, la administración de fluidos fríos intravenosos, los ventiladores, o las mantas de circulación de aire, aunque fáciles de usar y baratos, son poco eficaces, puesto que solo permiten velocidades de inducción bajas, con variaciones impredecibles en la temperatura corporal, por lo que no se recomienda su utilización durante la fase de mantenimiento y recalentamiento10. Los sistemas de refrigeración más modernos, como los dispositivos intravasculares (catéteres con balones rellenos de suero salino frío o componentes metálicos refrigerados) y los dispositivos de superficie avanzados (con mantas de circulación de agua fría o de hidrogel), logran altas velocidades de enfriamiento, lo que permite alcanzar más rápidamente la temperatura objetivo, y mantienen la temperatura dentro del rango deseado durante un tiempo más prolongado (es decir, producen menos sobreenfriamiento e hipertermia de rebote), mediante el uso de un sistema de retroalimentación para un control preciso de la temperatura. Los dispositivos intravasculares presentan los riesgos habitualmente asociados a la inserción y mantenimiento de catéteres intravasculares, como bacteriemia asociada a catéter y trombosis venosa profunda relacionada con el catéter.
Los ensayos clínicos11–15 que compararon el enfriamiento endovascular con el de superficie no mostraron diferencias en la supervivencia o el resultado neurológico al alta hospitalaria, aunque los dispositivos de enfriamiento endovascular fueron más precisos y eficaces en la inducción y el mantenimiento de la hipotermia.
Otros sistemas de refrigeración alternativos tratan de evitar los riesgos del acceso intravascular y las dificultades de transferencia de calor a través de la piel, como los dispositivos esofágicos y el enfriamiento selectivo del cerebro, que puede evitar las complicaciones sistémicas asociadas al enfriamiento de todo el cuerpo16,17 (material adicional: tablas 1e, 2e y 3e).
Estudios clínicos sobre los efectos de la aplicación de la hipotermia terapéuticaLa metodología de búsqueda bibliográfica para la redacción de este apartado está incluida en el material adicional.
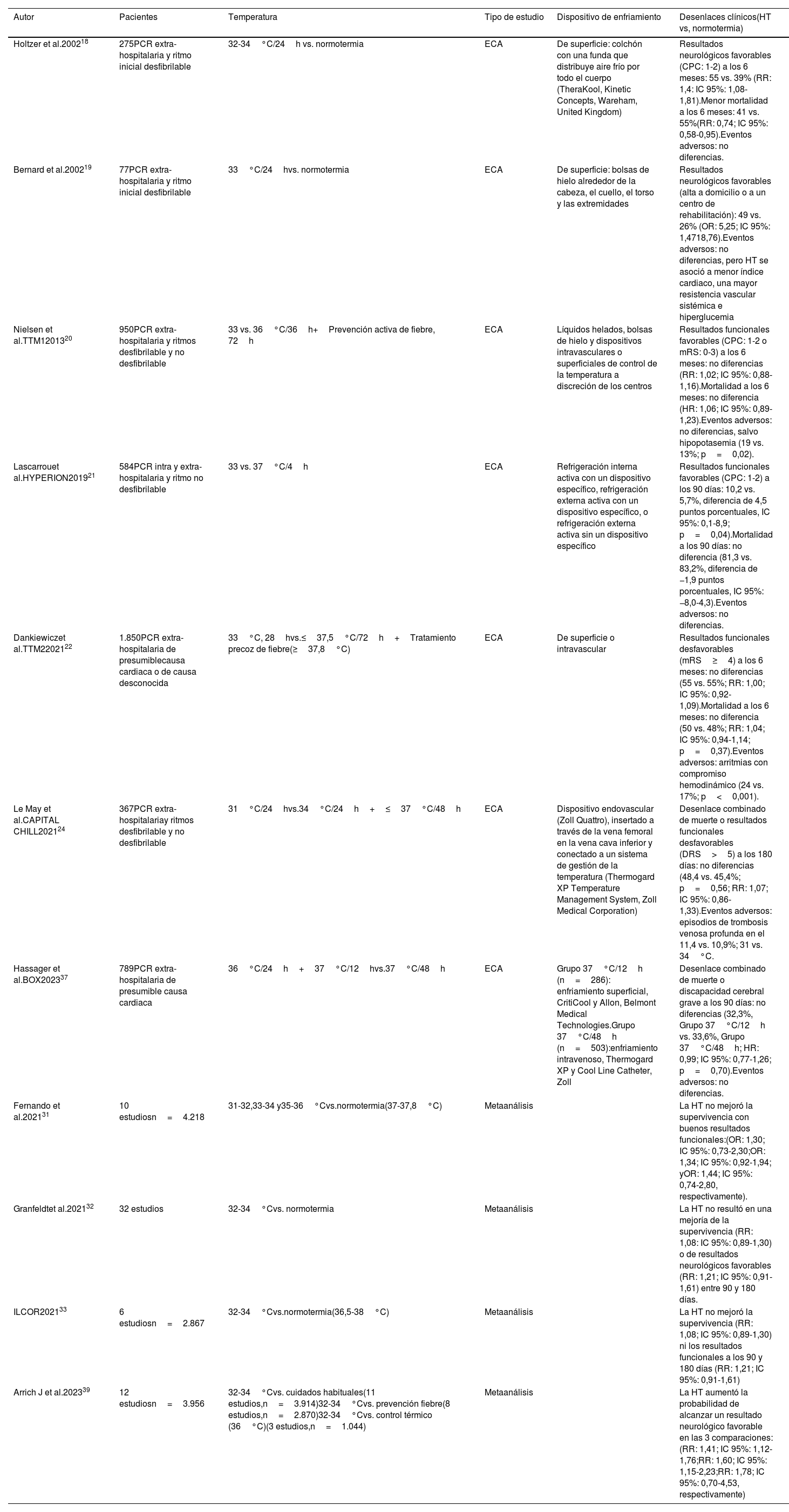
Daño hipóxico-isquémico posparada cardiacaEn el año 2002 se publicaron 2 ensayos clínicos aleatorizados (ECA)18,19 que mostraron una mejoría de la supervivencia con resultados neurológicos favorables tras la inducción de HT entre 32-34°C durante 12-24h, en pacientes con parada cardiorrespiratoria (PCR) extra-hospitalaria presenciada y ritmo inicial desfibrilable. Sin embargo, estos resultados prometedores no han sido confirmados en estudios posteriores. En el año 2013 se publicó el primer ECA de gran tamaño muestral, el TTM120, en el que se incluyeron 950 en pacientes inconscientes tras PCR extra/hospitalaria y ritmo inicial desfibrilable y no desfibrilable, sin apreciar diferencias ni en la mortalidad ni en los resultados funcionales con la aplicación de HT. A diferencia de los estudios de 200218,19, los investigadores del ensayo TTM1 utilizaron un enfoque protocolizado para establecer el pronóstico neurológico, y la temperatura en ambos brazos se controló activamente. Sin embargo, las principales limitaciones del estudio TTM1 fueron el tiempo para alcanzar la temperatura objetivo (se necesitaron aproximadamente 9h de promedio para alcanzar 33°C) y la alta tasa de retirada del soporte vital basada en el pronóstico neurológico.
Posteriormente, en el año 2019, el estudio HYPERION21 incluyó 584 pacientes en coma tras PCR intra y extra/hospitalaria y ritmo no desfibrilable, y comparó la HT (33°C) con el control térmico (37°C) durante 24h. Tampoco hubo diferencias en la mortalidad (81,3 y 83,2%, respectivamente), pero en los supervivientes el porcentaje de pacientes con resultados neurológicos favorables fue mayor en el grupo de hipotermia (10,2 vs. 5,7%; p=0,04). Cabe destacar que el estudio HYPERION tuvo un índice de fragilidad de 1, lo que sugiere que si un solo paciente hubiera tenido un resultado diferente (cambio de un resultado neurológico bueno a uno malo), los hallazgos no habrían alcanzado significación estadística.
El ECA más riguroso y de mayor tamaño muestral (TTM2) fue publicado 2 años más tarde22. En este estudio, 1.850 adultos en coma tras PCR extrahospitalaria de causa presumiblemente cardiaca o de causa desconocida, se aleatorizaron a HT (33°C durante 28h) o normotermia. No hubo diferencias en las altas de mortalidad reportadas (50 vs. 48%; p=0,37) ni en los resultados funcionales. Tampoco hubo diferencias en los desenlaces clínicos en función del tiempo hasta el retorno de la circulación espontánea (RCE) (mayor o menor de 25min) y el ritmo inicial. Entre las principales limitaciones del estudio TTM2 cabe destacar que, aunque el protocolo exigía alcanzar la temperatura objetivo en 90min o menos, la mitad de la población del estudio necesitó 7h desde la RCE hasta la hipotermia, quizás debido a la baja tasa de enfriamiento intravascular empleada en el ensayo (29%). Además, casi el 50% de los pacientes en ambos grupos tuvieron un control insuficiente de la fiebre pasadas las 72h, y de nuevo se produjo una alta tasa de retirada del soporte vital en base al pronóstico neurológico establecido según el protocolo del ensayo. Otro de los argumentos empleados para justificar la ausencia de beneficio clínico de la hipotermia en el estudio TTM2 es el elevado porcentaje de pacientes sedados con propofol, fármaco potencialmente neurotóxico y asociado a disfunción mitocondrial, una de las causas de la lesión cerebral hipóxico/isquémica23.
Más recientemente, el estudio CAPITAL CHILL24 abordó la cuestión de si una temperatura aún más baja sería más beneficiosa para la recuperación neurológica. El ECA incluyó 367 pacientes en coma tras PCR extra/hospitalaria con independencia del ritmo, y comparó la hipotermia moderada (31°C) con la hipotermia leve (34°C) durante 24h. No hubo diferencias en el desenlace combinado de muerte o resultados funcionales desfavorables a los 180 días. Es importante señalar que se trata de un estudio unicéntrico y probablemente no tuvo suficiente poder estadístico para detectar una diferencia clínicamente significativa. Por otro lado, este estudio24 comparó 2 estrategias de hipotermia (moderada y leve), y no incluyó un grupo no sometido a hipotermia, con lo cual el estudio no permite concluir sobre la eficacia del tratamiento con hipotermia (en comparación con normotermia).
La mayoría de los pacientes incluidos en los estudios realizados hasta el momento, a excepción del estudio HYPERION21, habían sufrido una PCR extra/hospitalaria con un ritmo cardiaco inicial desfibrilable y una causa cardiaca primaria conocida o presumible20,22,25, lo que plantea que, en otras categorías de pacientes, el control de la temperatura con hipotermia podría ser más eficaz. Los investigadores de TTM realizaron un metaanálisis de datos de pacientes individuales de los estudios TTM-1 y TTM-2, para evaluar si los efectos de la hipotermia difieren según las circunstancias del paro cardiaco o las características del paciente26. Los pacientes del grupo de 36°C de TTM-1 se combinaron con los del grupo de normotermia en TTM-2, y se compararon con los pacientes de los grupos de 33°C en ambos estudios de TTM. El resultado primario, mortalidad por todas las causas a los 6 meses (47,9 vs. 49,4%; p=0,41), y los resultados en los subgrupos predefinidos en cuanto edad, sexo, ritmo cardiaco inicial (desfibrilable o no desfibrilable), tiempo de RCE y shock circulatorio al ingreso no mostraron diferencias significativas entre ambos grupos. Por otro lado, en un reciente estudio27, realizado en 249 pacientes reanimados tras PCR intra/hospitalaria en Alemania, la inducción de hipotermia (32-34°C) tampoco mostró ningún beneficio sobre la mortalidad. Sin embargo, otros estudios observacionales han identificado un beneficio en la recuperación neurológica asociado a la HT de 33°C en comparación con 36°C en aquellos pacientes con una mayor gravedad de la lesión neurológica posparada28–30.
En el año 2021, una revisión sistemática y metaanálisis31 analizó la eficacia y la seguridad de mantener diferentes objetivos de temperatura tras PCR extra/hospitalaria. Se incluyeron 10 ECA con 4.218 pacientes y sus resultados confirmaron que la HT a 31-32°C, 33-34°C y 35-36°C no mejoró la supervivencia con buenos resultados funcionales en comparación con la normotermia a 37-37,8°C, mientras que se observó una mayor incidencia de arritmias entre los pacientes tratados con hipotermia a 31-32°C y 33-34°C. En el mismo año, se publicó otro metaanálisis elaborado por la International Liaison Committee on Resuscitation (ILCOR)32, en el que se identificaron nueve ECA, de los cuales seis fueron incluidos en el metaanálisis, y se concluyó que el tratamiento dirigido a alcanzar una temperatura objetivo de 32-34°C, no resultó en una mejoría de la supervivencia o un resultado neurológico favorable (bajo nivel de evidencia). Tres ensayos evaluaron diferentes objetivos de temperatura hipotérmica y no hallaron diferencias en los desenlaces entre 33-36°C o entre 32-34°C (bajo nivel de evidencia). En base a estos resultados, el ILCOR ALS Task Force publicó sus recomendaciones33, que se resumen en la tabla 1, en las que se sugiere prevenir activamente la fiebre (definida como una temperatura >37,7°C) mediante el objetivo de una temperatura de 37,5°C o inferior (recomendación débil, bajo nivel de evidencia), en lugar de recomendar la hipotermia para el tratamiento de los pacientes que permanecen en coma tras la RCE de parada cardiaca.
Resumen de las recomendaciones de las principales guías de práctica clínica sobre control térmico
| Daño hipóxico-isquémico posparada cardiaca |
| Guías ILCOR (2021)22 |
| Se sugiere la prevención activa de la fiebre mediante el objetivo de una temperatura de 37,5°C o inferior para los pacientes que permanecen en coma tras la RCE de una parada cardiaca (recomendación débil, bajo nivel de evidencia) |
| No está claro si subpoblaciones de pacientes con parada cardiaca pueden beneficiarse de la hipotermia a 32-34°C |
| Los pacientes comatosos con hipotermia leve tras la recuperación de circulación espontánea no deben ser calentados activamente para alcanzar la normotermia (declaración de buena práctica) |
| No se recomienda el uso rutinario de enfriamiento prehospitalario con infusión rápida de grandes volúmenes de líquido IV frío inmediatamente después de la recuperación de circulación espontánea (recomendación fuerte, nivel de evidencia moderada) |
| Se sugiere el empleo de técnicas de control de la temperatura superficiales o endovasculares cuando se utilice el control de la temperatura en pacientes comatosos tras la recuperación de circulación espontánea (recomendación débil, bajo nivel de evidencia) |
| Cuando se utiliza un dispositivo de enfriamiento, sugerimos utilizar un dispositivo de control de la temperatura que incluya un sistema de retroalimentación basado en la monitorización continua de la temperatura para mantener la temperatura objetivo (declaración de buena práctica) |
| Se sugiere la prevención activa de la fiebre durante al menos 72h en los pacientes en parada cardiaca que permanecen en coma (declaración de buena práctica) |
| Guías ERC y ESICM (2022)23,24 |
| Se recomienda la monitorización continua de la temperatura central y prevenir activamente la fiebre (>37,7°C) durante al menos 72h en pacientes que permanecen en coma tras una parada cardiaca |
| Accidente cerebro vascular isquémico agudo |
| Guías ESO (2015)39 |
| En pacientes con ictus isquémico agudo e hipertermia, no se puede hacer ninguna recomendación para tratar la hipertermia como medio para mejorar el resultado funcional y/o la supervivencia (grado de recomendación débil, bajo nivel de evidencia) |
| En pacientes con ictus isquémico agudo y normotermia, no se recomienda la prevención sistemática de la hipertermia con antitérmicos como medio para mejorar los resultados funcionales y/o la supervivencia (grado de recomendación débil, nivel de evidencia moderado) |
| En pacientes con ictus isquémico agudo, no se recomienda la inducción de hipotermia como medio para mejorar el resultado funcional y/o la supervivencia (grado de recomendación débil, nivel de evidencia muy bajo) |
| Guías AHA/American Stroke Association (2019)40 |
| En pacientes con ictus isquémico agudo, el beneficio de la hipotermia inducida es incierto (grado de recomendación moderado, nivel de evidencia moderado) |
| Traumatismo craneoencefálico |
| Guías BTF. Guidelines 4th Edition (2016)48 |
| No se recomienda la hipotermia profiláctica precoz (antes de 2,5h) y a corto plazo (48h tras la lesión) para mejorar los resultados en pacientes con lesiones difusas (Nivel de evidencia IIB) |
| Conferencia de consenso SIBICC (2019)49,50 |
| Se recomienda la hipotermia terapéutica leve (35-36°C) como intervención de nivel 3 para reducir la presión intracraneal en pacientes con hipertensión intracraneal en curso, una vez agotadas otras intervenciones de nivel 1 y 2 (Nivel de evidencia IV. Opinión de expertos) |
AHA: American Heart Association; BTF: Brain Trauma Foundation; ERC: European Resuscitation Council; ESICM: European Society of Intensive Care Medicine; ESO: European Stroke Organisation; RCE: recuperación de circulación espontánea; SIBICC: Seattle International Severe Traumatic Brain Injury Consensus Conference.
En 2022, the European Resuscitation Council (ERC) y the European Society of Intensive Care Medicine (ESICM)34,35, en consonancia con el documento de consenso del ILCOR, recomienda la monitorización continua de la temperatura central y prevenir activamente la fiebre (>37,7°C) durante al menos 72h en pacientes que permanecen en coma tras una PCR (tabla 1).
Una posible razón de la ausencia de beneficio clínico de la hipotermia tras una PCR es que, en los estudios realizados hasta ahora, la temperatura objetivo se alcanzó varias horas después de la RCE y potencialmente fuera de la ventana terapéutica. En un ECA36, la infusión pre/hospitalaria de hasta 2l de suero salino fisiológico a 4°C tras la RCE, redujo el tiempo necesario para alcanzar una temperatura de 34°C en más de una hora. Sin embargo, esta estrategia no mejoró la supervivencia o el estado neurológico en pacientes reanimados tras una fibrilación ventricular pre/hospitalaria ni en pacientes sin fibrilación ventricular, y se asoció a tasas significativamente más altas de recidiva de la parada y edema pulmonar en la primera radiografía de tórax.
La duración óptima de la HT sigue siendo objeto de debate. El único ensayo incluido en la revisión del ILCOR que abordó el problema de la duración del control de la temperatura, no demostró diferencia en los resultados entre el control de la temperatura a 32-34°C durante 24h en comparación con 48h tras PCR25. Tampoco la duración de la prevención activa de la fiebre parece tener un impacto en los desenlaces clínicos. En un estudio mucho más reciente37, realizado en 789 pacientes en coma tras PCR extra-hospitalaria de causa presumiblemente cardiaca, se comparó el control de temperatura con un objetivo de 36°C durante 24h, seguido de un control de 37°C durante un tiempo adicional de bien 12h o bien 48h, o hasta que el paciente recuperara la consciencia. La aparición de muerte o discapacidad cerebral grave o coma en un plazo de 90 días no fue significativamente diferente tras 36 o 72h de prevención activa de la fiebre.
Por último, la revisión Cochrane más reciente, que evaluó 12 estudios con 3.956 pacientes, concluye que la HT con una temperatura objetivo de 32 a 34°C puede mejorar los resultados neurológicos después de un paro cardiaco, aunque con nivel de evidencia bajo38.
Actualmente, se encuentra en fase de reclutamiento el estudio ICECAP (NCT04217551)39. Se trata de un ECA multicéntrico, aleatorizado, de asignación adaptativa para determinar si el aumento de la duración de la HT se asocia con un aumento de la tasa de buenos resultados neurológicos en supervivientes en coma tras PCR.
¿Se debe aplicar hipotermia terapéutica para el tratamiento de los pacientes que permanecen en coma tras el retorno de la circulación espontánea de parada cardiaca?Teniendo en cuenta todo lo expuesto, la evidencia actual (tabla 2) deja sin respuesta el manejo óptimo de la temperatura para los pacientes en PCR con ritmos iniciales no desfibrilables o para pacientes en los que la PCR se debe a una causa no cardiaca y, para aquellos con lesiones neurológicas más graves. Esto plantea la hipótesis de que el beneficio clínico de la HT después de una PCR pueda depender de factores que aún no conocemos en su totalidad.
Resumen de la evidencia del control térmico en pacientes con daño hipóxico-isquémico posparada cardiaca
| Autor | Pacientes | Temperatura | Tipo de estudio | Dispositivo de enfriamiento | Desenlaces clínicos(HT vs, normotermia) |
|---|---|---|---|---|---|
| Holtzer et al.200218 | 275PCR extra-hospitalaria y ritmo inicial desfibrilable | 32-34°C/24h vs. normotermia | ECA | De superficie: colchón con una funda que distribuye aire frío por todo el cuerpo (TheraKool, Kinetic Concepts, Wareham, United Kingdom) | Resultados neurológicos favorables (CPC: 1-2) a los 6 meses: 55 vs. 39% (RR: 1,4: IC 95%: 1,08-1,81).Menor mortalidad a los 6 meses: 41 vs. 55%(RR: 0,74; IC 95%: 0,58-0,95).Eventos adversos: no diferencias. |
| Bernard et al.200219 | 77PCR extra-hospitalaria y ritmo inicial desfibrilable | 33°C/24hvs. normotermia | ECA | De superficie: bolsas de hielo alrededor de la cabeza, el cuello, el torso y las extremidades | Resultados neurológicos favorables (alta a domicilio o a un centro de rehabilitación): 49 vs. 26% (OR: 5,25; IC 95%: 1,4718,76).Eventos adversos: no diferencias, pero HT se asoció a menor índice cardiaco, una mayor resistencia vascular sistémica e hiperglucemia |
| Nielsen et al.TTM1201320 | 950PCR extra-hospitalaria y ritmos desfibrilable y no desfibrilable | 33 vs. 36°C/36h+Prevención activa de fiebre, 72h | ECA | Líquidos helados, bolsas de hielo y dispositivos intravasculares o superficiales de control de la temperatura a discreción de los centros | Resultados funcionales favorables (CPC: 1-2 o mRS: 0-3) a los 6 meses: no diferencias (RR: 1,02; IC 95%: 0,88-1,16).Mortalidad a los 6 meses: no diferencia (HR: 1,06; IC 95%: 0,89-1,23).Eventos adversos: no diferencias, salvo hipopotasemia (19 vs. 13%; p=0,02). |
| Lascarrouet al.HYPERION201921 | 584PCR intra y extra-hospitalaria y ritmo no desfibrilable | 33 vs. 37°C/4h | ECA | Refrigeración interna activa con un dispositivo específico, refrigeración externa activa con un dispositivo específico, o refrigeración externa activa sin un dispositivo específico | Resultados funcionales favorables (CPC: 1-2) a los 90 días: 10,2 vs. 5,7%, diferencia de 4,5 puntos porcentuales, IC 95%: 0,1-8,9; p=0,04).Mortalidad a los 90 días: no diferencia (81,3 vs. 83,2%, diferencia de −1,9 puntos porcentuales, IC 95%: −8,0-4,3).Eventos adversos: no diferencias. |
| Dankiewiczet al.TTM2202122 | 1.850PCR extra-hospitalaria de presumiblecausa cardiaca o de causa desconocida | 33°C, 28hvs.≤37,5°C/72h+Tratamiento precoz de fiebre(≥37,8°C) | ECA | De superficie o intravascular | Resultados funcionales desfavorables (mRS≥4) a los 6 meses: no diferencias (55 vs. 55%; RR: 1,00; IC 95%: 0,92-1,09).Mortalidad a los 6 meses: no diferencia (50 vs. 48%; RR: 1,04; IC 95%: 0,94-1,14; p=0,37).Eventos adversos: arritmias con compromiso hemodinámico (24 vs. 17%; p<0,001). |
| Le May et al.CAPITAL CHILL202124 | 367PCR extra-hospitalariay ritmos desfibrilable y no desfibrilable | 31°C/24hvs.34°C/24h+≤37°C/48h | ECA | Dispositivo endovascular (Zoll Quattro), insertado a través de la vena femoral en la vena cava inferior y conectado a un sistema de gestión de la temperatura (Thermogard XP Temperature Management System, Zoll Medical Corporation) | Desenlace combinado de muerte o resultados funcionales desfavorables (DRS>5) a los 180 días: no diferencias (48,4 vs. 45,4%; p=0,56; RR: 1,07; IC 95%: 0,86-1,33).Eventos adversos: episodios de trombosis venosa profunda en el 11,4 vs. 10,9%; 31 vs. 34°C. |
| Hassager et al.BOX202337 | 789PCR extra-hospitalaria de presumible causa cardiaca | 36°C/24h+37°C/12hvs.37°C/48h | ECA | Grupo 37°C/12h (n=286): enfriamiento superficial, CritiCool y Allon, Belmont Medical Technologies.Grupo 37°C/48h (n=503):enfriamiento intravenoso, Thermogard XP y Cool Line Catheter, Zoll | Desenlace combinado de muerte o discapacidad cerebral grave a los 90 días: no diferencias (32,3%, Grupo 37°C/12h vs. 33,6%, Grupo 37°C/48h; HR: 0,99; IC 95%: 0,77-1,26; p=0,70).Eventos adversos: no diferencias. |
| Fernando et al.202131 | 10 estudiosn=4.218 | 31-32,33-34 y35-36°Cvs.normotermia(37-37,8°C) | Metaanálisis | La HT no mejoró la supervivencia con buenos resultados funcionales:(OR: 1,30; IC 95%: 0,73-2,30;OR: 1,34; IC 95%: 0,92-1,94; yOR: 1,44; IC 95%: 0,74-2,80, respectivamente). | |
| Granfeldtet al.202132 | 32 estudios | 32-34°Cvs. normotermia | Metaanálisis | La HT no resultó en una mejoría de la supervivencia (RR: 1,08: IC 95%: 0,89-1,30) o de resultados neurológicos favorables (RR: 1,21; IC 95%: 0,91-1,61) entre 90 y 180 días. | |
| ILCOR202133 | 6 estudiosn=2.867 | 32-34°Cvs.normotermia(36,5-38°C) | Metaanálisis | La HT no mejoró la supervivencia (RR: 1,08; IC 95%: 0,89-1,30) ni los resultados funcionales a los 90 y 180 días (RR: 1,21; IC 95%: 0,91-1,61) | |
| Arrich J et al.202339 | 12 estudiosn=3.956 | 32-34°Cvs. cuidados habituales(11 estudios,n=3.914)32-34°Cvs. prevención fiebre(8 estudios,n=2.870)32-34°Cvs. control térmico (36°C)(3 estudios,n=1.044) | Metaanálisis | La HT aumentó la probabilidad de alcanzar un resultado neurológico favorable en las 3 comparaciones:(RR: 1,41; IC 95%: 1,12-1,76;RR: 1,60; IC 95%: 1,15-2,23;RR: 1,78; IC 95%: 0,70-4,53, respectivamente) |
CPC: cerebral-performance category; DRS: Disability Rating Scale; ECA: ensayo clínico randomizado; h: horas; HR: hazard ratio; HT: hipotermia terapéutica; IC: intervalo de confianza; mRS: escala de Rankin modificada; OR: odds ratio; PCR: parada cardiorrespiratoria; RR: riesgo relativo; vs: versus.
Los autores de la presente revisión proponemos priorizar la prevención activa de la fiebre (≤37,5°C), la optimización de la hemodinámica, la oxigenación, la ventilación y, quizá lo más importante, evitar una evaluación pronóstica precoz y una retirada prematura del soporte vital, medidas generales que de manera consistente se han asociado a mejores resultados clínicos40–42.
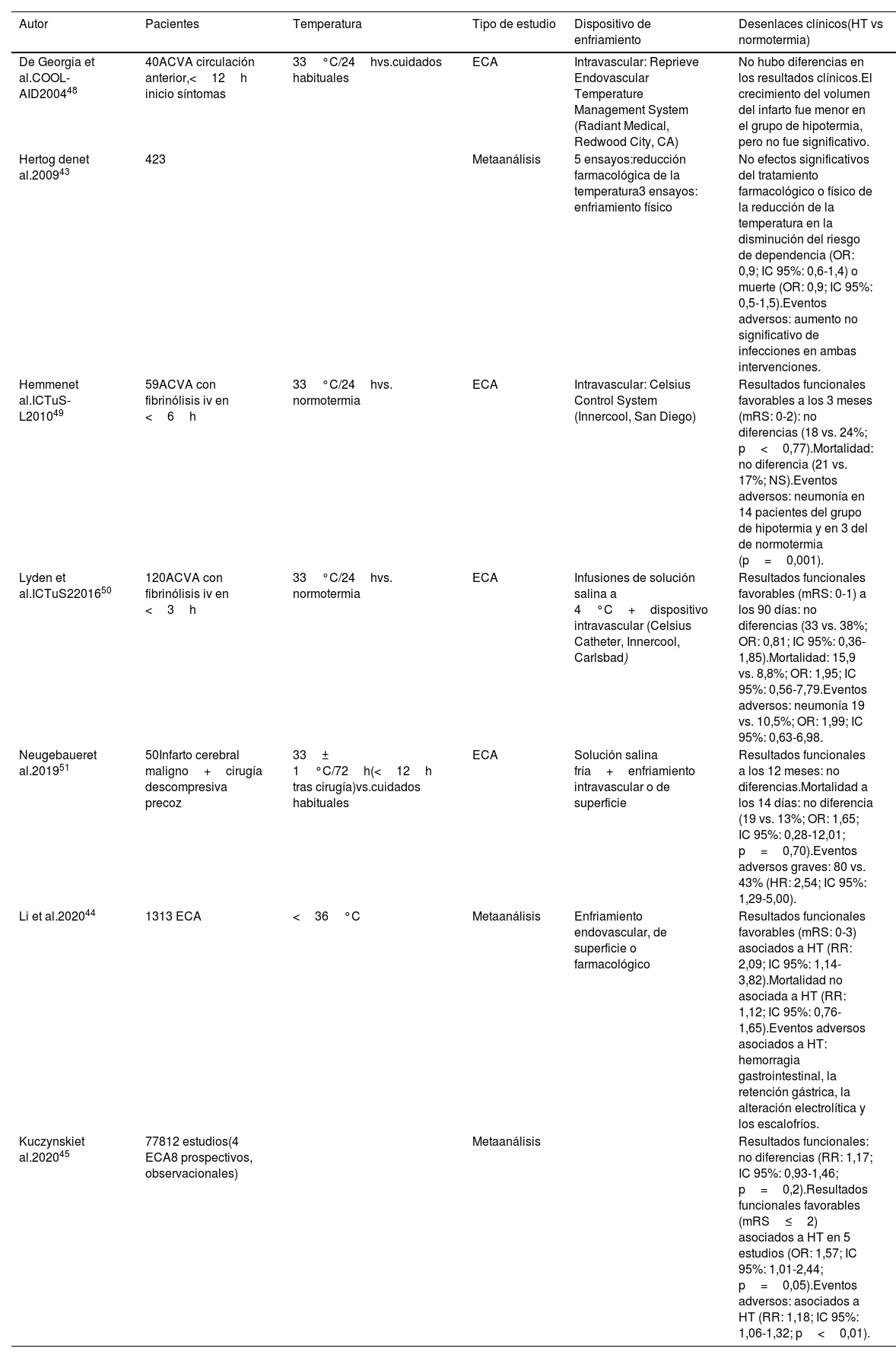
Accidente cerebrovascular isquémico agudoEn el año 2009 una revisión Cochrane43 que incluyó 5 ECA, no se encontraron efectos estadísticamente significativos del tratamiento farmacológico o físico de reducción de la temperatura en la disminución del riesgo de muerte o dependencia. Ambas intervenciones se asociaron a un aumento no significativo de la aparición de infecciones.
Otro metaanálisis posterior44, que incluyó tres estudios en 131 pacientes con grandes infartos hemisféricos, sugirió que la HT no estaba asociada con una disminución de la mortalidad; sin embargo, se asoció con la mejora del resultado neurológico de los supervivientes, aunque con un mayor riesgo de eventos adversos durante el tratamiento.
Un nuevo y reciente metaanálisis evaluó la bibliografía actual sobre la eficacia de la HT en el ACVA45. Se incluyeron 12 estudios con un total de 778 pacientes. La independencia funcional no difirió entre los grupos, aunque 5 estudios demostraron una tendencia hacia un mejor resultado funcional con la hipotermia (OR: 1,57; IC 95%: 1,01-2,44; p=0,05). Las complicaciones generales fueron mayores con la hipotermia (RR: 1,18; IC 95%: 1,06-1,32; p<0,01).
Las guías de la European Stroke Organisation (ESO)46 no recomiendan la inducción de hipotermia como medio para mejorar el resultado funcional y/o la supervivencia en pacientes con ACVA, con un grado de recomendación débil y un nivel de evidencia muy bajo. Asimismo, las guías de la American Heart Association/American Stroke Association47 establecen que, en pacientes con ACVA, el beneficio de la HT es incierto, con un grado de recomendación moderado y un nivel de evidencia moderado. Estas guías recomiendan identificar las causas de hipertermia (temperatura >38°C) y administrar antitérmicos para bajar la temperatura en los pacientes con ACVA, con un grado de recomendación fuerte y bajo nivel de evidencia (tabla 1).
La evidencia sobre el control térmico en pacientes con ACVA se resume en la tabla 343,48–51.
Resumen de la evidencia del control térmico en pacientes con accidente cerebro-vascular isquémico agudo
| Autor | Pacientes | Temperatura | Tipo de estudio | Dispositivo de enfriamiento | Desenlaces clínicos(HT vs normotermia) |
|---|---|---|---|---|---|
| De Georgia et al.COOL-AID200448 | 40ACVA circulación anterior,<12h inicio síntomas | 33°C/24hvs.cuidados habituales | ECA | Intravascular: Reprieve Endovascular Temperature Management System (Radiant Medical, Redwood City, CA) | No hubo diferencias en los resultados clínicos.El crecimiento del volumen del infarto fue menor en el grupo de hipotermia, pero no fue significativo. |
| Hertog denet al.200943 | 423 | Metaanálisis | 5 ensayos:reducción farmacológica de la temperatura3 ensayos: enfriamiento físico | No efectos significativos del tratamiento farmacológico o físico de la reducción de la temperatura en la disminución del riesgo de dependencia (OR: 0,9; IC 95%: 0,6-1,4) o muerte (OR: 0,9; IC 95%: 0,5-1,5).Eventos adversos: aumento no significativo de infecciones en ambas intervenciones. | |
| Hemmenet al.ICTuS-L201049 | 59ACVA con fibrinólisis iv en <6h | 33°C/24hvs. normotermia | ECA | Intravascular: Celsius Control System (Innercool, San Diego) | Resultados funcionales favorables a los 3 meses (mRS: 0-2): no diferencias (18 vs. 24%; p<0,77).Mortalidad: no diferencia (21 vs. 17%; NS).Eventos adversos: neumonía en 14 pacientes del grupo de hipotermia y en 3 del de normotermia (p=0,001). |
| Lyden et al.ICTuS2201650 | 120ACVA con fibrinólisis iv en <3h | 33°C/24hvs. normotermia | ECA | Infusiones de solución salina a 4°C+dispositivo intravascular (Celsius Catheter, Innercool, Carlsbad) | Resultados funcionales favorables (mRS: 0-1) a los 90 días: no diferencias (33 vs. 38%; OR: 0,81; IC 95%: 0,36-1,85).Mortalidad: 15,9 vs. 8,8%; OR: 1,95; IC 95%: 0,56-7,79.Eventos adversos: neumonía 19 vs. 10,5%; OR: 1,99; IC 95%: 0,63-6,98. |
| Neugebaueret al.201951 | 50Infarto cerebral maligno+cirugía descompresiva precoz | 33± 1°C/72h(<12h tras cirugía)vs.cuidados habituales | ECA | Solución salina fría+enfriamiento intravascular o de superficie | Resultados funcionales a los 12 meses: no diferencias.Mortalidad a los 14 días: no diferencia (19 vs. 13%; OR: 1,65; IC 95%: 0,28-12,01; p=0,70).Eventos adversos graves: 80 vs. 43% (HR: 2,54; IC 95%: 1,29-5,00). |
| Li et al.202044 | 1313 ECA | <36°C | Metaanálisis | Enfriamiento endovascular, de superficie o farmacológico | Resultados funcionales favorables (mRS: 0-3) asociados a HT (RR: 2,09; IC 95%: 1,14-3,82).Mortalidad no asociada a HT (RR: 1,12; IC 95%: 0,76-1,65).Eventos adversos asociados a HT: hemorragia gastrointestinal, la retención gástrica, la alteración electrolítica y los escalofríos. |
| Kuczynskiet al.202045 | 77812 estudios(4 ECA8 prospectivos, observacionales) | Metaanálisis | Resultados funcionales: no diferencias (RR: 1,17; IC 95%: 0,93-1,46; p=0,2).Resultados funcionales favorables (mRS≤2) asociados a HT en 5 estudios (OR: 1,57; IC 95%: 1,01-2,44; p=0,05).Eventos adversos: asociados a HT (RR: 1,18; IC 95%: 1,06-1,32; p<0,01). |
ACVA: accidente cerebro-vascular isquémico agudo; ECA: ensayo clínico randomizado; h: horas; HT: hipotermia terapéutica; IC: intervalo de confianza; mRS: escala de Rankin modificada; NS: no significativo; RR: riesgo relativo; OR: odds ratio; vs: versus.
Aunque algunos estudios han mostrado una tendencia hacia un mejor resultado funcional en pacientes con ACVA tratados con HT, no se ha observado un efecto beneficioso global, y su empleo se asocia a un aumento de las complicaciones. Por tanto, de acuerdo con el análisis de la evidencia aquí presentado, no recomendamos la aplicación de HT en este contexto clínico, y de nuevo consideramos que la prioridad debe centrarse en la prevención y el tratamiento activo de la fiebre.
Traumatismo craneoencefálico graveLos ensayos clínicos de HT en TCE han proporcionado resultados dispares, y los metaanálisis realizados han obtenido conclusiones contradictorias. La obtención de resultados inconsistentes puede deberse a diferencias en el diseño de los estudios. Los ECA de HT en el TCE grave pueden dividirse en aquellos en los que la hipotermia se utilizó para tratar la presión intracraneal (PIC) elevada y aquellos en los que la hipotermia se utilizó como neuroprotectora, para detener la cascada bioquímica tras la lesión.
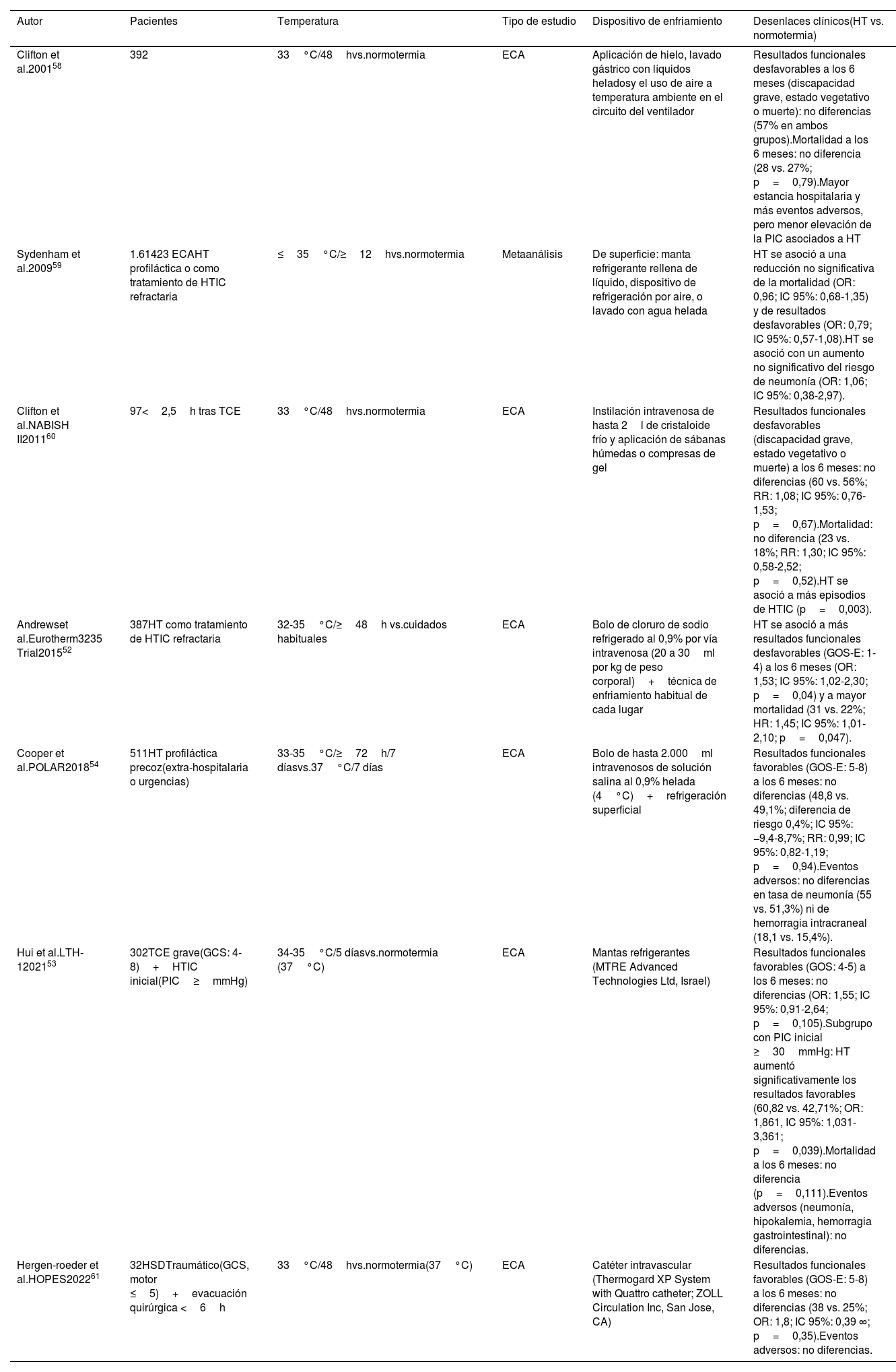
En el año 2015, el estudio Eurotherm323552 evaluó 387 pacientes con TCE grave e hipertensión intracraneal (HTIC) con fracaso de medidas de control de la PIC de primera línea, y comparó la HT (32-35°C durante ≥48h) con la atención estándar. Se observó mayor mortalidad (31 vs. 22%; HR: 1,45; IC 95%: 1,01-2,10, p=0,047) y resultados funcionales más desfavorables a los 6 meses de la lesión traumática (OR: 1,53; IC 95%: 1,02-2,30; p=0,04) en el grupo de hipotermia. Otro estudio más reciente53 comparó la HT leve prolongada (34-35°C/durante 5 días) con la normotermia en 302 pacientes con TCE grave (escala coma Glasgow 4-8) e HTIC inicial (PIC≥25mmHg). No se detectaron diferencias en el resultado neurológico ni en la mortalidad entre los grupos. En los pacientes con una PIC inicial ≥30mmHg, la HT aumentó significativamente el resultado favorable (60,8 vs. 42,7%; OR: 1,86; IC 95%: 1,03-3,36; p=0,039).
El mayor ECA de HT en pacientes con TCE hasta el momento, el estudio POLAR54, no halló ningún beneficio neurológico con la aplicación de hipotermia profiláctica (33-35°C)/durante 72h en 511 con puntuación de coma de Glasgow inferior a 9. Este estudio fue incluido en una revisión sistemática1 junto con otros 6 ECA con un total de 1.843 pacientes con TCE que abordaron la relación entre la HT (33-35°C) y el desenlace funcional y la mortalidad, con resultados de nuevo discordantes.
Las guías más recientes de la Brain Trauma Foundation para el tratamiento del TCE grave no recomiendan la hipotermia profiláctica precoz (antes de 2,5h) y a corto plazo (48h tras la lesión) para mejorar los resultados en pacientes con lesiones difusas, con nivel de evidencia IIB55. Por otro lado, la conferencia de consenso internacional de Seattle (SIBICC) para el tratamiento de la HTIC, recomienda la HT leve (35-36°C) como intervención de nivel 3 para reducir la PIC en pacientes con HTIC continua, una vez agotadas otras intervenciones de nivel 1 y 2, con un nivel de evidencia IV (opinión de expertos)56,57 (tabla 1).
La evidencia sobre el control térmico en pacientes con TCE se resume en la tabla 452,58–61.
Resumen de la evidencia del control térmico en pacientes con traumatismo craneoencefálico grave
| Autor | Pacientes | Temperatura | Tipo de estudio | Dispositivo de enfriamiento | Desenlaces clínicos(HT vs. normotermia) |
|---|---|---|---|---|---|
| Clifton et al.200158 | 392 | 33°C/48hvs.normotermia | ECA | Aplicación de hielo, lavado gástrico con líquidos heladosy el uso de aire a temperatura ambiente en el circuito del ventilador | Resultados funcionales desfavorables a los 6 meses (discapacidad grave, estado vegetativo o muerte): no diferencias (57% en ambos grupos).Mortalidad a los 6 meses: no diferencia (28 vs. 27%; p=0,79).Mayor estancia hospitalaria y más eventos adversos, pero menor elevación de la PIC asociados a HT |
| Sydenham et al.200959 | 1.61423 ECAHT profiláctica o como tratamiento de HTIC refractaria | ≤35°C/≥12hvs.normotermia | Metaanálisis | De superficie: manta refrigerante rellena de líquido, dispositivo de refrigeración por aire, o lavado con agua helada | HT se asoció a una reducción no significativa de la mortalidad (OR: 0,96; IC 95%: 0,68-1,35) y de resultados desfavorables (OR: 0,79; IC 95%: 0,57-1,08).HT se asoció con un aumento no significativo del riesgo de neumonía (OR: 1,06; IC 95%: 0,38-2,97). |
| Clifton et al.NABISH II201160 | 97<2,5h tras TCE | 33°C/48hvs.normotermia | ECA | Instilación intravenosa de hasta 2l de cristaloide frío y aplicación de sábanas húmedas o compresas de gel | Resultados funcionales desfavorables (discapacidad grave, estado vegetativo o muerte) a los 6 meses: no diferencias (60 vs. 56%; RR: 1,08; IC 95%: 0,76-1,53; p=0,67).Mortalidad: no diferencia (23 vs. 18%; RR: 1,30; IC 95%: 0,58-2,52; p=0,52).HT se asoció a más episodios de HTIC (p=0,003). |
| Andrewset al.Eurotherm3235 Trial201552 | 387HT como tratamiento de HTIC refractaria | 32-35°C/≥48h vs.cuidados habituales | ECA | Bolo de cloruro de sodio refrigerado al 0,9% por vía intravenosa (20 a 30ml por kg de peso corporal)+técnica de enfriamiento habitual de cada lugar | HT se asoció a más resultados funcionales desfavorables (GOS-E: 1-4) a los 6 meses (OR: 1,53; IC 95%: 1,02-2,30; p=0,04) y a mayor mortalidad (31 vs. 22%; HR: 1,45; IC 95%: 1,01-2,10; p=0,047). |
| Cooper et al.POLAR201854 | 511HT profiláctica precoz(extra-hospitalaria o urgencias) | 33-35°C/≥72h/7 díasvs.37°C/7 días | ECA | Bolo de hasta 2.000ml intravenosos de solución salina al 0,9% helada (4°C)+refrigeración superficial | Resultados funcionales favorables (GOS-E: 5-8) a los 6 meses: no diferencias (48,8 vs. 49,1%; diferencia de riesgo 0,4%; IC 95%: −9,4-8,7%; RR: 0,99; IC 95%: 0,82-1,19; p=0,94).Eventos adversos: no diferencias en tasa de neumonía (55 vs. 51,3%) ni de hemorragia intracraneal (18,1 vs. 15,4%). |
| Hui et al.LTH-1202153 | 302TCE grave(GCS: 4-8)+HTIC inicial(PIC≥mmHg) | 34-35°C/5 díasvs.normotermia (37°C) | ECA | Mantas refrigerantes (MTRE Advanced Technologies Ltd, Israel) | Resultados funcionales favorables (GOS: 4-5) a los 6 meses: no diferencias (OR: 1,55; IC 95%: 0,91-2,64; p=0,105).Subgrupo con PIC inicial ≥30mmHg: HT aumentó significativamente los resultados favorables (60,82 vs. 42,71%; OR: 1,861, IC 95%: 1,031-3,361; p=0,039).Mortalidad a los 6 meses: no diferencia (p=0,111).Eventos adversos (neumonía, hipokalemia, hemorragia gastrointestinal): no diferencias. |
| Hergen-roeder et al.HOPES202261 | 32HSDTraumático(GCS, motor ≤5)+evacuación quirúrgica <6h | 33°C/48hvs.normotermia(37°C) | ECA | Catéter intravascular (Thermogard XP System with Quattro catheter; ZOLL Circulation Inc, San Jose, CA) | Resultados funcionales favorables (GOS-E: 5-8) a los 6 meses: no diferencias (38 vs. 25%; OR: 1,8; IC 95%: 0,39 ∞; p=0,35).Eventos adversos: no diferencias. |
ECA: ensayo clínico randomizado; GCS: escala de coma de Glasgow; GOS: Glasgow Outcome Scale; GOS-E: Extended Glasgow Outcome Scale; h: horas; HR: hazard ratio; HSD: hematoma subdural; HT: hipotermia terapéutica; HTIC: hipertensión intracraneal; IC: intervalo de confianza; OR: odds ratio; PIC: presión intracraneal; RR: riesgo relativo; TCE: traumatismo craneoencefálico; vs: versus.
La HT en pacientes con TCE grave, empleada como neuroprotección o como tratamiento de la HTIC, no mejora los resultados funcionales ni la mortalidad, incluso puede resultar perjudicial y, por tanto, se desaconseja su utilización.
ConclusiónAunque la HT se presuponía como una estrategia prometedora como medio para mejorar los resultados neurológicos en distintas afecciones neurológicas, la evidencia disponible no ha logrado demostrar su beneficio clínico, y su aplicación se asocia a efectos adversos. Las guías actuales en general recomiendan la prevención activa y el tratamiento de la fiebre fundamentándose en gran medida en la asociación observada entre fiebre y peores desenlaces clínicos. Sin embargo, aún quedan preguntas fundamentales sin respuesta sobre el método de enfriamiento más adecuado, la temperatura objetivo, la duración óptima del control térmico y qué pacientes deben seleccionarse. Los resultados de ensayos clínicos en curso y futuros estudios sobre el control de la temperatura pueden aportar nueva evidencia sobre los efectos de la hipotermia y ayudar a definir vías terapéuticas que permitan una atención individualizada de los pacientes neurológicos en estado crítico.
FinanciaciónEsta investigación no recibió ninguna subvención específica de organismos de financiación de los sectores público, comercial o sin fines de lucro.
Conflicto de interesesTodos los autores declaran que no tienen conflictos de intereses relevantes.