El proceso de desconexión de la ventilación mecánica invasiva (weaning) es uno de los ejes centrales en la práctica clínica diaria de los intensivistas, que puede suponer hasta un 40% del tiempo total de ventilación mecánica invasiva (VMI)1. Consta de dos fases principales: la detección temprana de los pacientes preparados para iniciarlo (cribado) y la prueba de confirmación mediante la prueba de ventilación espontánea (PVE) (tabla 1).
Estándar actual del proceso de weaning1
| Estándar actual del cribado |
|---|
| Criterios subjetivos |
| • Resolución o estabilización de la situación que motivó la VMI |
| • Nivel mínimo de sedación continua |
| • Frecuencia respiratoria > 6 rpm y ≤ 35 rpm |
| Criterios objetivos |
| • Estabilidad cardiovascular con un máximo de 0,1 μg/kg/min de noradrenalina |
| • Hemoglobina > 7 g/dl |
| • Ionograma en rango |
| • Temperatura en rango de 36-38,5 °C |
| • Criterios predictores precoces de tolerancia a la PVE (IRSR, P0.1, PIM) |
| • PaO2/FiO2 ≥ 150 con PEEP ≤ 8 cmH2O |
| Intolerancia a la PVE |
|---|
| Criterios subjetivos |
| • Disminución del nivel de consciencia, sudoración profusa, cianosis, incremento del trabajo respiratorio y disnea. |
| Criterios objetivos |
| • PO2 ≤ 50-60 mmHg con FiO2 ≥ 0,5 o SpO2 < 90% |
| • PCO2 ≥ 50 mmHg o incremento ≥ 8 mmHg respecto al valor basal |
| • pH < 7,32 o disminución de ≥ 0,07 unidades de pH respecto al valor basal |
| • fR/VT (IRSR) > 105 respiraciones/min/l |
| • Frecuencia respiratoria ≥ 35 rpm o incremento del 50% sobre previa |
| • Frecuencia cardiaca ≥ 140 lpm, incremento del 20% o arritmia |
| • Presión arterial sistólica < 90 mm Hg o ≥ 180 mm Hg o incremento del 20% |
FiO2: fracción inspirada de oxígeno; fR: frecuencia respiratoria; IRSR: índice de respiración superficial rápida; P0.1: presión de oclusión de la vía aérea en los primeros 0,1 segundos; PaO2: presión arterial de oxígeno; PEEP: presión al final de la espiración; PIM: presión inspiratoria máxima; VT: volumen tidal.
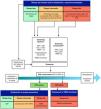
En los últimos años se han desarrollado dos nuevos aspectos: la estratificación del riesgo de fracasar la extubación y la aplicación de soporte respiratorio no invasivo tras la extubación. Este nuevo enfoque requiere el abordaje simultáneo de los cuatro aspectos (estratificación, cribado, PVE y soporte tras la extubación), más que el abordaje tradicional en dos fases secuenciales (fig. 1).
Propuesta de personalización del weaning considerando la estratificación del riesgo individual y la aplicación de soporte tras la extubación.
IMC: índice de masa corporal; OAF: oxigenoterapia de alto flujo; PEEP: presión al final de la espiración; PS: presión soporte; PVE: prueba de ventilación espontánea: VMNI: ventilación mecánica no invasiva.
* cribado agresivo (5); **: cribado conservador (1).
Para determinar el riesgo individual de fracasar existen múltiples factores descritos (tabla 2). El uso de un modelo complejo que incluye todas las variables2 permite una mejor subestratificación del riesgo y detección de subgrupos, mientras que un modelo simple con tres variables (edad, patología crónica cardiaca o pulmonar)3 es pragmático y reduce la carga del trabajo asistencial. Está por determinar si un modelo de cuatro factores, añadiendo la ventilación mecánica prolongada (>7días de VMI) puede ser la estrategia idónea en la estratificación del riesgo.
Factores de riesgo asociados con el fracaso tras la extubación2,3
| Modelo de 3 factores | Modelo de 11 factores |
|---|---|
| Edad > 65 años | Edad > 65 años |
| Patología cardiaca crónica | Insuficiencia cardiaca como causa de intubación |
| Patología respiratoria crónica | EPOC moderada-grave |
| Puntuación APACHE II > 12 el día de la extubación | |
| IMC > 30 kg/m2 | |
| Aspiración de secreciones > 2 veces en las 8 horas previas a la extubación | |
| Índice de comorbilidades de Charlson > 1 (incluye comorbilidades respiratoria y cardiaca) | |
| Factores de riesgo relacionados con vía aérea superior | |
| > 1 PVE fracasada | |
| Desarrollo de hipercapnia al finalizar la PVE | |
| Duración > 7 días de VMI |
APACHE II: Acute Physiology and Chronic Health Evaluation; EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; PVE: prueba de ventilación espontánea; VMI: ventilación mecánica invasiva.
El soporte ventilatorio no invasivo tras la extubación, bien con intención facilitadora o preventiva, debería individualizarse en función del riesgo individual y la presencia de factores de riesgo específicos, dadas las diferencias en su eficacia. Nuestra recomendación con intención preventiva incluye el uso de oxigenoterapia de alto flujo (OAF) durante 24horas en pacientes de bajo riesgo (pacientes sin ninguno de los factores de riesgo descritos), en riesgo intermedio (≤3factores de riesgo excluyendo obesos, hipercápnicos tras la PVE), la combinación de ventilación mecánica no invasiva (VMNI) y OAF durante 48horas3, y en riesgo alto (≥4factores de riesgo, obesos o hipercápnicos tras la PVE), VMNI optimizada con acondicionamiento de los gases a temperatura intermedia (29°C) durante 48horas y selección de la interfaz adecuada para el acondicionamiento2. El soporte ventilatorio no invasivo con intención facilitadora requiere además introducir modificaciones en el cribado y la PVE.
La detección temprana del paciente preparado para iniciar la desconexión de la VMI es clave para evitar retrasos en el weaning. El proceso de cribado requiere una actualización por varios motivos:
Primero, las recomendaciones vigentes aplicadas en pacientes de riesgo bajo o intermedio de fracaso pueden derivar en retrasos innecesarios del destete, complicaciones asociadas al mismo (por ejemplo, delirio adquirido en la UCI) y posible mayor tasa de fracaso de PVE4,5.
Segundo, la predicción de éxito de la PVE mediante el uso de parámetros como el índice de ventilación rápida y superficial no debe confundirse con la predicción de éxito de la extubación.
Tercero, los criterios no respiratorios de cribado excesivamente exigentes, como el empleo de noradrenalina a dosis <0,1μg/kg/min4,6,7 y protocolos de sedación inadecuados, pueden contribuir al retraso y aumentar la heterogeneidad de los resultados. Además, en el caso del uso de inotropos, no hay recomendaciones específicas a pesar de tratarse de fármacos que pueden resultar de utilidad en la transición a ventilación espontánea con presión negativa en pacientes con disfunción cardiaca.
Cuarto, la valoración de la recuperación de la función pulmonar ha mostrado una escasa evolución hasta hace poco, pasando de PaO2/FiO2 >200 con PEEP ≤5cm H2O y FiO2 ≤40% a PaO2/FiO2 ≥150 con PEEP ≤8 y FiO2 ≤40%, y finalmente a PaO2/FiO2 >180 con PEEP10 y FiO250%5,6. Además, las terapias no invasivas tras la extubación (preventivas o facilitadoras) reducen el trabajo respiratorio, permitiendo modificar estos parámetros del cribado.
La confirmación diagnóstica debe hacerse analizando el desempeño, durante la PVE, mediante 30minutos de aplicación de presión soporte, aunque el margen de presión todavía sigue siendo muy amplio (entre 5 y 8cmH2O)7. Por el momento no queda claro el papel de la PEEP durante la PVE, que actualmente se encuentra en estudio (Clinicaltrials.gov NCT 05526053). Además, los estudios epidemiológicos advierten de la frecuencia con que se extuba directamente sin realizar ninguna prueba de confirmación4. Aunque esta práctica puede ser una forma de acortar el tiempo de VMI, su empleo debería estar limitado a pacientes de muy bajo riesgo de fracasar la extubación hasta que se estandarice esta práctica o se acorten los tiempos, optimizando el cribado y la PVE.
Parece prioritario individualizar la PVE acorde al riesgo individual, el cribado y la terapia tras la extubación, antes de extubar sin realizarla o extubar subgrupos concretos tras fracasar la PVE a VMNI facilitadora, como pacientes seleccionados con fallo hipoxémico8 o pacientes con EPOC y fallo hipercápnico9.
Nos encontramos ante la necesidad de redefinir el proceso de weaning. La aplicación de soporte ventilatorio no invasivo tras la extubación supone redefinir términos como reintubación, pues se puede retrasar la aparición del fracaso respiratorio tras la extubación2. En el otro extremo se plantea el problema de acelerar la extubación. Se trata de un concepto excesivamente amplio, ya que incluye diversos escenarios: cribado agresivo sin realización de PVE, estratificación de riesgo ni prevención4; cribado agresivo con PVE no tolerada y aplicación de VMNI facilitadora10; cribado agresivo sin realización de PVE y aplicación de VMNI facilitadora8; cribado agresivo, PVE conservadora tolerada con estratificación de riesgo y OAF preventivo5. Hasta la fecha, el último es el único de estos abordajes testado con un diseño que reduce la subjetividad y con beneficio clínico demostrado.
La gran mayoría de los procesos diagnósticos en medicina incluyen un cribado y una prueba de confirmación, y el weaning debería ceñirse a las reglas habituales del acto diagnóstico médico. Además, la evolución de la medicina hacia la personalización debería incluir al weaning con la detección de subgrupos con un comportamiento clínico diferente.
Conflicto de interesesGonzalo Hernández tiene un conflicto de interés con Fisher & Paykel: pagos personales y gastos de viajes.