Los criterios del RIFLE y del AKIN han ayudado definitivamente a llamar la atención sobre la relación entre un deterioro de la función renal que produce un pequeño incremente de la concentración sérica de creatinina y un peor pronóstico. Sin embargo, la utilidad clínica concreta del uso de estos criterios permanece por definir. Se cree que la principal utilidad de estos criterios reside en su uso en estudios epidemiológicos y en ensayos clínicos, para definir criterios de inclusión y objetivos de una intervención.
La adopción del término DRA, reemplazando a la antigua terminología de IRA, resulta apropiada para designar la condición clínica caracterizada por daño del órgano, de la misma forma que se utiliza el término daño pulmonar agudo para describir la situación de lesión pulmonar que todavía no ha progresado a una situación de insuficiencia del órgano (disfunción).
Los biomarcadores séricos y urinarios (creatinina, urea, diuresis) actualmente en uso no son sensibles ni específicos para la detección de daño renal, limitando las opciones terapéuticas y potencialmente comprometiendo el pronóstico. Nuevos biomarcadores se encuentran en estudio con el objeto de diagnosticar de una forma más precoz y específica el DRA, con el potencial de cambio de los criterios de definición y estadificación del DRA, actualmente basados en la diuresis y la concentración sérica de creatinina.
The RIFLE and AKIN criteria have definitely help out to draw attention to the relationship between a deterioration of renal function that produces a small increase in serum creatinine and a worse outcome. However, the specific clinical utility of using these criteria remains to be well-defined. It is believed that the main use of these criteria is for the design of epidemiological studies and clinical trials to define inclusion criteria and objectives of an intervention.
AKI adopting term, re-summoning former ARF terminology, it is appropriate to describe the clinical condition characterized by damage to kidney, in the same way as the term is used to describe acute lung damage where the lung injury situation still has not increased to a situation of organ failure (dysfunction).
The serum and urine biomarkers (creatinine, urea, and diuresis) currently in use are not sensitive or specific for detecting kidney damage, limiting treatment options and potentially compromising the outcome. New biomarkers are being studied in order to diagnose an earlier and more specific AKI, with the potential to change the definition criteria of AKI with different stages, currently based in diuresis and serum creatinine.
La insuficiencia renal aguda (IRA) es un síndrome frecuente en la unidad de cuidados intensivos (UCI). La incidencia depende de la definición utilizada. En un reciente estudio español1, la incidencia de IRA (definida como una elevación de la concentración sérica de creatinina ≥2mg/dl o una diuresis <400ml/24h) fue del 5,7%. La incidencia es del 20-50% en otros estudios (revisados en referencia de Case et al.2) que utilizan los criterios más sensibles del Risk, Injury, Failure, Loss, End-stage disease (RIFLE). La IRA constituye un factor pronóstico independiente de supervivencia, y se asocia con una mortalidad del 40-90%2,3; del 43% en el estudio español FRAMI1. Aproximadamente el 4-5% de los pacientes críticos requieren terapia de sustitución renal2. En un estudio multinacional se describió que la prevalencia del uso de terapia sustitutiva renal es del 4%, o aproximadamente 2 tercios de los pacientes con IRA (definida en ese estudio como una diuresis <200ml/12h o BUN>84mg/dl)4. El desarrollo de IRA, con el consiguiente riesgo de requerir terapia sustitutiva renal, se asocia a un aumento de la morbilidad y del coste5.
Los objetivos de la presente revisión son (i) revisar conceptos recientes sobre el daño renal agudo (DRA) y sobre criterios diagnósticos actualmente en uso; y (ii) revisar la evidencia sobre la utilidad de biomarcadores de DRA. Se concluye con comentarios sobre avances prometedores sobre el uso de las ciencias -ómicas para la identificación de biomarcadores de DRA, así como con un comentario sobre la necesidad de demostrar mejoría de algún desenlace clínico de interés para poder recomendar algún biomarcador.
La concentración sérica de creatinina y de urea, así como la diuresis, son marcadores de disfunción renal: cambios en estas variables indican que el riñón no desarrolla adecuadamente su función fisiológica. Sin embargo, es conocido que tras un daño (isquemia, inflamación) el órgano sufre un daño o lesión (manifestado, p. ej., por cambios en el fenotipo celular), que precede a la fase de disfunción. La detección del daño del órgano antes de que desarrolle disfunción permitirá corregir la fisiología alterada antes de que se produzca la progresión a fases caracterizadas por irreversibilidad, menor eficacia del tratamiento y peor pronóstico.
Concepto de daño renal agudoLa IRA se define como una disminución abrupta del filtrado glomerular, con el consiguiente aumento de la concentración de productos nitrogenados en la sangre, que puede acompañarse o no de oliguria5. En las últimas décadas han coexistido más de 30 definiciones de IRA, basadas en diferentes valores de concentración sérica de creatinina6,7.
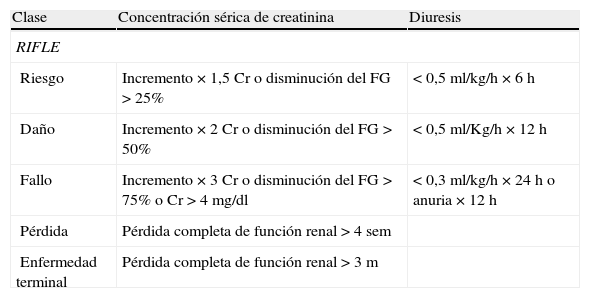
La Acute Dialysis Quality Initiative propuso el sistema de clasificación de la función renal denominado RIFLE para clasificar a los pacientes con IRA6. El RIFLE establece 3 categorías de disfunción renal (riesgo, daño y fracaso) y 2 desenlaces clínicos (pérdida de la función y enfermedad renal terminal) (tabla 1). Diversos estudios clínicos han demostrado la correlación de las diferentes categorías con el pronóstico de pacientes críticos, y su asociación independiente con la mortalidad5–8. Las categorías representan también estadios evolutivos, ya que el 56% de los pacientes que son clasificados como de riesgo progresan a otra categoría, y el 37% de los que presentan daño progresan a la categoría de fallo7.
Comparación de los criterios de clasificación RIFLE y RIFLE modificado por AKIN
| Clase | Concentración sérica de creatinina | Diuresis |
| RIFLE | ||
| Riesgo | Incremento×1,5Cr o disminución del FG>25% | <0,5ml/kg/h×6h |
| Daño | Incremento×2Cr o disminución del FG>50% | <0,5ml/Kg/h×12h |
| Fallo | Incremento×3Cr o disminución del FG>75% o Cr>4mg/dl | <0,3ml/kg/h×24h o anuria×12h |
| Pérdida | Pérdida completa de función renal>4 sem | |
| Enfermedad terminal | Pérdida completa de función renal>3 m | |
| Estadio | Concentración sérica de creatinina | Diuresis |
| RIFLE modificado por AKINb | ||
| 1 | Incremento Cr basal≥0,3 mg/dl o aumento del valor basal ≥150 a 200% en 48h | <0,5ml/kg/h×6h |
| 2 | Incremento Cr>200 a 300% | <0,5ml/kg/h×12h |
| 3a | Incremento Cr basal>300% del valor basal o Cr ≥4 mg/dl con incremento >0,5mg/dl | <0,3ml/kg/h×24h o anuria 12h |
AKIN: Acute Kidney Injury Network; Cr: concentración sérica de creatinina; DRA: daño renal agudo; FG: filtrado glomerular; RIFLE: riesgo (risk), daño (injury), fallo (failure), pérdida de función (loss), enfermedad renal terminal (end stage renal disease).
Los pacientes que requieren terapia sustitutiva renal son incluidos en el estadio 3, independientemente del valor de la concentración de creatinina o de la diuresis.
De acuerdo con las guías Kidney Disease Improving Global Outcome (KDIGO), la ventana temporal requerida para documentar un aumento en la concentración sérica de creatinina de 0,3mg/dl se mantiene en 48h, mientras que el tiempo para el aumento del 50% es de 7 días, tal como se sugirió inicialmente en los criterios de RIFLE.
Los criterios KDIGO solo utilizan cambios en la concentración sérica de creatinina y en la diuresis para la estadificación del DRA, pero no considera cambios en el filtrado glomerular, con la excepción de niños menores de 18 años (ver texto).
De acuerdo con los criterios KDIGO, el DRA se estadifica en estadio 1, estadio 2 o estadio 3, siguiendo los criterios de AKIN.
Posteriormente, el Acute Kidney Injury Network (AKIN), conformado por la Acute Dialysis Quality Initiative y la European Society of Intensive Care Medicine, propuso sustituir el término insuficiencia, que hace referencia a la pérdida de la función de filtración renal, por el término daño (injury)8. El AKIN definió el DRA como una alteración estructural o funcional o signos de daño renal, incluyendo cualquier alteración en un test de orina o de sangre, o en una prueba de imagen, de una duración inferior a 3 meses8–10. Los criterios diagnósticos de IRA actuales se presentan en la tabla 1.
La adición del criterio de una elevación de ≥0,3mg/dl se basa en resultados epidemiológicos que demuestran un aumento del 80% en la mortalidad asociado a cambios en la concentración de creatinina de 0,3 a 0,5mg/dl9. Este hallazgo fue reproducido posteriormente en pacientes ventilados mecánicamente10,11.
No está claro si la modificación de los criterios de RIFLE propuesta por el AKIN ha cambiado sustancialmente la clasificación de pacientes con DRA o ha mejorado la capacidad de predecir la mortalidad12.
Los criterios de estadificación AKIN de la IRA permiten definir 3 estadios de gravedad creciente que se corresponden con las categorías de riesgo (risk), daño (injury), y fallo (failure) de la clasificación RIFLE, eliminándose las categorías de pérdida (loss) y estadio terminal (end stage), los cuales son definidos como desenlaces.
Finalmente, las recientemente publicadas guías Kidney Disease Improving Global Outcome (KDIGO) para el tratamiento de la IRA han incluido una definición revisada de DRA manteniendo los criterios de estadificación del AKIN13 (tabla 1). La ventana temporal requerida para documentar un aumento en la concentración sérica de creatinina de 0,3mg/dl se mantiene en 48h, mientras que el tiempo para el aumento del 50% es de 7días, tal como se sugirió inicialmente en los criterios de RIFLE. Para la estadificación del DRA, los criterios KDIGO solo utilizan cambios en la concentración sérica de creatinina y en la diuresis, pero no cambios en el filtrado glomerular, con la excepción de niños menores de 18 años, en los cuales se incluye como criterio una disminución aguda del filtrado glomerular estimado a <35ml/min/1,73m2 de superficie corporal como criterio para el estadio 3. De la misma forma que para los criterios de RIFLE y de AKIN, el enfermo deberá ser clasificado de acuerdo con los criterios asociados con el estadio de daño más avanzado.
De acuerdo con los criterios KDIGO, el DRA se estadifica de la siguiente forma:
- -
estadio 1, aumento de 1,5-1,9 veces de la concentración sérica de creatinina o aumento absoluto de 0,3ml/dl o diuresis <0,5ml/kg/h durante 6-12h;
- -
estadio 2, 2,0-2,9 veces aumento de la concentración sérica de creatinina o diuresis <0,5ml/kg/h durante ≥12h;
- -
estadio 3, aumento ≥3 veces la concentración sérica de creatinina o concentración ≥4mg/dl o diuresis <0,3ml/kg/h ≥24h, o anuria durante ≥12h o inicio de tratamiento renal sustitutivo o (en pacientes <18 años de edad) disminución del filtrado glomerular estimado <35ml/min/1,73m2 de superficie corporal.
Aun cuando las nuevas definiciones y la propuesta de los criterios RIFLE y, quizá, AKIN suponen avances indudables para establecer el diagnóstico y el pronóstico del DRA, estas definiciones utilizan variables (la concentración sérica de creatinina y la diuresis) que están sujetas a serias limitaciones (vide infra), lo cual ha motivado el estudio de otros biomarcadores de mayor sensibilidad y especificidad para establecer el diagnóstico y pronóstico del DRA.
Concentración sérica de creatinina y urea: ventajas y limitacionesLa concentración sérica de creatinina es útil como marcador del filtrado glomerular, ya que la creatinina es un soluto que se filtra libremente a nivel glomerular y posee escaso manejo tubular. Sin embargo, el uso de la concentración sérica de creatinina como indicador de la función renal está sujeto a limitaciones, más evidentes en pacientes críticos. Primero, la concentración sérica de creatinina no es un marcador sensible ni precoz de disfunción renal, ya que requiere una disminución de al menos el 50% del filtrado glomerular para que se detecte un incremento en la concentración sérica de creatinina14. Segundo, en pacientes que no se encuentran en estado de equilibrio, la concentración sérica de creatinina puede ser baja mientras el filtrado glomerular real se encuentra muy reducido, ya que no ha habido tiempo para que la creatinina se acumule. Tercero, la caída del filtrado glomerular se acompaña de un aumento de la secreción tubular proximal de creatinina, que inicialmente logra mantener los valores séricos de creatinina. Cuarto, la concentración sérica de creatinina no depende únicamente del filtrado glomerular, sino también de otras variables, como (a) la masa muscular, que habitualmente se halla disminuida en los pacientes críticos; (b) la función hepática, responsable de su metabolismo; y (c) el volumen de distribución, frecuentemente aumentado en condiciones de respuesta inflamatoria sistémica. La concentración sérica de creatinina depende, pues, de múltiples variables, que también incluyen, p. ej., edad, sexo, dieta, metabolismo muscular, medicación e hidratación.
Al igual que sucede con la creatinina, la concentración sérica de urea no es un marcador específico del filtrado glomerular. Puede aumentar en ciertas condiciones en presencia de una función renal normal, como el tratamiento con corticoides, la hemorragia digestiva y la dieta hiperproteica14.
DiuresisLa diuresis es utilizada como parámetro indicativo del estado hemodinámico y de la función renal. La presencia de oligoanuria tiene alto valor predictivo positivo de insuficiencia renal y constituye un marcador de mal pronóstico en los pacientes críticos. Por otro lado, en los pacientes críticos la oliguria aparece antes que los cambios en la concentración sérica de creatinina y permite un diagnóstico precoz del DRA. Asimismo, la oliguria se asocia a una mayor mortalidad independientemente de la concentración sérica de creatinina.
Sin embargo, el grado de oliguria no presenta correlación con la gravedad del daño renal. Un gasto urinario normal no descarta la presencia de DRA, ya que muchos pacientes presentan una forma no oligúrica de DRA. Por otro lado, muchas intervenciones realizadas en la UCI (p. ej.., administración de diuréticos, resucitación con fluidos, administración de dopamina) afectan a la diuresis sin modificar necesariamente la función renal12,14.
Marcadores de daño renal agudoLa disponibilidad de un biomarcador de DRA puede facilitar (i) la detección precoz del daño renal, permitiendo así un tratamiento que posiblemente prevenga la progresión hacia categorías más avanzadas de disfunción renal; (ii) la distinción entre los diferentes tipos de DRA (prerrenal, renal, obstructivo); (iii) la estratificación del riesgo; (iv) la monitorización de la respuesta al tratamiento; y (v) la predicción de la respuesta al tratamiento. El biomarcador ideal debe ser sensible, específico, precoz, no invasivo, predictivo, indicativo del lugar de la lesión, pronóstico y económico.
Con estos objetivos, se han estudiado en los últimos años diversas moléculas detectables en la sangre o en la orina. Entre los biomarcadores séricos se encuentra cistatina C, neutrophil gelatinase-associated lipocallin (NGAL) y ácido úrico. Los biomarcadores urinarios se clasifican en:
- (1)
enzimas liberadas por las células tubulares dañadas (fosfatasa alcalina, γ- glutamiltranspeptidasa, alanin-aminopeptidasa, Ala-(Leu-Gly)-aminopeptidasa, fructosa-1-6-bifosfatasa, isoenzimas de la glutatión-S-transferasa α y π, N-acetil-β-D-glucosaminidasa);
- (2)
moléculas de bajo peso molecular que se expresan en el DRA (α-1-microglobulina, β-2-microglobulina, proteína ligadora del retinol, cistatina C, proteína ligadora de la adenosindeaminasa);
- (3)
proteínas específicamente producidas en el riñón en condiciones de DRA (proteína rica en cisteína 61, NGAL, KIM-1, citocinas y quemocinas como Gro-α, IL-18);
- (4)
proteínas estructurales y funcionales tubulares (actina F, intercambiador Na+/H+ isoforma 3);
- (5)
marcadores de filtrado glomerular (pro-ANP, cistatina C)15.
En la presente revisión analizaremos la evidencia sobre la posible utilidad clínica de los biomarcadores de DRA más estudiados.
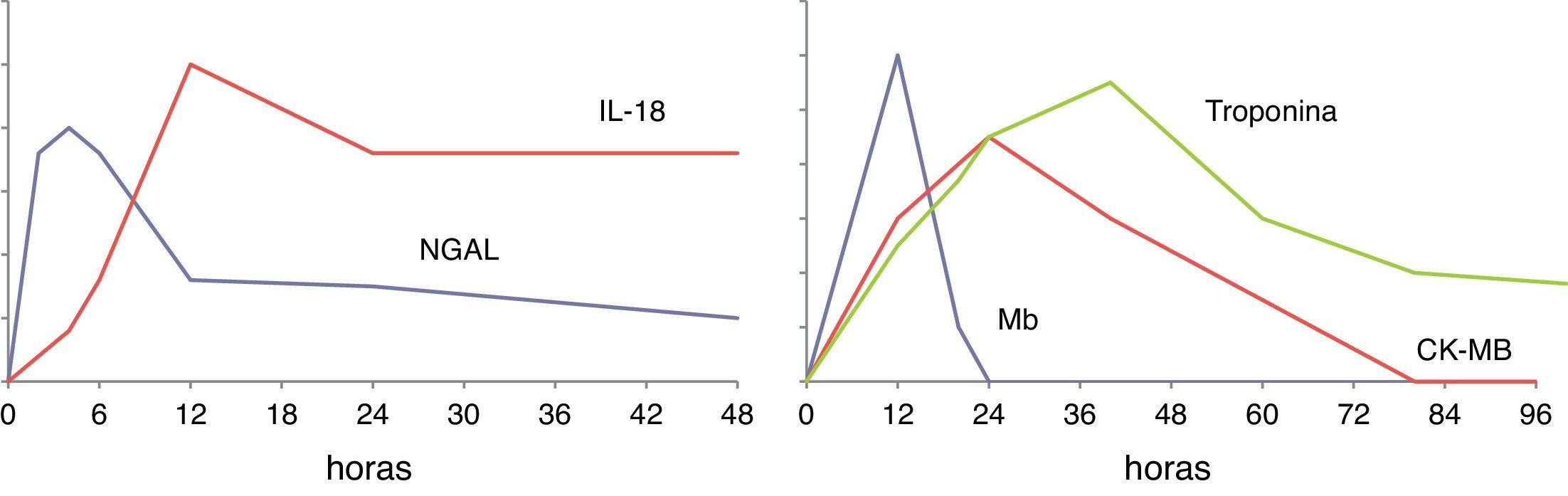
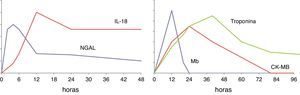
Cada uno de ellos posee diferentes propiedades como biomarcador (p. ej., aumentar la sensibilidad del diagnóstico, predecir el pronóstico, etc.). Por otro lado, se ha propuesto que el uso de un panel de varios biomarcadores puede mejorar sus propiedades individuales. Por ejemplo, en una revisión sistemática de la literatura se encontraron 25 estudios que reunían criterios de buena calidad metodológica15. Cistatina C sérica, IL-18 urinaria, y KIM-1 urinaria, tuvieron un buen comportamiento para el diagnóstico diferencial de DRA establecido. Cistatina C sérica y NGAL, IL-18, glutatión-S-transferasa-π, γ-glutatión-S-transferasa urinarios tuvieron un buen comportamiento para el diagnóstico precoz de DRA. NGAL fue un buen predictor de la necesidad de terapia de reemplazo renal16. N-acetil-β-D-glucosaminidasa, KIM-1, IL-18 urinarios, fueron más útiles para la predicción de la mortalidad en el DRA.
Cistatina CLa cistatina C es una proteína producida por todas las células nucleadas del organismo, que pertenece a la superfamilia de inhibidores de cistein-proteinasas. En condiciones fisiológicas, la cistatina C se filtra libremente (debido a su bajo peso molecular) ya que no se une a proteínas, y es reabsorbida en el túbulo proximal, donde sufre catabolismo15. Por tanto, el aumento de la concentración urinaria de cistatina C indica daño tubular renal17. En condiciones en que disminuye el filtrado glomerular la concentración sérica de cistatina también aumenta18.
Sin embargo, los niveles séricos de cistatina C no son específicos de daño renal, pues se encuentran elevados en enfermos ancianos, en varones, obesidad, tabaquismo, alteraciones de la función tiroidea y tratamiento inmunosupresor19.
Los estudios sobre la capacidad de la concentración sérica de cistatina C para predecir el desarrollo de DRA han conducido a resultados discrepantes. En pacientes críticos con riesgo de desarrollar DRA, la elevación de la concentración sérica de cistatina C se asoció al desarrollo de DRA, y precedió a la elevación de la concentración sérica de creatinina en 1-2 días20. En otro estudio, la concentración sérica de cistatina C predijo el desarrollo de DRA en un análisis univariante (área bajo la curva ROC 0,80)21. En enfermos sometidos a cirugía cardíaca, los niveles séricos de cistatina C en el momento del ingreso en la UCI predijeron el desarrollo de DRA así como la necesidad de terapia sustitutiva renal y la mortalidad22.
En un estudio en enfermos críticos, la concentración urinaria de cistatina C se asoció con el diagnóstico de sepsis o DRA, así como con la mortalidad23. En un metaanálisis de 19 estudios en poblaciones heterogéneas de pacientes (cirugía cardíaca, pediatría, UCI) la concentración sérica de cistatina C predijo el desarrollo de DRA (odds ratio [OR] 23,5, intervalo de confianza del 95% 14,2-38,9), siendo de menor utilidad la concentración urinaria24.
Interleucina 18La IL-18 es una citocina proinflamatoria de la familia de la IL-1, producida en monocitos, macrófagos y células tubulares proximales. Su concentración urinaria en pacientes con daño pulmonar agudo predice el desarrollo de DRA en 24h y en un análisis multivariante se asoció con la mortalidad25.
En un reciente estudio en 101 pacientes con DRA y necesidad de terapia sustitutiva renal, la concentración sérica de IL-18 se asoció con la mortalidad tras ajustar para el APACHE III26. En otro estudio en 137 pacientes pediátricos críticos, la concentración urinaria de IL-18 presentó una correlación significativa con el grado de gravedad del DRA27. En pacientes no sépticos, la concentración urinaria de IL-18 aumentó 2 días antes de que se apreciase un incremento de la concentración sérica de creatinina, era capaz de predecir el desarrollo y la duración del DRA en el primer día de UCI, y se asoció con la mortalidad de forma independiente al score RIFLE pediátrico27.
En un reciente metaanálsis que incluyó 18 estudios sobre el valor de la concentración urinaria de IL-18 para el diagnóstico de DRA de diferentes causas (cirgugía cardíaca, contraste intravenoso, en urgencias, o en la UCI)28 se encontró que la OR diagnóstica para DRA era de 4,22 (intervalo de confianza del 95% 2,90-6,14; con una sensibilidad y una especificidad de 0,58 y 0,75 respectivamente). El valor diagnóstico de la IL-18 urinaria era mayor en niños que en adultos28.
La concentración urinaria de IL-18 presenta un curso temporal (fig. 1), teniendo un incremento inicial a las 4-6h y una concentración máxima a las 12h, permaneciendo elevada 48h aproximadamente26–29.
Kidney injury molecule-1KIM-1, también denominada receptor celular del virus de la hepatitis A, o T cell immunoglobin and mucin-containing molecule (TIM-1), es una glucoproteína transmembrana, cuya expresión es mínima en condiciones normales y muy elevada tras la isquemia renal en la rata30. KIM-1 participa en el proceso de regeneración tras el daño epitelial, y en la eliminación de células muertas en la luz tubular31. La pérdida del ribete en cepillo de las células tubulares en el daño renal incluye al dominio extracelular de KIM-1, con el consiguiente incremento de su concentración en la orina. La concentración urinaria de KIM-1 se ha propuesto como un biomarcador de daño tubular proximal32.
Los niveles urinarios de KIM-1 se encuentran más elevados en los casos de DRA debidos a isquemia que en los casos debidos a otras causas32. KIM-1 se relaciona en enfermos críticos con la gravedad de la enfermedad, la necesidad de terapia sustitutiva renal y la mortalidad33. Varios estudios han demostrado la utilidad de la concentración urinaria de KIM-1 para predecir el desarrollo de DRA en pacientes sometidos a cirugía cardíaca34.
En una reciente revisión sistemática35, se analizaron 8 artículos en los que se compararon enfermos con DRA con enfermos sin DRA. La concentración de KIM-1 aumentó significativamente 2h tras la cirugía cardíaca. También aumentó en pacientes con DRA establecido, particularmente si presentaban necrosis tubular aguda. Sin embargo, la asociación con la necesidad de terapia sustitutiva renal o con la mortalidad fue débil.
Neutrophil gelatinase-associated lipocalinNGAL es una pequeña proteína de 178 aminoácidos que pertenece a la superfamilia de las lipocalinas, que consta de 20 proteínas. Estas proteínas comparten una estructura en barril beta que forma un cáliz que se une y transporta una serie de proteínas de bajo peso molecular que definen la actividad biológica de cada lipocalina. Ejemplos son la proteína ligadora del retinol, que transporta vitamina A, o la lipocalina α 1-microglobulina, que metaboliza el grupo heme. NGAL se descubrió inicialmente como una proteína unida a la gelatinasa de los neutrófilos, donde representa una de las proteínas de los gránulos secundarios (ver referencia de Haase et al.36).
Las bacterias producen sideróforos que se unen al hierro extracelular. La NGAL es afín por los sideróforos, y el complejo NGAL-sideróforo interacciona con receptores específicos de membrana y es internalizado en la célula, aumentando así la concentración intracelular de hierro. La NGAL previene el crecimiento de bacterias que dependen de los sideróforos para mantener su aporte de hierro. Por tanto, la NGAL es un componente crítico de la inmunidad innata.
NGAL se expresa en niveles muy bajos en diferentes tejidos, como el riñón, la tráquea, los pulmones, el estómago, o el colon, y su expresión aumenta marcadamente en la inflamación. Por tanto, constituye un biomarcador de activación leucocitaria sistémica, siendo considerado un reactante de fase aguda. Su función específica no está del todo aclarada, habiéndose descrito un papel protector renal, demostrado en estudios animales de DRA por isquemia-reperfusión, así como una función bacteriostática37,38. Existen diversas formas moleculares de NGAL, siendo la forma monomérica la sintetizada principalmente por las células tubulares y la dimérica la liberada por los neutrófilos. Los distintos ensayos existentes se dirigen a diferentes formas moleculares, lo cual podría explicar, al menos en parte, la diversidad de hallazgos en los trabajos publicados en la literatura39.
NGAL se filtra libremente y se reabsorbe a nivel tubular proximal por endocitosis. La lesión del epitelio tubular proximal altera su reabsorción. Por otra parte, en condiciones de daño renal, la expresión de NGAL en el epitelio tubular distal aumenta, particularmente en la rama ascendente del asa de Henle y en el túbulo colector. La concentración urinaria de NGAL aumenta en condiciones de daño tubular, tanto por una menor reabsorción como por una mayor liberación a la luz tubular, indicando daño tubular tanto proximal como distal.
NGAL constituye un marcador precoz de daño renal, ya que su concentración sérica se eleva a las 2h del daño y precede 24h al incremento de la concentración sérica de creatinina. Su concentración urinaria y sérica también se encuentran elevadas en otras condiciones, como la infección del tracto urinario y la enfermedad renal crónica40.
NGAL es uno de los biomarcadores de DRA más intensamente estudiados, sumando varios miles los pacientes estudiados en diferentes estudios36, los más representativos de los cuales son revisados aquí.
Cirugía cardíacaLa concentración urinaria y plasmática de NGAL se relaciona íntimamente con el desarrollo de DRA en pacientes sometidos a cirugía cardíaca. En 16 de 81 pacientes adultos sometidos a cirugía cardíaca que desarrollaron DRA, la concentración de NGAL urinario tras la intervención quirúrgica predijo el desarrollo de DRA con una sensibilidad del 81%, una especificidad del 48% y una exactitud del 58%41. En un estudio en 196 niños sometidos a cirugía cardíaca, 99 de los cuales desarrollaron IRA (definida como un aumento ≥50% del valor basal de la concentración basal de creatinina), los niveles de NGAL urinario aumentaron 15 veces 2h tras la intervención (área bajo la curva ROC 0,95, sensibilidad del 82% y especificidad del 90%), mientras que el diagnóstico de acuerdo con el criterio de la concentración de creatinina se demoró 2-3días42.
En otro estudio en 879 pacientes adultos, 75 de los cuales presentaron DRA (definido como un aumento ≥50% de la concentración basal de creatinina), el NGAL plasmático medido tras la intervención presentaba una sensibilidad del 39% y una especificidad del 81% para el diagnóstico de DRA43. Finalmente, en 1.219 adultos la concentración plasmática de NGAL mejoró la capacidad predictiva del modelo clínico (área bajo la curva ROC de 0,69 a 0,75)44. La sensibilidad, pues, de la concentración plasmática de NGAL para el diagnóstico de DRA fue más limitada en estos estudios44,45.
Pacientes críticosEn general, debido a que NGAL se libera en condiciones de inflamación sistémica, las propiedades de NGAL para predecir el desarrollo de DRA son peores en el grupo de enfermos críticos en general, especialmente si presentan sepsis, con mejores propiedades asociadas a la medición urinaria que plasmática.
En pacientes pediátricos en general, Zapitelli et al.45 demostraron en un grupo de 140 niños críticos que la concentración urinaria de NGAL precedió al aumento de la concentración sérica de creatinina en 2días en los enfermos que desarrollaron DRA (área bajo la curva ROC 0,79), pero no se demostró una asociación con la gravedad del daño renal. La concentración sérica de NGAL en las primeras 24h de ingreso en la UCI discriminó a niños sanos, con síndrome de respuesta inflamatoria sistémica, con sepsis y con shock séptico, y la concentración era mayor en los casos con DRA que sin DRA46.
En enfermos adultos, se ha demostrado en un grupo heterogéneo de 451 pacientes críticos que la concentración urinaria de NGAL a las 24 y a las 48h se relacionaba de forma moderada con el diagnóstico de DRA: la mediana de la concentración urinaria de NGAL era mayor en los no supervivientes, y era también mayor en pacientes que necesitaron tratamiento renal sustitutivo47. En 307 pacientes adultos ingresados en una UCI quirúrgica la concentración plasmática de NGAL en el momento del ingreso en dicha unidad era un buen marcador de desarrollo de DRA en las siguientes 48h (área bajo la curva ROC 0,78) y de la necesidad de tratamiento renal sustitutivo (área bajo la curva ROC 0,82)48. En otro estudio en enfermos críticos, no se demostró que la concentración urinaria o plasmática de NGAL en el momento del ingreso en la UCI fuera superior al cálculo del filtrado glomerular basado en la concentración sérica de creatinina para predecir el desarrollo de DRA. Sin embargo, la NGAL mejoró las propiedades del modelo predictivo que incluía variables clínicas y el filtrado glomerular49.
La relación de la NGAL con la respuesta inflamatoria y la sepsis puede empeorar sus características como biomarcador de DRA, cuyo principal factor de riesgo es la sepsis. Bagshaw et al.50 encontraron que la concentración urinaria y plasmática de NGAL era mayor en casos de DRA de origen séptico que en casos de DRA de origen no séptico. Sin embargo, en otro estudio se demostró que la concentración plasmática de NGAL no discriminó los casos de DRA de los casos de shock séptico, mientras que la concentración urinaria precedía el desarrollo de DRA en las siguientes 12h en los casos de shock séptico51. Kümpers et al.52 encontraron en pacientes críticos que la concentración sérica de NGAL era diferente en sujetos sanos, con SRIS, y con sepsis, y que existía una relación con la mortalidad y con la gravedad del DRA.
En un metaanálisis de 24 estudios y 2.538 pacientes, Haase et al.53 analizaron las propiedades de la concentración urinaria, sérica o plasmática de NGAL, bien dentro de las primeras 6h tras el daño, bien en las 24-48h que preceden al diagnóstico convencional de DRA. La OR de NGAL para predecir el diagnóstico de DRA fue de 18,6 (área bajo la curva ROC 0,81, una sensibilidad del 76% y una especificidad del 85%). Los resultados eran ligeramente mejores para niños que para adultos. Las características de NGAL en casos de cirugía cardíaca era OR 13,1; área bajo la curva ROC 0,77; sensibilidad y especificidad del 75 y 75%, respectivamente. La concentración urinaria presentaba un valor predictivo ligeramente superior a la concentración plasmática (área bajo la curva ROC 0,84 versus 0,77, respectivamente). NGAL se correlacionó con la necesidad de tratamiento renal sustitutivo (área bajo la curva ROC 0,78), pero no con la mortalidad hospitalaria53.
Otras situacionesLa capacidad de la NGAL para predecir el desarrollo de DRA se ha estudiado también en pacientes en el departamento de urgencias. Nickolas et al.54 midieron la concentración urinaria de NGAL en 635 enfermos consecutivos, encontrando una sensibilidad del 90% y una especificidad del 99% para predecir el desarrollo de DRA (para un punto de corte de concentración sérica de creatinina de 1,3mg/dl). La concentración urinaria de NGAL discriminó también entre DRA y otras causas de elevación de la concentración sérica de creatinina, como la insuficiencia renal crónica y la insuficiencia renal prerrenal54.
Trabajos recientes proponen a la NGAL como predictor de la nefropatía inducida por contraste55,56. El incremento de la concentración sérica de NGAL a las 24h del estudio angiográfico es superior a los cambios en la concentración sérica de creatinina para predecir el desarrollo de la forma temprana de IRA inducida por contraste57. Asimismo, se ha demostrado una relación entre la concentración urinaria de NGAL medida en el día del trasplante renal y el desarrollo de disfunción tardía del injerto58.
Debido a que la NGAL no es filtrada por la hemofiltración veno-venosa continua, se ha propuesto que puede ser un marcador de recuperación de la función renal en pacientes sometidos a tratamiento renal sustitutivo59.
Forma hepática de la proteína ligadora de ácidos grasosLas proteínas ligadoras de ácidos grasos (fatty-acid binding proteins, FABP) son una familia de 9 proteínas intracelulares transportadoras de ácidos grasos de cadena larga, denominadas de acuerdo con el tejido donde fueron inicialmente descritas. Limitan el efecto oxidante sobre las membranas celulares de productos intermediarios tóxicos60. La forma hepática (L-FABP) se expresa en el hígado y, en menor medida, en el riñón y en el intestino delgado. En el riñón, la L-FABP se expresa en células del túbulo proximal. Los niveles urinarios son indetectables en condiciones normales, y se libera a la orina en condiciones de hipoxia por disminución del flujo sanguíneo peritubular61.
La relación entre la concentración urinaria de L-FABP y el desarrollo de DRA se ha demostrado en pacientes sometidos a cirugía cardíaca62, pacientes con DRA inducido por contraste63 y pacientes sometidos a trasplante hepático64.
En enfermos sometidos a cirugía cardíaca, la concentración urinaria de L-FABP y de NGAL era mayor en los 28 de los 77 pacientes que desarrollaron DRA, pero la capacidad discriminativa era modesta (área bajo la curva 0,72 y 0,75, para L-FABP y NGAL, respectivamente, medidos a las 4h, y 0,81 para la combinación de ambas determinaciones)62. La medición urinaria de L-FABP mostró una gran sensibilidad mientras que la medición de NGAL se caracterizó por una gran especificidad, proponiéndose que un panel compuesto de ambos parámetros podría ser apropiado para el diagnóstico de DRA62. De hecho, el uso de ambos biomarcadores mejoró la capacidad diagnóstica de cada uno de forma individual y mejoró la predicción del riesgo de DRA en comparación con un modelo basado solo en variables clínicas.
En un grupo de 25 pacientes sometidos a trasplante hepático la concentración de L-FABP urinario era mayor en los enfermos que desarrollaron DRA, pero la capacidad discriminativa del NGAL urinario era mejor64. Por otro lado, la concentración urinaria de NGAL se eleva de forma más temprana que la de L-FABP, como ha indicado un estudio en 220 pacientes pediátricos sometidos a cirugía cardíaca65. Sin embargo, en otro estudio en 85 pacientes sometidos a cirugía cardíaca66, el biomarcador que mostró una mayor área bajo la curva para el diagnóstico de DRA fue la L-FABP urinaria. La concentración urinaria de este biomarcador antes y en las primeras 6h tras la intervención quirúrgica se asoció de forma independiente con el desarrollo de DRA66. Finalmente, en un grupo de 145 enfermos críticos con shock séptico complicado con DRA se ha demostrado que la concentración urinaria de L-FABP es mayor en no supervivientes en comparación con supervivientes (área bajo la curva ROC 0,99)67.
Descubrimiento de nuevos biomarcadores proteicos en grandes cohortes de pacientes: tissue inhibitor of metalloproteinase-2 e insulin-like growth factor-binding proteinUtilizando una metodología rigurosa, basada en la búsqueda de biomarcadores en una población extensa de enfermos críticos y en la posterior validación en una cohorte diferente de pacientes, se ha sugerido la utilidad de la medición de ciertas moléculas con un objetivo no diagnóstico sino de predicción del riesgo61. Kashani et al.68 determinaron 340 proteínas en 522 pacientes adultos procedentes de 3 cohortes diferentes de enfermos quirúrgicos, con sepsis, y trauma, encontrando que tissue inhibitor of metalloproteinase (TIMP)-2 e insulin-like growth factor-binding protein (IGFBP)-7 presentaban las mejores propiedades como predictores de DRA moderado o grave (estadios KDIGO 2 o 3), medida por el área bajo la curva ROC, en comparación con otros biomarcadores como NGAL, KIM-1, IL-18, π-GST y L-FABP urinarios, y cistatina C y NGAL plasmáticos.
En un posterior estudio de validación en 744 pacientes críticos sin DRA en el momento de la inclusión (Sapphire)68 se encontró que la combinación de ambas determinaciones (TIMP-2 e IGFBP-7) en muestras obtenidas dentro de las primeras 24h tras el ingreso en la UCI predecía el desarrollo de DRA en las 12h tras la obtención de la muestra, con un área bajo la curva ROC de 0,80.
TIMP-2 e IGFBP-7 son marcadores de progresión del ciclo celular en G1, y se encuentran implicados en la respuesta a diferentes estímulos, como inflamación, radiación UV, fármacos, toxinas y daño celulare69,70. Se desconoce si estos biomarcadores son también útiles para predecir la progresión y la recuperación del daño renal.
Uso combinado de biomarcadores: beneficio adicionalEn múltiples trabajos se plantea el beneficio adicional del uso combinado de más de un biomarcador. Como ya se mencionó, la determinación combinada de TIMP-2 e IGFBP-7 predice el desarrollo de DRA en las 12h siguientes68. De igual manera, se plantea que la combinación de NGAL, KIM-1 e IL-18 podría ser útil para detectar el daño en diferentes momentos dado sus distintos perfiles temporales71.
MetabolómicaLa metabolómica consiste en la evaluación de todos los metabolitos producidos por el organismo en una muestra de tejido o en un fluido orgánico. La metabolómica proporciona información completa sobre los procesos metabólicos de la célula, a diferencia de la genómica, la transcriptómica o la proteómica, que no informan sobre los productos de las reacciones metabólicas. Los metabolitos identificados incluyen productos del metabolismo intermediario, hormonas y otras moléculas de señalización. Este perfil metabólico puede estudiarse mediante espectroscopia de resonancia magnética o mediante espectrometría de masas. El espectro de todos los metabolitos obtenidos permite a través de un análisis multivariado crear un modelo matemático de predicción de un diagnóstico o de un desenlace, permitiendo el descubrimiento de biomarcadores diagnósticos o pronósticos72.
Esta nueva herramienta se encuentra en desarrollo para establecer el diagnóstico y el pronóstico de condiciones como la sepsis y el daño pulmonar agudo73,74. El papel de la espectroscopia de resonancia magnética y de la espectrometría de masas para el diagnóstico de DRA está siendo estudiado por diversos grupos75.
Perspectivas futurasA pesar de los avances en la comprensión de la fisiopatología del DRA, la morbimortalidad de esta condición continúa siendo elevada. El uso de la concentración sérica de creatinina y de la diuresis como biomarcadores del DRA está sometido a numerosas limitaciones relacionadas con la falta de precocidad, especificidad y sensibilidad de estas variables para el diagnóstico de DRA. Se han propuesto nuevos biomarcadores, cuya concentración se eleva de forma más precoz en condiciones en las que disminuye el filtrado glomerular. Sin embargo, en general carecen de especificidad. Es necesaria la búsqueda de biomarcadores que, a semejanza de los biomarcadores de lesión miocárdica, presenten un satisfactorio perfil de precocidad y especificidad. El papel de otros abordajes como la metabolómica para establecer el diagnóstico y el pronóstico del DRA es prometedor pero se encuentra aún por definir.
La recomendación sobre la utilización en la práctica clínica diaria, fuera de un entorno de investigación, de alguno de los biomarcadores revisados debería estar precedida por la demostración de que el uso de una determinación específica mejora algún desenlace de interés. No es suficiente que cierto marcador se encuentre elevado en el DRA. El uso (y el coste asociado) se justificaría si se lograra demostrar que esa determinación mejora el tratamiento de los pacientes o modifica algún desenlace de interés (p. ej., tratamiento más precoz, menor duración del DRA o mejor supervivencia).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.