Desde hace décadas España se mantiene líder en donantes de órganos con cifras alrededor de los 35 donantes pmp, la gran mayoría fallecidos con criterios de muerte encefálica (ME). Al mismo tiempo, la edad de los donantes debido al descenso de los TCE por accidentes (tráfico y laborales) se está incrementando y como consecuencia desciende el numero de órganos válidos por cada donante. En este contexto, surge la necesidad de ampliar la donación a los fallecidos con criterios cardiocirculatorios (asistolia) o Donors after Circulatory Death (DCD) por sus siglas en inglés, que tanto en los tipos no controlados (Maastricht 2) como en los controlados (Maastricht 3) están contribuyendo a incrementar el número de trasplantes de riñón y más recientemente, de trasplantes hepáticos1.
La donación en parada cardiocirculatoria controlada (DPCC) representa una estrategia en creciente expansión en los países de nuestro entorno y también en España2. Esta donación está muy desarrollada en países anglosajones, presentando España un gran incremento en los últimos años haciendo posible un número importante de trasplantes renales y hepáticos3,4, con una clara polarización en cuanto al tipo de DCD en función del país. Así, Australia, Bélgica, Canadá, EE.UU., Holanda y Reino Unido han potenciado la DPCC a partir de fallecidos en unidades de críticos tras la limitación del tratamiento de soporte vital (LTSV)5 mientras que el tipo predominante en España hasta la actualidad, es la donación en parada cardiocirculatoria no controlada (DPCNC) de personas fallecidas en parada cardiorrespiratoria (mayoritariamente fuera del hospital) no recuperada tras la realización de maniobras de resucitación cardiopulmonar. Ambos modelos están ética y legalmente soportados por la legislación y protocolos consensuados y publicados por la Organización Nacional de Trasplantes (ONT) y adaptados a los diferentes hospitales6.
Hasta hace unos años la mayoría de los órganos trasplantados de donantes fallecidos con criterios cardiocirculatorios han sido riñones, logrando demostrar una gran calidad de estos órganos equiparable a la de riñones de donantes estándar y mejor que los riñones de donantes expandidos4.
Recientemente se han comenzado a trasplantar hígados de DPCNC preservados con perfusión hepática en normotermia mediante oxigenadores de membrana que permitían recuperar y limitar la lesión isquémica aguda con buenos resultados funcionales3. Lamentablemente la inexactitud respecto a los tiempos de parada cardiaca no presenciada y a la efectividad del masaje cardiaco, conlleva incertidumbre en el momento de aceptar o rechazar el órgano, el cual soporta mucho peor que el riñón los periodos de isquemia caliente. Tras una experiencia de 18 casos de DPCC en los últimos 3 años con 30 riñones trasplantados7, presentamos resultados de los primeros 3 trasplantes de hígado procedentes de DPCC (Maastricht 3) en el Hospital Regional Universitario y Hospital Virgen de la Victoria de Málaga.
A diferencia de los donantes DPCC solo renales que fueron preservados con técnicas de perfusión-enfriamiento abdominal con catéter de doble balón y LTSV en la unidad de cuidados intensivos (UCI), en los donantes en los que además de riñones se valoró hígado, la LTSV se realizó siempre en quirófano para disminuir los tiempos de isquemia. La extracción de órganos iniciada por cirujanos expertos del programa de trasplante hepático, consistió en una adaptación de la técnica descrita como «extracción super-rápida»8. Este abordaje se inicia con la apertura de la piel inmediatamente después de declarado el fallecimiento (5min después de haberse producido la parada cardiocirculatoria), y canulación de la arteria aorta infrarrenal para la introducción directa de la solución fría de preservación (Custodiol® GmbH, Alemania). A continuación cierre aórtico supracelíaco (a nivel intratorácico o abdominal) con el fin de limitar el territorio de perfusión y drenaje de sangre y líquido de perfusión de la vena cava inferior y venas suprahepáticas. Finalmente, se procede al enfriamiento externo de los órganos abdominales con solución salina al 0,9% helada triturada y perfusión por vía portal, con la misma solución de preservación.
Los 3 pacientes presentados fueron candidatos a la LTSV por lesiones neurológicas severas y devastadoras, pero que no evolucionaron a ME. Una vez que el equipo médico de la UCI tomaba la decisión de LTSV, lo comunicaba a la familia y en caso de acuerdo, el equipo de Coordinación de Trasplantes, les ofrecía con posterioridad la opción de donar órganos tras el fallecimiento.
La principal preocupación a la hora de utilizar hígados procedentes de DPC es el estrés isquémico al que se exponen todos los órganos del donante y su trascendencia en cuanto al desarrollo de complicaciones en los receptores de trasplante hepático. Este daño isquémico se manifestará sobre hepatocitos y vía biliar de diferente modo (fallo hepático masivo con fracaso primario del injerto, disfunción más o menos grave del injerto y enfermedad inflamatoria estenosante de la vía biliar) y probablemente añade mayor riesgo para presentar rechazo del órgano por mayor expresión antigénica9.
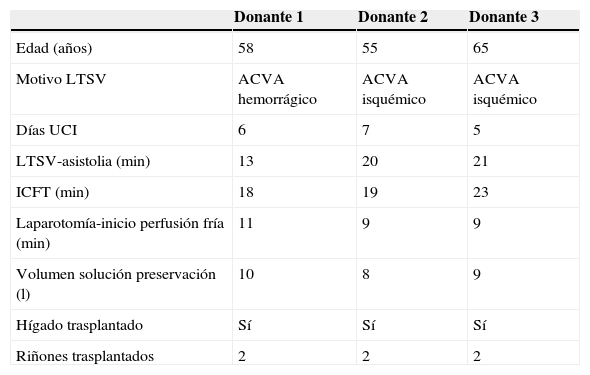
Para las determinaciones de los tiempos críticos de isquemia se han seguido las definiciones de los protocolos de la ONT y de Sociedades Científicas6,10 diferenciando el que media entre el inicio de la LTSV a la parada y constatación de la muerte (5min adicionales) del que es el tiempo de isquemia caliente funcional total (ICFT) medido entre el primer bache de hipotensión <60mmHg hasta el inicio de la perfusión fría. (tabla 1).
Características de los 3 donantes hepáticos y renales
| Donante 1 | Donante 2 | Donante 3 | |
|---|---|---|---|
| Edad (años) | 58 | 55 | 65 |
| Motivo LTSV | ACVA hemorrágico | ACVA isquémico | ACVA isquémico |
| Días UCI | 6 | 7 | 5 |
| LTSV-asistolia (min) | 13 | 20 | 21 |
| ICFT (min) | 18 | 19 | 23 |
| Laparotomía-inicio perfusión fría (min) | 11 | 9 | 9 |
| Volumen solución preservación (l) | 10 | 8 | 9 |
| Hígado trasplantado | Sí | Sí | Sí |
| Riñones trasplantados | 2 | 2 | 2 |
ACVA: accidente cerebrovascular agudo; ICFT: isquemia caliente funcional total; LTSV: limitación tratamiento soporte vital.
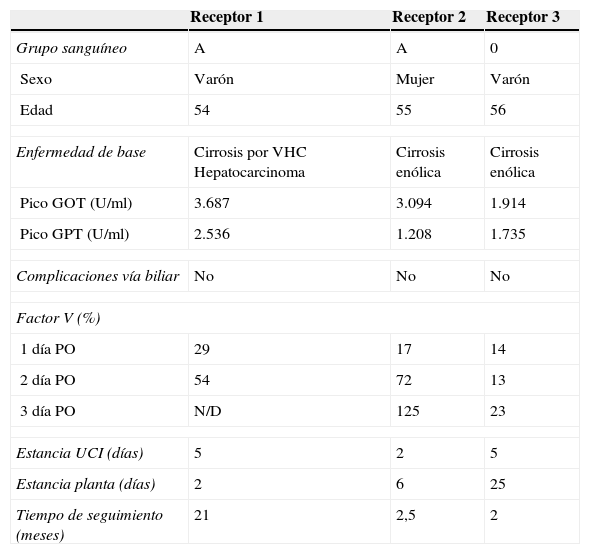
Todos los receptores de estos injertos procedentes de la DPCC están vivos y de alta hospitalaria. Los 2 primeros con una recuperación funcional hepática rápida como se puso de manifiesto por la recuperación del factor V que se normalizó al 2.° día de postoperatorio. Sin embargo, en el tercer trasplantado este parámetro no se normalizó hasta el 4.° día. Este paciente durante el ingreso en planta presentó disfunción hepática y en la biopsia realizada al 29.° día mostró signos de rechazo agudo que se trató con intensificación de la inmunosupresión (tabla 2).
Características de los receptores de trasplante de hígado
| Receptor 1 | Receptor 2 | Receptor 3 | |
|---|---|---|---|
| Grupo sanguíneo | A | A | 0 |
| Sexo | Varón | Mujer | Varón |
| Edad | 54 | 55 | 56 |
| Enfermedad de base | Cirrosis por VHC Hepatocarcinoma | Cirrosis enólica | Cirrosis enólica |
| Pico GOT (U/ml) | 3.687 | 3.094 | 1.914 |
| Pico GPT (U/ml) | 2.536 | 1.208 | 1.735 |
| Complicaciones vía biliar | No | No | No |
| Factor V (%) | |||
| 1 día PO | 29 | 17 | 14 |
| 2 día PO | 54 | 72 | 13 |
| 3 día PO | N/D | 125 | 23 |
| Estancia UCI (días) | 5 | 2 | 5 |
| Estancia planta (días) | 2 | 6 | 25 |
| Tiempo de seguimiento (meses) | 21 | 2,5 | 2 |
N/D: no disponible; PO: postoperatorio; U/ml: unidades/mililitro; VHC: virus hepatitis C.
La utilización de injertos hepáticos procedentes de la DPCC ofrece resultados prometedores, si somos capaces de minimizar la lesión isquémica, bien disminuyendo los tiempos de ICFT o mediante la utilización de técnicas de perfusión-oxigenación extracorpórea que recuperen al hígado de la isquemia causada en la fase anóxica pre y posparada cardiaca. Por ello, consideramos que el trasplante con hígados obtenidos de donantes fallecidos por criterios cardiocirculatorios tras LTSV son una magnifica oportunidad para ofrecer la opción al trasplante a una serie de pacientes sin otra alternativa terapéutica, y que si se planifica y ejecuta bien irán en aumento en los próximos años, sin resultar en competencia con la donación en ME y con resultados progresivamente mejores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.