Evaluar la efectividad e identificar predictores de fracaso de la ventilación mecánica no invasiva en la insuficiencia respiratoria aguda.
DiseñoEstudio retrospectivo, longitudinal y descriptivo.
ÁmbitoPacientes adultos con insuficiencia respiratoria aguda.
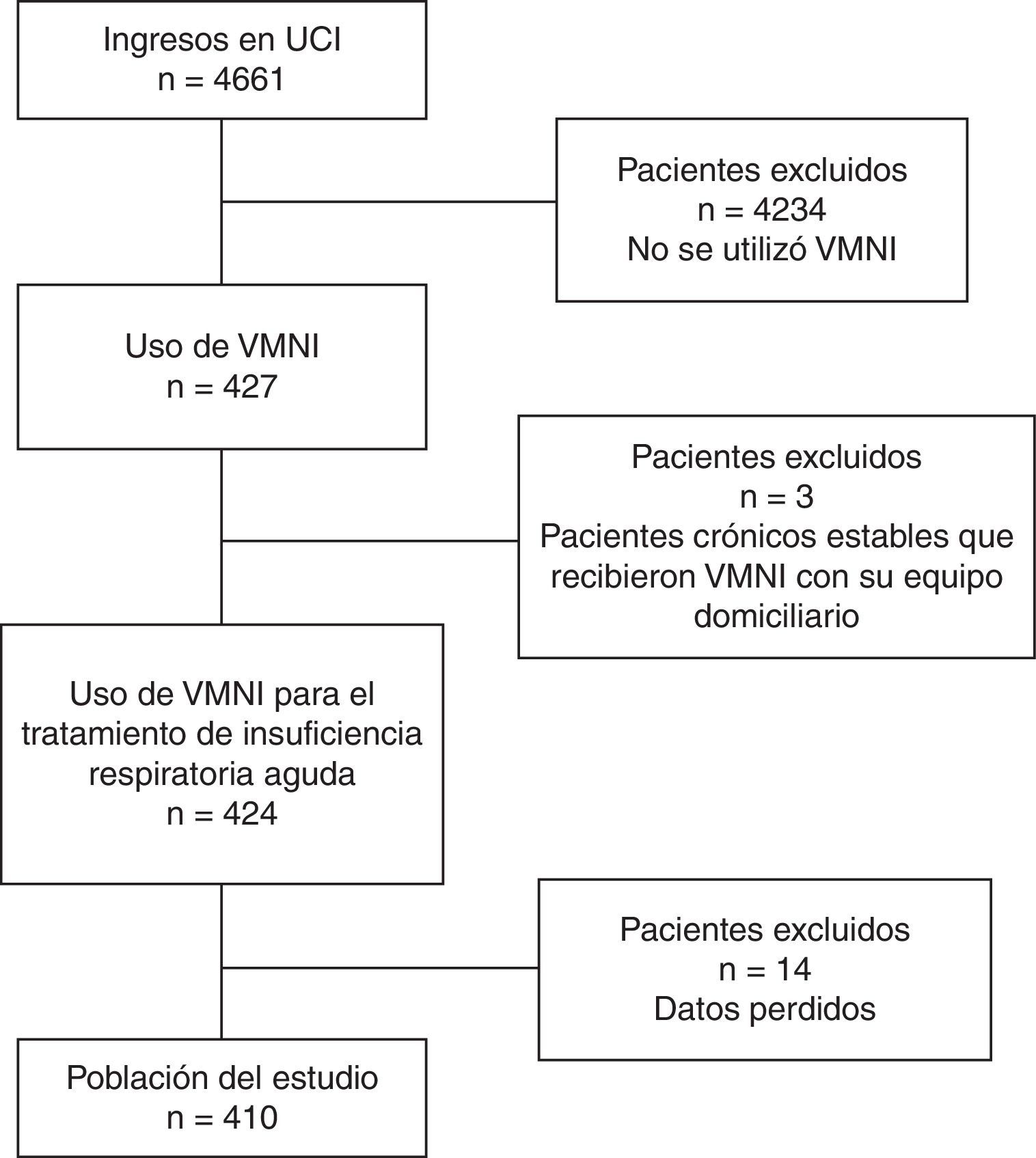
PacientesUn total de 410 pacientes (muestra consecutiva) tratados mediante ventilación mecánica no invasiva en una unidad de cuidados intensivos de un hospital universitario terciario entre 2006 y 2011.
IntervencionesVentilación mecánica no invasiva.
Variables principales de interésVariables demográficas, clínicas y analíticas desde el inicio de la ventilación mecánica no invasiva y 2h después. Variables evolutivas durante el ingreso en la unidad y hasta el alta hospitalaria.
ResultadosEl fracaso fue del 50%, y la mortalidad global del 33%. Un total de 156 pacientes presentaban insuficiencia respiratoria aguda hipoxémica, 87 insuficiencia respiratoria postextubación, 78 reagudización de enfermedad pulmonar obstructiva crónica, 61 insuficiencia respiratoria hipercápnica sin enfermedad pulmonar obstructiva crónica y 28 edema pulmonar agudo cardiogénico. El fracaso fue del 74, del 54, del 27, del 31 y del 21%, respectivamente. El tipo de insuficiencia respiratoria, la bilirrubina sérica al inicio, APACHEII, la existencia de hallazgos radiológicos, la necesidad de sedación para tolerarla y los cambios en el nivel de consciencia, ratio PaO2/FiO2, frecuencia respiratoria y frecuencia cardiaca entre el inicio y 2h después se asociaron con el fracaso.
ConclusionesLa efectividad de la técnica varió dependiendo del tipo de insuficiencia respiratoria. Su uso en la insuficiencia respiratoria aguda hipoxémica y la insuficiencia respiratoria postextubación debería valorarse individualmente. Los predictores de fracaso podrían ser útiles para prevenir el retraso en la intubación orotraqueal.
To assess the effectiveness and identify predictors of failure of noninvasive ventilation.
DesignA retrospective, longitudinal descriptive study was made.
SettingAdult patients with acute respiratory failure.
PatientsA total of 410 consecutive patients with noninvasive ventilation treated in an Intensive Care Unit of a tertiary university hospital from 2006 to 2011.
ProceduresNoninvasive ventilation.
Main variables of interestDemographic variables and clinical and laboratory test parameters at the start and two hours after the start of noninvasive ventilation. Evolution during admission to the Unit and until hospital discharge.
ResultsThe failure rate was 50%, with an overall mortality rate of 33%. A total of 156 patients had hypoxemic respiratory failure, 87 postextubation respiratory failure, 78 exacerbation of chronic obstructive pulmonary disease, 61 hypercapnic respiratory failure without chronic obstructive pulmonary disease, and 28 had acute pulmonary edema. The failure rates were 74%, 54%, 27%, 31% and 21%, respectively. The etiology of respiratory failure, serum bilirubin at the start, APACHEII score, radiological findings, the need for sedation to tolerate noninvasive ventilation, changes in level of consciousness, PaO2/FIO2 ratio, respiratory rate and heart rate from the start and two hours after the start of noninvasive ventilation were independently associated to failure.
ConclusionsThe effectiveness of noninvasive ventilation varies according to the etiology of respiratory failure. Its use in hypoxemic respiratory failure and postextubation respiratory failure should be assessed individually. Predictors of failure could be useful to prevent delayed intubation.
La ventilación mecánica no invasiva (VMNI) se ha convertido durante los últimos años en una alternativa a la intubación orotraqueal y conexión a ventilación mecánica invasiva para el tratamiento de la insuficiencia respiratoria (IR), ya que puede disminuir las complicaciones y las estancias en la unidad de cuidados intensivos (UCI). Las primeras patologías agudas tratadas con VMNI fueron las reagudizaciones de enfermedad pulmonar obstructiva crónica (EPOC)1 o el edema agudo de pulmón (EAP)2,3. Desde estos primeros estudios, la evidencia disponible es muy consistente en este tipo de pacientes4, y durante los últimos 20años su uso se ha extendido a pacientes con otro tipo de patologías5, como la IR hipoxémica o la IR postextubación. Sin embargo, su utilidad en este tipo de pacientes es mucho menos clara. Las últimas guías clínicas6 sugieren que la VMNI debería ser la primera opción de tratamiento en pacientes con reagudización de EPOC o con EAP; podría considerarse un intento de VMNI en los pacientes con IR posquirúrgica o en pacientes inmunodeprimidos; el uso de la VMNI también debería considerarse para permitir la extubación precoz de pacientes con EPOC7. Estas guías no hacen ninguna recomendación acerca del uso de la VMNI en pacientes con exacerbaciones de asma, lesión pulmonar aguda, neumonía aguda de la comunidad grave o traumatismo torácico. Sin embargo, la VMNI es frecuentemente utilizada en este tipo de pacientes.
Por todo esto es importante conocer el uso de la VMNI fuera de estudios protocolizados, en pacientes con diferentes tipos de IR.
Este trabajo se plantea 2 objetivos principales:
- -
Conocer cómo se está utilizando la VMNI en la práctica clínica y su grado de efectividad.
- -
Identificar marcadores predictores precoces de fracaso de la VMNI que puedan ser utilizados para una mejor selección de la técnica en futuros pacientes.
Se realizó un estudio retrospectivo y observacional de todos los pacientes que recibieron tratamiento con VMNI en la UCI de un hospital universitario terciario entre los años 2006 y 2011.
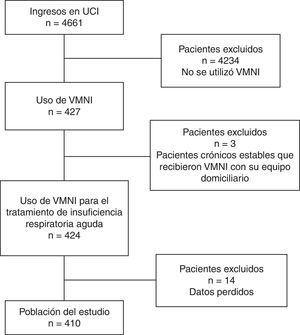
Los criterios de inclusión fueron pacientes con el diagnóstico de IR aguda (IRA), de cualquier etiología, que fueran tratados mediante VMNI entre los años 2006 y 2011. Fueron excluidos los pacientes si eran pacientes crónicos estables que recibieron VMNI como continuación de su tratamiento domiciliario (fig. 1).
El Comité de Ética del hospital aprobó la publicación de los resultados del estudio.
Procedimiento de VMNI y definición de fracasoLa VMNI fue aplicada a través de mascarillas faciales mediante 2 tipos de respiradores: BiPAP Vision (Respironics, Murrysville, Pa., EE.UU.) y Carina (Dräger Medical, Lübeck, Alemania).
Se consideró fracaso de la VMNI la necesidad de intubación y ventilación mecánica en las 72h siguientes a su retirada.
Entre las causas de fracaso de la VMNI, el trabajo respiratorio se definió como la persistencia de la taquipnea y uso de la musculatura accesoria.
Recogida de datosMediante la revisión de historias clínicas se recogieron variables demográficas, antecedentes personales, fechas de ingreso y alta (tanto hospitalarias como en UCI), mortalidad hospitalaria, tiempo de VMNI, parámetros de VMNI (presión positiva inspiratoria en vía aérea [IPAP], presión positiva espiratoria en vía aérea [EPAP] y fracción inspirada de oxígeno [FiO2]), aparición de complicaciones (neumonía asociada a VMNI, alteraciones hemodinámicas, neumotórax), hallazgos radiológicos, APACHEII, así como distintas variables fisiológicas (presión arterial sistólica, presión arterial diastólica, frecuencia respiratoria, frecuencia cardiaca, Glasgow Coma Scale (GCS) y temperatura), y analíticas (pH, PaCO2, PaO2, bicarbonato, lactato, hematócrito, leucocitos, urea, creatinina, albúmina, sodio, potasio y bilirrubina). Se recogieron las variables fisiológicas y gasométricas al inicio y a las 2h del inicio de la VMNI, mientras que de las bioquímicas y las hematológicas únicamente se recogieron los datos al inicio.
Se dividió el tipo de IR en 5 grupos8, usando la etiología de la IR (basada en los diagnósticos, los hallazgos radiológicos y de laboratorio, y la historia personal):
- -
Reagudización de EPOC.
- -
IR hipercápnica aguda o reagudización de IR crónica hipercápnica sin EPOC (PaCO2>50mmHg).
- -
IRA hipoxémica (ratio PaO2/FiO2<300 y PaCO2<50mmHg).
- -
EAP en paciente diagnosticado de insuficiencia cardiaca aguda o crónica.
- -
IR postextubación (definida como la que aparece en las 48h siguientes a la extubación).
Los pacientes con ratio PaO2/FiO2<300 y PaCO2>50mmHg (excepto los que fueron incluidos en el grupo de IR postextubación, según su definición) se clasificaron dentro del grupo de reagudización de EPOC o del de IR hipercápnica aguda o reagudización de IR crónica hipercápnica sin EPOC, dependiendo de la existencia o no de diagnóstico de EPOC.
Los hallazgos en la radiografía de tórax al inicio de la VMNI se clasificaron como:
- -
Parénquima limpio.
- -
Infiltrado/consolidación/derrame unilateral.
- -
Infiltrado/consolidación/derrame bilateral.
Para la descripción de las variables cuantitativas se utilizó la media y desviación típica. Para las cualitativas, los porcentajes.
Para la comparación de medias en 2 grupos se utilizó el test t para datos independientes y dependientes. En el caso de hetorocedasticidad se utilizó la aproximación de Welch. Para más de 2 grupos se aplicó el análisis de la varianza (ANOVA). Se aplicó la penalización de Bonferroni en los test tras el ANOVA. En los datos en los que no se verificó la hipótesis de normalidad se utilizaron las correspondientes versiones no paramétricas de los test mencionados: U de Mann-Whitney en datos independientes y test de Wilcoxon en resultados apareados. El análisis de variables cualitativas se llevó a cabo con el test de Chi-cuadrado para tablas de contingencia. La normalidad y la heterocedasticidad de las variables se contrastaron con el test de Kolmogorov-Smirnov y el de Levene, respectivamente.
Se ha realizado un modelo logístico para explorar los posibles factores pronósticos en la determinación de la presencia o no de un fracaso de la VMNI (variable respuesta). Se partió de las variables consideradas importantes como predictoras desde el punto de vista clínico. Los pacientes que presentaban la información completa para estas variables fueron 281. Este conjunto de pacientes se dividió aleatoriamente en 2 grupos: un grupo de 250 individuos, para la elaboración del modelo, y otro grupo de 31 pacientes, para la validación del mismo. De las variables de las que se disponía de datos al inicio y a las 2h, se decidió usar la diferencia entre ambas. Además, para facilitar el análisis los tipos de IR se recategorizaron en 2 grupos: por un lado, los pacientes con IR hipercápnica (reagudizaciones de EPOC e IR hipercápnica sin EPOC), que será la variable de referencia, y por otro los restantes 3 tipos (IRA hipoxémica, EAP e IR postextubación). La variable radiografía de tórax también se recodificó, agrupando los pacientes con condensación/infiltrado/derrame (unilateral o bilateral), por lo que se crearon 2 grupos: radiografía limpia (referencia) vs resto. Para la selección de las variables se utilizó el procedimiento descrito por Collett9 para la obtención del modelo que mejor explique y ajuste la variable respuesta del fracaso de la VMNI. El test utilizado para la comparación de modelos fue la razón de verosimilitud. La bondad de ajuste se valoró con el R2 de Nagelkerke y la tabla de bien clasificados. Se calculó la sensibilidad y especificidad del modelo, y a partir de la muestra de validación el valor predictivo positivo y negativo.
El nivel de significación utilizado es el 0,05. Los análisis se realizaron con el software IBM SPSS 21 (IBM Corp. Armonk, NY., EE.UU.).
ResultadosEn total se contabilizaron 410 casos de VMNI, con una edad media de 66,7±13,4años y un APACHEII medio de 20,8±7,4. El 60,2% eran hombres.
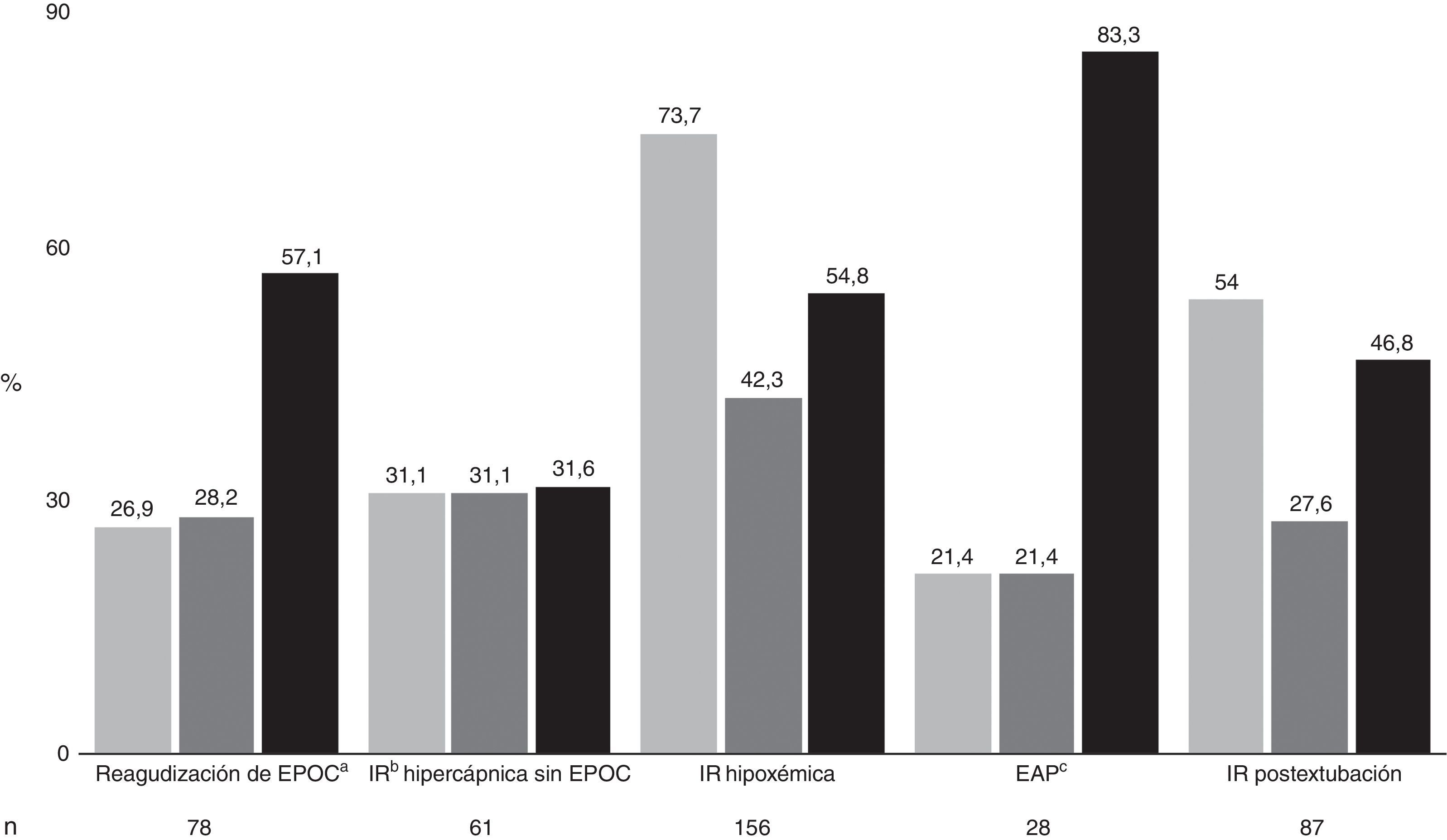
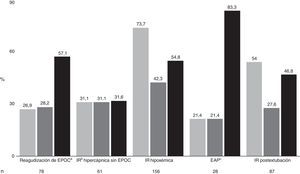
El porcentaje de fracaso total fue del 50,7%, con una mortalidad global del 33,4%. La figura 2 muestra la distribución por etiologías junto con el porcentaje de fracaso, la mortalidad y la mortalidad entre los pacientes en los que fracasó la VMNI. La causa más frecuente de uso fue en la IR aguda hipoxémica (38%), seguida de lejos de la IR postextubación (21,2%) y la reagudización de EPOC (19%). Los grupos menos numerosos fueron la IR hipercápnica sin EPOC (14,9%) y el EAP (6,8%). Analizando el fracaso por tipo de IR, el peor resultado fue en la IR aguda hipoxémica (73,7%), mientras que los mejores se obtuvieron en el EAP (21,4%), la reagudización de EPOC (26,9%) y la IR hipercápnica sin EPOC (31,1%). El porcentaje de fracaso en la IR postextubación fue del 54%. La mayor mortalidad se observó en los pacientes con IR hipoxémica. En los sujetos en los que fracasó la VMNI, el porcentaje de mortalidad fue muy elevado (83,3%) en los pacientes con EAP, aunque el escaso número de pacientes en este grupo hace que los datos tengan que ser valorados con cautela. Por el contrario, la menor mortalidad en pacientes en los que fracasó la VMNI se observó en el grupo de los pacientes con IR hipercápnica sin EPOC (31,6%).
Distribución por etiologías (n), junto con el porcentaje de fracaso (gris claro), de mortalidad (gris oscuro) y de mortalidad entre los pacientes en los que fracasó la VMNI (negro).
aEPOC: enfermedad pulmonar obstructiva crónica.
bIR: insuficiencia respiratoria.cEAP: edema agudo de pulmón.
Los pacientes en los que la VMNI fue exitosa tuvieron menor mortalidad (14,4 vs 51,9%, p<0,001), con menor estancia en UCI (4,7±5,0 vs 16,3±19,2 días, p<0,01) y hospitalaria (20,8±17 vs 31,7±26,7 días, p<0,01) que los pacientes en los que fracasó.
En cuanto a las diferencias de estancias por tipo de IR, se observaron diferencias significativas en la estancia en UCI en los pacientes con reagudización de EPOC (2,7±1,6 vs 9,9±16,7días, p<0,005), IR hipercápnica sin EPOC (4,1±5,6 vs 14,4±12,4días, p<0,001), IR aguda hipoxémica (6±7,4 vs 16,5±21,4días, p<0,001) e IR postextubación (7,6±4 vs 20,8±16,7días, p<0,001), siendo la diferencia en el grupo del EAP no significativa (3,4±2,6 vs 5,2±3,4días, p=0,13). En la estancia hospitalaria se observaron diferencias significativas en el grupo con IR postextubación (23,9±11,7 vs 37,1±25días, p<0,05), siendo el resto de las diferencias no significativas: reagudización de EPOC (14,5±8,6 vs 18,2 ±19,2días, p=0,94); IR hipercápnica sin EPOC (19,9±12,9 vs 25,9±17,8días, p=0,11); IR aguda hipoxémica (29±28,9 vs 33,6±29,1días, p=0,19) y EAP (18,1±11,7 vs 20,3±24,1días, p=0,53).
También se observaron diferencias en mortalidad en todos los grupos salvo en el de IR hipercápnica sin EPOC (31 vs 31,6%, p=0,96): reagudización de EPOC (17,5 vs 57,1%, p<0,001); IR aguda hipoxémica (7,3 vs 54,8%, p<0,005); EAP (4,5 vs 83,3% p<0,005); IR postextubación (5 vs 46,8% p<0,005).
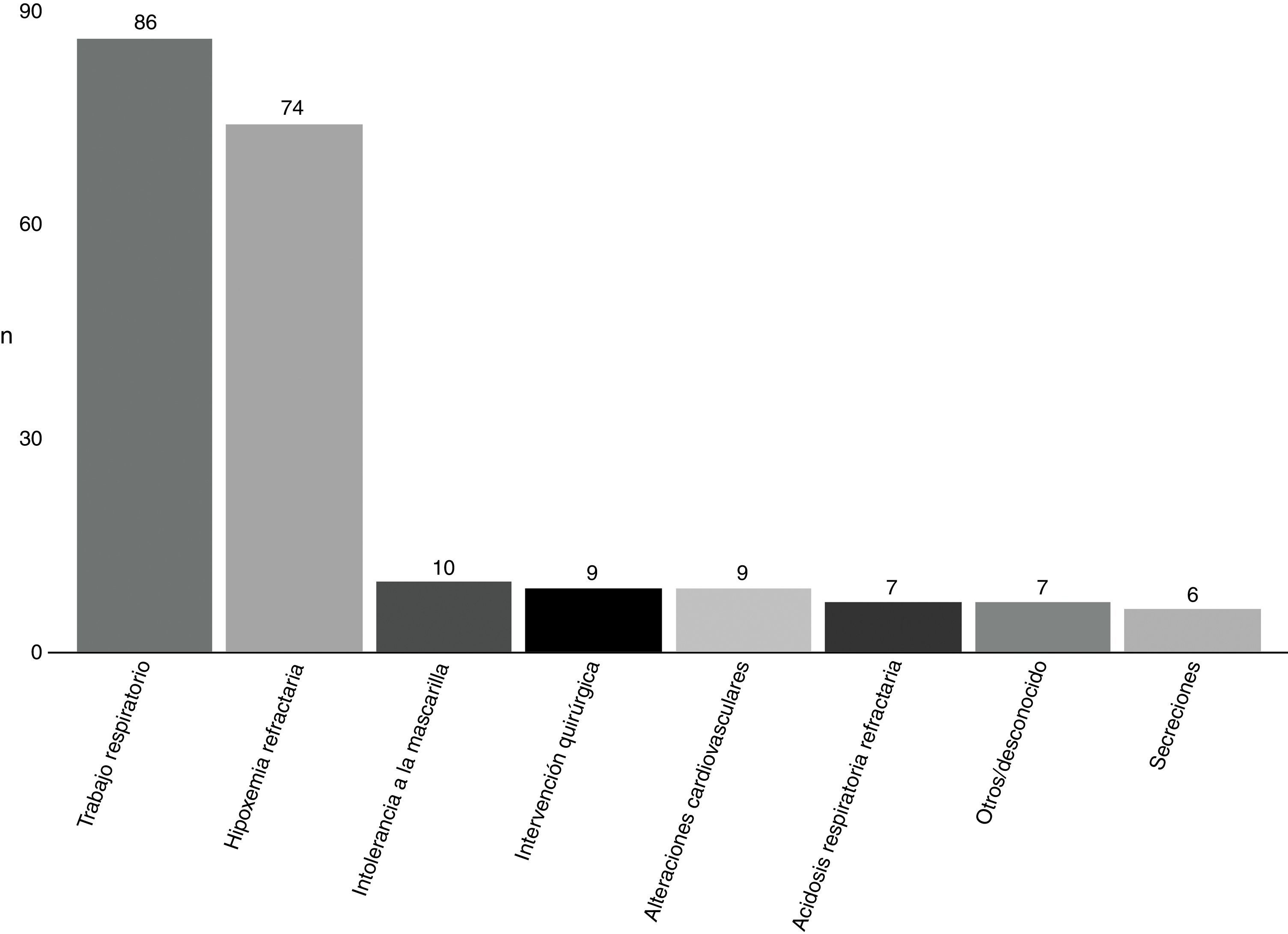
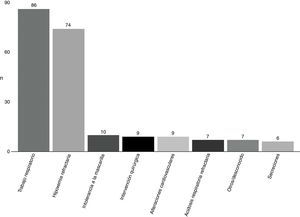
La causa más frecuente de fracaso de VMNI (fig. 3) fue el excesivo trabajo respiratorio (41,3%), seguido de la hipoxemia refractaria (35,6%).
Las complicaciones asociadas a la técnica fueron poco frecuentes, identificándose únicamente 18 alteraciones hemodinámicas (4,4%) y una neumonía asociada a VMNI (0,2%).
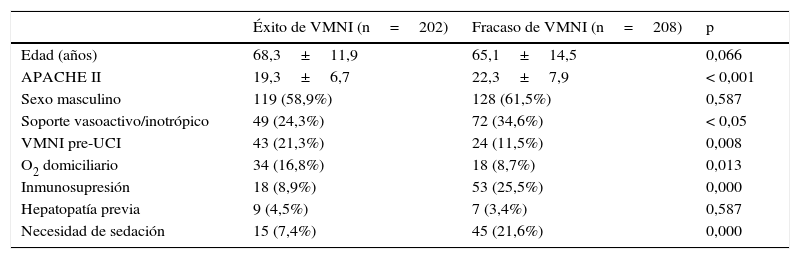
La tabla 1 muestra las diferencias en las características generales entre los pacientes en los que la VMNI tuvo éxito y en los que fracasó. Se observaron diferencias significativas en el APACHEII, el uso de la VMNI antes del ingreso en la UCI, la utilización de soporte inotrópico/vasopresor, el tratamiento con oxigenoterapia domiciliaria, la necesidad de sedación para tolerar la VMNI y la existencia de algún tipo de inmunosupresión (según la definición de la escala APACHEII).
Características generales de los pacientes según el resultado de la VMNI
| Éxito de VMNI (n=202) | Fracaso de VMNI (n=208) | p | |
|---|---|---|---|
| Edad (años) | 68,3±11,9 | 65,1±14,5 | 0,066 |
| APACHE II | 19,3±6,7 | 22,3±7,9 | < 0,001 |
| Sexo masculino | 119 (58,9%) | 128 (61,5%) | 0,587 |
| Soporte vasoactivo/inotrópico | 49 (24,3%) | 72 (34,6%) | < 0,05 |
| VMNI pre-UCI | 43 (21,3%) | 24 (11,5%) | 0,008 |
| O2 domiciliario | 34 (16,8%) | 18 (8,7%) | 0,013 |
| Inmunosupresión | 18 (8,9%) | 53 (25,5%) | 0,000 |
| Hepatopatía previa | 9 (4,5%) | 7 (3,4%) | 0,587 |
| Necesidad de sedación | 15 (7,4%) | 45 (21,6%) | 0,000 |
APACHE II: Acute Physiology And Chronic Health Evaluation II; UCI: unidad de cuidados intensivos; VMNI: ventilación mecánica no invasiva.
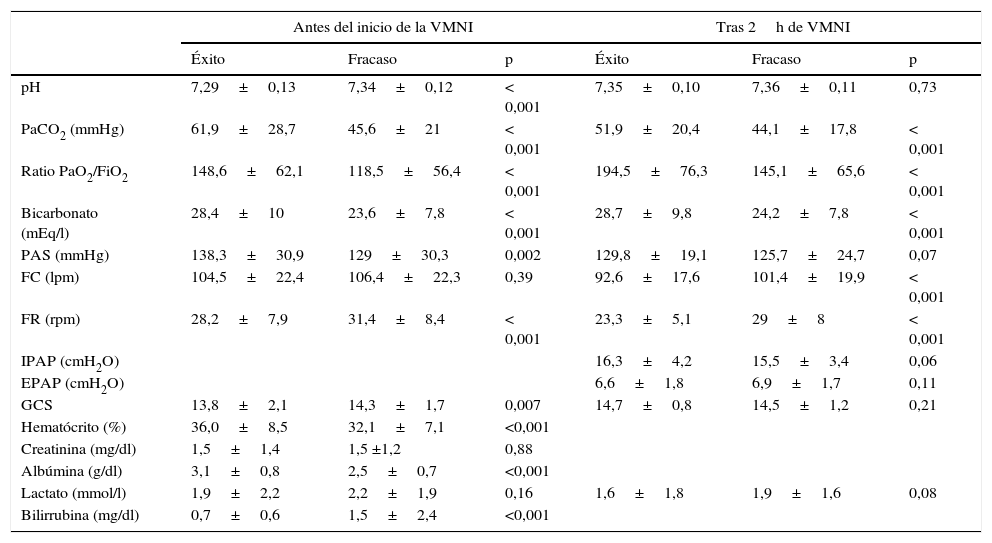
En la tabla 2 se reflejan los hallazgos clínicos y de laboratorio antes y 2h después del inicio de la VMNI. Al inicio, los pacientes en los que no fracasó la VMNI tenían un menor pH, frecuencia respiratoria, GCS, lactato sérico y bilirrubina sérica, y una mayor PaCO2, PaO2/FiO2, bicarbonato y presión arterial sistólica.
Hallazgos clínicos y de laboratorio (expresados en media±desviación estándar) previos al inicio y tras 2h de VMNI, según su resultado
| Antes del inicio de la VMNI | Tras 2h de VMNI | |||||
|---|---|---|---|---|---|---|
| Éxito | Fracaso | p | Éxito | Fracaso | p | |
| pH | 7,29±0,13 | 7,34±0,12 | < 0,001 | 7,35±0,10 | 7,36±0,11 | 0,73 |
| PaCO2 (mmHg) | 61,9±28,7 | 45,6±21 | < 0,001 | 51,9±20,4 | 44,1±17,8 | < 0,001 |
| Ratio PaO2/FiO2 | 148,6±62,1 | 118,5±56,4 | < 0,001 | 194,5±76,3 | 145,1±65,6 | < 0,001 |
| Bicarbonato (mEq/l) | 28,4±10 | 23,6±7,8 | < 0,001 | 28,7±9,8 | 24,2±7,8 | < 0,001 |
| PAS (mmHg) | 138,3±30,9 | 129±30,3 | 0,002 | 129,8±19,1 | 125,7±24,7 | 0,07 |
| FC (lpm) | 104,5±22,4 | 106,4±22,3 | 0,39 | 92,6±17,6 | 101,4±19,9 | < 0,001 |
| FR (rpm) | 28,2±7,9 | 31,4±8,4 | < 0,001 | 23,3±5,1 | 29±8 | < 0,001 |
| IPAP (cmH2O) | 16,3±4,2 | 15,5±3,4 | 0,06 | |||
| EPAP (cmH2O) | 6,6±1,8 | 6,9±1,7 | 0,11 | |||
| GCS | 13,8±2,1 | 14,3±1,7 | 0,007 | 14,7±0,8 | 14,5±1,2 | 0,21 |
| Hematócrito (%) | 36,0±8,5 | 32,1±7,1 | <0,001 | |||
| Creatinina (mg/dl) | 1,5±1,4 | 1,5 ±1,2 | 0,88 | |||
| Albúmina (g/dl) | 3,1±0,8 | 2,5±0,7 | <0,001 | |||
| Lactato (mmol/l) | 1,9±2,2 | 2,2±1,9 | 0,16 | 1,6±1,8 | 1,9±1,6 | 0,08 |
| Bilirrubina (mg/dl) | 0,7±0,6 | 1,5±2,4 | <0,001 | |||
EPAP: expiratory positive airway pressure; FC: frecuencia cardiaca; FR: frecuencia respiratoria; GCS: Glasgow Coma Scale; IPAP: inspiratory positive airway pressure; PAS: presión arterial sistólica; VMNI: ventilación mecánica no invasiva.
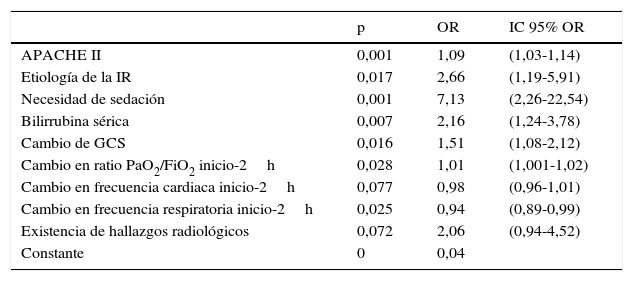
En la tabla 3 se muestran las variables que proporcionaron el mejor ajuste del modelo logístico. La bondad del ajuste del modelo fue de 0,48. El porcentaje de bien clasificados fue del 77%, con una sensibilidad del 70% y una especificidad del 84%. Con la muestra de validación se obtuvo un 74% de bien clasificados, con una valor predictivo positivo del 66% y valor predictivo negativo del 72%.
Resultados del análisis de regresión logística que identifica factores de riesgo de fracaso de la VMNI
| p | OR | IC 95% OR | |
|---|---|---|---|
| APACHE II | 0,001 | 1,09 | (1,03-1,14) |
| Etiología de la IR | 0,017 | 2,66 | (1,19-5,91) |
| Necesidad de sedación | 0,001 | 7,13 | (2,26-22,54) |
| Bilirrubina sérica | 0,007 | 2,16 | (1,24-3,78) |
| Cambio de GCS | 0,016 | 1,51 | (1,08-2,12) |
| Cambio en ratio PaO2/FiO2 inicio-2h | 0,028 | 1,01 | (1,001-1,02) |
| Cambio en frecuencia cardiaca inicio-2h | 0,077 | 0,98 | (0,96-1,01) |
| Cambio en frecuencia respiratoria inicio-2h | 0,025 | 0,94 | (0,89-0,99) |
| Existencia de hallazgos radiológicos | 0,072 | 2,06 | (0,94-4,52) |
| Constante | 0 | 0,04 |
APACHE II: Acute Physiology And Chronic Health Evaluation II; GCS: Glasgow Coma Scale; IC: intervalo de confianza; IR: insuficiencia respiratoria; OR: odds-ratio calculado por los coeficientes del modelo (eβ^); VMNI: ventilación mecánica no invasiva.
El cambio de frecuencia cardiaca y la existencia de hallazgos radiológicos, a pesar de no ser significativos, fueron mantenidos en el modelo por su importancia clínica y porque la presencia de estas variables en el mismo proporcionaba mejores porcentajes de bien clasificados. La necesidad de sedación, el tipo de IR (hipercápnica vs no hipercápnica), la bilirrubina sérica al inicio y la existencia de hallazgos radiológicos son los factores de riesgo con mayor magnitud en el efecto, mientras que el cambio de frecuencia cardiaca y respiratoria son factores protectores aunque su magnitud es débil. Es necesario aclarar la interpretación de las variables que definen el cambio desde el momento inicial a las 2h: en el caso del cambio de GCS de un paciente que mejora, este arroja valores negativos (al pasar de un GCS menor a otro mayor); un resultado más negativo refleja una mejor evolución que uno menos negativo, por lo que un incremento en esta escala (es decir, un resultado menos negativo) identifica una menor mejoría, y por lo tanto produce peores pronósticos.
DiscusiónEl fracaso de la VMNI fue del 50,7%. Revisando los resultados de estudios previos10,11, esta varía entre el 24 y el 58%, siendo esta última tasa la observada en un estudio aleatorizado con diferentes tipos de IR12. Existe también evidencia concordante con nuestros datos a favor de la disminución de la estancia en la UCI13,14 y la hospitalaria14 en los pacientes en los que la VMNI es exitosa.
Sin embargo, el amplio abanico de resultados previos en cuanto a porcentaje de fracaso es un dato llamativo; probablemente la causa fundamental sea la diferente proporción de tipos de IR en los distintos estudios. Por eso podría ser más útil comparar resultados por tipo de IR.
Así, en las reagudizaciones de EPOC, en el EAP y en la IR hipercápnica sin EPOC el porcentaje de éxito fue elevado, entre el 70 y el 78%. El los 2 primeros grupos, la evidencia científica es abrumadora a favor del uso de la VMNI1,15,16. En estos pacientes, nuestros resultados son similares a estudios previos en cuanto a tasa de éxito15,16 y a disminución de la mortalidad y la estancia en la UCI16 si la VMNI resultaba exitosa.
Igualmente, en los pacientes con EAP el porcentaje de fracaso se situó en el 21,4%, similar a la evidencia disponible17, observándose también una menor mortalidad en los pacientes en los que no fracasó. Pese a todo, los resultados en este grupo han de ser valorados con cautela, dado el escaso número de pacientes.
Con respecto al último grupo, la IR hipercápnica sin EPOC, la evidencia es mucho menor, con pocos trabajos y además con pacientes con patologías muy diversas, con tasas de éxito que varían desde el 89%18 hasta el 38%11. En nuestro estudio, al contrario que en la evidencia previa, no se observa una mayor mortalidad ni un mayor fracaso de la VMNI de los pacientes no EPOC con respecto a los EPOC.
En nuestra experiencia, la VMNI puede ser utilizada con altas probabilidades de éxito en estos 3 tipos de pacientes (reagudización de EPOC, EAP e IR hipercápnica sin EPOC).
Por el contrario, en la IRA hipoxémica el fracaso fue muy elevado, del 73,7%. En este tipo de patología hay mucha menos evidencia disponible para apoyar su uso. La gran variabilidad de causas de IRA hipoxémica dificultan la comparación de resultados, con tasas de fracaso entre el 12 y el 60%11,19,20.
En nuestro estudio, los pacientes en los que la VMNI fue exitosa tuvieron una menor mortalidad y estancia en la UCI. En la literatura, aunque hay estudios que demuestran disminución del número de complicaciones serias, de la necesidad de VM y de la estancia en la UCI19-21, el metaanálisis de Keenan et al.22 concluye que la gran variabilidad de resultados en los estudios analizados hace que no se pueda recomendar de forma generalizada su uso en la IRA hipoxémica.
Los datos de nuestro estudio deben hacer que se reconsidere el uso de la VMNI en este tipo de pacientes.
En el subgrupo de la IR postextubación, el éxito fue únicamente moderado, con un fracaso del 54%. Mientras que el uso de la VMNI en la prevención de la IR postextubación durante el weaning está avalado por la evidencia científica23, su efectividad en la IR postextubación es mucho más controvertida. Al igual que en la IRA hipoxémica, la gran variedad de causas de IR y la diversidad de patologías por las que el paciente precisó intubación orotraqueal complican la evaluación de la VMNI en estos pacientes. Dos estudios aleatorizados24,25 no encontraron diferencias en reintubación, y uno de ellos24 mostró una mortalidad mayor en el grupo de la VMNI.
Las complicaciones de la VMNI fueron poco frecuentes (una neumonía asociada a VMNI y 18 alteraciones hemodinámicas), aunque la naturaleza retrospectiva del estudio hizo imposible determinar de una manera adecuada las complicaciones menores, como la aparición de lesiones cutáneas secundarias a la aplicación de la interfase. Se produjeron 6 paradas cardiorrespiratorias (1,5%), todas ellas en asistolia o actividad eléctrica sin pulso. La incidencia de paradas cardiorrespiratorias en estudios previos varió entre el 0%15 y el 7%12. No se identificó ningún episodio de isquemia miocárdica (definida como la aparición de cambios agudos en el ECG y/o elevación de enzimas cardiacas), a diferencia del estudio de Mehta et al.17, que mostró un aumento de la incidencia de los infartos de miocardio en el grupo de la ventilación con doble nivel de presión (BPAP). Los 6 casos de parada cardiorrespiratoria ocurrieron en pacientes con múltiples patologías previas que justificaban el manejo conservador (3 de ellos de hecho eran pacientes con orden de no intubar).
Los resultados del análisis de regresión logística son concordantes con la evidencia previa, que identificó como predictores de fracaso el diagnóstico de neumonía12, APACHEII elevado12, frecuencia respiratoria >35lpm12, SAPSII elevado8,11,26, mala tolerancia a la VMNI26, IPAP elevada27, pH bajo27,28, GCS previo a la VMNI11, PaO2/FiO2 previo a la VMNI11 o PaO2/FiO2 tras una hora de VMNI28. La reagudización de EPOC ha sido identificada como predictora de éxito29.
De forma general, nuestros datos sugieren que los pacientes más graves, así como los que tuvieron una peor respuesta inicial a la VMNI, tenían más probabilidades de fracasar con VMNI.
El hallazgo de la bilirrubina sérica previa al inicio de la VMNI como predictor de fracaso, que no ha sido referido en ningún estudio previo, podría identificar a pacientes con disfunción multiorgánica (ya que no había diferencias significativas en cuanto a la existencia de hepatopatía previa entre los grupos de éxito y fracaso de la técnica); evidencia previa30 mostró que los pacientes con mayor fallo orgánico (medido mediante el SOFA score) tuvieron peores resultados.
La mayor limitación de nuestro estudio es la de no ser un estudio aleatorizado controlado, sino un estudio retrospectivo. El hecho de ser un estudio unicéntrico implica que los resultados podrían no ser generalizables. Además, es posible que su larga duración (6años) lleve implícito un cambio en la tecnología y en el manejo de los pacientes que deba ser tenido en cuenta a la hora de interpretar los datos.
Dado que una de las claves a la hora de decidir la aplicación de la VMNI es la probabilidad de fracaso, que puede empeorar el pronóstico de los pacientes con IR, nuestros resultados podrían ayudar en la toma de decisiones, ya que se identifican varios predictores de fracaso que podrían ser útiles. Con estos predictores podría ser posible decidir no iniciar la VMNI, o terminarla de manera precoz si la probabilidad de fracaso es elevada.
La VMNI es una técnica útil para tratar pacientes con IR, y puede evitar la intubación orotraqueal en aproximadamente la mitad de los casos. Su efectividad es mayor en los pacientes con reagudización de EPOC, con EAP o con IR hipercápnica sin EPOC. Su uso en los pacientes con IR hipoxémica o IR postextubación debería valorarse individualmente.
FinanciaciónNo se ha recibido financiación para la realización de este estudio.
Conflicto de interesesNo existe conflicto de intereses de ninguno de los autores.
Estudio realizado en la Unidad de Cuidados Intensivos del Hospital Universitario de Salamanca.