La encefalopatía de Wernicke (EW) constituye una entidad neurológica por déficit de tiamina, que se asociaba clásicamente con el alcoholismo, aunque aparece en no alcohólicos1,2. Su prevalencia estimada es entre el 0,4-2,8%, pero la coexistencia con enfermedades del mismo perfil y la inaccesibilidad a las pruebas diagnósticas hacen que la incidencia real sea desconocida1. Dado la gravedad e inocuidad del tratamiento, se recomienda la administración inmediata de tiamina ante la sospecha, deteniéndose así la enfermedad y favoreciendo la recuperación1,3. Para prevenirla, los profesionales debemos conocer las situaciones e intervenciones terapéuticas en los que exista un aumento de la demanda metabólica que precipiten su déficit3. En vistas a esta situación, consideramos presentar el caso de una paciente con encefalopatía rápidamente progresiva relacionada con el déficit de tiamina.
Se trata de una mujer de 57 años cuyo único antecedente es una bulbitis duodenal. Desde hacía 2 meses padecía un cuadro de alteraciones comportamentales, vértigo, vómitos, dolor abdominal e intolerancia alimenticia, que finalmente provocó un fracaso renal agudo y acidosis metabólica grave, ingresando así en su hospital de referencia. Al ingreso iniciaron tratamiento sintomático y fluidoterapia, recuperándose la función renal, pero la persistencia de la clínica digestiva obligó al inicio de nutrición parenteral (NP). Se realizaron una tomografía computarizada (TC) abdominal, una endoscopia digestiva, y diversas pruebas serológicas y microbiológicas, todas con resultados anodinos. Progresivamente las alteraciones del comportamiento se magnificaron con paso a deteriorar el nivel de conciencia hasta los 9-10 puntos en la escala de coma de Glasgow (GCS). Se realizó una TC de cráneo y una punción lumbar, ambas no patológicas. Ante la incertidumbre diagnóstica se traslada a nuestra unidad al ser especializada en enfermedad neurocrítica.
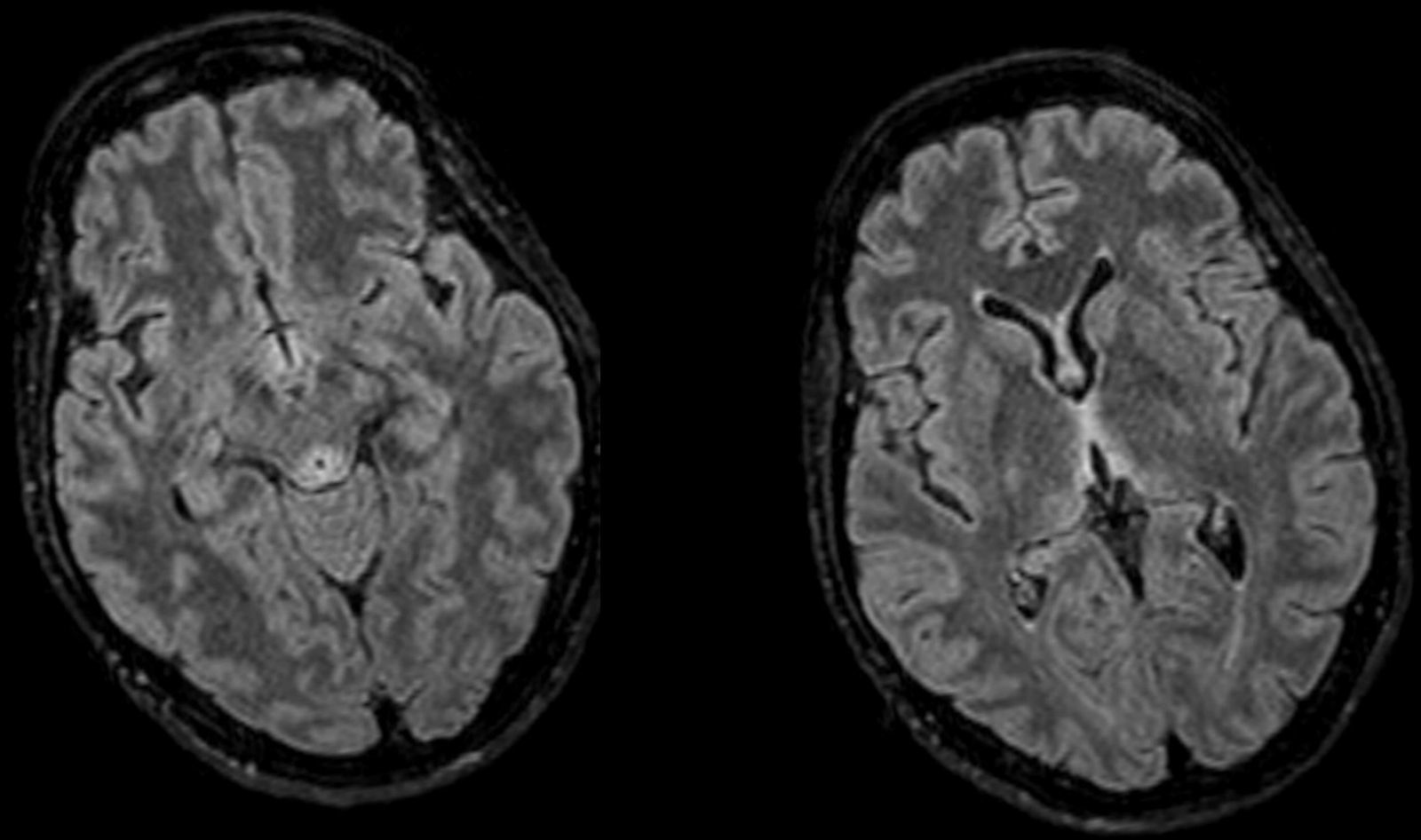
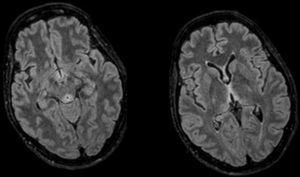
A su llegada constatamos un GCS entre los 8-12 puntos. Su única focalidad física era la inexistencia de reflejos oculocefálicos. Ante la clínica, cronopatología y negatividad de las pruebas, la sospecha inicial incluyo la posibilidad de EW, administrándose tiamina intravenosa, 24-48h más tarde, presentó una mejoría evidente, mostrándose bradipsíquica pero consciente y colaboradora. Se realizó una resonancia magnética (RM) craneal, observándose lesiones simétricas hiperintensas periacueductales, talámicas, cuerpos mamilares y tubérculos cuadrigéminos, hallazgos característicos de la EW, pudiendo ser dada de alta de forma precoz. A pesar de la rápida recuperación inicial, en las revisiones continuadas mantenía algunas secuelas sobre la marcha y la memoria.
Existen múltiples publicaciones sobre la EW. La tríada clínica clásica incluye la alteración del estado mental, signos oculomotores y alteraciones cerebelosas1–3. La coexistencia de estos síntomas es variable, pero las series coinciden en que es más frecuente en pacientes alcohólicos que en no alcohólicos, en los que el curso es más rápido y fatal, dificultando su detección1,3. La sensibilidad diagnóstica de la triada es limitada (20%), pero mejora al incluir el déficit nutricional: si están presentes 2 de estos 4 síntomas, podremos detectar hasta el 85%4, coexistiendo todos en nuestro caso. No obstante, ocasionalmente se realiza por exclusión1,3.
Las reservas de tiamina son limitadas y precisamos un consumo alimenticio regular5. Se hidroliza intestinalmente, y su absorción local es saturable, por lo que la administración oral es ineficaz para incrementar rápidamente los niveles4,5, siendo la parenteral esencial1,3,5. Su función es ser cofactor de enzimas del metabolismo de los hidratos de carbono, esenciales en la producción de energía cerebral, produciendo su déficit3,5 neurotoxicidad y muerte neuronal.
Ante insuficiente ingesta o pérdidas incrementadas, los depósitos se depleccionan en 3-4 semanas5. La ingesta tras un ayuno prolongado y/o la administración de soluciones glucosadas incrementan las necesidades, por esta razón se recomienda administrarla antes o junto a las soluciones glucosadas3.
La causa más frecuente es el alcoholismo, aunque se puede desarrollar por malnutrición, pérdidas (vómitos, diálisis), aumento de requerimientos (sepsis grave, quemados) y trastornos genéticos del metabolismo1,2, siendo la coexistencia de varios de estos factores el escenario ideal para una progresión rápida. En el caso, la hiperémesis prolongada fue la responsable inicial, aunque la introducción de NP incrementó la demanda metabólica en una paciente en la que el déficit era inadvertido, agravando la progresión. Las preparaciones de multivitaminas habituales proporcionan entre 3-3,5mg de tiamina. Según las guías actuales los pacientes en riesgo que inicien NP deberían recibir entre 100-300mg/día durante los primeros 3 días1,3,6, especialmente malnutridos7. No obstante, existe una baja adherencia. No hay un consenso sobre la dosis en EW.
El diagnóstico es clínico, aunque existen pruebas para evaluación y apoyo. La RMN cerebral es la prueba de elección1,3 por su especificidad (93%) y valor predictivo positivo (89%), descartándose la TC por su escasa sensibilidad. Las lesiones típicas son simétricas y afectan al tálamo medial, cuerpos mamilares, placa tectal y región periacueductal8, como en nuestro caso (fig. 1). El déficit de tiamina puede analizarse mediante cromatografía líquida de alta resolución o a partir de la actividad de la transcetolasa eritrocitaria1,3,7, donde actúa como cofactor. En nuestra paciente no pudimos obtener niveles ya que un error de extracción inutilizó la muestra. La rápida recuperación tras la administración es el mejor diagnóstico, como en nuestra paciente1,3,7.
Se deben suplementar vitaminas y otros déficits coexistentes. El magnesio es un importante cofactor de las vías de utilización de la tiamina. Un estudio reciente demostró un incremento significativo de la actividad de la transcetolasa eritrocitaria en el grupo tratado con magnesio y tiamina, frente al que recibió solo tiamina, por lo que podría intuirse que la administración de ambas podría acelerar la restauración de las vías metabólicas9,10.
El pronóstico de la EW va ligado a la precocidad del diagnóstico y tratamiento1,3,5. Su bajo coste e inocuidad apoyan su administración temprana. Los déficits residuales son frecuentes, como ocurrió en el caso presentado.
Nos gustaría terminar con la siguiente reflexión. El diagnóstico de EW es clínico y la respuesta al tratamiento con tiamina es la mejor prueba. Deberíamos considerarlo en cualquier cuadro neurológico no filiado en pacientes con factores de riesgo (aumento de la demanda metabólica u origen carencial). Ante la sospecha, debemos suplementar con tiamina intravenosa, ya que por su buen perfil de seguridad e inocuidad, podría prevenir e incluso detener, los efectos devastadores.
FinanciaciónLos autores declaran no haber recibido fuentes de financiación.