La hipoxemia refractaria constituye una entidad de profunda complejidad y repercusión clínica con elevada morbimortalidad. Dicha situación clínica constituye un proceso avanzado que se engloba en el síndrome de insuficiencia respiratoria aguda (SDRA), definida por la conferencia americano-europea1 con el propósito de consensuar unos criterios heterogéneos en 1994. Se define la insuficiencia respiratoria aguda en función de parámetros clínicos, radiológicos y gasométricos. La lesión pulmonar aguda (LPA) se define por un cociente PaO2/FiO2 inferior a 300mmHg y en el SDRA, por debajo de los 200mmHg. Recientemente, en el año 2011, se reunieron en Berlín expertos y redefinieron la clasificación («Berlin definition»)2, mejorando la estratificación y la predicción de mortalidad del síndrome, pero sin llegar a solucionar otros factores, como el papel de la presión positiva al final de la espiración (PEEP), la fisiopatología o la etiología del proceso. Desaparece el término LPA y se clasifican según el valor de PaO2/FiO2, para una PEEP establecida, como SDRA leve, moderado o grave (PaO2/FiO2 200-300 con PEEP ≥ 5; PaO2/FiO2 ≤ 200 con PEEP ≥ 5, y PaO2/FiO2 ≤ 100 con PEEP ≥ 10, respectivamente).
La ventilación mecánica (VM) «per se» supone una agresión pulmonar que se describe en diversos trabajos, como los de Amato et al.3 y Brochard et al.4, sugiriéndose el uso de maniobras ventilatorias neumoprotectoras. Basándose en estos datos, el estudio del grupo ARDS Network5 del año 2000 consiguió demostrar una disminución de la mortalidad en los pacientes con LPA/SDRA bajo ventilación neumoprotectora. El objetivo de esta estrategia era disminuir la lesión inducida por el ventilador (VILI) y se basaba en evitar la sobredistensión alveolar (volutrauma) y la apertura y el cierre cíclicos de unidades alveolares (atelectrauma). Posteriores estudios corroboraron esta estrategia, incluso en pacientes sin criterios de lesión pulmonar, como el realizado por Determann et al.6, que demostró un aumento de casos de LPA en pacientes ventilados con volumen corriente (VT) de 10ml/kg de peso ideal (ml/kg IBW) frente a 6ml/kg IBW, hasta el punto de detener el estudio precozmente. El estudio publicado por Needham et al.7 en 2012 analizó la supervivencia a los 2 años de pacientes con LPA ventilados con medidas neumoprotectoras. Mostró una mortalidad del 64% en los primeros 2 años. El cumplimiento de las medidas neumoprotectoras en el 50% de las ocasiones suponía una reducción de riesgo absoluto de mortalidad a partir de los 2 años del 4%, y el 8% si la adherencia era del 100%. Por el contrario, el riesgo relativo de mortalidad aumentaba el 18% por cada 1ml/kg IBW que se aumentaba el VT.
Bajo estas premisas, toda insuficiencia respiratoria aguda que, bajo medidas neumoprotectoras, mantiene persistentemente una PaO2/FiO2 < 100 o una Pplat > 30 cmH2O se puede catalogar como hipoxemia refractaria8. Una vez hecho el diagnóstico, deben valorarse diferentes medidas terapéuticas que engloben y actúen sobre diferentes aspectos de la fisiopatología pulmonar. El objetivo de esta revisión es la descripción de los tratamientos dirigidos a tratar la hipoxia y, en segundo lugar, mejorar la supervivencia.
2Opciones ventilatoriasLa ventilación mecánica constituye la piedra angular del tratamiento y engloba diferentes modos y/o maniobras ventilatorias que tratan de mejorar la superficie efectiva de intercambio gaseoso: el nivel de PEEP, las maniobras de reclutamiento, las modalidades ventilatorias reguladas por presión, la relación inspiración-espiración invertida, la ventilación con liberación de presión en la vía aérea (airway pressure release ventilation, APRV) y la ventilación con alta frecuencia oscilatoria (HFOV).
Presión positiva al final de la espiración y maniobras de reclutamientoEn el pulmón enfermo existe una distribución heterogénea entre unidades alveolares sanas y otras con diferentes grados de colapso alveolar, que en conjunto suponen una menor superficie de intercambio gaseoso. La aplicación de presión en el sistema respiratorio puede descolapsar los alvéolos dañados. La dificultad principal consiste en alcanzar un nivel de presión suficiente para reclutar (descolapsar) las unidades alveolares enfermas y simultáneamente evitar la apertura y el cierre cíclicos (atelectrauma), la sobredistensión de los alvéolos sanos y los efectos hemodinámicos adversos (alteración de la ventilación-perfusión y del gasto cardiaco).
Existen dos maniobras fundamentales para alcanzar la mayor cantidad de superficie de intercambio, que se diferencian por la intensidad y el tiempo de aplicación. La PEEP aplica una presión continua durante la ventilación con un reclutamiento lento y progresivo, mientras que las maniobras de reclutamiento (MR) consisten en presiones elevadas durante un corto período, reclutando la mayor cantidad de alvéolos colapsados.
En los últimos años, el debate de la PEEP gira en torno a la aplicación de PEEP moderada frente a PEEP alta. Los resultados muestran una mejoría de la PaO2/FiO2, sin influir en la supervivencia. El estudio ALVEOLI9 comparó bajo volumen-control en 2 regímenes de PEEP, mejorando la oxigenación y la mecánica respiratoria en el grupo de PEEP alta. Sin embargo, no hubo diferencias en la mortalidad, los días libres de ventilación mecánica o el desarrollo de barotrauma, aunque cierto disbalance entre los grupos podría explicarlo. En la misma línea, el estudio de Meade et al.10 comparó volumen-control (PEEP moderada) frente a presión-control (PEEP alta), demostrando una mejoría de la hipoxemia refractaria y de la muerte por hipoxemia en el grupo de PEEP alta, pero sin diferencias en la mortalidad global o la incidencia de barotrauma. El estudio de Mercat et al.11 comparó bajo volumen-control en un grupo estándar y otro con elevación de PEEP hasta alcanzar presión meseta de 28-30 cmH2O. No solo no hubo beneficios, sino incluso efectos adversos en el grupo de PEEP alta con insuficiencia respiratoria leve.
Gordo-Vidal et al. revisaron el efecto de diferentes niveles de PEEP en 4 estudios de alta calidad metodológica, de 12 considerados relevantes12. Seleccionaron los trabajos de Amato et al.13, Ranieri et al.14, Brower et al.9 y Villar et al.15, concluyendo que el nivel de PEEP no afectaba a la mortalidad ni a la incidencia de barotrauma. El mismo análisis, sin contar con el estudio ALVEOLI de Brower et al.9, mostró una reducción de la mortalidad y el barotrauma significativos (RR = 0,6; IC del 95%, 0,4-0,8, y RR = 0,2; IC del 95%, 0,1-0,7, respectivamente). La diferencia se basó en que en estos 3 estudios la PEEP se ajustó en función de la identificación del punto de inflexión inferior de la rama ascendente del bucle presión/volumen.
En resumen, se puede concluir que la utilización de PEEP alta para incrementar la oxigenación muestra, según los estudios descritos, mejores resultados. Sin embargo, aumentos de la PEEP que no se traducen en un aumento de la superficie alveolar suponen aumentos de la presión transpulmonar, mecanismo relacionado con la VILI16. Se recomienda la monitorización de la PEEP según bucles P-V o «stress-index» para evitar efectos deletéreos hemodinámicos o pulmonares.
Las MR amplían la superficie de intercambio mediante un aumento intenso y transitorio de la presión transpulmonar, reclutando alvéolos colapsados. Estudios como el de Oczenski et al.17 muestran una mejoría gasométrica temporal. Se generaban presiones de 50 cmH2O durante 30 s, mejorando la oxigenación durante 30 min. Los mismos resultados se obtuvieron en el estudio de Meade et al.18, con efectos adversos como hipotensión o barotrauma. Por otro lado, la PEEP necesaria tras la MR puede ajustarse mediante la identificación del punto de inflexión de la rama ascendente de la curva presión-volumen, como en el estudio de Amato et al.13, o por la desaturación ante el decremento progresivo de la PEEP, como en el estudio de Girgis et al.19. La revisión de 40 estudios de Fan et al.20 en pacientes con LPA confirma la mejoría temporal de la oxigenación, con menores efectos adversos que en otros artículos. Concluyen que no debe ser considerada una medida rutinaria, sino individualizada en pacientes en situación de riesgo vital.
Las MR son una técnica de aplicación discutida, de efectos transitorios, en que no se han acordado el método óptimo, el «timing» o la frecuencia de aplicación. Esperamos que el estudio multicéntrico OLA ofrezca resultados próximamente.
Técnicas ventilatoriasVentilación controlada por presiónLa ventilación controlada por presión (VCP) es una opción ventilatoria en caso de hipoxemia refractaria, ya que puede mejorar la hipoxemia sin añadir más riesgos, aunque no mejora el pronóstico. En el estudio de Esteban et al.21 se aleatorizó a 79 pacientes en 2 ramas, control-volumen y control-presión, sin encontrar diferencias gasométricas, de mecánica ventilatoria o en el número de fracasos orgánicos.
Dado que esta modalidad ventilatoria es de aplicación no solo en la hipoxemia refractaria, se sugiere acudir al tema correspondiente de la serie.
Relación inspiración-espiración invertidaSe han planteado mecanismos que aumenten la presión media en el pulmón. Alargar la fase inspiratoria hasta superar el tiempo de espiración, invirtiendo la relación, puede ser un mecanismo. Aunque es factible bajo cualquier modalidad ventilatoria, es en las reguladas por presión donde se ha aplicado tradicionalmente, demostrando una disminución en las presiones picos, una mejoría de la ventilación y oxigenación, etc.22.
Sin embargo, con el tiempo no se han demostrado claros beneficios respecto a modos convencionales con esta técnica. Existe un mayor número de asincronías que obligan a aumentar la sedación o, incluso, recurrir a la relajación. Aumenta el riesgo de atrapamiento aéreo, con el riesgo de deterioro hemodinámico. Mercat et al.23 compararon ventilación control-volumen, control-presión tradicional y control-presión con relación invertida. La ventilación (PaCO2: VCV 45±5mmHg, VCP 43±5mmHg, PC-IRV 39±4mmHg; p < 0,05) y las presiones en el sistema respiratorio mejoraron en el grupo de relación invertida, pero sin cambios en la oxigenación. Se demostró, sin embargo, un deterioro en el índice cardiaco (3,3±0,2 vs. 3,7±0,2 l/min/m2; p<0,05) y el transporte de O2 (DO2 424±28 vs. 469±38ml/min/m2; p<0,05).
La ausencia de claros beneficios ha ido desplazando su utilización clínica, al menos en modalidades ventilatorias convencionales reguladas por presión24.
Ventilación con liberación de presión en la vía aéreaLa combinación de la ventilación regulada por presión y la relación inspiración-espiración invertida (I:E invertida) dio como resultado la APVR.
La APRV es una modalidad regulada por presión donde se establecen una «presión baja» y una «presión alta». En esencia, equivale a una VCP, pero con 2 diferencias fundamentales. El ventilador posee una válvula espiratoria activa que permite la respiración espontánea del paciente en cualquiera de las fases de presión y, en segundo lugar, la duración de la fase de «presión alta» siempre es mayor que la de «presión baja», lo que equivale a una relación I:E invertida. La ventilación espontánea reduce las necesidades de sedación y fármacos vasoactivos25, aumenta el reclutamiento de las zonas dependientes y mejora la relación V/Q y la oxigenación26,27. Por otro lado, las fases de liberación de presión (fase de presión baja) resuelven los problemas hemodinámicos26.
Putensen et al.26 compararon en 24 pacientes APRV con respiración espontánea, APRV sin capacidad de asistir y ventilación en presión de soporte (PSV), divididas en 2 ramas: igual presión inspiratoria total12 o igual volumen por minuto12. La comparación de APRV con y sin respiración espontánea mejoró significativamente en la rama de respiración espontánea el índice cardiaco, la oxigenación y la relación V/Q, y disminuyó la resistencia vascular pulmonar. La PSV, aun siendo una modalidad de ventilación parcial, no mejoró el índice cardiaco ni la relación V/Q frente a la APRV sin asistencia. Concluyeron que la respiración espontánea de la APRV suponía una ventaja en términos de ventilación, oxigenación y hemodinámica cardiovascular, básicamente al promover la actividad y el reclutamiento de las regiones pulmonares dorsales. En el 2001, el mismo grupo25 comparó en 30 pacientes la APRV frente a la VCP durante las primeras 72 h de ventilación mecánica. Se controlaron estrictamente todas las variables y la diferencia entre los 2 grupos era la presencia de respiración espontánea en APRV frente a la ausencia total (bajo relajación) en el grupo de VCP. Se analizaron parámetros gasométricos, respiratorios y hemodinámicos en los primeros 10 días desde el ingreso. El grupo APRV mostró incrementos significativos de la distensibilidad, PaO2, V/Q e índice cardiaco frente al grupo VCP, además de menores requerimientos de sedación y fármacos vasoactivos. En esta misma línea, Varpula et al.28 realizaron un estudio similar comparando en 58 pacientes la APRV frente a la SIMV-PS. Se analizaron la evolución gasométrica, respiratoria y hemodinámica, así como los días libres de VM y la mortalidad a los 28 días. El estudio fue detenido por futilidad antes de conseguir los 80 pacientes estimados, dado que los resultados en el «ínterin análisis» no mostraron diferencias entre los grupos. Los resultados gasométricos y hemodinámicos no mostraron diferencias significativas, así como los días libres de VM (APRV: 13,4±1,7 días vs. SIMV: 12,2±1,5 días) y mortalidad a los 28 días (APRV 17% vs. SIMV 18%). El estudio muestra una serie de elementos que complican la interpretación de los resultados. Por un lado, existía una restricción de la frecuencia respiratoria espontánea máxima para ambas modalidades, siendo la libertad de ventilación espontánea una de las características diferenciadoras y fundamentales en la fisiopatología de la APRV. Por otro lado, se introdujeron 2 factores de confusión que podrían influir en diferente grado en los resultados, la utilización de la posición prono y la metilprednisolona.
El estudio de Neumann et al.29 analizó los posibles efectos adversos de la APRV. Los pacientes con tiempos espiratorios largos, como en las enfermedades pulmonares obstructivas, mostraron un incremento progresivo de auto-PEEP cuando se disminuyó la duración de la fase de presión baja. Incluso se observó que la respiración espontánea podía provocar VT y cambios de presión pleural en ocasiones muy elevados, lo que se asociaría a presiones transpulmonares elevadas y aumento en el riesgo de VILI.
Hasta ahora ninguno de los estudios ha mostrado un aumento de la supervivencia. En cambio, sí puede suponer una mejoría en la hemodinámica y la mecánica respiratoria, sin olvidar los riesgos en su aplicación. En conclusión, a pesar de ser una alternativa ventilatoria, no se puede llegar a recomendar su aplicación de forma rutinaria. Y, en tal caso, bajo estricto control de los volúmenes corrientes y la generación de auto-PEEP.
Ventilación con alta frecuencia oscilatoriaAlternativa ventilatoria que se caracteriza por la aplicación de una frecuencia respiratoria superior a 100 respiraciones por minuto (high frequency oscillatory ventilation o HFOV) y que se expresan en hertzios (en general, entre 3-15Hz). La combinación de FiO2 y la presión media generada en el sistema respiratorio determina la oxigenación. Dicha presión media es el resultado de una mínima oscilación de presión (ΔP) que genera unos VT inferiores al espacio muerto, pero suficientes para mantener una ventilación adecuada. Gran parte de la presión generada se atenúa en las vías aéreas principales, por lo que la cantidad de volumen y presión que llega a los alvéolos es tan baja que permite el reclutamiento alveolar sin provocar sobredistensión o fenómenos de colapso-apertura alveolar cíclicos. El resultado es una mejoría del intercambio gaseoso, manteniendo medidas neumoprotectoras.
La literatura describe esta modalidad como efectiva y segura en cuanto a oxigenación y ventilación. Derdak et al.30 realizaron un estudio multicéntrico comparando una ventilación convencional (control-presión) con HFOV en 150 pacientes con criterios de SDRA. El principal objetivo, la disminución de la mortalidad a los 30 días, no llegó a ser significativo (HFOV 37% vs. VCP 52%, p=0,1). Se plantearon controversias en el resultado por no seguir las recomendaciones neumoprotectoras de la ARDS Network1 y que podría explicar la alta mortalidad en el grupo control. Se observó, sin embargo, una mejoría significativa del cociente PaO2/FiO2 en el grupo HFOV en las primeras 16 h (205 vs. 143mmHg; p<0,007), que posteriormente tendía a igualarse. En el estudio se incluyeron tratamientos alternativos (posición prono, óxido nítrico [NO] o corticoides a dosis altas) que eran añadidos en ambos grupos a decisión del médico responsable y que, en parte, podrían influir en los resultados. En el 2005, Bollen et al.31 realizan un estudio similar comparando HFOV con control-presión, pero ajustando los volúmenes corrientes, sin encontrar tampoco diferencias en la mortalidad a los 30 días (HFOV 43% vs. CV 33%; p=0,59). El estudio post hoc mostró que la alternativa terapéutica con HFOV podría disminuir la mortalidad en pacientes con un índice de oxigenación más deteriorado al inicio del tratamiento.
En resumen, se requiere de más estudios para catalogar la HFOV como una alternativa para mejorar la oxigenación frente a las modalidades convencionales, y sin datos concluyentes en la supervivencia. Siempre contando con maquinaria específica y centros con experiencia para su aplicación.
3Opciones no ventilatoriasLa aplicación de terapias no ventilatorias simultáneas puede ser de gran ayuda para mejorar la hipoxemia grave. Como alternativas se describen los relajantes musculares, los fármacos inhalados o con propiedades vasoactivas, la posición prono y las terapias de oxigenación extracorpóreas u otras estrategias de segunda línea, como la administración de corticoides.
Relajantes muscularesLa utilización de relajantes en el paciente hipoxémico persigue mejorar la sincronía paciente-ventilador ante una mecánica respiratoria deteriorada y a la que imponemos unas medidas neumoprotectoras. Su utilización resulta conflictiva al asociarse históricamente con el desarrollo de miopatía, por un lado, y reducir los beneficios de la respiración espontánea según diferentes modelos, por el otro.
Papazian et al. han realizado una serie de estudios controlados y aleatorizados que valoran los beneficios de los relajantes neuromusculares32-34. Con el mismo método, en pacientes con criterios de SDRA tratados bajo sedación profunda, compararon placebo frente a relajantes. En el 2004 analizaron la evolución de la oxigenación en los 2 grupos, constatando una mejoría mantenida y significativa en el grupo con relajantes frente al control. Se atribuyó el resultado a la mejoría de la distensibilidad torácica y a una disminución del consumo de O2. En el 200633, analizaron los marcadores inflamatorios a nivel sérico y pulmonar (lavados broncoalveolares), mostrando una amortiguación de la respuesta proinflamatoria (descenso de IL-1, IL-6 e IL-8) en el grupo de relajantes frente al control. En el 2010 se realiza un estudio multicéntrico34 incluyendo a 340 pacientes con una PaO2/FiO2 < 150 y comparando cisatracurio frente a placebo. No se llegó a demostrar una reducción de la mortalidad a los 90 días entre el grupo cisatracurio frente al control (31,6 vs. 40,7%; p=0,08), pero el modelo de regresión de Cox asociaba el cisatracurio a un efecto protector (RR = 0,68; IC del 95%, 0,48-0,98; p=0,04). El estudio post hoc mostró claros beneficios en pacientes con PaO2/FiO2< 120. Se demostró también una menor incidencia de barotrauma en el grupo cisatracurio (RR = 0,43; IC del 95%, 0,2-0,9; p=0,03) e igual incidencia de miopatía (64,3 vs. 68,5%; p=0,51). A pesar de la importante repercusión del estudio, existen dudas en su interpretación35. Los relajantes musculares se utilizaron solo las primeras 48 h y las diferencias de mortalidad, según la gráfica de Kaplan-Meier, se observaban a partir del 12.° día; la supervivencia fue superior a lo esperada para ambos grupos, lo que hacía perder potencia estadística, requiriendo una muestra superior (885 pacientes) para demostrar la diferencia de mortalidad. Se constató un mayor número de infracciones en las medidas neumoprotectoras para el grupo control que explicaba la mayor incidencia de barotrauma y, finalmente, se comparaba relajación frente a sedación profunda, hecho que impide extrapolar los beneficios de la ventilación espontánea25.
Por tanto, la utilización de relajantes musculares sugiere un mejor pronóstico. Sin embargo, persisten dudas sobre la interpretación de los mecanismos fisiológicos que intervienen, sin desacreditar los resultados. En todo caso, las guías recomiendan la utilización del sistema «tren de 4» para evitar sus efectos deletéreos.
Terapias farmacológicasExisten otros tipos de fármacos que, siguiendo diferentes mecanismos fisiológicos, pueden aportar beneficios en términos de incremento de oxigenación.
En los últimos 20 años se ha utilizado el óxido nítrico (NO) inhalado por su efecto vasodilatador pulmonar, optimizando el cociente ventilación-perfusión y mejorando la oxigenación. Sin embargo, su repercusión clínica y pronóstica no ha alcanzado el éxito esperado, siendo una técnica en desuso, que aún se aplica en situaciones extremas. La revisión de 5 estudios aleatorizados realizada por Sokol et al.36, con 535 pacientes, mostró una mejoría temporal de la oxigenación, aunque no mejoró la mortalidad. Otro metaanálisis37 de 12 estudios que englobaba a 1.237 pacientes no llegó a demostrar mejoría de la oxigenación ni de la supervivencia o días libres de VM. Por otro lado, sí se observó un riesgo aumentado de desarrollar insuficiencia renal aguda. El riesgo de intoxicación por niveles altos en sangre de metahemoglobinemia solo se observa con dosis superiores a 80ppm de NO, y los efectos terapéuticos se consiguen generalmente con dosis < 20ppm.
Una alternativa interesante al NO son las prostaciclinas inhaladas (epoprostenol, iloprost, treprostinil). Se engloban en el grupo de los prostanoides, metabolitos del ácido araquidónico sintetizados en el endotelio y con propiedades vasodilatadoras. Se utiliza la vía intravenosa en el tratamiento de la hipertensión pulmonar con insuficiencia cardiaca derecha. Presentan una vida media muy corta, por lo que deben ser administrados de forma continua y su metabolito tiene un efecto despreciable. Es conocido su efecto en la disfunción plaquetar, pero sin trascendencia clínica. Los pocos estudios sobre su utilización en el ARDS constatan la mejoría de la hipoxemia, sin llegar a mejorar el pronóstico38.
Decúbito pronoManiobra ampliamente implantada en numerosas unidades de cuidados intensivos para pacientes con altos requerimientos de oxígeno. Aunque en los estudios no se discute la mejoría de la oxigenación, resulta más complicado demostrar una mejoría en la supervivencia. El beneficio de la posición prono se basa en la inversión de las fuerzas gravitacionales, disminuyendo la presión pleural en las regiones dorsales. Ello conllevaría una mejoría de la ventilación de dichas zonas, el reclutamiento alveolar y la optimización del cociente ventilación-perfusión.
Los 2 estudios prospectivos realizados con mayor número de pacientes que trataron de demostrar una mejoría en la supervivencia son los de Gattinoni et al.39 y Guerin et al.40. En el estudio multicéntrico de Gattinoni et al., que englobó a 304 pacientes, se compararon 2 grupos, uno con tratamiento convencional y el otro con sesiones de prono (7 h diarias durante 10 días). La mortalidad fue la misma entre prono y supino a los 10 días (21,1 vs. 25%; RR = 0,84; IC del 95%, 0,56-1,27), al alta de la UCI (50,7 vs. 48%; RR = 1,05; IC del 95%, 0,84-1,32) y a los 6 meses (62,5 vs. 58,6%; RR = 1,06; IC del 95%, 0,88-1,28). Sí mejoró la oxigenación en el grupo prono y no se objetivaron diferencias en cuanto a úlceras por presión, pérdida de accesos venosos o retiradas accidentales de vías aéreas. El análisis post hoc mostró una disminución de la mortalidad en el prono frente al supino cuando la PaO2/FiO2< 88 y SAPS > 49 (23,1 vs. 47,2%; RR = 0,45; IC del 95%, 0,25-0,95). Las réplicas dadas al estudio fueron la utilización de VT > 10ml/kg, la inclusión tardía en prono y las pocas horas de sesiones de prono.
Guerin et al.40, en el 2004, incluyeron a 791 pacientes siguiendo el mismo método de Gattinoni (en este caso, 8 h diarias de prono). Tampoco observaron diferencias de mortalidad entre prono y supino a los 28 días (32,4 vs. 31,5%; RR = 0,97; IC de 95%, 0,79-1,19; p=0,7) y a los 90 días (43,3 vs. 42,2%; RR = 0,98; IC del 95%, 0,84-1,13; p=0,7). Tampoco cambiaron los días de VM (7,8 vs. 8,6 días; p=0,9). También constataron una mejoría de la oxigenación en el grupo prono, así como una menor incidencia de neumonía asociada al ventilador (1,66 vs. 2,14/100 pacientes día de intubación). En este estudio sí se demostró una mayor incidencia de complicaciones en el grupo prono, como la obstrucción del tubo endotraqueal, la intubación selectiva y las úlceras por presión. Aunque en este caso se respetó el VT, y la instauración del prono fue temprana, las sesiones y la aplicación total fueron cortas (8h/sesión durante 4 días de promedio). La inclusión de pacientes fue heterogénea y hubo un importante «crossover» de pacientes de un grupo a otro, hechos que podían interferir en las conclusiones.
En el 2005 el estudio multicéntrico de Mancebo et al.41 trata de soslayar los defectos de los estudios previos. El prono se realizó precozmente, durante 17 h por sesión y un promedio de 10 días, en pacientes con ALI o ARDS. De los 136 pacientes reclutados, se confirmaron en el grupo prono una menor FiO2 (p < 0,001), una mayor PaO2/FiO2 (p < 0,001) y menores niveles de VT (p < 0,01) y PEEP (p < 0,048). La mortalidad durante la estancia en la UCI no cambió entre grupos (prono 43% vs. supino 58%; p=0,12). Se constataron un total de 28 eventos no deseados en el prono, todos ellos reversibles y que no influyeron en el pronóstico. El estudio multicéntrico de Taccone et al.42, en el 2009, estableció 2 subgrupos, hipoxemia moderada (PaO2/FiO2 100-200mmHg) e hipoxemia grave (PaO2/FiO2 < 100mmHg) dentro del grupo prono (18 h/sesión, 8 días) y supino. La mortalidad a los 28 días y a los 6 meses entre los grupos no fue significativa (31 vs. 32,8%; RR = 0,97; IC del 95%, 0,84-1,13; p=0,7, y 47 vs. 52,3%; RR = 0,9; IC del 95%, 0,73-1,11; p=0,33, respectivamente). Los subgrupos tampoco mostraron diferencias a los 28 días para la hipoxemia moderada (25,5 vs. 22,5%; RR = 1,04; IC del 95%, 0,89-1,22; p=0,62), aunque sí una tendencia, no significativa, a una menor mortalidad en la hipoxemia grave para prono (37,8 vs. 46,1%; RR = 0,87; IC del 95%, 0,66-1,14; p=0,31). Las efectos adversos fueron significativamente mayores en el prono, constatándose al menos una complicación por paciente (159/168 [94,6%]) frente al supino (133/174 [76,4%]).
El análisis conjunto de los 4 estudios descritos realizado por Gattinoni et al.43 concluyó una reducción de mortalidad del 10% a favor del prono en aquellos casos de hipoxemia grave, aplicado precoz (primeras 72 h) y prolongadamente (> 16h/día). En cambio, en el grupo de hipoxemia moderada, el dudoso beneficio en la mortalidad frente a los riesgos de la extubación espontánea, la desconexión accidental de vías y las úlceras de decúbito empeoraba el balance riesgo-beneficio.
Simultáneamente, el metaanálisis de Sud et al.44 valoró la importancia del grado de hipoxia y el efecto del prono en la supervivencia. Comparó 10 estudios con alta calidad metodológica y homogeneidad, diferenciando hipoxemia moderada (PaO2/FiO2 > 100) y grave (PaO2/FiO2 < 100). El prono mejoró significativamente la supervivencia en la hipoxemia grave (RR = 0,84; IC del 95%, 0,74-0,96; p=0,01), necesitándose 11 pacientes en prono para evitar una muerte (IC del 95%, 6-50). Sin embargo, aumentó el riesgo de úlceras de decúbito (RR = 1,29; IC del 95%, 1,16-1,44), obstrucción del tubo endotraqueal (RR = 1,58; IC del 95%, 1,24-2,01) y salida accidental de drenajes (RR = 3,14; IC del 95%, 1,02-9,69).
En conclusión, el prono constituye una estrategia de rescate eficaz para mejorar la oxigenación. Numerosos datos avalan la posibilidad de influir en la supervivencia de los casos graves. Las complicaciones en el prono parecen mostrar una mayor incidencia, dependiendo directamente del tiempo de las sesiones y, probablemente, de la experiencia del equipo. Sin embargo, la ratio beneficio-riesgo se decanta a su aplicación en los pacientes más graves.
Sistemas extracorpóreosEl desarrollo de circuitos extracorpóreos, como la membrana de oxigenación extracorpórea (ECMO), se basa en tratar de disminuir el efecto de la lesión pulmonar inducida por la VM. En general, esta técnica se ha difundido en el tratamiento del distrés respiratorio neonatal o pediátrico, donde su eficacia está demostrada45. Sin embargo, pocos centros la aplican en la insuficiencia respiratoria del adulto, dado sus dudosos resultados. En el 2008, Schuerer et al.45 publicaron una revisión sobre indicaciones de utilización de la ECMO basadas en 145 centros a nivel mundial. A partir de entonces, se unificaron criterios de inclusión: fracaso respiratorio grave (PaO2/FiO2 < 100) bajo VM inferior a 7 días, en menores de 65 años y ausencia de comorbilidades importantes o contraindicación para la anticoagulación. Los resultados mostraban una supervivencia > 80% en el fracaso respiratorio neonatal y > 60-70% en el pediátrico. En los adultos, sin embargo, no superaba el 40%. En el caso de la insuficiencia cardiaca los resultados eran poco alentadores, independientemente de la edad (supervivencia del 30-40%).
El estudio CESAR, de Peek et al.46, comparó el tratamiento convencional en SDRA frente a ECMO. Intervinieron 103 hospitales y se reclutó a 180 pacientes, la mitad en cada rama. Los pacientes aleatorizados al grupo ECMO eran transferidos al hospital coordinador. La supervivencia a los 6 meses fue superior en la ECMO (63 vs. 47%; RR = 0,69; IC del 95%, 0,05-0,97; p=0,03). Existen, sin embargo, dudas metodológicas dado que la adherencia a las medidas neumoprotectoras fue mayor en el centro coordinador y se combinaban otras terapias que podían influir en los resultados, como HFOV, prono o NO.
En el 2009, Nehra et al.47 analizaron los resultados de 81 pacientes que recibieron ECMO entre 1990 y 2008. La supervivencia general fue del 53% y, al subdividir los resultados por afección, fue mejor en neumonías vírica o bacteriana (el 78 y el 53%, respectivamente), frente a traumáticos o quemados (33%). Aunque no englobó a neonatos, el promedio de edad fue de 23 años (entre 2 meses y 61 años). Por grupos de edad, la supervivencia fue alta hasta los 9 años (72%), seguida por el 62% entre los 30 y los 39 años, y solo del 40% en > 40 años. La mortalidad era mayor en los fracasos multiorgánicos frente al fracaso respiratorio único (60 vs. 33%).
La SEMICYUC colaboró en la elaboración de un registro de pacientes con ECMO durante la epidemia de gripe A-H1N148. De los 239 pacientes registrados en 148 UCI, solo se aplicó ECMO en 9 pacientes (4%) y de forma precoz (4,5 días de VM). Cuatro fallecieron durante la técnica, uno tras retirarla por mejoría pero con complicaciones posteriores, y otros 4 sobrevivieron (44%). El mayor sesgo del estudio es el bajo número de pacientes, aunque los estudios internacionales presentan resultados similares en supervivencia y complicaciones.
En conclusión, se trata de una técnica de difícil implantación, costosa y que requiere de una importante infraestructura (hospitales de tercer nivel). A esto se suma una supervivencia no claramente superior a técnicas más asequibles en cualquier centro.
Terapia corticoideaLos corticoides continúan generando controversia por sus potenciales efectos deletéreos sobre la atrofia muscular y/o el aumento de infecciones.
Meduri et al.49 comenzaron a tratar el SDRA en las primeras 72 h, durante 28 días con metilprednisolona. Al 7.° día constataron un mayor éxito de extubación frente al control (53,9 vs. 25%; p=0,01), menos días de VM, menor estancia en la UCI, menor mortalidad (20,6 vs. 42,9%; p=0,03) y mejor cociente PaO2/FiO2 (256 vs. 179mmHg; p=0,006). Atribuyeron los resultados a la atenuación de la respuesta inflamatoria inducida por los corticoides. El estudio de la ARDS Network50 comparó metilprednisolona y placebo a partir del 7.° día de distrés, observando pros y contras. Se constató una mejoría de la oxigenación, días libres de VM y requerimientos de fármacos vasoactivos. Aumentó la atrofia muscular y no mejoró la supervivencia ni a los 60 ni a los 180 días, incluso disminuyó en aquellos que se comenzaban a tratar a partir de los 14 días de iniciado el distrés. Por último, el metaanálisis de Tang et al.51 analizó 9 estudios que utilizaron corticoides en el distrés, mostrando un RR de mortalidad inferior al administrar corticoides (RR = 0,62; IC del 95%, 0,43-0,91; p=0,01). La estancia en la UCI, los días de VM, el número de infecciones o el fracaso multiorgánico fueron menores en el grupo de corticoides, sin detectarse una mayor incidencia de miopatía.
Los datos sugieren que si se decide la utilización de corticoides, sus beneficios son posibles solo si se comienza precozmente, de lo contrario, los resultados pueden ser negativos.
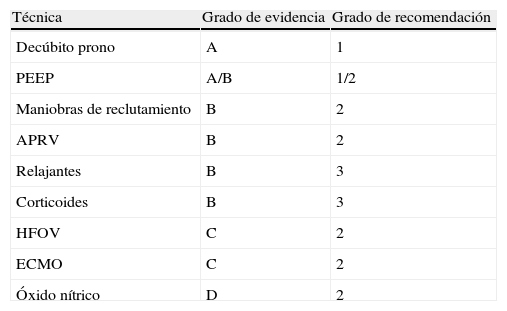
4ConclusiónLa hipoxemia refractaria supone la fase más avanzada del SDRA, en el que el riesgo vital sugiere recurrir a medidas de rescate agresivas. Tanto en los tratamientos ventilatorios, piedra angular del tratamiento, como en los no ventilatorios, el objetivo fundamental es la mejoría de la oxigenación y del equilibrio ventilación-perfusión, aumentando la superficie de intercambio. La tabla 1 muestra los grados de recomendación para cada una de las técnicas sobre la base de los estudios analizados.
Escala GRADE de estimación de recomendaciones
| Técnica | Grado de evidencia | Grado de recomendación |
| Decúbito prono | A | 1 |
| PEEP | A/B | 1/2 |
| Maniobras de reclutamiento | B | 2 |
| APRV | B | 2 |
| Relajantes | B | 3 |
| Corticoides | B | 3 |
| HFOV | C | 2 |
| ECMO | C | 2 |
| Óxido nítrico | D | 2 |
Grado de evidencia: A, alto; B, moderado; C, bajo; D, muy bajo.
Grado de recomendación: 1, mayoría de especialistas elegirían esta opción; 2, muchos especialistas elegirían esta opción pero otra proporción sustancial; 3, se recomienda, según consenso, pero prevalece criterio individual.
En conclusión, a la hora de abordar al paciente crítico con hipoxemia refractaria y riesgo vital, se deben considerar todas las opciones, dependiendo siempre de la experiencia clínica del centro y la disponibilidad de recursos, buscando siempre el principio de «primum non nocere».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Mientras estaba pendiente de publicación este artículo han sido presentados dos estudios importantes. El primero, de Guerin et al. (ESICM Congress 2012), demuestra una mejoría muy significativa de la mortalidad en el SDRA grave con el decúbito prono. El segundo, de Ferguson et al. (NEJM. 2013 Jan 22 [Epub ahead of print]), no consigue mejorar la supervivencia del SDRA con ventilación oscilatoria de alta frecuencia.