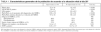INTRODUCCIÓN
Desde que Ashbaugh et al1 describieron por primera vez el síndrome de distrés respiratorio en adultos en 1967 y se publicaron los primeros casos en España por nuestro centro2, múltiples estudios han intentado determinar su incidencia, describir los principales factores de riesgo o etiologías implicadas en su desarrollo y las variables que se asocian a una mayor mortalidad.
Pero la ausencia de una definición concreta y aceptada del síndrome hizo que los resultados de los primeros estudios realizados fueran dispares según la definición empleada. En 1994, la Conferencia de Consenso Europeo-Norteamericana desarrolló la actual definición del síndrome de distrés respiratorio agudo (SDRA)3. Ello ha permitido una unificación de criterios diagnósticos que a su vez conlleva la homogeneización en las cohortes de los estudios, haciendo posible su comparación. Pese a la unificación en cuanto al criterio diagnóstico, los estudios siguen aportando resultados dispares en cuanto a las variables que caracterizan esta entidad. Estudios recientes sitúan la incidencia del SDRA entre el 1,6% y el 7,7% de los pacientes ingresados en unidades de críticos4,5, entre el 8% y el 19,7% de los pacientes que requieren ventilación mecánica4-7 y entre 17 y 26 casos por 100.000 personas/año cuando nos referimos a la población general8.
Aunque la frecuencia de SDRA podría no parecernos alarmante, las cifras son muy elevadas cuando nos referimos a la mortalidad, que oscila entre el 25%-31% según sea dentro del propio Servicio de Medicina Intensiva (SMI) o en el hospital de acuerdo a los resultados del último estudio de la ARDSNet9, hasta el 58% en otras series4,5,7,10,11.
Se han reportado resultados contradictorios en las diferentes series sobre algunos factores pronósticos como el papel que desempeña el grado de hipoxemia5,7,12; muchos estudios la sitúan como una causa secundaria de muerte12-14, con un porcentaje atribuible que oscila entre el 9% y el 16%.
Dados los resultados dispares y habiendo realizado previamente estudios con menos pacientes13, decidimos analizar una amplia población de pacientes críticos con SDRA ingresados en nuestro centro con un doble objetivo: determinar la frecuencia de aparición y la mortalidad asociada a esta patología en un grupo homogéneo de pacientes.
PACIENTES Y MÉTODOS
Población de estudio
El estudio se llevó a cabo en las áreas de críticos de un hospital universitario de tercer nivel. A lo largo de cinco años, desde enero de 1998 a febrero de 2003, se analizaron todos los pacientes que ingresaron en el SMI del Área General del hospital, que dispone de una unidad polivalente de 32 camas en la que no se incluyen enfermos coronarios pero sí algunos operados de cirugía cardíaca complicada. Desde el año 2002 se incorporó al estudio el SMI del Área de Traumatología, que dispone de 10 camas especializadas.
Criterios de selección de pacientes
Se analizó diariamente a todos los pacientes ingresados en ambos SMI por parte de un grupo de 4 facultativos, incluyendo en el estudio aquellos que cumplían los criterios de la Conferencia de Consenso Europeo-Norteamericana para el SDRA3: insuficiencia respiratoria aguda con relación PaO2/FIO2 ≤ 200 mmHg (independientemente del nivel de presión positiva al final de la espiración [PEEP]), con infiltrados radiológicos bilaterales y presión de enclavamiento pulmonar ≤ 18 mmHg o ausencia de clínica compatible con insuficiencia cardíaca izquierda.
Variables registradas
En el momento que cumplían todos los criterios de SDRA se iniciaba la recogida de los datos de los pacientes que proseguía hasta el momento del alta del SMI. Se calculaba la puntuación de APACHE II a las 24 horas de ingreso en el SMI14 y el Lung Injury Score (LIS) durante la evolución del SDRA15. Se obtuvo información sobre los siguientes aspectos: origen del SDRA (intra o extrapulmonar), etiología del SDRA (neumonía, broncoaspiración, sepsis abdominal, sepsis urinaria, inhalación de humos y politransfusión), parámetros ventilatorios (tipo de ventilación mecánica usada, volumen tidal [Vt] medio y presión plateau media durante el período hipoxémico entendido como los días con relación PaO2/FIO2 < 200 mmHg, duración de la hipoxemia, relación PaO2/FIO2 en el momento del diagnóstico del SDRA (después de la intubación en los pacientes sometidos a ventilación mecánica invasiva), duración de la ventilación mecánica, desarrollo de alguna de las siguientes complicaciones durante la evolución: barotrauma (neumotórax visible en la radiografía de tórax con o sin necesidad de drenaje), sobreinfección respiratoria bien sea en forma de traqueobronquitis o neumonía16, necesidad de soporte vasoactivo, necesidad de depuración extrarrenal, así como medidas terapéuticas empleadas para tratar la hipoxemia (tratamiento con óxido nítrico inhalado, aplicación de decúbito prono, corticoides). Se consideró síndrome de disfunción multiorgánica (SDMO) a la presencia de disfunción de tres o más órganos y se calculó el índice Sequential Organ Failure Assessment (SOFA) en el momento del diagnóstico del SDRA y durante cada día de su evolución17. Se recogió la mortalidad a los 28 días y la mortalidad hospitalaria.
Análisis estadístico
La variable principal analizada fue la mortalidad a los 28 días. Las variables se expresan como media ± desviación estándar (DE), excepto en aquellos casos en que mostraron una marcada dispersión, como la estancia en Unidad de Cuidados Intensivos (UCI), en que se expresan como mediana (rango). Se utilizó la prueba de Chi cuadrado para variables cualitativas y la prueba t de Student para variables cuantitativas. Se consideró significativo un valor de p < 0,05. Se realizó el estudio univariante de las variables en las que se demostró diferencias significativas entre supervivientes y no supervivientes, estableciendo un punto de corte en el valor medio obtenido de cada variable. Adicionalmente se realizó un análisis de regresión logística mediante el procedimiento de forward stepwise para poder evaluar las variables asociadas de manera independiente con la mortalidad a los 28 días. Se seleccionaron inicialmente aquellas variables que resultaron significativas en el análisis univariante y se mantuvieron en el modelo aquéllas con un valor de significación < 0,1. Se presentan los resultados en forma de odds ratio (OR) e intervalos de confianza al 95% (IC 95%).
RESULTADOS
A lo largo del período de estudio ingresaron 5.618 pacientes en el SMI, de los que 191 (3,4%) cumplieron criterios de SDRA. La edad media de estos pacientes fue de 56 ± 17 años, un 64% eran varones, y tuvieron una mediana de estancia en el SMI de 20 días (rango: 1-218).
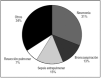
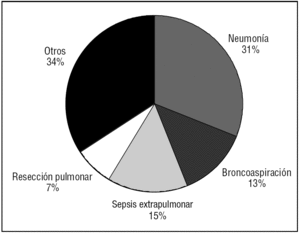
La principal etiología del SDRA fue la neumonía, ya sea comunitaria o asociada a la ventilación mecánica (NAV), que fue responsable de 61 (31,9%) casos, seguida de la sepsis abdominal (15,2%) y de la aspiración del contenido gástrico (13,1%) (fig. 1). El origen del SDRA fue intrapulmonar en 120 (63%) pacientes y secundario a causas sépticas (intra o extrapulmonares) en 126 (66%) pacientes.
Figura 1. Etiología del síndrome de distrés respiratorio agudo.
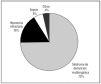
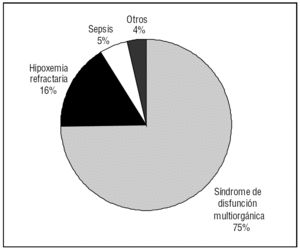
La mortalidad en el día 28 de seguimiento fue del 48% (92/191) y la mortalidad hospitalaria aumentó hasta el 58% (111/191). La principal causa de muerte fue la disfunción multiorgánica en un 75% de los casos (84 pacientes) (fig. 2).
Figura 2. Principales causas de muerte.
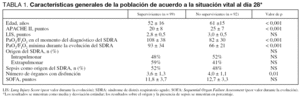
Las características generales de la población estudiada, comparando supervivientes y no supervivientes, se muestran en la tabla 1. Los pacientes no supervivientes tuvieron mayor edad, mayor deterioro de la oxigenación y mayor gravedad que los pacientes que sobrevivieron.
En la evolución tan sólo 9 (4,7%) pacientes presentaron barotrauma; 49 (25,6%) pacientes presentaron sobreinfección respiratoria (en 31 casos se trató de traqueobronquitis mientras que en los restantes 17 casos se consideró que presentaban criterios de NAV). Ni el hecho de presentar barotrauma ni el de presentar sobreinfección respiratoria, ya sea en forma de traqueobronquitis o neumonía, implicó un peor pronóstico.
Los pacientes que fueron tratados con óxido nítrico inhalado (26%) presentaron una mortalidad superior (59% frente al 41%; p < 0,001), si bien era una población marcadamente más grave. No apreciamos diferencias en la mortalidad en el grupo de pacientes en los que se aplicó decúbito prono. El grupo de pacientes tratados con corticoides (24%) presentó una mortalidad inferior (29% frente al 45%; p = 0,003).
En cuanto a cómo se ventiló mecánicamente a estos pacientes, se observó a lo largo de los años una tendencia a limitar más las presiones de vía aérea usando un Vt cada vez más bajo. Durante todo el período estudiado, las presiones plateau medias fueron ≤ 30 cmH2O y el Vt ≤ 9 ml/kg de peso ideal. No hemos detectado ninguna diferencia significativa entre la presión plateau y el Vt usado a lo largo de los cinco años de estudio. Este hecho, a su vez, tampoco ha determinado ninguna diferencia en la mortalidad a lo largo del período de estudio.
Respecto a los modos de ventilación mecánica, si bien durante los primeros años del estudio prácticamente la totalidad de los pacientes eran ventilados en volumen control, el número global de pacientes ventilados en presión control fue del 19% durante todo el período que duró el estudio, aunque es básicamente en los últimos 24 meses cuando la modalidad de ventilación por control de presión se empleó en el 69% de los pacientes.
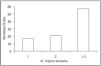
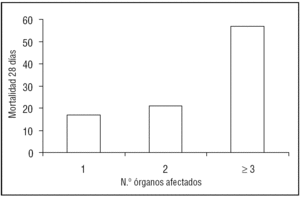
Los 147 (77%) pacientes que presentaron disfunción multiorgánica, entendida como disfunción de tres o más órganos, tuvieron una mortalidad significativamente mayor (57% frente al 19%; p < 0,01), aunque no se constataron diferencias significativas cuando tuvimos en cuenta el momento de aparición del fallo multiorgánico. Es decir, no había diferencias en cuanto a la mortalidad de los pacientes que presentaban SDMO en el momento del diagnóstico del SDRA en comparación con los que lo presentaron a lo largo de su evolución. Asimismo, se aprecia un aumento de la mortalidad a medida que aparece afectación de un mayor número de órganos (fig. 3). Al analizar los fallos por separado de los distintos órganos y sistemas, los pacientes con insuficiencia renal o insuficiencia hematológica presentaron significativamente mayor mortalidad. No se encontraron diferencias significativas cuando se analizó la puntuación de los pacientes obtenida a través del sistema SOFA, pero sí cuando teníamos en cuenta el número de órganos fracasados (tabla 1).
Figura 3. Mortalidad a los 28 días según número de órganos afectados, presentando o no síndrome de disfunción multiorgánica (< ó ≥ 3 disfunciones orgánicas).
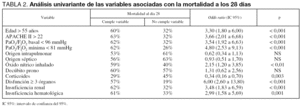
En el análisis univariante, las variables que se asociaron a una mayor mortalidad de manera estadísticamente significativa fueron: edad > 55 años, APACHE II > 22, relación PaO2/FIO2 basal < 96 mmHg, relación PaO2/FIO2 mínima durante la evolución del SDRA < 81 mmHg, la presencia de disfunción multiorgánica (fig. 3), insuficiencia renal, insuficiencia hematológica y tratamiento con óxido nítrico inhalado. No obstante, el tratamiento con corticoides a partir del décimo día de evolución cuando persiste la hipoxemia mostró un efecto protector sobre la mortalidad de estos pacientes (tabla 2).
Sin embargo, al efectuar el análisis multivariante, sólo siguen manteniendo significación en relación a la mortalidad a los 28 días la relación PaO2/FIO2 mínima, el APACHE II y el presentar disfunción multiorgánica (tabla 3).
DISCUSIÓN
La incidencia de SDRA varía según los diferentes estudios realizados, que a su vez consideran diferentes definiciones de SDRA, con diferentes poblaciones de pacientes. Un 3,4% de los pacientes de nuestro SMI cumplían los criterios de SDRA del último consenso, cifra que se acerca bastante al 2%-3% que reportaron Esteban et al en un estudio multicéntrico prospectivo18. En otros estudios la incidencia fue claramente mayor, como por ejemplo el 6,1% observado en un reciente estudio multicéntrico que se realizó durante 2 meses en 78 UCI11, el 7,7% del estudio de Roupie et al7, el 7% de una serie de 217 pacientes publicada por Estenssoro et al5, o el 9% estimado por Esteban et al en otro estudio multicéntrico que incluía 5.183 pacientes ventilados mecánicamente6.
La etiología más frecuente fue la sepsis, al igual que en la mayoría de las series publicadas7,19. El origen intrapulmonar fue más frecuente que el extrapulmonar, aunque a diferencia de algunas series20, nosotros no apreciamos diferencias significativas en cuanto a la mortalidad.
Cuando analizamos las medidas de gravedad, tanto de la lesión pulmonar como de la agresión sistémica, a través de las puntuaciones en APACHE II y LIS, obtuvimos resultados opuestos. Así pues, un incremento en el LIS no se asoció a un incremento en la mortalidad de nuestros pacientes. Resultados similares son los que presentaron Doyle et al19 y Zileberberg et al10 en sus estudios. Por el contrario, sí que evidenciamos un aumento en la mortalidad de manera significativa en aquellos pacientes con un APACHE más alto. Los estudios realizados hasta la fecha ofrecen resultados contradictorios en este aspecto, pudiendo encontrar resultados en el mismo sentido que nuestro estudio10,21 o en sentido contrario22. Otros estudios han usado otros marcadores de gravedad de la afectación sistémica, encontrando una asociación entre, por ejemplo, el SAPS II y la mortalidad de los pacientes con SDRA11. En nuestra serie, a diferencia de otras series, hemos constatado que el grado de oxigenación medido como la relación PaO2/FIO2 tanto en el momento del diagnóstico del SDRA como el valor mínimo obtenido durante la evolución, es un factor pronóstico. Sin embargo, el LIS no se ha mostrado como un índice pronóstico, probablemente por la dispersión que el efecto de la PEEP aporta pero que sorprendentemente no afecta al índice PaO2/FIO2. Sin embargo, un resultado parecido se ha constatado por otros grupos como el de Brochard23.
Un hecho destacable fue la baja incidencia de barotrauma, que en nuestra serie se situó en un 4,7%, a diferencia de otras series en las que la incidencia llegó a ser del 13,3% en pacientes no traumáticos11. El escaso número de pacientes que presentaron barotrauma hace que, probablemente, éste sea el motivo por el cual no se detectan diferencias significativas en cuanto a la mortalidad, y lo relacionamos con la ventilación protectora que venimos utilizando desde 199824,25.
Otro hecho importante fue la baja incidencia de sobreinfección respiratoria en nuestra serie, afectando a 49 (26%) pacientes. Su presencia no implicó un peor pronóstico. No hubo diferencias en el pronóstico de los pacientes en función del tipo de sobreinfección. El porcentaje fue mayor en otras series26. Esta variabilidad viene motivada por la dificultad en el diagnóstico de NAV en pacientes con infiltrados radiológicos bilaterales previos27.
El uso de corticoides en pacientes con SDRA no resuelto a partir de los 10 días de hipoxemia es una práctica parcialmente aceptada desde el estudio de Meduri et al28. El hecho de que los pacientes de nuestra serie que recibieron tratamiento con corticoides presentaran una mortalidad significativamente menor coincide con los resultados de los estudios realizados hasta la fecha, si bien este resultado debe tomarse con reserva al no ser un estudio diseñado con este fin.
Si bien estudios realizados han demostrado el efecto beneficioso que el óxido nítrico inhalado tiene sobre la oxigenación y la hemodinámica pulmonar en la fase aguda del SDRA29, ninguno ha conseguido demostrar una disminución en la mortalidad de los pacientes tratados. Pese a que en la reciente Conferencia de Consenso sobre el tratamiento con óxido nítrico inhalado en adultos en fase de publicación no se recomienda su uso rutinario en pacientes con SDRA, dado sus efectos fisiológicos, sí que se considera razonable su aplicación, como medida de rescate, en pacientes que presentan hipoxemia refractaria30.
La mortalidad a los 28 días observada en nuestra serie de pacientes fue del 48%, ascendiendo hasta el 58% cuando nos referíamos a la mortalidad hospitalaria. Recientemente la ARDSNetwork ha publicado un estudio en el cual se comparaban dos estrategias ventilatorias en pacientes con SDRA, una con PEEP alta y la otra con PEEP baja, y los resultados muestran una mortalidad que oscilaba en ambos grupos entre el 25%-31%. Pero, por regla general, esta mortalidad queda muy lejos de la que se constata en estudios de carácter observacional, como los de Zileberberg et al10 y Estenssoro et al5, con criterios de inclusión de pacientes mucho menos estrictos y donde la mortalidad llega a ser del 58%. Al igual que en la gran mayoría de las series publicadas, la principal causa de muerte en nuestros pacientes fue la disfunción multiorgánica, con más de tres cuartas partes de los casos, mientras que el porcentaje de pacientes que fallecen fundamentalmente a causa de hipoxemia refractaria estaba entorno al 16%5.
Después de numerosos intentos por esclarecer el papel pronóstico del grado de hipoxemia, los resultados dispares entre los diferentes estudios realizados hasta la fecha hacen que aún genere ciertas dudas. El estudio ALIVE11 mostró cómo la mortalidad de los pacientes con lesión pulmonar aguda y SDRA aumentaba a medida que disminuía la relación PaO2/FIO2; pese a ello no pudo encontrar un punto de corte que mostrara un claro interés pronóstico. Más estudios han mostrado una asociación directa entre el grado de hipoxemia, con diferentes puntos de corte en la relación PaO2/FIO25,7,12,19, y la mortalidad, mientras que otros no lo han conseguido4. En nuestra serie, si bien el LIS no se mostró como un marcador pronóstico, el grado de hipoxemia analizado como la relación PaO2/FIO2 sí que lo fue, con un punto de corte si analizábamos la PaO2/FIO2 basal de 96 mmHg, o si nos referíamos a la PaO2/FIO2 mínima en la evolución del SDRA de 81 mmHg. Creemos que aunque un 16% de mortalidad por hipoxemia es un porcentaje bajo, obliga a seguir trabajando en este punto para tratar de rescatar a estos pacientes al igual que se hace en otros campos como el de la sepsis, por lo que ensayos clínicos con surfactante pulmonar, oxigenación extracorpórea u otras terapias están plenamente justificados.
Es en el análisis multivariante donde comprobamos que la relación pronóstica de estos pacientes está claramente relacionada con el grado de hipoxemia ya no basal, sino extrema durante su evolución, pero también con el grado de gravedad sistémica (APACHE II y disfunción multiorgánica).
En resumen, en nuestra población de pacientes, la incidencia observada de SDRA fue del 3,4% con una mortalidad a los 28 días que llegó hasta el 48%, siendo la disfunción multiorgánica la principal causa de muerte, aunque un 16% fallecieron por hipoxemia refractaria. Los pacientes que presentaron mayor mortalidad fueron fundamentalmente los más graves, tanto a nivel pulmonar como sistémico, sin constatar un claro papel de alguno de los medios terapéuticos utilizados, aunque el diseño de este estudio no era su fin. También se constató un posible efecto protector de los corticoides, aunque harían falta más estudios específicamente diseñados para definir exactamente el papel que podrían desempeñar en la evolución de esta patología.
Así pues, el SDRA es una entidad cuyo pronóstico depende no sólo de la afectación pulmonar, sino también del grado de afectación sistémica. Pese a una incidencia no muy alarmante, es una patología que aún presenta una elevada mortalidad y sobre la que debemos seguir investigando en relación a los tratamientos, tanto sistémicos como pulmonares, que puedan modular su evolución.
AGRADECIMIENTOS
Agradecemos al Dr. Ferran Torres por la inestimable ayuda y colaboración en el soporte estadístico que nos ha proporcionado para el análisis de los resultados.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses
*Red GIRA G03/63. Instituto de Salud Carlos III. Ministerio de Sanidad.
Manuscrito aceptado el 26-VIII-2005.
Correspondencia: Dr. O. Roca i Gas.
Servei de Medicina Intensiva. Àrea General.
Hospital Universitari Vall d'Hebron.
Passeig de la Vall d'Hebron, 119-129.
08035 Barcelona. España.
Correo electrónico: 36416org@comb.es