El aturdimiento miocárdico ha sido definido como una disfunción miocárdica reversible y autolimitada que persiste tras la reperfusión miocárdica en ausencia de una lesión irreversible, o tras la restauración normal o casi normal del flujo coronario. Es una complicación clásica y muy conocida en los pacientes con enfermedad isquémica cardíaca1-3. No obstante, en la actualidad se está extendiendo y generalizando su diagnóstico a otras formas de disfunción cardíaca no relacionadas con una isquemia miocárdica, sino aparecidas en el contexto de una patología crítica, como el asma, la pancreatitis, el politraumatismo, etc.4-7. La aparición de disfunción miocárdica en el contexto de una patología neurológica grave se considera en la actualidad un nuevo síndrome, conocido con el nombre de aturdimiento miocárdico neurogénico6.
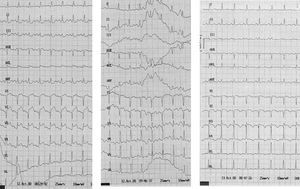
Desde la década de los cincuenta se conoce la asociación entre la patología neurológica aguda y ciertas alteraciones electrocardiográficas8, algunas de ellas muy inespecíficas, como cambios de la onda P, acortamiento del espacio PR, alargamiento del intervalo QTc, inversión de la onda T, alteraciones del segmento ST, grandes ondas U, o aparición de ondas Q9,10. Estos hallazgos electrocardiográficos han sido imputados a la propia patología cerebral aguda, descartándose un origen intrínsecamente cardiológico. Más recientemente se ha descrito la existencia de una disfunción ventricular reversible como complicación de la patología cerebrovascular aguda, en especial en pacientes con hemorragia subaracnoidea aguda11-19, infarto cerebral isquémico20, hematoma subdural21, traumatismo craneoencefálico y epilepsia22, tras la terapia con electroshock23, el síndrome de Guillain-Barré24, las metástasis cerebrales25 y la cuadriplejia26. En todos estos casos se ha detectado una disfunción miocárdica que se hace reversible en los supervivientes en un tiempo variable15. Esta disfunción suele ser un hallazgo encontrado al realizar una ecocardiografía y, en menor medida, una ventriculografía, buscando signos sugerentes de cardiopatía isquémica que justificaran las alteraciones electrocardiográficas. Con ambos modos diagnósticos se observan alteraciones de la contractilidad global o segmentaria. La alteración de la contractilidad segmentaria puede afectar a cualquier zona del ventrículo izquierdo, y en especial a nivel anterior, septal y apical, produciéndose una disfunción sistólica con fracciones de eyección del ventrículo izquierdo que oscilan entre un 10% y un 50%, y también ha sido descrita, con mucha menor frecuencia, la disfunción ventricular derecha15-24. Los trastornos de la contractilidad podrían afectar a entre un 8% y un 9,4% de los pacientes con hemorragia subaracnoidea u otra lesión cerebral grave27. Zaroff et al14 encuentran que esta disfunción miocárdica afecta con más frecuencia a mujeres (77%) y se asocia al tabaquismo y a la hipertensión arterial. Frecuentemente se acompaña de un incremento de creatincinasa (CK) (en especial la fracción MB)19, o de troponina19-21,28, hecho que podría estar en relación con una disfunción miocárdica cardiotóxica con generación de necrosis miocárdica. Esta disfunción miocárdica con trastornos de la contractilidad segmentaria se suele acompañar de alteraciones electrocardiográficas inespecíficas, pero habitualmente coincidentes con el segmento afectado, como alargamiento o alteraciones de la dispersión del intervalo QT, inversión o elevación picuda de la onda T, o cambios del segmento ST, especialmente elevación, bloqueo auriculoventricular, bloqueo sinoauricular, e incluso trastornos de conducción interventriculares o hemibloqueos8-28. Kono et al13 estudiaron la relación existente entre los hallazgos electrocardiográficos y las anormalidades de la contractilidad segmentaria de los pacientes con hemorragia subaracnoidea, comparando a 7 pacientes que mostraban ascenso del segmento ST en V4-V6 con 5 pacientes sin ascenso del segmento ST. Los autores encontraron que los pacientes con ascenso del segmento ST mostraban alteración de la movilidad en la zona apical, y la elevación del segmento ST se podía mantener mientras existiera alteración de la contractilidad segmentaria. Mayer et al15 realizaron electrocardiografía (ECG) y ecocardiografía a 57 pacientes con hemorragia subaracnoidea sin enfermedad cardíaca previa, y encontraron que un 8% presentaba disfunción miocárdica con alteración segmentaría de la contractilidad del ventrículo izquierdo, y que existía una asociación entre disfunción miocárdica y determinados hallazgos electrocardiográficos, concretamente la inversión simétrica de la onda T y el incremento del QTc por encima de 500 mseg, reportando una sensibilidad del 100% y una especificidad del 81% para el diagnóstico de alteración de la contractilidad si existían los mencionados hallazgos electrocardiográficos. Estos cambios electrocardiográficos asociados a la disfunción miocárdica neurogénica pueden presentar un patrón evolutivo que simula la aparición de un infarto agudo de miocardio, aunque cuando han sido realizadas coronariografías siempre han resultado normales (fig. 1).
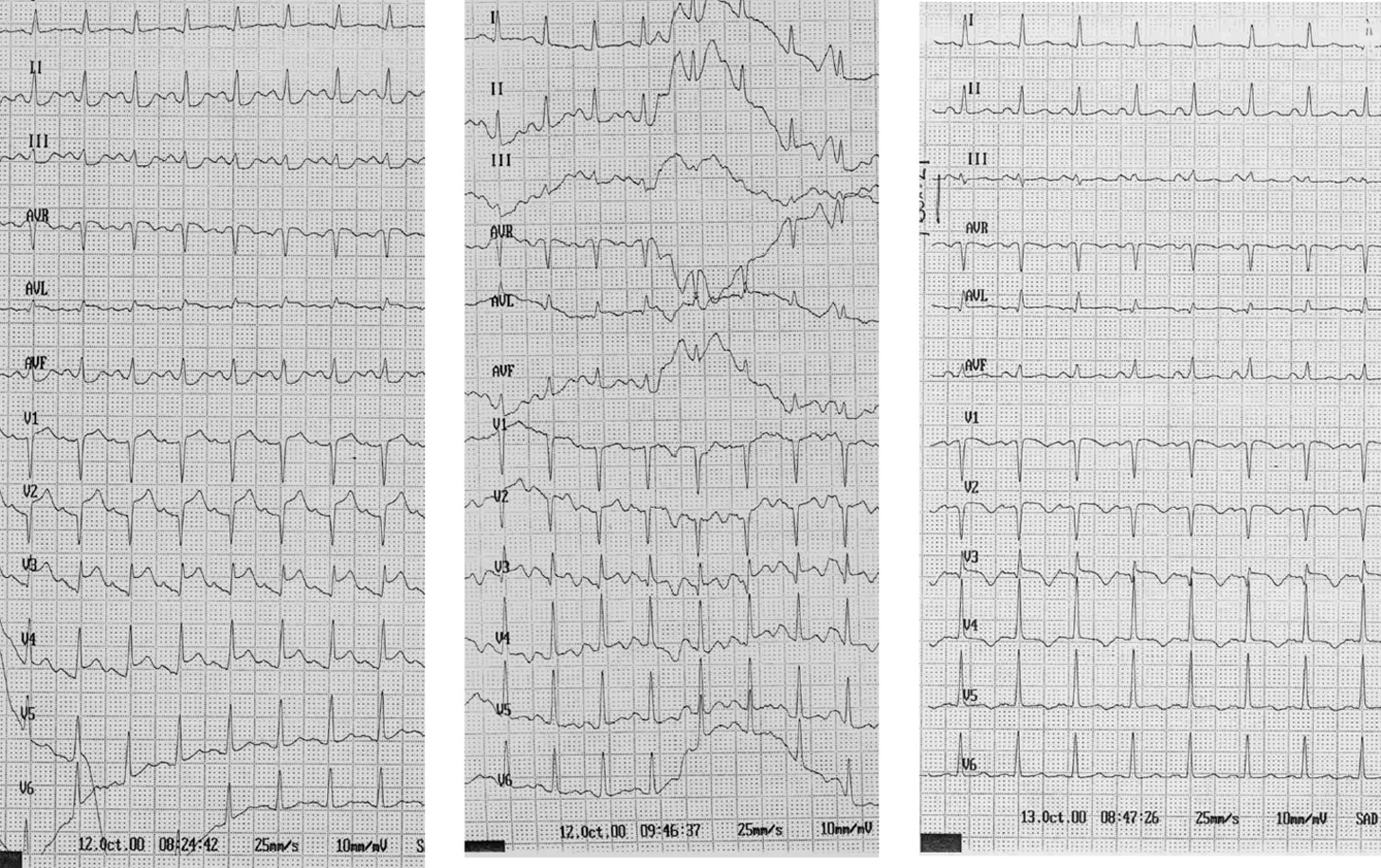
Figura 1. Paciente de 30 años con una hemorragia subaracnoidea aguda. El electrocardiograma realizado en la primera hora de evolución muestra elevación del segmento ST en V1-V4 y descenso del segmento ST en II, III y AVF, en ausencia de dolor torácico (izquierda). A los 90 minutos se observaba normalización del segmento ST (centro). A las 24 horas se observaba inversión de ondas T en derivaciones precordiales (derecha). La ecocardiografía mostró una disfunción ventricular izquierda sistólica grave con hipoquinesia global. La coronariografía resultó normal.
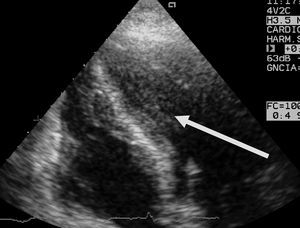
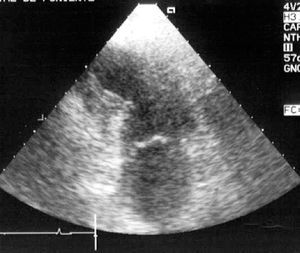
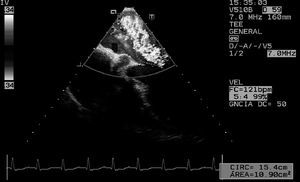
Aparte de la heterogeneidad de las distintas descripciones, de todos los estudios publicados se desprende que en presencia de patología neurológica grave se puede producir una disfunción miocárdica con una incidencia desconocida, pero que podría estar en torno al 9%, que mejora habitualmente en la primera semana, y es reversible en la mayoría de los supervivientes entre el primer y el sexto mes. Aunque la causa del fallecimiento es dependiente de la propia patología cerebral, dicha disfunción miocárdica reversible puede contribuir a la mortalidad, o al menos incrementar la morbilidad al poder cursar con complicaciones tales como arritmias potencialmente letales15,29, hipotensión arterial, edema pulmonar15,29, hipoxemia13-21, que podrían potenciar las lesiones cerebrales secundarias, así como formación de trombos intracavitarios en el ventrículo izquierdo12,14,15,18 que podrían provocar embolias15 (fig. 2). Por otra parte, esta disfunción miocárdica puede ser una causa directa del edema neurogénico o al menos contribuir a su desarrollo, ya sea por la propia disfunción ventricular sistólica o por otras complicaciones asociadas, tales como una insuficiencia mitral grave (figs. 3 y 4).
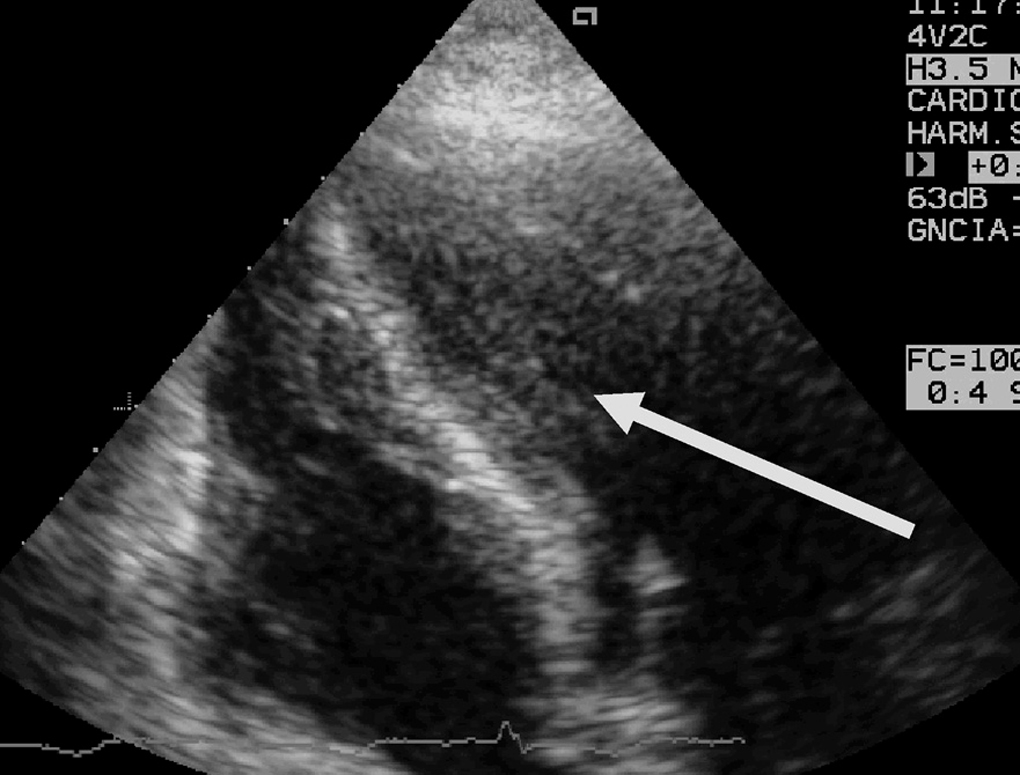
Figura 2. Ecocardiografía transtorácica, plano apical 4 cámaras, donde puede observarse una imagen de trombo y ecocontraste espontáneo en el ventrículo izquierdo de un paciente de 21 años con hemorragia subaracnoidea e hipoquinesia ventricular izquierda global grave.
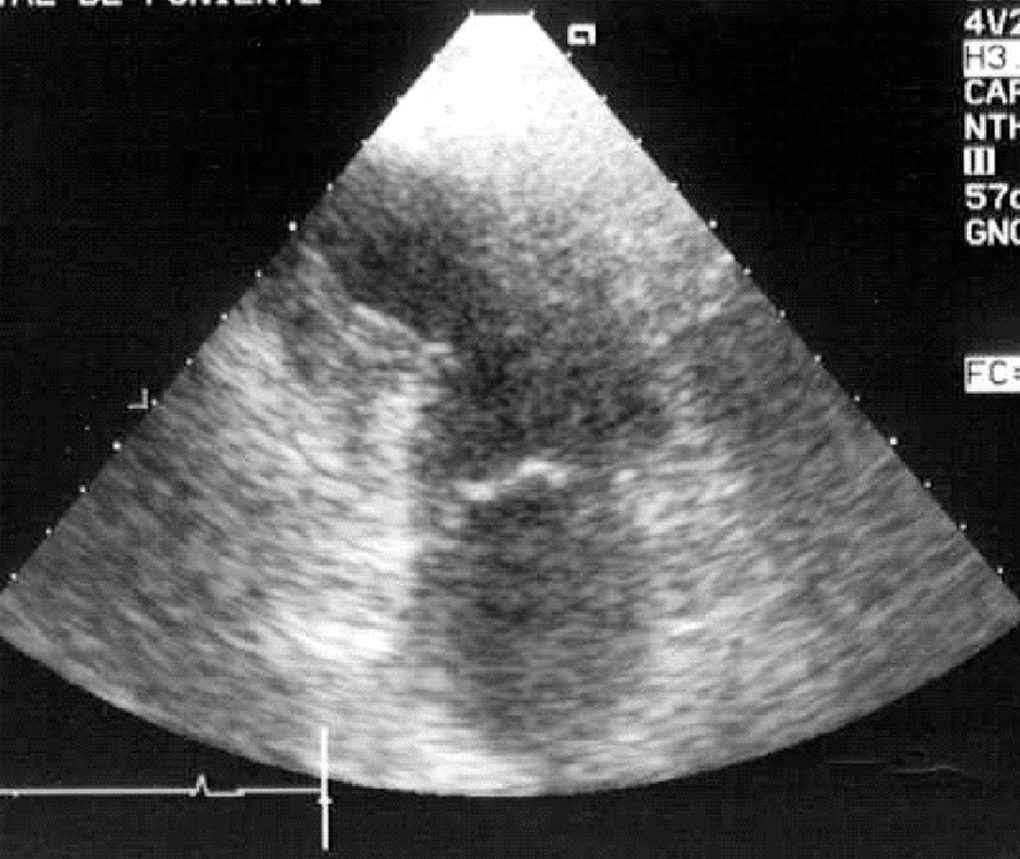
Figura 3. Ecocardiografía transtorácica, plano apical 2 cámaras, donde se puede observar un aneurisma septo e inferoapical de un paciente con hemorragia intracraneal complicada con edema neurogénico. La coronariografía realizada fue normal.
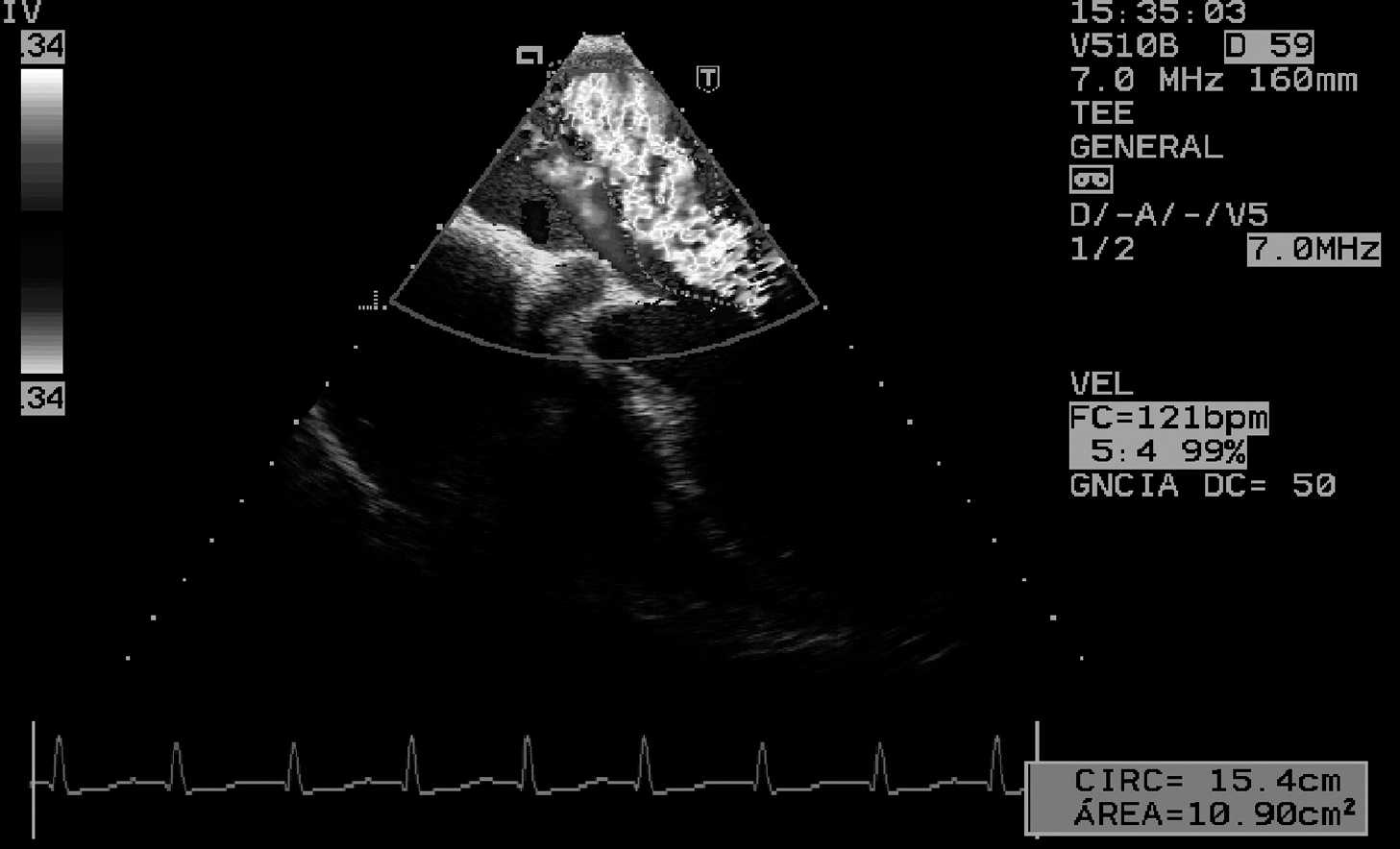
Figura 4. Ecocardiografía transtorácica, plano apical, donde se puede observar una insuficiencia mitral grave en un paciente de 28 años con una hemorragia subaracnoidea. Además, el paciente mostró trastornos electrocardiográficos con alteración dinámica del segmento ST en cara anterior. La ecocardiografía transtorácica y transesofágica mostraron alteraciones de contractilidad segmentaria de la cara apical y de los tres segmentos inferiores junto a insuficiencia mitral grave. El paciente presentó shock y edema pulmonar (inicialmente identificado como edema neurogénico) y, finalmente, muerte cerebral. Se realizó coronariografía, que fue normal.
La sospecha de una disfunción miocárdica en el seno de una patología neurológica grave supone la necesidad de realizar un diagnóstico diferencial con otras patologías como son las siguientes: a) la miocarditis, entidad que cursa de modo similar al aturdimiento neurogénico desde el punto de vista clínico; b) síndrome coronario agudo, el aturdimiento miocárdico neurogénico cursa con trastornos electrocardiográficos, ecocardiográficos, e incluso con incremento enzimático, que podrían simular un síndrome coronario agudo, y en especial un infarto agudo de miocardio; sin embargo, las coronariografías realizadas a este tipo de pacientes siempre han encontrado normalidad de las arterias coronarias epicárdicas. Se han intentado formas de diferenciar ambos diagnósticos, al margen de la coronariografía, uno de ellos podría ser el valor pico de troponina I. Bulsara et al30 estudiaron a un grupo de 350 pacientes con hemorragia subaracnoidea y sin enfermedad cardíaca previa y encontraron que 10 (2,9%) de ellos presentaban disfunción miocárdica grave con un valor medio de fracción de eyección del ventrículo izquierdo del 33%. Los autores compararon a estos pacientes con controles históricos que habían tenido una disfunción miocárdica similar como consecuencia de un infarto agudo de miocardio, y no encontraron diferencias en el valor pico de creatinfosfocinasa (CPK)-MB, sin embargo, el valor pico de troponina fue 10 veces mayor en los pacientes con infarto de miocardio que en los pacientes con aturdimiento miocárdico neurogénico (2,8 ng/ml frente a 0,22 ng/ml).
La etiopatogenia del aturdimiento miocárdico neurogénico no está clara y podría obedecer a un fenómeno de isquemia miocárdica, con un fenómeno posterior de reperfusión, que produce liberación de radicales libres y activación de la cascada inflamatoria similar a la que ocurre en el síndrome de respuesta inflamatoria sistémica, que finalmente ocasiona una cardiomiodepresión o incluso un fenómeno de citotoxicidad cardíaca directa2,4,6,7. Se han propuesto otras causas como son las siguientes: a) un efecto directo de la corteza cerebral que produce disminución de la contractilidad miocárdica inducida a través de un exceso de catecolaminas19,31, que también podría provocar vasoespasmo coronario13,31,32, o vasoconstricción de la microcirculación coronaria32; b) la disfunción endotelial generada por alteración del metabolismo de la serotonina33; c) liberación de citocinas y génesis de un síndrome de respuesta inflamatoria sistémica y disfunción miocárdica similar al que ocurre en la sepsis grave34; d) alteraciones o déficit enzimáticos35; e) déficit hormonales36, y f) alteración del estado hemodinámico, con modificación de la precarga y/o poscarga, hechos que modificarían, al menos temporalmente, la fracción de eyección, pero que no podrían explicar satisfactoriamente los trastornos de contractilidad segmentaria37. Éstas son algunas de las causas que teóricamente podrían inducir una disfunción miocárdica en el paciente neurológico críticamente enfermo, aunque muy probablemente esta disfunción miocárdica obedezca a una etiopatogenia multifactorial38. La génesis de esta disfunción miocárdica podría estar en relación directa con el grado de lesión neurológica y estar mediada por mecanismos neuronales; de hecho, se ha encontrado que la puntuación en la escala de Hunt-Hess es un factor que se asocia de manera independiente con el desarrollo de disfunción miocárdica en los pacientes con hemorragia subaracnoidea39. Un aspecto especial es que la mayoría de los trastornos de contractilidad segmentaria se localicen en el segmento septoapical, hecho que podría explicarse por un mayor número de receptores catecolaminérgicos o por alteraciones de la microcirculación coronaria a ese nivel5-7.
Otro aspecto interesante es la aparición de disfunción miocárdica neurogénica en la situación de muerte cerebral. Aunque existen estudios que muestran que la disfunción es reversible tras el trasplante16,40,41, su presencia podría generar la duda de realización de trasplante cardíaco al poder incidir en el rechazo del injerto, mantenerse la disfunción o incluso favorecer la infección, habiéndose llegado a investigar el valor de la ecocardiografía con dobutamina para evaluar la reversibilidad42.
Es probable que la disfunción miocárdica neurogénica sea infradiagnosticada en la práctica clínica, pues aunque puede ser sospechada ante una patología neurológica grave y ante cambios electrocardiográficos, requiere de técnicas diagnósticas, como la ventriculografía y en especial de la ecocardiografía. Por lo tanto, parece obvio la necesidad de incorporar la ecocardiografía realizada por los intensivistas a la cabecera de la cama de los pacientes críticamente enfermos, como una técnica diagnóstica más propia de la medicina intensiva. Una vez diagnosticada la disfunción miocárdica neurogénica se debería plantear su tratamiento de forma similar a cualquier otra disfunción miocárdica30,43-45 y, quizás en un futuro, se podrá considerar algún tratamiento profiláctico, mediante bloqueo beta-adrenérgico u otros fármacos cardioprotectores.
AGRADECIMIENTOS
Al personal del Hospital de Poniente de El Ejido por su colaboración, en especial a doña Nohemí Gil, y a todo el personal del Servicio de Cuidados Críticos y Urgencias, por su inestimable colaboración y su ayuda en la localización de la bibliografía requerida.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses
Manuscrito aceptado el 28-XII-2004.
00Med Intensiva. 2006;30(1):13-8 X
Correspondencia: Dr. M. Ruiz Bailén.
C/ Las Torres, 57.
23650 Torredonjimeno. Jaén. España.
Correo electrónico: ruizbailen@telefonica.net