INTRODUCCIÓN
El tratamiento de la hemorragia que amenaza la vida es una de las constantes de la Medicina con unas terapéuticas dominadas por la hemostasia quirúrgica, la radiología intervencionista y la reposición de los componentes perdidos, que son complementadas en la actualidad por nuevas formulaciones medicamentosas. Entre ellas una de las más importantes es el factor VII activo recombinante (rFVIIa), sustancia estructuralmente casi idéntica al factor de la coagulación VIIa humano.
MECANISMO DE ACCIÓN
La hemostasia es el cese del sangrado, mientras que la coagulación es la transformación de un líquido en una masa coherente sólida o semisólida. En la práctica estos términos con frecuencia se intercambian para describir los procesos fisiológicos mediante los cuales la sangre se mantiene en su estado fluido dentro del torrente circulatorio cerrado.
Actualmente se piensa que la coagulación sanguínea es iniciada por la vía extrínseca y amplificada por la vía intrínseca. La amplificación ocurriría por dos mecanismos: primero, el factor VIIa de la vía extrínseca activa el factor IX de la vía intrínseca (cross-talk); segundo, la trombina activa el factor VIII y XI junto a la superficie de las plaquetas.
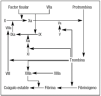
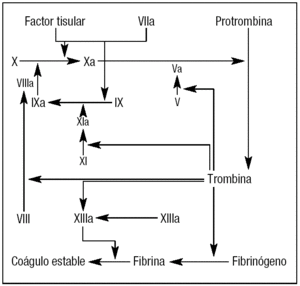
El factor tisular es expuesto en lugares donde los vasos están lesionados. Cuando el factor VIIa circulante forma un complejo con el factor tisular expuesto en el endotelio se inicia la coagulación, activando a su vez los factores de la coagulación IX y X. El factor IXa también activa el factor X. El factor Xa forma a su vez un complejo con el factor V, calcio y fosfolípidos, adquiriendo la capacidad de convertir rápidamente la protrombina en trombina. La trombina activa el factor V y el factor VIII, acelerando la activación de la protrombina y factor X, respectivamente. La trombina también activa el factor XI que, como XIa, activa a su vez al factor IX. La generación de grandes cantidades de factor Xa por el factor IXa y el factor VIIIa asegura que suficientes cantidades de trombina sean generadas de forma continua para convertir el fibrinógeno a fibrina, creando la hemostasia a nivel local. La trombina activa el factor XIII a factor XIIIa, que transforma los monómeros de fibrina solubles a una forma estable de coágulo en unión con las plaquetas en el lugar de la lesión vascular (fig. 1)1.
Figura 1. Diagrama simplificado de la coagulación.
Algunos autores piensan que el factor VIIa, en altas dosis, puede unirse directamente a las plaquetas, con una vía final de activación del factor X y así facilitar la conversión de trombina mediante un mecanismo factor tisular-independiente2.
APLICACIONES CLÍNICAS
En el año 1999 la institución estadounidense FDA (Food and Drug Administration) aprobó por primera vez el uso del rFVIIa para el tratamiento de los episodios hemorrágicos en pacientes con hemofilia A o B e inhibidores al factor VIII o IX. En el año 2005 la misma institución aprobó indicaciones adicionales: procedimientos quirúrgicos en pacientes con hemofilia A o B e inhibidores, y tratamientos de los episodios de sangrado en pacientes con deficiencia del factor VII.
Pero su utilización no se ha limitado a estos ámbitos terapéuticos dada su capacidad de promover la hemostasia. Así, la literatura médica describe de forma progresivamente mayor la utilización de rFVIIa en pacientes sin las indicaciones comentadas (off-license use), incrementándose de forma drástica su uso3. Antes de repasar brevemente éstas es necesario comentar un hecho conocido: la acidosis disminuye de forma importante la capacidad de acción de este fármaco. Esto podría condicionar en determinados contextos su eficacia probada en ausencia de una alteración severa del equilibrio ácido-básico, por lo que se recomienda mantener un pH por encima de 7,1. Algunas de las situaciones clínicas en las que actualmente se emplea el rFVIIa son las siguientes:
1. Hemorragia intracerebral no traumática. La utilización del rFVIIa en su tratamiento ha tenido un fuerte impulso con la aparición de los resultados de un estudio multicéntrico, randomizado y controlado con placebo, en fase IIb4. Este estudio analiza el efecto de la administración de varias dosis de rFVIIa sobre el tamaño del hematoma. Además, establece como objetivo secundario el efecto del tratamiento sobre la evolución clínica a los 90 días. Los resultados mostraron que cada una de las tres dosis de rFVIIa evaluadas (40, 80 y 160 µg/kg), administradas en las primeras 4 horas de aparición de los síntomas, se asociaban con una reducción significativa en el crecimiento del hematoma en comparación con la administración de placebo. Además, se observó una mejoría en la evolución clínica y en la supervivencia a los 90 días en el grupo de tratamiento. Es importante considerar que el beneficio del rFVIIa fue bastante mayor cuando el tratamiento era iniciado dentro de las tres primeras horas de aparición de los síntomas. Aquellos pacientes tratados con más de tres horas desde la aparición de los síntomas no tuvieron diferencias significativas en el crecimiento del hematoma en comparación con el grupo placebo, sugiriendo de forma clara que la ventana de tiempo para la intervención está limitada a este corto intervalo de tiempo. Este estudio ha sido refrendado por otros que, aunque de menor entidad científica, ayudan a confirmar estos resultados incidiendo en una menor mortalidad cuando se emplea el rFVIIa en este contexto5.
2. Pacientes politraumatizados. La administración del rFVIIa ha tenido resultados esperanzadores desde su utilización como agente hemostático a principios del presente siglo6. El traumatismo es la causa principal de muerte de personas menores de 44 años y la exanguinación es el principal mecanismo que la provoca (40%)7. La grandes series de pacientes politraumatizados descritos por Dutton et al demostraron el potencial de esta sustancia en limitar el sangrado en pacientes transfundidos masivamente8. Un ensayo clínico reciente, randomizado, controlado con placebo y doble ciego realizado en 227 pacientes con traumatismo, tanto cerrado (143 pacientes) como penetrante (134 pacientes), en los que se administraron tres dosis repetidas de rFVIIa (200, 100, y 100 µg/kg) o placebo, mostró una reducción significativa de los requerimientos transfusionales en los pacientes con trauma cerrado, con una reducción estimada de 2,6 bolsas de concentrados de hematíes y reducción de la necesidad de una transfusión masiva, definida como la infusión de más de 20 unidades de concentrados de hematíes9. En los pacientes con trauma penetrante, aunque no se alcanzó una significación estadística, se mostró una tendencia hacia la reducción de la transfusión (reducción estimada de 1 unidad de concentrado de hematíes), así como de la necesidad de una transfusión masiva. Así mismo se observó una tendencia hacia la reducción en la mortalidad y en las complicaciones críticas. El grupo de Martinowitz ha contribuido con su gran experiencia en estos pacientes, y muestra que con un politraumatismo grave la administración de rFVIIa disminuye de una forma rápida los prolongados tiempos de protrombina y de tromboplastina parcial, existiendo un importante porcentaje de pacientes en los que cesa la hemorragia con una tasa de supervivencia favorable a la utilización de este fármaco (61%)10.
A pesar de la necesidad de estudios más concluyentes, los resultados de los estudios comentados sugieren la eficacia clínica el rFVIIa, por lo que está formando parte del arsenal terapéutico de una forma casi «rutinaria»11. En muchos de los protocolos de nuestro entorno hospitalario, el rFVIIa se emplea cuando la utilización de hemoderivados es importante, por ejemplo en el protocolo de la Universidad de Oregón se utiliza cuando se han administrado más de 4 concentrados de hematíes, pero no es desdeñable que en el futuro el inicio del tratamiento sea más precoz y con menos pérdidas sanguíneas, intentando evitar éstas.
3. Prostatectomía retropúbica electiva. Se ha realizado un estudio prospectivo y randomizado con un número reducido de pacientes, demostrando que el rFVIIa reduce tanto las pérdidas sanguíneas, disminuyendo la necesidad de transfusión, como la duración de la intervención quirúrgica12.
En otras intervenciones quirúrgicas, ya sean neuroquirúrgicas13, ortopédicas14, cardíacas15-18, de cirugía general19 y obstétricas20,21, aunque con un número de pacientes pequeño y en forma de casos aislados, se ha reportado una disminución en el sangrado y en la necesidad de transfusión de hemoderivados.
4. Disfunción hepática. El rFVIIa también se ha administrado en pacientes con enfermedad hepática avanzada, con cirrosis en estadios de Child-Pugh B y C, y hemorragia digestiva por varices. En un ensayo randomizado en que se administró rFVIIa antes de la realización de la endoscopia, disminuyó la hemorragia gastrointestinal en las primeras 24 horas22. Los mejores resultados se obtuvieron en pacientes con enfermedad hepática más avanzada y coagulopatía más intensa. También ha demostrado reducir el riesgo hemorrágico durante procedimientos invasivos como la biopsia hepática, corrigiendo la coagulopatía en unos valores superiores al 70% en menos de 10 minutos23. Ha sido probado en pacientes de forma preoperatoria al trasplante ortotópico hepático o a hepatectomía parcial24,25.
EFECTOS ADVERSOS
La frecuencia de los efectos adversos graves en los estudios clínicos se relaciona con la capacidad trombogénica del fármaco, tanto arterial como venosa. Así se han comunicado casos de síndrome coronario agudo, accidentes cerebrovasculares agudos, embolismo pulmonar, trombosis arteriales, trombosis venosas (incluyendo trombosis venosa profunda) y coagulación de dispositivos intravasculares. El riesgo trombótico, aunque para algunos autores se considera bajo e inferior al observado con otros concentrados de factores de coagulación, está siendo revisado en muchos de los trabajos más actuales dada la relevancia de estas complicaciones26.
La formación patológica de coágulos sigue un razonamiento biológico dado el mecanismo de acción del rFVIIa. In vitro, altos niveles de rFVIIa aceleran la generación de trombina en ausencia aparente de factor tisular y el efecto farmacológico del rFVIIa puede no estar limitado a la superficie de las plaquetas en el lugar de sangrado2. Estos hallazgos son de una significación clínica incierta, aunque sugestivos de que puede ser el rFVIIa más trombogénico en pacientes con condiciones que predispongan a trombosis, medicaciones hemostáticas concomitantes, historia de eventos tromboembólicos, edad o condiciones médicas predisponentes. Por otra parte, mientras que la eliminación del rFVIIa es relativamente rápida (vida media de dos horas), la evidencia clínica de trombosis puede no ser inmediatamente aparente.
De los trabajos llevados a cabo recientemente, el realizado por O`Connell et al26 ha revisado la frecuencia de los eventos adversos tromboembólicos en la base de datos de la FDA. Aunque asumen que infraestiman los eventos adversos, los autores no pueden determinar la frecuencia de eventos tromboembólicos asociados al rFVIIa, dado el alto número de factores de confusión que intervienen, requiriéndose más estudios destinados a este fin, lo que da una idea de la complejidad del problema.
En la larga serie de casos de Dutton et al8 no se registraron complicaciones resultantes de esta hipercoagulabilidad y en el estudio randomizado en el seno de la prostectomía retropúbica no se observó ningún efecto adverso12.
En el estudio de Mayer et al4 en la hemorragia intracerebral espontánea, los eventos arteriales tromboembólicos tuvieron una frecuencia del 7% en el grupo de rFVIIa, mientras que en el grupo control fueron del 2%. Estos eventos fueron fundamentalmente infarto agudo de miocardio e infarto cerebral. La mitad de los 16 episodios arteriales en el grupo de rFVIIa ocurrieron cuando se utilizaban dosis más altas (160 µg/kg) y es probable que el uso de dosis más bajas conduzca a una reducción del riesgo de este tipo de complicaciones. Esta hipótesis se ha tenido en cuenta en el diseño del estudio internacional en fase III FAST (rFVIIa in Acute Hemorrhagic Stroke Treatment), en la que se comparan dosis de 20 y 80 µg/kg de rFVIIa con placebo.
En el estudio randomizado de Boffard et al9 en pacientes con trauma los eventos adversos, incluyendo los tromboembólicos, estaban regularmente distribuidos entre los grupos.
También se han descrito en un 8% efectos adversos no graves como dolor en el punto de administración, fiebre, cefalea, vómitos, variaciones en la presión arterial y reacciones de hipersensibilidad cutánea27.
El número de publicaciones y comunicaciones a congresos que refieren la utilización de rFVIIa ha ido aumentando, superando su aplicación clínica el ritmo que marcan los resultados de los ensayos clínicos. Así, cada vez se utiliza con mayor frecuencia en muchas de las Unidades de Cuidados Intensivos (UCI), reanimación y quirófanos para tratar de controlar el sangrado masivo.
Su utilización actual está sufriendo una transformación hacia un uso cada vez mayor. Desde luego el rFVIIa se ha hecho un lugar en las UCI para el tratamiento del sangrado masivo y la coagulopatía refractaria (aquella que no responde a la transfusión de plasma fresco congelado, crioprecipitados, fibrinógeno comercial o transfusión de plaquetas), especialmente si el paciente está sangrando de forma aguda. Así, se utiliza en muchas Unidades para el tratamiento del control del sangrado grave del enfermo politraumatizado, la hemorragia intracraneal espontánea y en aquellas situaciones perioperatorias en las que el sangrado pueda afectar a la estabilidad vital. Esto se apoya en su utilización por uso compasivo, ya que todavía no son indicaciones aprobadas. Aunque bien es cierto que las indicaciones en las que se utiliza como uso compasivo (off-label use) son situaciones graves que no tienen alternativas claras y que condicionan un contexto de muy alta mortalidad.
Pero este amplio uso no nos debe de hacer olvidar la falta de ensayos apropiados y dirigidos hacia la determinación real de las complicaciones tromboembólicas. Por otra parte debemos recordar el coste elevado del producto, aunque el ahorro en sangre, mejoría de la capacidad funcional o disminución de la mortalidad podrían compensar su mayor coste inicial. Por otra parte no hay que olvidar la seguridad de ausencia de contenido viral.
Ante una indicación fuera de registro deberíamos tener en cuenta la importancia del factor tiempo en la administración, puesto que su infusión precoz mejora los resultados en los estudios publicados.
Dado que hasta el día de hoy las series publicadas son muy heterogéneas en cuanto a las dosis administradas, repetición de las mismas e intervalo de administración, así como la monitorización del tratamiento y, mientras existan sólo datos sugerentes de su beneficio, deberían crearse recomendaciones de expertos y no dejar que cada grupo hospitalario cree las propias. En todo caso, la dosis más recomendada en la mayoría de los protocolos es la de 90 µg/kg, que se podrá repetir si se considerase adecuado. En pacientes con sangrado intracraneal que se encuentran en tratamiento con anticoagulantes se podría utilizar dosis de 40 µg/kg, también en dosis única.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia: Dr. M. Quintana Díaz.
Correo electrónico: mquintanadiaz@arrakis.es
Manuscrito aceptado el 12-VII-2006.