La ventilación asistida proporcional (PAV) + genera una presión en la vía aérea que depende del esfuerzo inspiratorio del paciente, ajustando automáticamente el flujo y volumen generados según los cambios en la mecánica respiratoria. Pretendimos analizar los factores clínicos asociados al éxito de la PAV+ como primera línea de tratamiento en la fase aguda del paciente crítico.
MétodosEstudio prospectivo, de cohortes. En todo paciente con ventilación mecánica estimada>24h se sustituía la ventilación asistida controlada por PAV+ en cuanto recuperaban la actividad respiratoria espontánea. La PAV+ se programó para generar una asistencia elevada. Se compararon los pacientes en que la PAV+ se aplicó con éxito frente a aquellos en los que fracasó.
ResultadosPAV+ fue un éxito en 12 pacientes (63%) y fracasó en 7 (37%) debido a taquipnea (n=4), hipercapnia (n=2) y acidosis metabólica (n=1), aunque no llegó a demostrarse estadísticamente. Los parámetros clínicos fueron similares para ambos grupos. El día de ingreso, el trabajo total respiratorio (WOBTOT) fue inferior en el grupo de éxito (WOBTOT: 0,95 [0,8-1,35] vs. 1,6 [1,4-1,8] J/L; p<0,007). El área bajo la curva ROC fue 0,89±0,08 para WOBTOT. El mejor punto de corte para predecir el éxito de la PAV+ fue un WOBTOT<1,4J/L (sensibilidad: 1 [0,7-1], especificidad: 0,6 [0,4-0,6], VPP: 0,7 [0,5-0,7], y VPN: 1 [0,6-1]).
ConclusiónPAV+ fue una técnica aplicable como primera línea de tratamiento en el 63% de los pacientes, fundamentalmente en aquellos sin deterioro excesivo del trabajo respiratorio. Las variables clínicas asociadas al fracaso fueron la taquipnea y la hipercapnia, aunque sin significación estadística.
Proportional assist ventilation plus (PAV+) applies pressure depending on the patient's inspiratory effort, automatically adjusting flow and volume assist to changes in respiratory mechanics. We aimed to assess the clinical factors associated with the success of PAV+ as first-line support in the acute phase of critical illness.
MethodsA prospective cohort study was carried out. Mechanically ventilated patients>24h were switched from assist-control ventilation to PAV+ as soon as they regained spontaneous breathing activity. PAV+ was set to deliver the highest assistance. We compared patients in whom PAV+ succeeded versus those in whom it failed.
ResultsPAV+ succeeded in 12 (63%) patients, but failed in 7 (37%) due to tachypnea (n=4), hypercapnia (n=2), and metabolic acidosis (n=1), but without statistical significance. Both groups had similar clinical parameters. On the day of inclusion, total work of breathing per breath was lower in the successful PAV+ group (WOBTOT: 0.95 [0.8-1.35] vs. 1.6 [1.4-1.8] J/L; P<.007). The area under the ROC curve was 0.89±0.08 for WOBTOT. The best cut-off for predicting PAV+ success was WOBTOT<1.4J/L (sensitivity: 1 [0.7-1], specificity: 0.6 [0.4-0.6], PPV: 0.7 [0.5-0.7], and NPV: 1 [0.6-1]).
ConclusionPAV+ proved feasible as first-line ventilatory support in 63% of the patients, mostly in individuals without extreme derangements in WOBTOT. Tachypnea and hypercapnia were the clinical factors associated with failure, though statistical significance was not reached.
La ventilación asistida proporcional (PAV) constituye un modo ventilatorio asistido, desarrollado y descrito por Younes en 19921,2. Inicialmente fue concebido como una herramienta de investigación del centro respiratorio, que suplía la actividad de los músculos respiratorios. Sin embargo, la PAV demostró tener la capacidad de reemplazar en gran parte el exceso de esfuerzo muscular desarrollado durante el fallo respiratorio agudo.
En la PAV el ventilador genera una presión inspiratoria que es directamente proporcional al flujo y volumen generado por el esfuerzo muscular del paciente3,4. Los pacientes mantienen espontáneamente el patrón respiratorio más óptimo para controlar su homeostasis interna, mientras que el profesional determina el nivel de apoyo ventilatorio (gain, ganancia) que considera más adecuado para ayudar al paciente. Al contrario de otras modalidades ventilatorias, la PAV establece un feedback positivo entre paciente y ventilador. Más que sustituir el esfuerzo muscular del paciente, la PAV multiplica los resultados de dicho esfuerzo en una proporción predefinida (gain).
Aunque la PAV originalmente suponía una modalidad de difícil aplicación clínica, actualmente existe un nuevo software (PAV+) que refleja continuamente los cambios que se producen en la mecánica del sistema respiratorio. Consiste en la determinación no invasiva de los valores de resistencia y elastancia. Esto hace más sencillo utilizar esta modalidad, dado que la proporción de ayuda predeterminada (gain) se mantiene estable durante los habituales cambios fisiológicos que se producen en la mecánica respiratoria5,6.
En los últimos años, diferentes estudios han comparado la PAV con la presión de soporte (PSV)7–14. De forma general han demostrado que la PAV supone una ventaja en términos de interacción paciente-ventilador, comodidad, disminución de trabajo respiratorio (WOB) y capacidad de adaptación del paciente a variaciones de la homeostasis y de la mecánica respiratoria7,10–13. Dos de estos estudios analizan la aplicación temprana de la PAV+ en pacientes críticos: Kondili et al.13 compararon el patrón respiratorio y coste energético entre PAV y PSV, con y sin la adición de una carga, durante un corto período de tiempo en pacientes críticos. Demostraron una mejor capacidad de compensación de la PAV+ ante una carga añadida, en términos de consumo energético y acoplamiento neuroventilatorio. Por otro lado, Xirouchaki et al.14 compararon la aplicación de PAV+ y PSV durante 48h en pacientes críticos. Observaron una mayor incidencia de fracaso ventilatorio y asincronía en los pacientes ventilados con PSV. Estos resultados muestran que, a pesar de que la PSV es una modalidad rutinaria de sencilla aplicación, la PAV+ es probablemente mejor en términos de compensación ante deterioros clínicos añadidos y sincronía paciente-ventilador. Por otro lado, la PAV+ permite decidir el grado de descarga muscular en el paciente para vencer una mecánica respiratoria deteriorada a través de la ganancia. El estudio de Ruiz-Ferron et al.15 analizó el WOB realizado por los pacientes con diferentes niveles de soporte ventilatorio, confirmando la relación inversa entre ganancia y WOB del paciente. Así, una ganancia del 80% correspondía a un trabajo realizado por el paciente de 0,1 a 0,2J/L, lo que equivaldría a una descarga muscular máxima.
Basándonos en la poca experiencia de la PAV+ en la fase aguda y los beneficios de la respiración espontánea16–18, pretendemos analizar los factores clínicos (mecánica respiratoria, hemodinámica y características gasométricas) asociados al éxito de la PAV cuando se emplea de forma rutinaria en la fase aguda del paciente crítico bajo alta asistencia, una vez que adquiera un ritmo respiratorio espontáneo y suficiente para regular su homeostasis interna.
Material y métodosPacientesEl estudio fue realizado en 3 unidades de críticos medicoquirúrgicas tras la aprobación de los comités de ética correspondientes a cada centro. Los familiares o representantes dieron el consentimiento escrito en cada caso (anexo). Los criterios de inclusión englobaban la necesidad anticipada de ventilación mecánica durante al menos 24h y la selección se llevó a cabo en las primeras 48h de estancia en UCI. Eran excluidos los pacientes menores de 18 o mayores de 85 años, con una FiO2≥0,8, ventilación en posición prono, gestación, shock cardiogénico, arritmias cardiacas graves, altos requerimientos de fármacos vasoactivos (dopamina>15microg/kg/min o noradrenalina>0,5microg/kg/min), altas necesidades de sedación que influyeran en la ventilación espontánea, estados de limitación o retirada terapéutica, protocolo de hipotermia, contraindicación para aplicar PAV (fuga aérea, enfermedad neurológica o neuromuscular), y la no disponibilidad de ventilador con PAV.
El período de inclusión en el estudio correspondía a las primeras 24h, donde, inicialmente, los pacientes eran ventilados en modo asistido-controlado por volumen (ACV) y, tan pronto como se consiguiera una estabilidad hemodinámica, respiratoria y de sedación suficiente para activar el trigger del ventilador, se pasaba a modalidad PAV+. El objetivo era un nivel de sedación 3-4 según la escala de Ramsay19. El manejo de la presión positiva al final de la espiración y la FiO2 se establecía según práctica rutinaria y los pacientes se mantenían en posición semiincorporada entre 30° y 40°.
ProtocoloEn los pacientes se monitorizaban continuamente la presión arterial (invasiva y no invasiva), la saturación de oxígeno y el ritmo cardiaco (electrocardiograma). La ventilación mecánica era realizada con ventiladores Puritan-Bennet® 840 plus (Nellcor Puritan Bennett LLC, Gosport, Reino Unido).
Se estableció como objetivo una liberación máxima de trabajo muscular desde el inicio de la PAV+ y durante todo el período de estudio (fase aguda), lo que correspondía a un 90% de ganancia (gain). Si el paciente desarrollaba volúmenes corrientes elevados (VT) o altas presiones pico (Paw), dicho gain era reducido en fracciones del 10% hasta un mínimo del 60% de asistencia.
Se consideró como éxito de la PAV+ su aplicación desde el inicio de la misma hasta que se presentaran los criterios clínicos para iniciar el weaning (FiO2≤0,4 en supino, TA sist>100mmHg sin vasopresores, frecuencia cardiaca<140l/min, nivel de conciencia adecuado, capacidad para toser). Los criterios que indicaban el fracaso de la PAV+ y la sustitución por ACV eran: VT≤3ml/kg o≥10ml/kg, frecuencia respiratoria≤10/min o≥40/min, presión pico (Paw)>45cmH2O, notable utilización de musculatura accesoria, sudoración, movimiento abdominal paradójico o inestabilidad hemodinámica (arritmias graves, aumento progresivo de fármacos vasoactivos por incapacidad de mantener una TA sist>100mmHg).
Una vez alcanzados los criterios de weaning los pacientes eran colocados directamente en «tubo en T» o se realizaba una reducción progresiva de la asistencia ventilatoria en PSV o en PAV+. Este proceso se realizaba a discreción del médico responsable, dado que el objetivo del estudio se basaba en valorar la fase crítica y no la del proceso de retirada de la asistencia ventilatoria (weaning).
Durante el período de inclusión y antes de aplicar PAV+ se recogían datos sobre la causa del fracaso respiratorio, edad, sexo, riesgo de mortalidad SAPS3 y PaO2/FiO2. La recogida de datos en PAV+ se realizaba el día de inclusión en la primera hora del cambio a esta modalidad y tras conseguir un patrón respiratorio estable. Los días siguientes la recogida de datos se realizaba a primera hora de la mañana. Los parámetros respiratorios eran recogidos desde la pantalla del ventilador: VT, frecuencia respiratoria, Paw, compliance del sistema respiratorio (CPAV), resistencia del sistema respiratorio (RPAV=Raw, que corresponde a la resistencia de la vía aérea estimada por el ventilador tras eliminar la resistencia calculada de la vía artificial), y el trabajo ventilatorio total (WOBTOT=WOBpaciente+WOBventilador). El WOBpaciente era calculado a través de la integración electrónica de la presión muscular estimada y el volumen inspiratorio, donde la primera se obtenía a partir de la ecuación de movimiento basada en los valores de resistencia y compliance que medía de forma continua el ventilador. La precisión de este método fue validada por Iotti et al.20, comparándola con la presión esofágica. Se analizaba diariamente la gasometría arterial, que se obtenía en el mismo momento en que se recogían los datos respiratorios.
Análisis estadísticoLos datos demográficos se muestran según mediana y rango intercuartílico. Se utilizó el test U de Mann-Whitney para comparar los grupos de éxito y fracaso de la PAV+, dado el bajo número de pacientes incluidos. Se desarrollaron curvas ROC que determinaran el valor predictivo de cada una de las variables asociadas con el éxito de la PAV+, calculando la sensibilidad, la especificidad y los valores predictivos positivo y negativo. Se utilizó el software SPSS® 14.0 para realizar el análisis.
ResultadosEl estudio se realizó entre septiembre de 2008 y marzo de 2009. Durante este período se analizaron un total de 108 pacientes entre los 3 hospitales, de los cuales solo 19 cumplieron los criterios de inclusión. Los pacientes fueron incluidos dentro de las primeras 24h tras la intubación. Los 89 pacientes restantes fueron excluidos debido a ventilación mecánica estimada inferior a 24h (postoperados, n=36; 40%), inestabilidad hemodinámica o respiratoria (n=12; 13%), trastornos neurológicos (n=21; 24%), pronóstico infausto (n=9; 10%), y otros (n=11; 12%).
La PAV+ se aplicó con éxito en 12 pacientes (63%) y fracasó en 7 (37%). Los fracasos fueron atribuidos, según criterio del clínico responsable, a taquipnea en 4 casos (57%) (uno de ellos con Paw>50cmH2O), hipercapnia en 2 (29%) y acidosis metabólica en uno (14%). No hubo diferencias entre ambos grupos en cuanto a edad, escala de gravedad o ratio de oxigenación (tabla 1).
Características basales de los pacientes en el momento de la inclusión
| Pacientes | Diagnóstico | Edad (años) | Sexo | SAPS3, riesgo de mortalidad (%) | PaO2/FiO2 (mmHg) |
| PAV éxito | |||||
| 1 | Peritonitis | 69 | Mujer | 52 | 500 |
| 2 | Fracaso respiratorio agudo | 46 | Varón | 80 | 218 |
| 3 | Peritonitis | 68 | Varón | 17 | 218 |
| 4 | Agudización COPD | 82 | Varón | 90 | 122 |
| 5 | Meningitis | 76 | Varón | 89 | 300 |
| 6 | Neumonía | 37 | Varón | 18 | 240 |
| 7 | Politraumático | 41 | Varón | 13 | 155 |
| 8 | Sepsis | 33 | Mujer | 80 | 227 |
| 9 | Neumonía | 84 | Mujer | 74 | 320 |
| 10 | Neumonía | 83 | Varón | 82 | 252 |
| 11 | Politraumático | 43 | Varón | 28 | 257 |
| 12 | Neumonía | 19 | Mujer | 5 | 472 |
| Mediana | 57 | 63 | 246 | ||
| IQR | 38-80 | 17-81 | 218-315 | ||
| PAV fracaso | |||||
| 1 | Hemorragia digestiva alta | 53 | Varón | 84 | 244 |
| 2 | Sepsis | 73 | Mujer | NA | 223 |
| 3 | Neumonía | 80 | Varón | 76 | 236 |
| 4 | Pancreatitis | 44 | Varón | 54 | 183 |
| 5 | Peritonitis | 68 | Varón | 87 | 217 |
| 6 | Neumonía | 30 | Varón | 11 | 290 |
| 7 | Peritonitis | 82 | Varón | 77 | 310 |
| Mediana | 68 | 76 | 236 | ||
| IQR | 44-80 | 43-85 | 217-290 | ||
| p | 0,8 | 0,7 | 0,6 | ||
COPD: enfermedad pulmonar obstructiva crónica; IQR: rango intercuartílico; NA: no aportado; PaO2/FiO2: presión arterial de oxígeno/fracción inspiratoria de oxígeno; PAV: ventilación asistida proporcional.
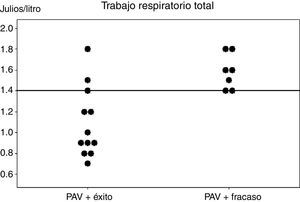
El análisis de los parámetros para predecir el fracaso o éxito de la PAV+ durante el primer día de inclusión no mostró diferencias salvo en el WOBTOT, que resultaba significativamente más alto en el grupo de fracaso de la técnica (WOBTOT: 1,6 [1,4-1,8] vs. 0,95 [0,8-1,35] J/L; p<0,007) (fig. 1). No se obtuvieron diferencias significativas en la frecuencia respiratoria, la PaCO2 o el pH en la valoración conjunta de estos 2 grupos, a pesar de que dichos parámetros fueron motivo de suspensión de la modalidad en el grupo de fracaso según la valoración clínica de los profesionales (tabla 2 y fig. 1).
Valores individuales del trabajo respiratorio de los 2 grupos de pacientes, adquiridos en la primera hora tras iniciar la ventilación asistida proporcional + y en fase de estabilidad clínica y respiratoria. Se muestra en una línea horizontal el mejor cutt-off para predecir los resultados de la ventilación asistida proporcional +.
Variables al primer día de inclusión de ventilación asistida proporcional + en los pacientes en los que se aplicó con éxito frente a aquellos en que fracasó
| PAV+ éxito, n=12 | PAV+ fracaso, n=7 | p | |
| Volumen tidal (ml) | 537 (399-657) | 500 (500-660) | 0,7 |
| Frecuencia respiratoria (min−1) | 20,5 (16-28,7) | 27 (16-32) | 0,5 |
| Volumen minuto (L) | 10,5 (8,3-12,9) | 10,8 (9,5-18,9) | 0,3 |
| PEEP (cmH2O) | 7,5 (7-8) | 7 (6-10) | 0,5 |
| PaO2/FiO2 (mmHg) | 246 (218-434) | 233 (209-295) | 0,6 |
| pH | 7,37 (7,31-7,44) | 7,36 (7,31-7,46) | 0,9 |
| PaCO2 (mmHg) | 35 (32-41) | 38 (34-49) | 0.6 |
| PAV+ gain (%) | 90 (80-90) | 90 (80-90) | 0.6 |
| Presión pico vía aérea (cmH2O) | 20 (19-26) | 27 (25-29) | 0.06 |
| Compliance (mL/cmH2O) | 50 (36-74) | 49 829-74) | 0.7 |
| Resistencia vía aérea (cmH2O/L/s) | 6,9 (6-8) | 7,8 (6-8,8) | 0.3 |
| WOB/ciclo (J/L) | 0,95 (0,8-1,35) | 1,6 (1,4-1,8) | 0.007 |
| MV duración (días) | 7 (5-16) | 10 (7-16) | 0.4 |
MV: ventilación mecánica; PaCO2: presión parcial arterial de CO2; PaO2/FiO2: presión arterial de oxígeno/fracción inspiratoria de oxígeno; PAV: ventilación asistida proporcional; PEEP: presión positiva espiratoria al final de la espiración; WOB: trabajo respiratorio.
Datos expresados en mediana (intervalo intercuartílico).
La figura 1 muestra los valores individuales de WOBTOT en la primera hora de inicio de la PAV+ para cada grupo. El área bajo la curva ROC fue de 0,89±0,08 para WOBTOT. El mejor punto de corte para predecir el éxito de la PAV+ fue un WOBTOT<1,4J/L (sensibilidad: 1 [0,7-1], especificidad: 0,6 [0,4-0,6], valor predictivo positivo: 0,7 [0,5-0,7], y valor predictivo negativo: 1 [0,6-1]).
El segundo día de aplicación de PAV+ (tabla 3) tampoco mostró diferencias en los parámetros respiratorios, tanto del patrón como del intercambio gaseoso. Continuaba manteniéndose una diferencia significativa del WOBTOT (WOBTOT: 1,7 [1,4-1,8] vs. 0,95 [0,8-1,2] J/L; p<0,001) y se observó mayor resistencia en la vía aérea en el grupo de fracaso de PAV+, que en el primer día no era significativa (Raw 7,8 vs. 6,9cmH2O/L/s; p=0,3) y que en el segundo día adquiere mayor intensidad (Raw 8,5 [7-12] vs. 6,2 [5,7-7] cmH2O/L/s; p=0,004). Sin embargo, no se sigue observando tal diferencia en el tercer día.
Variables al segundo día de inclusión de ventilación asistida proporcional + en los pacientes en los que se aplicó con éxito frente a aquellos en los que fracasó
| PAV+ éxito, n=12 | PAV+ fracaso, n=7 | p | |
| Volumen tidal (ml) | 555 (425-755) | 500 (460-550) | 0,5 |
| Frecuencia respiratoria (min−1) | 19,5 (13,5-26,7) | 28 (13-36) | 0,2 |
| Volumen minuto (L) | 11 (8,2-13,5) | 12,5 (11,2-16,5) | 0,3 |
| PEEP (cmH2O) | 6,5 (5,2-8) | 7 (6-9) | 0,6 |
| PaO2/FiO2 (mmHg) | 253 (177-298) | 236 (176-262) | 0,6 |
| pH | 7,39 (7,38-7,42) | 7,37 (7,36-7,43) | 0,5 |
| PaCO2 (mmHg) | 38 (34-43) | 35 (34-49) | 0,6 |
| PAV+ gain (%) | 80 (70-90) | 80 (70-90) | 0,8 |
| Presión pico vía aérea (cmH2O) | 21 (17,5-24,5) | 26 (22-33) | 0,07 |
| Compliance (mL/cmH2O) | 59 (35-88) | 50 (28-75) | 0,4 |
| Resistencia vía aérea (cmH2O/L/s) | 6,2 (5,7-7) | 8,5 (7-12) | 0,004 |
| WOB/ciclo (J/L) | 0,95 (0,8-1,2) | 1,7 (1,4-1,8) | <0,001 |
PaCO2: presión parcial arterial de CO2; PaO2/FiO2: presión arterial de oxígeno/fracción inspiratoria de oxígeno; PAV: ventilación asistida proporcional; PEEP: presión positiva espiratoria al final de la espiración; WOB: trabajo respiratorio.
Datos expresados en mediana (intervalo intercuartílico).
Al tercer día de ventilación, y con menos pacientes en cada grupo (PAV+ éxito n=8 y PAV+ fracaso=3), no se llegaron a observar diferencias en ninguno de los parámetros analizados (tabla 4).
Variables al tercer día de inclusión de ventilación asistida proporcional + en los pacientes en los que se aplicó con éxito frente a aquellos en los que fracasó
| PAV+ éxito, n=8 | PAV+ fracaso, n=3 | p | |
| Volumen tidal (ml) | 605 (514-762) | 670 (500-870) | 0,6 |
| Frecuencia respiratoria (min−1) | 17,5 (14-21,5) | 20 (20-34) | 0,2 |
| Volumen minuto (L) | 9,5 (8,7-12) | 17 (13,4-17,4) | 0,08 |
| PEEP (cmH2O) | 7 (6-8) | 6 (5-9) | 0,7 |
| PaO2/FiO2 (mmHg) | 255 (180-312) | 195 (194-286) | 0,6 |
| pH | 7,39 (7,38-7,47) | 7,33 (7,32-7,4) | 0,1 |
| PaCO2 (mmHg) | 37,5 (33-42,7) | 37 (34-38,4) | 0,9 |
| PAV+ gain (%) | 70 (60-90) | 90 (70-90) | 0,2 |
| Presión pico vía aérea (cmH2O) | 20,5 (16,2-27,2) | 24 (19-30) | 0,4 |
| Compliance (mL/cmH2O) | 60 (37-89) | 46 (25-68) | 0,4 |
| Resistencia vía aérea (cmH2O/L/s) | 6,2 (4-8,6) | 7 (4,8-7,7) | 0,7 |
| WOB/ciclo (J/L) | 1 (0,9-1) | 1,5 (1,3-1,5) | 0,09 |
PaCO2: presión parcial arterial de CO2; PaO2/FiO2: presión arterial de oxígeno/fracción inspiratoria de oxígeno; PAV: ventilación asistida proporcional; PEEP: presión positiva espiratoria al final de la espiración; WOB: trabajo respiratorio.
Datos expresados en mediana (intervalo intercuartílico).
El grado de asistencia objetivo era del 90% de ganancia. Durante el estudio se aplicó una ganancia entre el 60 y el 90%, siendo de promedio del 80%, sin que se observaran diferencias entre los 2 grupos en los días analizados (tablas 2–4).
El fracaso de la PAV+ mostró una tendencia no significativa a aumentar los días de ventilación mecánica (10 días [7-16] vs. 7 días [5-16]; p=0,4) (tabla 2). Finalmente, 2 pacientes en cada grupo murieron durante su estancia en UCI.
DiscusiónLa PAV+, como primera opción ventilatoria en pacientes agudos, fue aplicada con éxito en las dos terceras partes de los casos. Por otro lado, el WOBTOT supuso un buen predictor para la aplicación de esta técnica. Estos hallazgos podrían ser útiles en un futuro para una mejor selección de pacientes.
Estudios previos han mostrado que la PAV, comparada con la PSV, aporta ventajas en términos de interacción paciente-ventilador para diferentes situaciones clínicas8,10,11,21. La mayor parte de estos estudios están enfocados a la aplicación de la PAV durante la fase de weaning o cortos períodos de tiempo en estudios fisiológicos. Los resultados muestran, en general, que la PAV proporciona un soporte seguro en el paciente crítico. La principal contribución de nuestro estudio es la identificación de los factores clínicos que están asociados al éxito-fracaso en la aplicación continua de este modo ventilatorio.
La primera nota de atención sobre el estudio fue la baja proporción de pacientes seleccionados (<20%). Probablemente, este hecho fue debido a nuestra actitud conservadora, excluyendo aquellos pacientes en los que se presumía una duración de la ventilación inferior a 24h, postoperados o con inestabilidad hemodinámica y/o respiratoria. Asimismo, el daño neurológico, la sedación profunda o la parálisis muscular son contraindicaciones per se en la PAV.
El fracaso clínico de la PAV+ estuvo siempre asociado con un elevado WOBTOT a pesar de la habilidad teórica de este modo ventilatorio para compensar deterioros importantes de la mecánica respiratoria. Consideramos que los pacientes con afectación importante de la musculatura respiratoria eran incapaces de afrontar esta situación clínica, aun cuando desarrollaban un mínimo WOB bajo ganancia elevada de la PAV+. El no haber incluido previamente en el protocolo la medición directa de la función muscular nos impide extraer mayores conclusiones en este campo. Por otro lado, la ausencia de diferencias significativas en el volumen minuto, la frecuencia respiratoria o la compliance podría estar relacionada con el pequeño tamaño de la muestra.
En el grupo de fracaso de la PAV+ se observó un aumento progresivo de las resistencias en la vía aérea, que al segundo día resultó significativo. Dicho dato no fue consistente en los días sucesivos, por lo que no se le dio relevancia. El hecho de que al tercer día existiesen menos pacientes en cada grupo ventilados en PAV+ no nos permite extraer más conclusiones. Por otro lado, el objetivo del estudio era estimar los valores predictores de fracaso en el primer día de inclusión.
La causa clínica más común adoptada por los clínicos como fracaso de la PAV+ fue la taquipnea (>40rpm). Dicho evento podría estar relacionado con el alto WOBTOT, a pesar de que los valores promedio de frecuencia respiratoria no llegaron a ser significativos entre los 2 grupos (tabla 2) debido a que los datos ventilatorios se recogían en un momento determinado del día y el episodio que motivaba el fracaso de la PAV+ se producía a lo largo de este período. Podrían existir diferentes hipótesis que explicasen la taquipnea observada por los clínicos: en primer lugar, el patrón ventilatorio adoptado en la PAV+ varía de forma amplia debido a la capacidad intrínseca de esta modalidad de reflejar los cambios fisiológicos inherentes del paciente para compensar su homeostasis interna ante diferentes situaciones clínicas y que, en muchas ocasiones, se encuentran enmascarados en otras modalidades ventilatorias22,23. En segundo lugar, cuando la taquipnea evidenciaba malestar (uso de musculatura accesoria, inestabilidad hemodinámica), podría estar reflejando una asincronía paciente-ventilador. Du et al.24 analizaron la sincronía paciente-ventilador bajo ventilación con PAV utilizando un simulador informático y voluntarios sanos. Se pudo llegar a constatar una asincronía significativa al final de la inspiración, consistente en un descenso retrasado del flujo inspiratorio del ventilador respecto al cese del esfuerzo muscular del paciente. Este fenómeno se pudo correlacionar con 3 factores: el retraso intrínseco de los procesadores del ventilador, el grado de asistencia (gain) y la constante de tiempo respiratorio. Este fenómeno de asincronía surgía de la combinación de altas Raw y gain programados altos. Este podría ser el caso de nuestro estudio, donde los gain programados eran siempre altos y existió un aumento significativo de las resistencias en la vía aérea en el grupo de fracaso durante el segundo día (tabla 3), lo que podría explicar este fenómeno; sin embargo, se mantiene como hipótesis.
Dentro de los pacientes con taquipnea solo uno mostró altas Paw. Georgopoulos et al.22 atribuyeron las Paw elevadas a una liberación inadecuadamente excesiva de presión o volumen, el denominado fenómeno runaway, y la falta de linealidad en la relación presión-volumen y presión-flujo25. Observaron, asimismo, que dicho fenómeno era extremadamente infrecuente con gain<85%. En nuestro estudio, aunque el gain objetivo inicial era del 90%, el medio aplicado fue del 80% para ambos grupos. De la misma manera, en el estudio de Xirouchaki et al.14, también con alto nivel de gain, la Pplateau fue<30cmH2O en el 98% de los casos y<26cmH2O en el 94%. Estos resultados concuerdan con los propuestos por Younes et al.25, que evidenciaban que la PAV activaba el reflejo de Hering-Breuer inhibiendo la musculatura inspiratoria cuando los pulmones alcanzan su capacidad total, reduciendo, por tanto, el riesgo de hiperinsuflación.
La PaCO2 elevada fue interpretada por los clínicos como hipercapnia en un tercio de los pacientes en los que fracasó la PAV+ y fue clínicamente atribuido a un exceso de sedación. Asimismo, tampoco se pudo constatar una diferencia significativa de los valores en la comparación de fracaso vs. éxito (tabla 2). La ausencia de diferencias también podría ser explicable por el hecho de que los datos analizados son los planteados en el protocolo como recogida diaria de datos y que no se llega a registrar la PaCO2 en el momento que se considera fracaso de la técnica y que corresponde a cualquier gasometría de control rutinario que se realizaba a lo largo del día. La PaCO2 elevada constituye una de las cuestiones críticas de la PAV+ por ser especialmente vulnerable al exceso de sedación, inhibiendo el control central del patrón ventilatorio y amortiguando la capacidad de feedback. Xirouchaki et al.14 también informaron de tal evento debido al exceso de sedación. Consideraron que el control de la sedación constituye uno de los pilares en el proceso de aprendizaje del manejo de la PAV, así como la necesidad de protocolos que minimizaran el riesgo de sedación inapropiada. A pesar de existir en nuestro estudio un objetivo de Ramsay de 3-4, donde teóricamente los pacientes son capaces de autorregular su homeostasis interna, en nuestro estudio pudimos constatar una variabilidad interindividual en la que existía un estrecho margen entre la sedación profunda (Ramsay 5-6), la superficial o la agitación (Ramsay 1), que hacía difícil en algunos casos conseguir tal objetivo. Es por ello que estamos de acuerdo con la opinión de Xirouchaki et al.
No se observaron diferencias significativas en el intercambio gaseoso (PaO2/FiO2, PaCO2 y pH) en ninguno de los 2 grupos, como ya se ha constatado en estudios previos10,13,14, mostrando la habilidad de la PAV para mantener la homeostasis sanguínea. Sin embargo, en nuestro estudio hubo un caso de acidosis metabólica y 2 de hipercapnia que fueron interpretados como fracaso de la PAV+ por exceso de sedación, pero que no llegan a ser registrados en los datos analizados.
En resumen, las causas clínicas de suspensión del tratamiento no llegaron a constatarse estadísticamente. Constituyeron decisiones clínicas individuales en momentos concretos que fueron interpretadas con la suficiente relevancia como para motivar el cambio de modalidad. Posiblemente, un aumento en el número de pacientes podría mostrar tales diferencias con el grupo de éxito.
Nuestro objetivo de conseguir el máximo soporte ventilatorio en la fase aguda con alta asistencia de PAV+ fue mayormente conseguida. A pesar de que el objetivo inicial fue una asistencia del 90%, se consiguió para ambos grupos el 80%, lo cual suponía igualmente la asistencia de la mayor parte del WOB por parte del ventilador. Delaere et al.26 demostraron que una PAV del 80% suponía un elevado nivel de asistencia ventilatoria en términos de trabajo de la musculatura respiratoria comparado con una PAV del 50%. Xirouchaki et al.14 compararon la efectividad de la PAV+ frente a la PSV en la fase aguda del paciente crítico, aunque solo durante 48h. PAV+ se aplicó con éxito en el 89% de los casos frente a PSV en términos de asincronía. Concluyeron que la PAV+ incrementaba la probabilidad de mantenerse bajo respiración espontánea debido a la mejor interacción paciente-ventilador. Las causas de fracaso de la PAV+ estuvieron asociadas con disincronías (particularmente esfuerzos ineficaces) y deterioros clínicos (inestabilidad hemodinámica, distrés respiratorio e hipercapnia). Sin embargo, no profundizaron en los factores asociados con el fracaso. Nuestro bajo índice de éxito de PAV+ (60%) respecto al mencionado estudio puede ser atribuible a que la inclusión de pacientes fue más temprana, así como a un mayor tiempo de aplicación (>48h).
Limitaciones del estudioDada la ausencia de estudios clínicos que determinen la eficacia de esta modalidad en la fase inicial, la selección de pacientes fue muy cautelosa, seleccionando aquellos cuya situación clínica no fuera de tal gravedad que requiriera medidas terapéuticas agresivas adicionales, ni tampoco aquellos pacientes donde se presuponía una extubación rápida. Ello explica la baja inclusión de pacientes respecto al número total de individuos analizados, así como que en las primeras horas de ingreso (siempre dentro de las primeras 24h) el paciente estuviera en ACV hasta conseguir una respiración espontánea suficiente que asegurara la capacidad de ajustar la homeostasis interna, tras optimización de la sedación. Este estudio fue realizado durante la actividad clínica rutinaria y los datos fueron obtenidos en cada paciente solo una vez por día. Por tanto, dado que el patrón respiratorio de la PAV+ puede variar constantemente según el estado clínico del paciente (fiebre, dolor, ansiedad, etc.), nuestros resultados pueden estar afectados por el mero hecho del momento de la recogida de los datos.
En el presente estudio, a pesar de que la sedación no fue protocolizada, las 3 unidades participantes utilizaron la escala de sedación de Ramsay. Sin embargo, la utilización de diferentes tipos de sedantes podría afectar al grado y duración de la sedación y, en consecuencia, a la preservación del control central. La falta de un protocolo unificado de weaning podría haber influido en la decisión de los profesionales a la hora de reducir la alta asistencia ventilatoria y proseguir con el weaning.
En resumen, hay que tener en cuenta que se trata de un estudio piloto con una muestra muy pequeña y heterogénea, con poca capacidad para identificar todos los posibles factores asociados al fracaso, limitando una interpretación más amplia de los resultados y requiriendo en el futuro la comparación con modalidades ventilatorias utilizadas rutinariamente en la fase aguda.
Finalmente, concluimos que la alta asistencia de PAV+ es aplicable como alternativa ventilatoria en la fase aguda de un grupo sustancial de pacientes, fundamentalmente en aquellos sin deterioro importante del WOBTOT, pudiendo utilizarse el WOB como predictor del éxito o fracaso de la técnica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Hospital Sant Joan de Déu, Fundación Althaia; Hospital Clínic de Barcelona; Hospital General de Cataluña.
Denominación del comité ético y número de aprobación del proyecto: Comité Ètic d’Investigació Clínica Fundació Unió Catalana d’Hospitals. Número de aprobación: no dispone de número. Fecha de aprobación: 4 de septiembre de 2008.