El fallo multiorgánico tras el trauma grave constituye una de las principales causas de morbimortalidad tardía en este grupo de pacientes. En su fase precoz, es consecuencia de un estado de hiperinflamación no controlado, mientras que en su presentación tardía (>72h) se relaciona principalmente con las complicaciones infecciosas. Se resumen los mecanismos fisiopatológicos implicados en su desarrollo, la valoración mediante diferentes escalas y los factores clínicos asociados, además de las potenciales opciones de tratamiento.
Multiorgan failure remains one of the leading causes of late morbidity and mortality after severe trauma. In the early phase, it is related with an uncontrolled hyper-inflammation state, whereas in the late phase (>72h), septic complications play a major role. We review the underlying pathophysiology, the evaluation with different scales and the clinical factors associated with multiorgan failure, as well as potential treatment options.
El desarrollo del fallo multiorgánico (FMO) después del trauma grave constituye una de las principales causas de mortalidad tardía en estos pacientes1,2. Su incidencia oscila entre el 7-66% y, a pesar de los recientes avances en el manejo prehospitalario y hospitalario de los pacientes, se asocia a una elevada mortalidad y prolongada estancia hospitalaria1–5. Aunque existe consenso en considerarlo un proceso evolutivo, su definición no es uniforme6. Su fisiopatología es controvertida, implicando a diferentes componentes del sistema inmune e inflamatorio7,8.
El objetivo de este artículo es revisar los conocimientos actuales en cuanto a la epidemiología y fisiopatología, revisar las escalas de valoración del FMO y los factores clínicos asociados al desarrollo del mismo, y evaluar las posibilidades de tratamiento.
DefiniciónHasta el momento, no existe una definición uniforme del FMO postraumático6. Por ello, se han desarrollado diferentes escalas que evalúan la función respiratoria, cardiovascular, hepática, renal, la afectación neurológica y el estado de la coagulación. Entre estas escalas destacan las de Denver, Marshall y Sequential-related Organ Failure Assessment (SOFA). Estas escalas se revisarán más adelante.
Aun con estas limitaciones en la definición de la entidad, sí existe cierto consenso en considerar un FMO precoz cuando acontece en las primeras 72h tras el traumatismo (aproximadamente un 40% de los casos) y tardío cuando la aparición es posterior al tercer día del traumatismo (un 60% de los casos)6.
Aspectos epidemiológicosEl FMO postraumático constituye la causa principal de mortalidad tardía en el trauma grave, siendo responsable de un 50-60% de estas muertes1–6. Los pacientes que desarrollan un FMO postraumático tienen una estancia en la unidad de cuidados intensivos (UCI) más prolongada. La mortalidad asociada oscila entre el 27-100%, siendo esta creciente en relación con el mayor número de órganos afectos6,8,9. En 1980, Fry et al.8 ya mostraron que la mortalidad aumentaba desde un 30% cuando se producía disfunción de un órgano hasta el 100% si existía disfunción de 4 órganos. Un estudio de un solo centro de referencia en la atención al trauma grave en Estados Unidos con datos recogidos de modo prospectivo durante un período de 12 años, mostró que la incidencia, duración y mortalidad del FMO se ha reducido en los últimos años, algo que se relaciona con los avances y nuevas modalidades de tratamiento en el manejo de los pacientes con trauma grave y un descenso en el número de transfusiones1. Un estudio multicéntrico reciente que incluyó a 1.643 pacientes traumáticos mostró una disminución de la incidencia de casi un 50%, aunque la mortalidad relacionada siguió siendo muy alta2.
La incidencia es mayor en los pacientes con trauma cerrado y en estos casos se asocia a una mayor mortalidad respecto al trauma penetrante1,6.
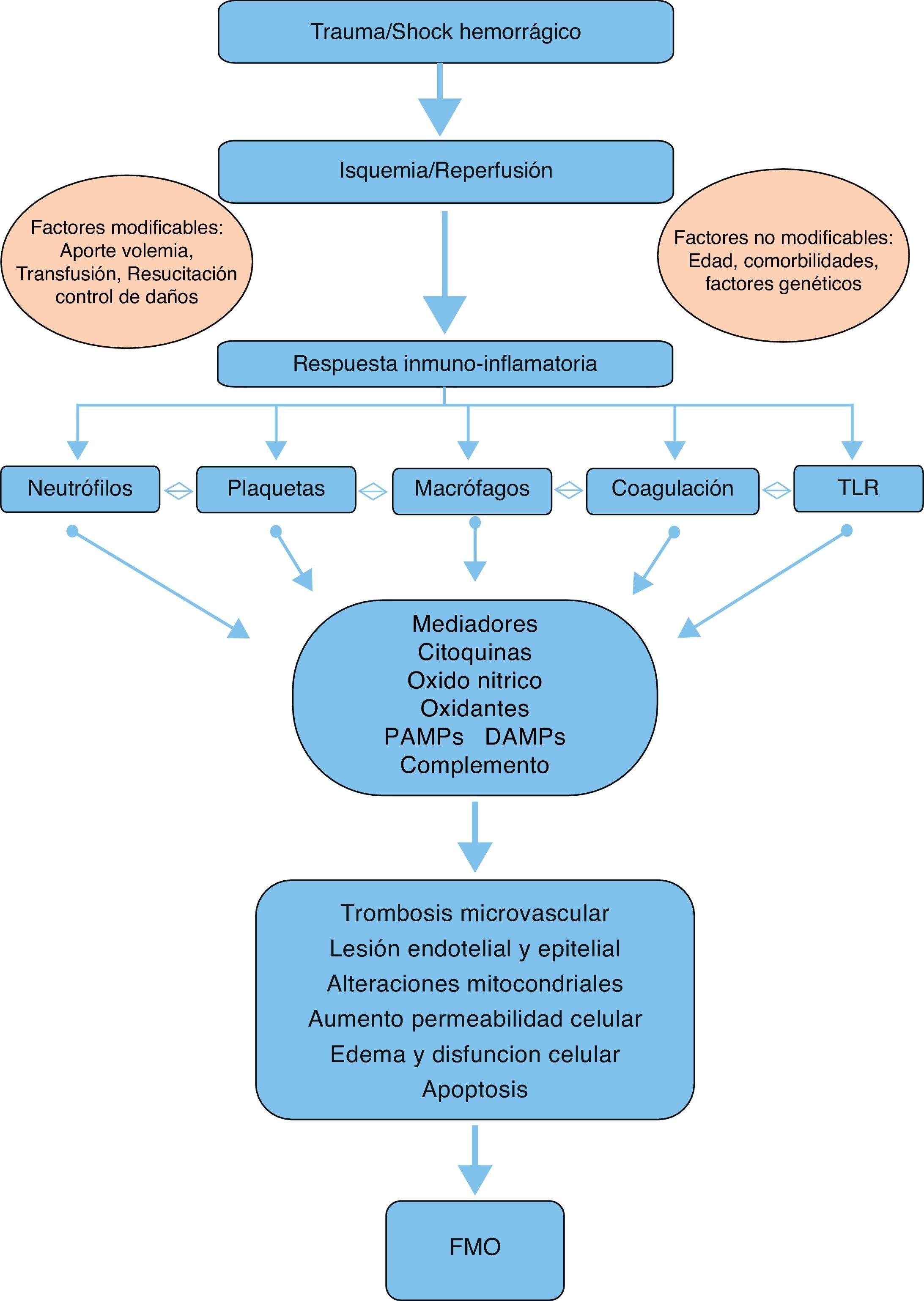
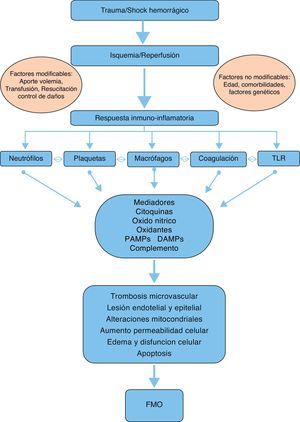
FisiopatologíaAunque la fisiopatología del FMO en el trauma grave todavía no es bien conocida y ha evolucionado en los últimos 30 años, en la actualidad se acepta que existe un fenómeno bimodal con 2 picos de presentación, como consecuencia de una alteración en el balance de la respuesta inflamatoria sistémica seguida de un fenómeno de isquemia-reperfusión tras el shock hemorrágico, en contraste con las teorías iniciales que sugerían una infección generalizada como causante único del FMO6,9.
Así, en el FMO precoz parece desempeñar un papel determinante la insuficiencia respiratoria, que ocurre en el 99% de los casos y habitualmente precede a la disfunción cardiaca en unas horas y a la disfunción hepática y renal en aproximadamente 5 días10. Por otro lado, en el FMO tardío que ocurre a partir de las 72h es necesario un segundo golpe (hit en terminología anglosajona)6, que habitualmente es un proceso infeccioso, en la mayor parte de las ocasiones de origen pulmonar10.
En el desarrollo del FMO postraumático intervienen diversos mediadores y «efectores» que pueden intervenir en su fisiopatología (fig. 1):
Mediadores:- -
Citocinas: El equilibrio entre las citocinas proinflamatorias y antiinflamatorias tiene un papel fundamental en el mantenimiento de la homeostasis. Tras un trauma grave, existe una sobreproducción de citocinas proinflamatorias, como factor de necrosis tumoral-alfa (TNF-α), interleucina (IL)-1β, IL-6 e IL-8 por parte de los monocitos y macrófagos como parte de la respuesta en fase aguda, contribuyendo al inicio y perpetuación de la respuesta inflamatoria local y sistémica7,11. El TNF-α aumenta la producción de óxido nítrico y activa la ciclooxigenasa, resultando en un aumento y liberación de tromboxanos, prostaglandinas y factor activador de plaquetas con un consecuente aumento de actividad procoagulante7,12. Por su parte, la IL-6, producida por diferentes células como monocitos activados, macrófagos, neutrófilos y células endoteliales desempeña un papel importante en la respuesta aguda, interviniendo en la producción de proteína C reactiva, procalcitonina, fribrinógeno, α-1-antitripsina y factores de complemento6. Además regula el crecimiento y diferenciación de los linfocitos y activa células «natural killer» y neutrófilos. Existe consenso en que la determinación de IL-6 es un buen parámetro para estimar la gravedad y el pronóstico del trauma13. La IL-8 participa en el reclutamiento leucocitario facilitando además su activación en el lugar de la lesión. Sus niveles se correlacionan con el desarrollo de síndrome de distrés respiratorio agudo tras el trauma grave7. De entre las citocinas antiinflamatorias, destaca el papel de la IL-10, sintetizada por linfocitos y monocitos. Su papel fundamental es la inhibición de la producción de TNF-α, IL-6 e IL-87.
- -
Sistema complemento: La activación del sistema de complemento puede ocurrir tras el trauma grave a través de cualquiera de las vías conocidas (alternativa, clásica, lectina), generándose así péptidos biológicamente activos, que desempeñan un papel fundamental a través de diversos mecanismos7,14: eliminación de patógenos invasivos a través de opsonización en fagocitosis (C3b, C4b), quimiotaxis de leucocitos (C3a, C5a), y lisis de patógenos a través del complejo de ataque de membrana (C5b-9). Además, las anafilotoxinas C3a, C4a y C5a atraen fagocitos y leucocitos polimorfonucleares (PMN) hacia el lugar de la lesión15,16 e inducen la degranulación de mastocitos, basófilos y eosinófilos7,14. La investigación experimental y clínica ha demostrado que la activación del complemento ocurre tanto a nivel local, en el lugar de la lesión, como de modo sistémico tras el trauma14. Los niveles de C3 plasmáticos en pacientes traumáticos se correlacionan con la gravedad del traumatismo y las complicaciones infecciosas y mortalidad tras el trauma16.
- -
«Pathogen-associated molecular patterns» (PAMP), «damage-associated molecular patterns» (DAMP) y alarminas: Los PAMP constituyen unas moléculas inflamatorias relacionadas con la activación del sistema innato inmune en casos de infección, mientras que las alarminas representan su equivalente en ausencia de un proceso infeccioso y presencia de lesión tisular14. Entre ellas destacan las proteínas «heat-shock», anexinas, defensinas, HMGB1 y S100. Ambas familias se han agrupado en una familia mayor de DAMP, que son reconocidas por el sistema inmune a través de receptores multiligando como los receptores toll-like17. Sin embargo, su papel definitivo en el desarrollo de FMO todavía no está bien definido14.
- -
Neutrófilos: Los leucocitos PMN, monocitos, macrófagos, células dendríticas y células «natural killer» desempeñan un papel relevante en la respuesta inmune celular tras el trauma6–9,18. Los neutrófilos son atraídos al lugar de la lesión por las quimiocinas, como la IL-8, participando en la defensa y desbridamiento del tejido lesionado. Además, participan en la activación de moléculas como el TNF-α, IL-8, factor activador de plaquetas y anafilotoxina (C5a), llevando a un estado de hiperinflamación y activación y reclutamiento de PMN, contribuyendo al desarrollo del síndrome de respuesta inflamatoria sistémica y del FMO6–8,19. Esta movilización de los PMN resulta en una neutrofilia 3h después de la lesión, lo que representa una ventana «vulnerable» en la que un segundo hit puede desencadenar un FMO6,20. En los pacientes que desarrollan FMO, la neutrofilia se sigue de una neutropenia a las 6-12h tras el trauma6. Además, los PMN inducen lesión endotelial y epitelial a través de la sobrerregulación de moléculas de adhesión en las células, lo que lleva a modificaciones de la permeabilidad y edema celular con disfunción celular7.
- -
Isquemia-reperfusión: El fenómeno de isquemia-reperfusión en trauma ocurre en 2 fases: una primera donde se produce una transitoria deprivación de nutrientes y oxígeno por la falta de aporte sanguíneo de manera que se cambia el metabolismo aerobio a anaerobio a nivel celular, y una posterior donde se produce un retorno del aporte sanguíneo y suplemento de oxígeno al tejido isquémico7. En la fase isquémica, la hipoxemia conduce a una baja producción y un consumo elevado de adenosín trifosfato, que es degradado a adenosín difosfato y este a inosina e hipoxantina21, desencadenando alteraciones en la permeabilidad con aumento del sodio intracelular que ocasiona edema celular y disrupción de la membrana7,22. Además, esta depleción de adenosín trifosfato produce daño celular mediado por alteraciones en las concentraciones de calcio citosólico23,24. La fase de reperfusión tiene mayor importancia en cuanto al daño tisular y el FMO. En esta fase, la hipoxantina se degrada a xantina y finalmente a ácido úrico a través de la xantina oxidasa, con producción de aniones superóxido (O2+−) del oxígeno disponible. Estos se reducen además a peróxido de hidrógeno (H2O2) e iones hidroxilo (OH2+−) por la superoxidodismutasa. Estos radicales libres potencian las alteraciones de la homeostasis del calcio intracelular e inducen peroxidación lipídica, desintegración membranosa y alteraciones en el ácido desoxirribonucleico, con resultado de apoptosis y necrosis celular22.
- -
Hipótesis intestinal: Las alteraciones en la estructura y permeabilidad de la mucosa intestinal tienen un papel fundamental como fuente de productos bacterianos y mediadores antiinflamatorios que pasan a la circulación sistémica para dañar diferentes órganos. Dos factores fundamentales pueden contribuir a este fenómeno: estasis intestinal que permite el sobrecrecimiento bacteriano, e isquemia-reperfusión, que incrementa la permeabilidad intestinal. Sin embargo, los mecanismos últimos implicados no están bien establecidos6.
Como se ha mencionado previamente, no existe una definición uniforme del FMO postraumático6. Sin embargo, se han desarrollado diferentes escalas que evalúan la función respiratoria, cardiovascular, hepática, renal, la afectación neurológica y el estado de la coagulación. Las más ampliamente utilizadas se resumen a continuación.
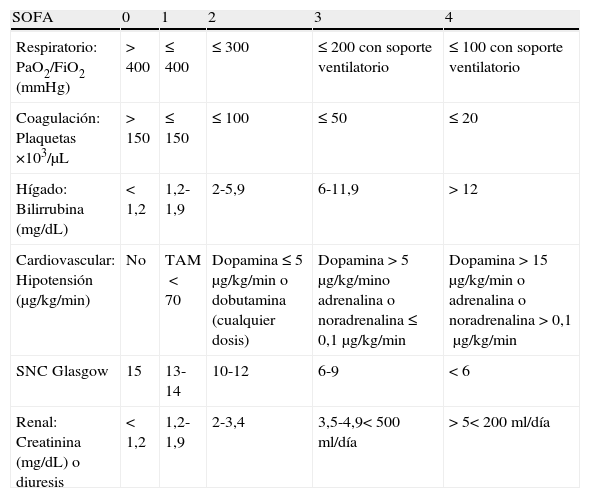
Escala Sequential-related Organ Failure AssessmentFue descrita en 1994, promovida por la European Society of Intensive Care Medicine para disponer de una herramienta objetiva que valorara cuantitativamente la disfunción o fallo de órganos a lo largo del tiempo y que por tanto sirviera también para evaluar la respuesta al tratamiento23. Esta escala puntúa 6 órganos de 0 a 4 según el grado de disfunción que presentan (tabla 1). Se define FMO como la afectación de 2 o más órganos con una puntuación igual o mayor de 3 23. Aunque el objetivo inicial de la escala SOFA era evaluar la morbilidad, se ha observado una buena correlación entre la puntuación máxima obtenida y la mortalidad. De esta forma, la mortalidad es mayor del 90% en aquellos pacientes con una puntuación mayor de 15 (con una especificidad de casi el 99%)24.
Escala SOFA
| SOFA | 0 | 1 | 2 | 3 | 4 |
| Respiratorio: PaO2/FiO2 (mmHg) | >400 | ≤400 | ≤300 | ≤200 con soporte ventilatorio | ≤100 con soporte ventilatorio |
| Coagulación: Plaquetas ×103/μL | >150 | ≤150 | ≤100 | ≤50 | ≤20 |
| Hígado: Bilirrubina (mg/dL) | <1,2 | 1,2-1,9 | 2-5,9 | 6-11,9 | >12 |
| Cardiovascular: Hipotensión (μg/kg/min) | No | TAM<70 | Dopamina≤5μg/kg/min o dobutamina (cualquier dosis) | Dopamina>5μg/kg/mino adrenalina o noradrenalina≤0,1μg/kg/min | Dopamina>15μg/kg/min o adrenalina o noradrenalina>0,1μg/kg/min |
| SNC Glasgow | 15 | 13-14 | 10-12 | 6-9 | <6 |
| Renal: Creatinina (mg/dL) o diuresis | <1,2 | 1,2-1,9 | 2-3,4 | 3,5-4,9<500 ml/día | >5<200ml/día |
Glasgow: puntuación en la escala de coma de Glasgow; TAM: presión arterial media; SNC: sistema nervioso central.
Antonelli et al.25 evaluaron esta escala en pacientes traumáticos y observaron que los no supervivientes tenían una peor puntuación a nivel respiratorio, cardiovascular y neurológico, especialmente durante los primeros 5 días de ingreso. En este contexto, la evaluación neurológica es la más complicada de realizar en ciertos casos, tanto por la interferencia que puedan ocasionar los fármacos sedantes como por la presencia de un traumatismo craneoencefálico. Recientemente esta escala ha sido empleada por un grupo alemán en la mayor serie de pacientes traumáticos publicada hasta la fecha evaluando el FMO en 31.154 pacientes26. Los autores hallaron una incidencia del 32%, lo que podría hacer pensar que esta escala pueda sobreestimar la incidencia de FMO postraumático. Esta escala, desarrollada a nivel europeo, se emplea en el registro nacional de trauma en UCI (RETRAUCI) para valorar la incidencia de FMO27.
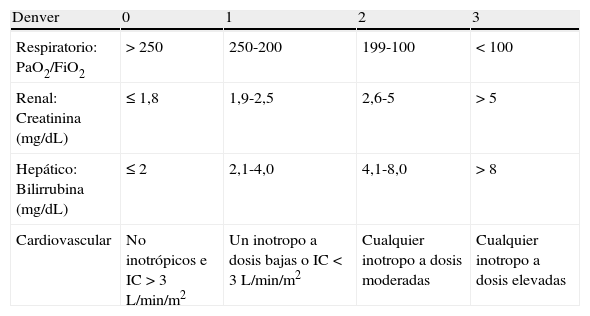
Escala de DenverEl grupo de Denver desarrolló por primera vez en 1987 una escala para definir el FMO28. Se evalúan 4 sistemas puntuándolos de 0 a 3 (tabla 2). El fallo de un órgano viene definido con una puntuación por encima de 0 y el FMO como el fracaso de 2 o más órganos con una puntuación total igual o mayor a 4 transcurridas las primeras 48h tras el trauma28. La validez de esta escala ha sido revisada en varias ocasiones desde su definición y algunos parámetros originales han sufrido modificaciones, fundamentalmente en el apartado respiratorio y cardiovascular. En su versión actualizada se evalúan los parámetros descritos en la tabla 2.
Escala de Denver
| Denver | 0 | 1 | 2 | 3 |
| Respiratorio: PaO2/FiO2 | >250 | 250-200 | 199-100 | <100 |
| Renal: Creatinina (mg/dL) | ≤1,8 | 1,9-2,5 | 2,6-5 | >5 |
| Hepático: Bilirrubina (mg/dL) | ≤2 | 2,1-4,0 | 4,1-8,0 | >8 |
| Cardiovascular | No inotrópicos e IC>3L/min/m2 | Un inotropo a dosis bajas o IC<3 L/min/m2 | Cualquier inotropo a dosis moderadas | Cualquier inotropo a dosis elevadas |
IC: índice cardiaco.
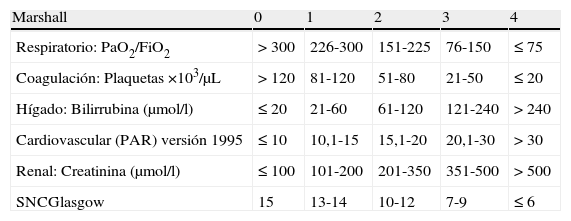
En los años 90, Marshall et al. presentaron una nueva escala para definir el FMO29. Evaluaron 6 sistemas puntuándolos de 0 a 4 (tabla 3), recogiendo siempre los parámetros en el mismo momento del día (el primer valor de la mañana). Esta escala no considera unos valores específicos como indicativos de FMO como tal, sino que establece unos intervalos de gravedad que se definieron por la mortalidad observada. Así, no se observó ningún fallecido en pacientes con una puntuación de 0. La mortalidad fue del 25% en aquellos que presentaban una puntuación entre 9-12, del 50% entre 13-16, del 75% entre 17-20 y del 100% con una puntuación por encima de 20. También se observó una buena correlación con la estancia hospitalaria. Al igual que en la escala SOFA, en la escala de Marshall se evalúa la situación neurológica. En este caso, se asume una puntuación en la escala de coma de Glasgow de 15 en los pacientes sedados. Por otro lado, ante la dificultad de encontrar el parámetro óptimo para valorar el aspecto hemodinámico, se definió una variable nueva (Pressure adjusted heart rate [PAR]) en la versión actualizada en 1995, cuyo valor es el cociente que resulta del producto de la frecuencia cardiaca y la presión venosa central entre la tensión arterial media.
Escala de Marshall
| Marshall | 0 | 1 | 2 | 3 | 4 |
| Respiratorio: PaO2/FiO2 | >300 | 226-300 | 151-225 | 76-150 | ≤75 |
| Coagulación: Plaquetas ×103/μL | >120 | 81-120 | 51-80 | 21-50 | ≤20 |
| Hígado: Bilirrubina (μmol/l) | ≤20 | 21-60 | 61-120 | 121-240 | >240 |
| Cardiovascular (PAR) versión 1995 | ≤10 | 10,1-15 | 15,1-20 | 20,1-30 | >30 |
| Renal: Creatinina (μmol/l) | ≤100 | 101-200 | 201-350 | 351-500 | >500 |
| SNCGlasgow | 15 | 13-14 | 10-12 | 7-9 | ≤6 |
FC: frecuencia cardiaca; Glasgow: puntuación en la escala de coma de Glasgow; TAM: presión arterial media; PAR: pressure adjusted heart rate; PVC: presión venosa central; SNC: sistema nervioso central.
PAR=FC×PVC/TAM.
Factor conversión bilirrubina: 1mg/dL=17,1μmol/L.
Factor conversión creatinina: 1mg/dL=88,4μmol/L.
Algunos estudios han comparado las diferentes escalas mencionadas previamente. Un trabajo alemán analizó el rendimiento de las escalas de Goris, Marshall y Denver, siendo superior la escala de Denver con una sensibilidad del 81% y una especificidad del 88%30. Los autores reseñaron que la escala de Denver no incluyó evaluaciones más complejas como los valores de aspartato transaminasa (GOT) o PAR, que tuvieron escasa influencia en los cálculos efectuados. Unos años más tarde, el grupo de Denver comparó su escala con la de Marshall en pacientes de su base de datos con trauma grave y excluyendo los traumatismos craneoencefálicos puros o aquellos con un Abbreviated Injury Scale extracraneal menor de 2. El análisis con curvas ROC mostró resultados similares, aunque la escala de Denver presentó una mayor especificidad y una mayor capacidad de evaluar la respuesta al tratamiento31. Diversos estudios han comparado la escala SOFA con la escala de Marshall, aunque ninguno en una población específica de pacientes traumáticos.
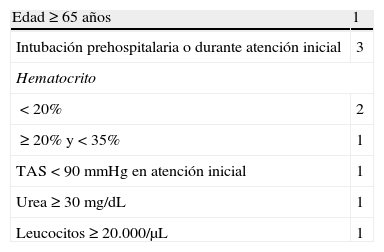
Recientemente se ha definido una nueva escala, Denver Emergency Department Trauma Organ Failure Score («Denver ED TOF Score»)32. Es la primera vez que se propone una escala cuyo objetivo es poder predecir precozmente (en las primeras 4h tras el trauma) el desarrollo de FMO en los 7 primeros días de ingreso. Incluye variables prehospitalarias y de la atención inicial en el box de emergencias (tabla 4). La puntuación tiene un rango de 0 a 9 y los autores indican un mayor riesgo de FMO con puntuaciones mayores con excelente calibración y discriminación. Esta escala no solo podría ayudar a identificar a los pacientes en estadios tempranos de desarrollo de FMO, sino resultar útil como herramienta de triage para realizar el traslado a un centro de referencia. La principal limitación del estudio radica en la menor gravedad de los pacientes (mediana Injury Severity Score [ISS] 9 con rango intercuartílico 4-16), el tratarse de un análisis secundario de una base de datos no diseñada para este propósito y la ausencia de validación externa.
Factores pronósticos de desarrollo de fallo multiorgánico tras trauma graveDiferentes parámetros se han asociado con un mayor riesgo de desarrollar FMO postraumático. Entre ellos, los más repetidos en la literatura son los siguientes:
- -
Edad: En los últimos años hemos asistido a un aumento en la edad de los pacientes con patología traumática. La edad es considerada en diversos estudios un factor de riesgo independiente de desarrollar FMO, empleando diferentes puntos de corte, principalmente 55 o 65 años1,5,26,33.
- -
Género: En los estudios previos el género masculino no se había considerado un factor de riesgo en el desarrollo de FMO postraumático. Sin embargo, en el reciente registro alemán el género masculino (un 73,1% de todos los pacientes) fue considerado como un factor de riesgo en el análisis multivariado26. Dicho resultado podría estar mediado por unos mayores niveles de IL-6 en los hombres tras el trauma grave34.
- -
Gravedad del trauma: La gravedad del trauma, evaluado por el ISS se considera un factor de riesgo de modo consistente1,2,4,26,33, siendo el punto de corte más utilizado una puntuación de 24. Sin embargo, algunos autores creen que el ISS ha perdido valor como predictor de FMO, puesto que puede infraestimar la gravedad en los pacientes con varias lesiones en un área anatómica. De hecho, el ISS ha sido comparado con el New Injury Severity Score (NISS) como factores predictores de desarrollo de FMO en una población reducida de pacientes35, siendo superior el NISS. Sin embargo, el uso esta escala, aunque atractiva, no se ha generalizado en los grandes registros de trauma.
- -
Traumatismo craneoencefálico: Entre las diferentes regiones corporales analizadas en el ISS, una puntuación en el Abbreviated Injury Scale≥3 en la cabeza se relaciona con un mayor riesgo de padecer FMO27,34, así como presentar una puntuación inicial en la escala de coma de Glasgow≤826.
- -
Hemoderivados: Es bien conocido que los hemoderivados contienen una elevada carga de mediadores que actúan como inmunomoduladores. Por ello, su uso está relacionado con una mayor incidencia de infecciones nosocomiales, FMO y mortalidad. Muchos son los estudios que han demostrado que la transfusión de más de 6 concentrados de hematíes en las primeras horas constituye un factor independiente para el desarrollo de FMO1,26,33. Además, la edad de los concentrados está asociada también a un mayor riesgo de desarrollarlo36. La transfusión de plasma fresco congelado supone también un factor de riesgo para desarrollar síndrome de distrés respiratorio agudo y FMO37, no así la transfusión de plaquetas.
- -
Coagulopatía y trombocitopenia: Es bien conocido el papel pronóstico de las alteraciones de la coagulación y recuento plaquetario en el FMO postraumático. Recientemente se ha correlacionado el número de plaquetas en las primeras horas de ingreso como predictor independiente de FMO en diferentes puntos de corte y tiempo tras el trauma: valores por debajo de 80.000/μL a 150.000/μL entre el ingreso y las primeras 24h han sido evaluados. Además, aquellos pacientes que continúan presentando niveles bajos de plaquetas transcurridos varios días tienen un peor pronóstico38.
- -
Situación hemodinámica y lactato: La situación hemodinámica al ingreso, evaluada a través de parámetros de shock como la tensión arterial sistólica (≤90mmHg), el déficit de bases o el valor de lactato, han demostrado ser también factores de riesgo1,26. En el caso del lactato, no solo tiene valor pronóstico su valor inicial, sino también el tiempo transcurrido hasta la normalización si esta ocurre39.
- -
Otros factores que se ha sugerido que pueden desempeñar un papel en la predicción de desarrollo de FMO son las cifras de bilirrubina mínima o la creatinina máxima en las primeras 24h. También la obesidad puede tener un papel. Sin embargo, la evidencia que apoya estos factores es mucho más limitada.
Aunque no existe un tratamiento específico del FMO una vez que este se ha desarrollado, se considera que la incidencia ha disminuido en los últimos años debido a los avances en el manejo general de los pacientes traumáticos críticos y en la corrección precoz del shock1,2,6,26. Más controvertido resulta el considerar que la mortalidad se ha reducido en los últimos años, si tenemos en cuenta los resultados publicados recientemente por el grupo alemán26. Algunas estrategias del manejo precoz de estos pacientes parecen contribuir a evitar el desarrollo de FMO1,6, y entre ellas destacan:
- -
Soporte cardiorrespiratorio: Inicialmente, las recomendaciones de manejo de los pacientes con shock traumático aconsejaban alcanzar unos parámetros que suponían un transporte de oxígeno supranormal. Sin embargo, en los últimos años se ha modificado el concepto general de manejo de estos pacientes, orientándose hacia una hipotensión permisiva, corrección de la hipotermia, coagulopatía y la acidosis40,41. De este modo se consigue disminuir el aporte de cristaloides, la incidencia de síndrome compartimental abdominal, FMO y muerte42. Merece destacarse que la presencia de traumatismo craneoencefálico obliga a mantener unos objetivos de tensión arterial más elevados.
- -
Cirugía de control de daños y desbridamiento focos infecciosos: El primer objetivo es el control del foco hemorrágico evitando intervenciones prolongadas, en un intento de no agravar la acidosis y coagulopatía. Además, así se limita la liberación de mediadores inflamatorios en la fase aguda22. También, el desbridamiento de focos infecciosos con resección de tejidos no viables, empleo de sistemas de vacío e intervenciones en segundo tiempo contribuyen a disminuir las complicaciones infecciosas que desempeñan un papel muy importante en el FMO tardío.
- -
Aporte de volemia y hemoderivados: Este aspecto resulta todavía controvertido, aunque la tendencia en el momento actual es aportar menores volúmenes de cristaloides. Además, puesto que se conoce que la transfusión de hemoderivados se asocia de modo significativo con el desarrollo de FMO1,26,33, se recomienda una actitud más restrictiva para evitar transfusiones innecesarias, aunque este es un aspecto en continua discusión.
- -
Otros: Diferentes medidas de tratamiento empleadas en los pacientes críticos en general, como la ventilación mecánica protectora, soporte nutricional adecuado, tratamiento de la hiperglucemia con insulina o el tratamiento sustitutivo suprarrenal, aunque controvertidas en la población general de pacientes en UCI, podrían tener un papel en la disminución de la incidencia del FMO postraumático.
En resumen, el FMO postraumático continúa siendo una importante causa de morbimortalidad en el paciente con trauma grave. Su verdadera incidencia todavía no está bien establecida debido a las diferentes definiciones empleadas. El registro RETRAUCI, promovido por el grupo de trabajo de Trauma y Neurocríticos de la SEMICYUC ayudará a definir la incidencia en nuestro medio. Su pronóstico ha mejorado en los últimos años, probablemente debido a las mejoras en el manejo general de los pacientes traumáticos críticos. Mientras algunos factores no modificables como la mayor edad y comorbilidades de los pacientes traumáticos en la actualidad implican un peor pronóstico de estos pacientes, la aplicación de protocolos uniformes de resucitación de control de daños, sedación y reposición de líquidos parece haber mitigado el efecto negativo de los factores no modificables anteriormente citados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.