Resucitación del paciente con sepsis y shock séptico
Más datosLa reanimación con fluidos es una parte crucial en el tratamiento de la hipotensión y el shock de cualquier etiología y, particularmente en el shock séptico, un elemento esencial del bundle de atención inicial. Como todos los tratamientos en sepsis, también está expuesto a múltiples controversias: qué tipo de fluido, qué cantidad, en cuánto tiempo se administra, cuáles son los potenciales riesgos y la toxicidad. La principal guía, la Surviving Sepsis Campaign, sigue indicando los cristaloides como principal fluido en la reanimación. Pero la posibilidad de cristaloides balanceados sobre el suero salino al 0,9% o el uso combinado con albúmina en la reanimación del paciente séptico siguen en debate. Probablemente estemos delante de otro punto en que deberíamos considerar siempre individualizar tanto el tipo como la cantidad de fluidos que se administran en las fases inicial y de mantenimiento en el tratamiento de la sepsis y el shock séptico.
Fluid resuscitation is a crucial part of the treatment of hypotension and shock of any etiology. Particularly in septic shock, it is an essential element of the initial care bundle. Like all treatments in sepsis, it is also subject to multiple controversies: what type of fluid, how much, how long to administer it, potential risks, toxicity? The main guideline, the Surviving Sepsis Campaign, continues to indicate crystalloids as the main fluid in resuscitation. But the possibility of crystalloids balanced on 0.9% saline or combined use with albumin in the resuscitation of the septic patient is still under debate. This is probably another point where we should always consider individualizing both the type and amount of fluids to be administered in both the initial and maintenance phases of the management of sepsis and septic shock.
La sepsis es un síndrome clínico basado en una compleja y dinámica interacción entre patógeno y huésped. La identificación de diferentes fenotipos y la heterogenidad de la sepsis obligan a cambiar paradigmas en el diagnóstico-tratamiento1. En los últimos años, se ha (r)evolucionado la atención de la sepsis, con especial enfoque en el shock séptico (SS) por su gravedad y su mayor morbimortalidad. Consensos como la Surviving Sepsis Campaign (SSC) o el Documento Código Sepsis (DCS) en España han intentado homogeneizar el tratamiento diagnóstico-terapéutico1–4, y se ha demostrado que la introducción del concepto de los bundles o paquetes de medidas mejora la atención e incluso la morbimortalidad1–5. La SSC enfatiza la importancia del bundle de la primera hora: obtener hemocultivos (y otros cultivos), determinar el lactato plasmático, el rápido inicio de una adecuada antibioticoterapia empírica y fluidoterapia y administración precoz de vasopresores4. El DCS amplía estos bundles hasta 4 y destaca la importancia del tratamiento integral e indivi-dualizado en las diferentes fases de la sepsis1,5.
En los últimos 15 años, una serie de estudios observacionales, ensayos clínicos y consensos han mantenido importantes controversias sobre la reanimación con fluidos en la sepsis. Estas se basan en qué tipo de fluido es el más adecuado, qué cantidad, cuánto tiempo se debe administrar o cómo se debe monitorizar la respuesta hemodinámica. Tiene importancia capital evitar balances hídricos positivos por el aumento de la morbimortalidad. Otra cuestión importante es el inicio más precoz de los vasopresores1,2,4–10.
Por ello, en este artículo se revisan los principales conceptos, estudios y controversias de la reanimación con fluidos en enfermos sépticos.
2Justificación fisiopatológica del papel de la fluidoterapia en la sepsis y el shock sépticoEl SS se caracteriza por una distribución anormal del flujo sanguíneo en los diferentes tejidos, con la consiguiente caída de la presión arterial media (PAM), así como la disminución del retorno venoso. La vasodilatación venosa da lugar a un aumento del volumen intravascular a expensas de volumen no estresado (incapaz de generar presión que venza la distensibilidad y la capacitancia de la pared venosa), lo que produce una disminución del retorno venoso y el gasto cardiaco (GC) del ventrículo derecho (VD), que se transmite posteriormente al ventrículo izquierdo (VI) disminuyendo su precarga y el GC1,2,6–11.
Simultáneamente a la vasodilatación arterial y venosa por vasoplejía, se incrementan los mediadores de la respuesta inmunitaria innata, que puede resultar en lesión microvascular, un suministro inadecuado de oxígeno a los tejidos y un metabolismo celular inadecuado8–12.
Hay varios factores asociados con el descenso del retorno venoso. El más importante es la inmovilización venosa (en pequeños y grandes vasos) que puede complicarse aún más por la escasa ingesta/administración de líquidos o el aumento de las pérdidas intravasculares durante la fase inicial de la sepsis. Otro mecanismo importante, que puede empeorar aún más dicho retorno venoso y consecuentemente la microcirculación, es el daño endotelial que genera fuga capilar hacia el intersticio2,6,9–11. Este puede generar un síndrome compartimental celular y estimular la producción de citocinas proinflamatorias, que mantiene un ciclo y pérdida de la homeostasis2.
Las manifestaciones clínicas y analíticas precoces más importantes del SS son hipotensión arterial (PAM<65mmHg), mala perfusión (disminución de la diuresis y alteración cutánea o de conciencia), empeoramiento de la saturación venosa mixta de oxígeno (SatVO2) y el aumento del lactato plasmático. El SS es una entidad más compleja que la hipotensión arterial, pues puede haber shock tisular sin hipotensión arterial1,2.
La administración de fluidos en el SS se basa en intentar que aumente el volumen intravascular y en consecuencia el retorno venoso para contrarrestar la “hipovolemia” relativa. De esta forma se favorece el aumento de la precarga del VD y, en ausencia de fallo de este, la precarga y el GC del VI y, por tanto, la mejoría de la perfusión tisular y del trasporte de oxígeno1,2,4,7,9.
Los principales elementos para una reanimación eficaz con fluidos dependerán del tipo de fluido elegido, así como el volumen y el tiempo de administración. Pero también es un factor determinante la monitorización de la respuesta hemodinámica, tanto para evaluar su respuesta como para evitar la sobrecarga hídrica2,6–13.
En la Tabla 1 se describen las 4 fases de fluidoterapia en la reanimación del SS según distintos parámetros: a) fase 1: reanimación; b) fase 2: optimización; c) fase 3: estabilización o consolidación, y d) fase 4: evacuación o desescalada terapéutica2,6–9,12,13.
Fases de la reanimación por fluidos en el shock séptico
| Variables | Fase 1: reanimación | Fase 2: optimización | Fase 3: estabilización | Fase 4: desescaladaevacuación |
|---|---|---|---|---|
| Tiempo de presentación | Minutos | Horas | Horas-días | Días-semanas |
| Forma de presentación | Sepsis o shock séptico | Inestabilidad hemodinámica o shock | Ausencia de shock | Recuperación del shock o persistencia de permeabilidad capilar aumentada |
| Mecanismode inestabilidad | Primera señal: inflamación | Segunda señal: isquemia-reperfusión | Segunda señal:isquemia-reperfusión | Tercera señal: permeabilidad capilar aumentada |
| Cómo se aplica la terapiacon fluidos | Bolo de 30ml/kg. Monitorización de respuesta a la fluidoterapia basada en parámetros dependientesde la precarga | Bolo basado en parámetros dependientes de la precarga, preferentemente dinámicos, de respuesta a los fluidos. Tb con lactato y SatvO2 | Solamente para mantenimientoy/o como reposición de otras pérdidas | Reversión del balance hídrico positivo |
| Resultado | Supervivencia inmediata del paciente | Rescate o asistencia de órganos | Rescate o asistencia de órganos | Recuperación de la disfunción orgánica |
| Riesgos | Reanimación insuficiente | Reanimación insuficienteo sobrecarga hídrica (edema pulmonar, síndrome compartimental celular, hipertensión abdominal) | Sobrecarga hídrica (edema pulmonar, síndrome compartimental celular, hipertensión abdominal) | Eliminación excesiva de líquidosy posibilidad de hipotensióny/o hipoperfusióntisular |
| Balance hídrico | Positivo | Neutral | Neutral o negativo | Negativo |
| Objetivo principalModificada de las r | Administración de fluidosguiada por objetivoseferencias 1, 4, 6, 7 y 8. | Basada en asistencia de órganos y mantenimiento de la perfusión tisular | Tratamiento de fluidos conservador y tardío | Eliminación tardía de líquidos basada en objetivos |
La fase 1 o de reanimación tiene como principal objetivo salvar el paciente. Para ello se debe alcanzar una PAM y un GC mínimos para mantener la perfusión tisular. No es necesaria una monitorización sofisticada, pero sí vigilar los signos vitales. También se deben considerar intervenciones/tratamientos concomitantes, como drenajes o revascularización.
La fase 2 es la de optimización de la terapia y el principal objetivo es mejorar la disponibilidad intracelular de oxígeno. Además de incrementar la PAM y el GC, se puede necesitar un aumento de la hemoglobina con trasfusiones. La respuesta a la fluidoterapia se monitoriza eficaz y rápidamente con el lactato plasmático y/o la SatVO2, así como con los parámetros de la precarga.
La fase 3 o de estabilización es un momento de consolidación de la terapia con fluidos e intenta prevenir la disfunción orgánica (DO), incluso en pacientes que ya han llegado a la estabilidad hemodinámica. Se debe asistir a los diferentes órganos para evitar sus respectivas disfunciones, que son un factor independiente de mayor morbimortalidad.
Por último, la fase 4, denominada de evacuación o desescalada terapéutica hídrica, es clave para la eficacia global de la reanimación por fluidos. Su principal objetivo es alcanzar balances hídricos negativos. Destaca la desresucitación, con lo que se busca la desescalada, la disminución de los fluidos y forzar el balance hídrico negativo proporcionados previamente en la resucitación. Para ello, se busca facilitar la eliminación espontánea o forzada de líquidos a través de diuréticos o técnicas de reemplazo renal (TRR) y reducir/suspender los fármacos vasoactivos.
Las principales complicaciones asociadas con la sobrecarga hídrica se exponen en la Tabla 2.1,2,4,7–15
Diferentes complicaciones de la sobrecarga hídrica
| Cardiovascular | Pulmonar | Abdominal | Renal | SNC | Piel-muslo |
|---|---|---|---|---|---|
| Edema pulmonar, | Edema pulmonar | Edema GI | Edema renal | Edema cerebral | Edema tisular |
| disfunción del VI | Hipoxemia | Ascitis | f Filtrado | Alteración | f Perfusión |
| f Retorno venoso | Derrame pleural | Hipertensión abdominal | glomerular | de la conciencia, | periférica |
| f FE, GC | Alteración de la | F Presión | F Presión venosa | confusión | F Úlceras |
| F PVC, POAP | distensibilidad | intraabdominal | renal | Delirio, coma | de presión |
| Depresión | pulmonar | F Permeabilidad | F Presión intersticial | f Presión de | f Masa |
| miocárdica | f Volumen | intestinal | Insuficiencia renal | perfusión cerebral | muscular |
| Dilatación del VI | pulmonar | F Traslocación | agudo | F Presión | f Movilidad |
| Disfunción | f Gradiente | bacteriana | F Creatinina, uremia | intracraneal | Peor |
| diastólica | alveoloarterial | Síndrome | F Resistencia | Hipertensión | evolución |
| Edema miorcárdico | F Trabajo | compartimental: | vascular renal | intracraneal | de las heridas |
| Derrame | respiratorio | GI | Retención de agua | Síndrome | F Infección |
| pericárdico | Dificultad | Hepático | y solutos | compartimental | de heridas |
| Alteración de | destete VM | Pared abdominal | Síndrome | intracraneal | |
| la conducción AV | F NAVM | f Perfusión esplácnica | compartimental | F Presión intraocular | |
| Arritmias | f pH intragástrico | renal | Síndrome | ||
| Colestasis | compartimental | ||||
| f Actividad de CP450 | ocular | ||||
| Intolerancia digestiva |
AV: auriculoventricular; CP450: citpcromo 450; FE: fracción de eyección; GC: gasto cardiaco; GI: gastrointestinal; NAVM: neu- monía asociada con VM; POAP: presión de oclusión de la arteria pulmonar; PVC: presión venosa central; VI: ventrículo izquierdo; VM: ventilación mecánica; F: aumento; f: reducción.
La cantidad de fluidos en la resucitación de la sepsis, tanto en su fase inicial como las horas y días posteriores, sigue siendo un tema controvertido1,2,4–6.
Con el objetivo de proponer un tratamiento unificado la SSC, tanto en 2016 como en 2021, aconsejó, con débil grado de recomendación y baja evidencia científica, administrar cristaloides a 30ml/kg de peso ideal vía endovenosa en las primeras 3h de la resucitación inicial con fluidos3,4. No obstante, dicha cantidad de líquido se basa exclusivamente en estudios observacionales y no en ensayos prospectivos que comparen resultados de la administración de diferentes volúmenes de fluidos7. Esto dio lugar a una corrección en la nueva guía de 2021, en la que reaparecen los 30ml/kg como recomendación de bajo grado y nivel de evidencia4.
En cuanto a la velocidad de la administración, también hay controversias. El reciente ensayo clínico aleatorizado con más de 10.000 pacientes críticos realizado en Brasil, Basics, no encontró diferencia significativa en la mortalidad a los 90 días entre una administración lenta (333ml/h) y una rápida (999ml/h)16.
Dados el posible deterioro orgánico y el aumento de la mortalidad asociado con un exceso de volumen, es necesario individualizar el tratamiento. Para ello se requiere una evaluación inicial exhaustiva y una revaluación continua de la respuesta al tratamiento basada en parámetros hemodinámicos estáticos o, preferentemente, dinámicos2,12,13,15,17.
4Índices estáticosClásicamente, se han utilizado los índices estáticos para determinar si el paciente responde a los líquidos y guiar así la fluidoterapia. La determinación de la precarga del VD a través de la presión venosa central (PVC), la precarga del VI a través de la presión de oclusión de la arteria pulmonar (PAOP), la determinación de parámetros volumétricos por termodilución transpulmonar o la medición de los volúmenes telediastólicos ventriculares por ecocardiografía son los parámetros estáticos más utilizados para determinar el estado intravascular del paciente7,8,11.
No obstante, los parámetros estáticos se han demostrado malos predictores de la volemia de la respuesta al volumen con valor predictivo moderado y con predicción aceptable tan solo en valores extremos. Son más útiles para determinar el riesgo potencial de administrar más líquidos que para predecir de manera fiable la respuesta al volumen, por lo que son marcadores de precarga y no de la respuesta a esta17–19. A pesar de ello, los marcadores estáticos de precarga siguen siendo ampliamente utilizados para guiar el tratamiento con fluidos, tal y como muestra el estudio observacional FENICE20.
5Índices dinámicosSe ha demostrado una mejor precisión diagnóstica de los índices dinámicos para predecir la capacidad de respuesta a los fluidos1–6,21. Así, tanto el DCS como la SCC sugieren el uso de índices dinámicos frente estáticos para predecir la respuesta a la administración de fluidos1,4. A continuación se describen algunos de ellos.
5.1Variación de volumen sistólico (VVS) y variación de la presión de pulso (VPP)Probablemente los parámetros más utilizados, se basan en la repercusión de la positiva intratóracica secundaria a la ventilación mecánica en la precarga y, por consiguiente, en el GC. La presión positiva reduce la precarga en el VD; si esto se transmite a la precarga del VI y, por ende, disminuye el volumen sistólico del VI de forma cíclica con la presión positiva, indicaría que ambos ventrículos son dependientes dela precarga2,6,9,16,20,21.
No obstante, el VVS y el VPP presentan limitaciones importantes. Requieren de ventilación mecánica y son poco fiables en caso de respiración espontánea. Su fiabilidad también disminuye en caso de arritmia cardiaca, bajos volúmenes tidales (Vt) o baja distensibilidad pulmonar (p. ej., en el síndrome de distrés respiratorio agudo [SDRA]), esternotomía, aumento de la presión intraabdominal, frecuencias respiratorias altas o insuficiencia cardíaca derecha21–23.
5.2Colapsabilidad o distensibilidad de la vena cavaLos cambios de la presión intratorácica inducidos por la ventilación mecánica generan variaciones en las venas cavas cuando la precarga es baja, lo que permite estimar la respuesta a la administración de volumen, tanto la variación del diámetro de la vena cava inferior, por ecografía transtorácica, como la colapsabilidad de la vena cava superior por ecografía transesofágica2,6,23.
Su fiabilidad para predecir la respuesta ha sido cuestionada por sus limitaciones23. Al igual que en el caso de la VVS y la VPP, la precisión de dichas mediciones disminuye considerablemente en pacientes en respiración espontánea —en cuyo caso parece que solo las variaciones de gran amplitud predicen buena respuesta a los líquidos6,24— y los casos de Vt bajos o baja distensibilidad pulmonar6,24. Además, requiere pericia con la ecografía transtorácica o transesofágica (en el caso de la vena cava superior). A diferencia de la VPP y la VVS, los índices de colapsabilidad y distensibilidad de la vena cava sí son fiables en pacientes con arritmias cardiacas2,20,24–26.
5.3Fluid challengeClásicamente esta prueba se basa en la administración de un volumen de 250–500ml de líquido en 30min, y si produce un aumento del GC ≥ 15%, se considera dependiente de precarga y, por lo tanto, respuesta a la administración de fluidos20,6–9.
No obstante, tiene principalmente dos limitaciones. Por un lado, requiere la medición continua del GC; por otro, la administración deliberada de fluidos para predecir la respuesta es en sí misma un tratamiento que contribuye a la sobrecarga de líquidos y la hemodilución. Esto último ha dado lugar al desarrollo de una provocación con minifluidos, en la que se administran solo 100ml de líquido en corto tiempo, con una fiabilidad de predicción de respuesta a fluidos incluso mejor que la VPP. No obstante, como ya se ha comentado, requiere una medición precisa del GC9,27,28.
5.4Elevación pasiva de las piernasSe trata de un fluid challenge “interno”, reversible, reproducible y de aproximadamente 300ml de sangre, suficiente para inducir un aumento significativo del GC que predice de manera fiable la respuesta a la administración exógena de líquidos. Se trata de una prueba fiable en pacientes en respiración espontánea, con bajos volúmenes o baja distensibilidad pulmonar, así como en caso de hipertensión intraabdominal. Pese a que puede producir un aumento de la PAM en situaciones de dependencia de precarga y, por consiguiente, respuesta a los líquidos, los cambios de la presión arterial no permiten determinar con fiabilidad si los pacientes responden a los líquidos. Por ello se requiere la medición continua del GC con técnicas invasivas o no invasivas1,9,29,30.
5.5Prueba de oclusión al final de espiraciónConsiste en realizar una pausa espiratoria durante al menos 15 s. Si el GC aumenta más del 5%, indica que ambos ventrículos son dependientes de la precarga. Requiere medición continua del GC (tanto invasiva como no invasiva) y es fiable en caso de Vt bajo y baja distensibilidad pulmonar; por lo tanto, en el SDRA. Una posible limitación es la ventilación en decúbito prono y no se puede realizar con pacientes que no se encuentren intubados o no toleren pausas espiratorias ≥ 15 s1,6,9,21,22.
6Otros índices de respuesta a volumen6.1Aclaramiento de lactato séricoSe ha propuesto normalizar su concentración como objetivo de la reanimación inicial en el SS. Sin embargo, las cifras de lactato sérico han de interpretarse en el contexto clínico y tras descartar otras causas de incremento. En cualquier caso, en una estrategia guiada por el lactato se ha de tener cautela y solo para las primeras horas del SS, en las que la hiperlactacidemia es secundaria a disfunción tisular por hipoperfusión1,4,6.
6.2Normalización del tiempo de llenado capilarMedida alternativa y no invasiva cuando no se dispone de monitorización hemodinámica. Permite evaluar con seguridad y eficacia la administración de fluidos según la perfusión tisular. Se ha demostrado una eficacia similar a la del tratamiento guiado por el aclaramiento de lactato31,32.
Los índices y parámetros hemodinámicos nunca deben considerarse de manera aislada y con valores predeterminados, sino como un dato más que apoya una sospecha fundada en una correcta y completa valoración del enfermo, y siempre se debe individualizar cada caso1,2,4–9.
7Características de los distintos tipos de fluidosLos fluidos se clasifican según su comportamiento frente a la membrana capilar y hay de 2 tipos: cristaloides y coloides (Tabla 3 y Tabla 4).
Composición de los principales tipos de cristaloides frente al plasma
| Tipo de soluciones | Soluciones balanceadas | Soluciones no balanceadas | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ringer | Ringer | Plasmalyte® (Baxter | Isolyte S® (B. Braun | NaCl | NaCl 0,18%/ | NaCl 0,45%/ | Glucosa | NaHCO3 | NaHCO3 | NaHCO3 | |||
| Parámetro | Plasma | lactato | acetato | International) | Medical Inc.) | 0,9% | glucosa 4% | glucosa 4% | 5% | Hartmann | 1,26% | 1,4% | 8,4% |
| Na+ (mmol/l) | 135-145 | 130 | 130 | 140 | 141 | 154 | 31 | 77 | 131 | 150 | 167 | 1.000 | |
| K+ (mmol/l) | 3,5-4,5 | 4 | 5 | 5 | 5 | 5 | |||||||
| Cl–(mmol/l) | 95-105 | 109 | 112 | 98 | 98 | 154 | 31 | 77 | 111 | ||||
| Ca2+ (mmol/l) | 2,2-2,6 | 1,5 | 1 | 2 | |||||||||
| Mg2+ (mmol/l) | 0,8-1,2 | 1 | 1,5 | 3 | |||||||||
| HCO3–(mmol/l) | 24-32 | 28 | 27 | 27mmol (acetato) | 27mmol (acetato) | 29 | 150 | 167 | 1.000 | ||||
| 23mmol | 23mmol | ||||||||||||
| (gluconato) | (gluconato) | ||||||||||||
| Lactato (mmol/l) | 1 | 28 | 29 | ||||||||||
| Fosfato (mmol/l) | 0,8-1,2 | 1 | |||||||||||
| Glucosa (mmol/l) | 3,5-6,0 | 236 | 278 | 252 | |||||||||
| PH | 7,35-7,45 | 6,0-7,5 | 6,0-8,0 | 4,0-6,5 | 6,3-7,3 | 5,5 | 3,5-5,5 | 3,5-6,5 | 3,5-5,5 | 5,0-7,0 | 7,0-8,5 | 7,0-8,5 | 7,0-8,5 |
| Osmolaridad | 275-295 | 273 | 277 | 295 | 295 | 308 | 284 | 406 | 278 | 278 | 301 | 333 | 2.000 |
| (mOsmol/l) | |||||||||||||
Composición de los diferentes tipos de coloides frente al plasma
| Gelofusine® | Geloplasma® | Hetastarch® 6% | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Párametro | Plasma | Albúmina 5% | Albúmina 20% | Haemacel® | (B. Braun Medical Inc.) | (Fresenius Kabi) | Dextran® 40 | Dextran® 70 en NaCl | HES130/0.4 (B. Braun Medical Inc.) |
| Donante | Donante | Gelatina | Gelatina | Gelatina | |||||
| Fuente | humano | humano | bovina | bovina | bovina | Sucrosa | Sucrosa | Almidón de maíz | |
| Na+ (mmol/l) | 135-145 | 148 | 130 | 145 | 154 | 150 | 154 | 154 | 154 |
| K+ (mmol/l) | 3,5-4,5 | 5,1 | 5 | ||||||
| Cl–(mmol/l) | 95-105 | 128 | 77 | 120 | 120 | 100 | 154 | 154 | 154 |
| Ca2+ (mmol/l) | 2,2-2,6 | 6,25 | |||||||
| Mg2+ (mmol/l) | 0,8-1,2 | 1,5 | |||||||
| HCO3–(mmol/l) | 24-32 | 30 (como | |||||||
| lactato) | |||||||||
| Lactato (mmol/l) | 1 | 30 | |||||||
| Glucosa (mmol/l) | 3,5-6,0 | 252 | |||||||
| Acetato | |||||||||
| Malato | |||||||||
| Octanotato | 8 | 16 | |||||||
| PH | 7,35-7,45 | 6,4-7,4 | 6,7-7,3 | 7,4 | 7,4 | 7,4 | 3,0-7,0 | 4,5-7,0 | 4,0-5,5 |
| PM (kD) | 69 | 69 | 30 | 30 | 30 | 40 | 63-77 | 130 | |
| Osmolaridad (mOsmol/l) | 275-295 | 309 | 130 | 274-300 | 274 | 273 | 308-310 | 310 | 286-308 |
| Vida media efectiva (h) | 15 | 15 | 5 | 2.5 | 2.5 | 12-24 | 12-24 | 6-12 |
HES: hidroxietilalmidón; PM: peso molecular.
Los cristaloides generalmente están constituidos por agua y sales minerales, que se diluyen y difunden junto con el disolvente. La mayoría de las soluciones cristaloides se distribuyen bien en el líquido intracelular y extracelular, con un alto índice de eliminación: a los 60min de la infusión, solamente permanece el 20% del volumen infundido en el espacio intravascular1,11.
8.1Soluciones no balanceadasLas soluciones no balanceadas son todas las que tienen osmolaridad, tonicidad y contenido electrolítico distinto del plasma. La más utilizada es la solución salina al 0,9%, (SS0,9%) mal denominada “fisiológica”, pues es hipertónica y ácida respecto al plasma y contiene una cantidad supranormal de sodio y cloro. Su capacidad de expandir la volemia depende de la concentración de sodio: cuanto mayor concentración, más incremento de la volemia7,8. No existe evidencia para administrar suero hipertónico para la resucitación en la sepsis4,6–8.
Las soluciones glucosadas también tienen una osmolaridad diferente, y cuanto mayor concentración de glucosa, mayor osmolaridad. Sin embargo, las soluciones glucosadas no contienen electrolitos y tienen un coeficiente de Staverman extremo bajo, de ahí que se conozcan como agua libre. Su permanencia en el espacio intravascular es muy corta2,8. Las soluciones no balanceadas tienen en común varios efectos adversos. Todas hacen un efecto de dilución, mientras que las de alto contenido en NaCl generan hipercloremia y eventualmente acidosis11.
8.2Soluciones balanceadasLas soluciones balanceadas son las más parecidas al plasma y tienen un amortiguador como lactato, acetato o malato, y cloro ≤ 110 mEq/l; también se las llama bajas en cloro, en lugar de balanceadas. Por ejemplo, la solución de Hartmann tiene como variante el Ringer lactato como amortiguador. La solución Plasmalyte® tiene una osmolaridad cercana a la del plasma; además contiene acetato y malato como amortiguador, lo cual genera menor desequilibrio acidobásico1,4.
9ColoidesLos coloides son suspensiones de partículas sólidas muy finas, de 10−9 a 10−5m, que no se difunden con su disolvente cuando este tiene que atravesar una membrana porosa. Las macromoléculas pueden estar elaboradas a partir de proteínas o carbohidratos, por lo que todos los coloides en el mercado son sintéticos (dextranos, hidroxi-etil-almidón [HEA] y gelatinas) con excepción de la albúmina. El HEA y las gelatinas tienen similar capacidad de expansión plasmática1,7,11.
Aunque los coloides tienen tendencia a permanecer más tiempo en el espacio intravascular, depende en gran parte de la integridad del glucocáliz; en la sepsis, como otros síndromes, hay una pérdida, lo que aumenta el paso de los coloides a través de la membrana capilar, o sea, fuga capilar al intersticio7–9.
El gran peso molecular, teóricamente, confiere un alto coeficiente de reflexión de Staverman; sin embargo, en la práctica clínica el líquido en el que estas macromoléculas están suspendidas puede difundir pasivamente al intersticio o por medio de gradientes de presión oncótica1,9.
La albúmina es la proteína más abundante en el plasma humano (50–60%) y aporta el 80% de la presión oncótica del plasma. Regula la presión coloidoncótica, trasporta fármacos, es antioxidante y modula el óxido nítrico7,9,11.
10Evidencias en fluidoterapia en la resucitación de la sepsis10.1CristaloidesLos cristaloides siguen siendo los fluidos más indicados parael tratamiento inicial de la sepsis y el SS1,2,4–13.
En 2014, un estudio retrospectivo observó menor mortalidad dependiente de la dosis en pacientes con SS reanimados en las primeras 48h con una combinación de cristaloides clásicos y balanceados, comparados con los que habían recibido solo SS0,9%33.
Otro estudio con propensity score comparó el SS0,9% con 2 soluciones balanceadas (Plasmalyte® y Normosol®) en más de 3.000 pacientes con criterios de SRIS que habían recibido más de 500ml en las primeras 48h. Se observó que el SS0,9% incrementaba la mortalidad, las complicaciones cardiacas, respiratorias y hemáticas, la necesidad de reemplazo de electrolitos e infecciones, pero no en los riñones34. El ensayo aleatorizado SMART, con más de 15.000 pacientes críticos, comparó la SS0,9% con cristaloides balanceados (Ringer lactato o Plasmalyte®). El objetivo combinado era: mortalidad a los 30 días y/o aparición de insuficiencia renal aguda con necesidad de TRR. Hubo un mayor beneficio en el grupo de cristaloides balanceados, pero al analizar el subgrupo con 1.600 pacientes sépticos, estos resultados eran más marcados. Incluso había una disminución significativa de la mortalidad a los 30 días35,36.
Sin embargo, en un reciente estudio aleatorizado con 10.520 pacientes críticos que comparó la SS0,9% con solución balanceada, no hubo diferencia significativa en la mortalidad a los 90 días (el 27,2 frente al 26,4% respectivamente). Hay que destacar que el 48,4% eran pacientes de cirugía programada, aunque el 60% tenía hipotensión o tomaba vasopresores, pero solamente alrededor del 18% estaban sépticos37.
Otro reciente estudio aleatorizado, controlado y a doble ciego en 53 unidades de cuidados intensivos (UCI) de Australia y Nueva Zelanda comparó una solución balanceada (Plasmalyte® 148) con la SS0,9% en 5.037 pacientes. Los autores no observaron diferencias significativas entre los 2 grupos en la mortalidad a los 90 días, la aparición de insuficiencia renal aguda o el número de otros efectos secundarios38.
10.2Coloides sintéticosEl uso de coloides tipo almidones (HEA) se han asociado a distintos efectos secundarios, tales como anafilaxia, coagulopatía o insuficiencia renal. El HEA tiene mayor poder oncótico cuanto mayor peso molecular (PM) tenga y un efecto más duradero cuanto mayor sea su índice de sustitución (IS). Hace varios años, el ensayo VISEP asoció la dosis de HEA (PM, 200; IS, 0,5) con insuficiencia renal aguda, necesidad de TRR y mayor mortalidad39. Posteriormente, el 6S también describió una mayor mortalidad dependiente de la necesidad de TRR a los 90 días en los pacientes sépticos reanimados con HEA 130/04 comparados con el Ringer acetato40. En 2013, un metanálisis incluyó a 3.456 pacientes sépticos para comparar HES 130/0,38-0,45 frente a cristaloides o albumina. Los autores no encontraron diferencias en mortalidad, pero en el grupo de HEA se incrementó significativamente el riesgo de TRR y administración de hemoderivados41. Estos resultados se confirmaron en 2 metanálisis posteriores42,43. Uno de ellos incluyó 38 ensayos con más de 10.800 pacientes diagnosticados de sepsis, traumatismos o hipovolemias en Urgencias o UCI entre 1982 y 2012. Se comparó HEA con cristaloides, gelatinas y albúmina. No hubo diferencias en la mortalidad y la estancia en UCI u hospitalaria entre los grupos. Sin embargo, en el análisis de subgrupos los pacientes tratados con HES presentaban un significativo aumento de la insuficiencia renal aguda y necesidad de TRR43.
Un estudio con 7.000 pacientes de 34 UCI comparó la SS0,9% con coloides frente a HEA. La dosis máxima de HEA fue 50ml/kg/día. No hubo diferencias de mortalidad a los 90 días, pero sí un incremento estadísticamente significativo de la necesidad de TRR en el grupo de HEA, con un incremento relativo del 21%. Este grupo también presentaba más insuficiencia renal aguda, eritema y prurito, insuficiencia hepática y necesidad de trasfusiones, aunque en el grupo de HEA mejoró la insuficiencia cardiaca y disminuyó la necesidad y el tiempo de vasopresores44. Por todo ello, desde 2013 las autoridades sanitarias españolas han restringido el uso de coloides tipo HEA por los potenciales efectos secundarios graves en pacientes sépticos1,11.
Sobre las gelatinas hay menos estudios, aunque la mayoría no aporta beneficios comparadas con los cristaloides, y varios de ellos describen mayor riesgo de anafilaxia, hemorragias, insuficiencia renal o mortalidad hospitalaria1,4,45,46.
Una revisión sistematizada de la literatura y metanálisis de 40 estudios prospectivos y ensayos clínicos con 3.275 pacientes evaluó la seguridad de las gelatinas comparadas con un grupo de control que incluía a pacientes tratados con SS0,9%, Ringer lactato, plasma y albúmina. La dosis media de las gelatinas fue 17ml/kg en las primeras 24h, una media de 1 l. Los autores concluyen que eran heterogéneos los grupos de pacientes y los estudios. No observaron aumento de trasfusiones, insuficiencia renal o mortalidad entre gelatinas y el grupo de control con una dosis de 17ml/kg. Sin embargo, cuando la dosis de gelatinas era>30ml/kg, aumentaba el riesgo de mortalidad y de trasfusiones46.
11AlbúminaEl coloide natural que genera mucho debate es la albúmina. El ensayo SAFE incluyó a casi 7.000 pacientes críticos y comparó los tratamientos con SS0,9% y con albúmina al 4% en la reanimación inicial. La principal conclusión fue que no se observaron diferencias en la mortalidad47, pero al analizar el subgrupo de pacientes sépticos de la serie, los tratados con albúmina al 4% presentaban una mortalidad significativamente menor (odds ratio [OR]=0,71; p=0,03). Otro in teresante estudio, EARSS, administró aleatoriamente 10ml de albúmina al 20% o 100ml de SS0,9% cada 8h durante 3 días a 798 pacientes críticos. No encontraron diferencias en estancia en UCI u hospitalaria o en mortalidad, pero los tratados con albúmina al 20% tenían significativamente menos días con vasopresores48. Un estudio que ha sido importante para los defensores de la albúmina en la sepsis es el ensayo clínico ALBIOS. Este aleatorizó a 2 grupos de pacientes con sepsis graves: cristaloides frente a albúmina al 20%, para alcanzar un objetivo de albúmina plasmática>30g/l. No hubo diferencias en mortalidad a los 28 y a los 90 días, pero los pacientes con SS que recibieron albúmina al 20% presentaban una mortalidad a los 90 días significativamente menor (p=0,03)49.
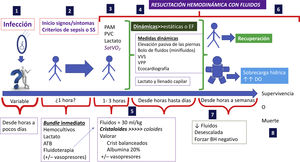
- 1.
Infección y potencial inicio de los fenómenos fisiopatogénicos de la sepsis: tiempo muy variable, desde horas hasta días después.
- 2.
Ya empiezan los signos/síntomas de alteraciones clínicas/analíticas/radiológicas compatibles con inflamación y DO de sepsis. Estos son muy variables y dependen de la interacción entre patógeno y huésped. Por ejemplo, la variabilidad fenotípica de presentación de una sepsis depende de varios factores: genómicos del paciente, del tipo de patógeno (virus o bacteria), ambientales, administración de otros fármacos (p. ej., quimioterapia), etc. En este momento de detección hay que proceder al bundle inicial: toma de hemocultivos, iniciar ATB, lactato plasmático, e iniciar tratamiento hemodinámico con fluidoterapia y considerar VP.
- 3.
Una tercera fase precoz (primeras 3h) del proceso séptico, en que se valora específicamente la HD, está solapada a la previa, que es la monitorización utilizando criterios clínicos (PAM, FC), de laboratorio (lactato, SatVO2), parámetros estáticos (PVC) y, por supuesto, también dinámicos. La nueva SSC de 2021 no incluye la SatVO2 para monitorización.
- 4.
La cuarta fase de la evolución de la sepsis, que puede desarrollarse desde las primeras horas hasta días, la monitorización HD utilizando parámetros dinámicos es crucial para evaluar la respuesta clínica y los potenciales ajustes del tratamiento HD. Se ha demostrado que las maniobras como elevar pasivamente las piernas o minifluidos, ecocardiografía o los parámetros VVS y VVP aportan más y mejores datos para el tratamiento HD. Y el lactato, principalmente en las primeras 24–48h, considerando sus limitaciones, también aporta una rápida información de la respuesta HD.
- 5.
Hay que destacar que actualmente, según la mayoría de consensos, la indicación es iniciar el tratamiento HD con fluidos tipo cristaloides a dosis de 30ml/kg, pero hay muchas controversias en este punto. Uno, la dosis: la tendencia actual es ajustar/personalizar esta dosis. Dos, la posibilidad de sustituir por cristaloides balanceados que podrían tener más eficacia y menos efectos secundarios (p. ej., hipercloremia). Tres, la posibilidad de tratamiento con fluidos combinado (p. ej., con albúmina) con varios estudios muy favorables, incluso con menor mortalidad asociada en enfermos sépticos. Cuatro, hay que considerar el inicio precoz de los VP ¡siempre!
- 6.
Esta fase, que también es muy variable, pero serán días, hasta semanas, es cuando puede haber solución clínica del proceso séptico, pero también se puede observar los efectos deletéreos de los distintos tratamientos, como ATB, VP o fluidos. En este caso, uno de vital importancia es la sobrecarga hídrica con aumento de DO (que puede ocurrir desde las fases iniciales en las primeras horas de la resucitación HD). Se trata de un factor asociado con la mayor morbimortalidad del paciente séptico.
- 7.
Por ello, para evitar la sobrecarga hídrica, se debe ser proactivos en el ajuste/desescalada de fluidos y el balance hídrico negativo evaluando de manera continua, principalmente con una monitorización HD basada en parámetros dinámicos. Por ello, la atención continuada es crucial para una resucitación HD eficaz y con mínimos efectos secundarios para el paciente.
- 8.
Todo el proceso séptico, específicamente el tratamiento HD, siempre se debe considerar individualizadamente, tanto el tipo como la dosis, las cantidades y la desescalada de fluidos, así como su monitorización de respuesta clínica HD. La medicina personalizada es un reto en la atención de la sepsis, y el tratamiento HD es un reto complejo que necesita experiencia y flexibilidad durante las diferentes fases de la sepsis.
ATB: antibióticos; DO: difunción orgánica; EF: exploración física; HD: hemodinámica; SS: shock séptico; VP: vasopresores; VPP: variación de la presión de pulso; VVS: variación de volumen sistólico.
El ensayo multicéntrico internacional CRISTAL comparó la reanimación con cristaloides frente a coloides en 2.857 pacientes en shock hipovolémico, includos sépticos. El grupo de control con cristaloides bajo SS0,9% y Ringer lactato frente a coloides hipooncóticos (gelatinas, albumina al 4%) e hiperoncóticos (dextranos, albúmina al 20% y HEA en dosis < 30ml/kg). La media de volumen de cristaloides administrado fue 3.000ml y dependía del facultativo. El volumen medio de coloides administrado fue 2.000ml. El tiempo promedio de administración fue menos de 2 días. No hubo diferencias de mortalidad entre uno y otro grupo a los 28 días, pero sí a los 90 días, cuando fue significativamente mayor en el grupo de cristaloides, motivo por el que se suspendió el estudio. Tampoco hubo diferencias en los días de estancia en UCI u hospitalaria, SOFA a los 28 días o necesidad de TRR a los 7 y 28 días. Los pacientes con coloides tenían menos días de ventilación mecánica y vasopresores50.
Sobre el empleo de albúminas al 4-5% frente al 20%, el estudio SWIPE las comparó en la reanimación en pacientes críticos. El grupo con albúmina al 20% recibió una media de 600ml (65%) menos de fluidos (p<0,001) y un balance hídrico acumulado a las 48h significativamente menor, alrededor de 576ml (p=0,01). Se observó menos sodio y potasio en el grupo de albúmina al 20%. Por último, no se han observado diferencias en anafilaxia, aparición de insuficiencia renal aguda o mortalidad en UCI u hospitalaria51.
12Combinación de fluidosDe la combinación de cristaloides y albumina hay nueva evidencia, incluso la SSC de 2021 indica considerar esta posibilidad en pacientes que hayan recibido gran cantidad de volumen4. En un reciente análisis retrospectivo de reanimación con fluidos en pacientes sépticos de la base MIMIC-IV, 6.597 pacientes recibieron solo cristaloides frente a 920 con una combinación precoz de cristaloides más albumina. Se objetivó que los pacientes con la combinación administrada en las primeras 24h tenían una mortalidad a los 28 días significativamente menor (el 12,5 frente al 16,4%; p=0,003), aunque tenían una estancia en UCI significativamente más larga (p<0,001)52.
13Comentarios finalesAunque sigue habiendo controversias en la reanimación con fluidos en la sepsis y el SS, hay algunos puntos de la práctica clínica basada en la “poca” evidencia que se siguen en la actualidad1,2,4,53.
La fluidoterapia es, por lo tanto, un elemento clave en el tratamiento de la sepsis, y su inicio inmediato en la resucitación precoz es imprescindible con el objetivo de restaurar el volumen intravascular para mejorar el GC y, por ende, la perfusión tisular. En la Fig. 1 se resume el papel de la fluidoterapia y cómo plantearla en las diferentes fases de la resucitación en la sepsis.
En principio, para los pacientes sépticos se debe iniciar la reanimación con cristaloides1,4, pero hay que valorar la posibilidad de reanimar con los cristaloides balanceados en determinados casos (p. ej., que ya hayan recibido SS0,9% o tengan cifras elevadas de cloro plasmático) por sus potenciales ventajas, como menor incidencia de acidosis metabólica hiperclorémica o insuficiencia renal4,7,9.
La tendencia actual es considerar la posibilidad de reanimación con fluidos mixta con cristaloides (considerando la posibilidad de los balanceados), con albúmina (más al 20% que al 4%), para los pacientes que necesiten altas cantidades de los primeros o ya estén en tratamiento con dosis elevadas de vasopresores y tengan la albúmina plasmática<30g/l40,7–9. Otro factor determinante es alcanzar una reanimación con fluidos eficaz, pero restrictiva para evitar la sobrecarga hídrica. Para ello, la monitorización dinámica (más que la estática), principalmente en las fases de optimización y estabilización, son cruciales para disminuir la potencial morbimortalidad de balances hídricos positivos acumulados. Ensayos clínicos como de Douglas et al. han demostrado que las medidas dinámicas (como el aumento de la precarga durante la movilización de las extremidades inferiores) pueden orientar una resucitación con fluidos y vasopresores más eficaz, segura y restrictiva en cuanto a evitar la sobrecarga hídrica54.
Por todo ello, actualmente se recomienda individualizar la terapia con fluidos y una monitorización hemodinámica adecuada de cada paciente4,7–9.
14Conflicto de interesesMarcio Borges Sa, ha sido ponente de simposos de MSD, Pfizer y Biomerieux.
Los demás autores declaran no tener conflictos de intereses.
15Nota al suplementoEste artículo forma parte del suplemento «Resucitación del paciente con sepsis y shock séptico», que cuenta con el patrocinio de AOP HEALTH IBERIA.