Dada la importancia del manejo de la sedación, analgesia y delirium en las unidades de cuidados intensivos, y con el fin de actualizar las guías publicadas anteriormente, se decidió elaborar una nueva guía de práctica clínica con los soportes, manejos e intervenciones más relevantes acordes con las publicaciones recientes. Para elaborar esta guía, se reunió un grupo de 24 intensivistas procedentes de 9 países de la Federación Panamericana e Ibérica de Sociedades de Medicina Crítica y Terapia Intensiva. Se acogió la propuesta del Grading of Recommendations Assessment, Development and Evaluation Working Group para emitir el grado de recomendación y evaluar la calidad de la evidencia. Se realizó una búsqueda sistemática de la literatura utilizándose: MEDLINE, las siguientes bases de datos de la biblioteca Cochrane: Cochrane Database of Systematic Reviews, Cochrane Central Register of Controlled Trials (CENTRAL), Database of Abstracts of Reviews of Effects, National Health Service Economic Evaluation Database, y la base de datos de Literatura Latinoamericana y del Caribe en Ciencias de la Salud (LILACS). Finalmente, se seleccionaron 438 referencias, permitiendo realizar 47 recomendaciones fuertes con evidencia alta y moderada, 14 recomendaciones condicionales con evidencia moderada y 65 recomendaciones condicionales con evidencia baja. Se confirma la importancia del manejo inicial y multimodal del dolor, se hace énfasis en la disminución de los niveles de sedación y la utilización de sedación profunda solo en casos específicos. Aumenta la evidencia y recomendaciones para el uso de medicamentos como dexmedetomidina, remifentanil, ketamina, entre otros.
Given the importance of the management of sedation, analgesia and delirium in Intensive Care Units, and in order to update the previously published guidelines, a new clinical practice guide is presented, addressing the most relevant management and intervention aspects based on the recent literature. A group of 24 intensivists from 9 countries of the Pan-American and Iberian Federation of Societies of Critical Medicine and Intensive Therapy met to develop the guidelines. Assessment of evidence quality and recommendations was made according to the Grading of Recommendations Assessment, Development and Evaluation Working Group. A systematic search of the literature was carried out using MEDLINE, Cochrane Library databases such as the Cochrane Database of Systematic Reviews and the Cochrane Central Register of Controlled Trials (CENTRAL), the Database of Abstracts of Reviews of Effects, the National Health Service Economic Evaluation Database and the database of Latin American and Caribbean Literature in Health Sciences (LILACS). A total of 438 references were selected. After consensus, 47 strong recommendations with high and moderate quality evidence, 14 conditional recommendations with moderate quality evidence, and 65 conditional recommendations with low quality evidence were established. Finally, the importance of initial and multimodal pain management was underscored. Emphasis was placed on decreasing sedation levels and the use of deep sedation only in specific cases. The evidence and recommendations for the use of drugs such as dexmedetomidine, remifentanil, ketamine and others were incremented.
En 2007, la Federación Panamericana e Ibérica de Sociedades de Medicina Crítica y Cuidados Intensivos (FEPIMCTI) publicó las primeras guías de práctica clínica basada en la evidencia para el manejo de la sedoanalgesia en el paciente adulto críticamente enfermo1. Estas guías fueron seguidas por una actualización bilingüe (español e inglés) en 20132. El éxito de estas y otras guías llevó a numerosas publicaciones similares por sociedades científicas como las de la Sociedad Americana de Medicina Crítica y Cuidado Intensivo recientemente actualizadas3.
La investigación soportando estos documentos y la concienciación generada por los mismos han llevado a cambios en nuestras prácticas de sedación y analgesia en las unidades de cuidados intensivos. Algunas de estas nuevas prácticas están asociadas con una mejoría significativa en los resultados clínicos4. Es por esto que la actualización de las guías y diseminación de los avances recientes tienen tanta importancia.
Esta nueva revisión de las guías de práctica clínica basadas en la evidencia se realizó para actualizar las recomendaciones de manejo de la sedación, analgesia y delirium en el paciente adulto críticamente enfermo y otra vez en las dos lenguas, español e inglés. El grupo de trabajo cubrió extensivamente la literatura en las tres áreas mencionadas y usó como partida las guías publicadas en estos dos idiomas en el 20132. Debido a la extensión de esta guía se presenta el resumen ejecutivo de la misma y como material adicional el texto completo con las justificaciones de cada recomendación.
MetodologíaEn 2017, el consejo de FEPIMCTI invitó a sus miembros a identificar expertos para representarles en la fuerza de trabajo encargada de elaborar las nuevas guías. Un total de 24 especialistas en medicina crítica con soporte epidemiológico y de investigación bibliográfica formaron el grupo final. Sus responsabilidades incluyeron establecer el alcance de las guías, definir los temas a evaluar, y desarrollar las preguntas clínicamente relevantes a las cuales dar respuesta. Cada pregunta fue asignada a 2 expertos por tema. El objetivo principal del documento creado incluyó la actualización de las guías de práctica clínica basadas en la evidencia para el manejo de la sedoanalgesia en el paciente adulto críticamente enfermo publicadas previamente2. Los usuarios previstos de estas guías son médicos, enfermeras, farmacólogos clínicos, estudiantes, y profesionales de las numerosas disciplinas que forman parte del equipo multidisciplinario en las unidades de cuidado intensivo involucrados en el manejo de pacientes adultos en estado crítico.
Los estudios relevantes se identificaron llevando a cabo una búsqueda electrónica de todos los estudios relacionados con los temas propuestos, tomando como punto de partida la fecha donde se terminó la búsqueda de las guías previas2. Se utilizaron MEDLINE a través de PUBMED (1 de enero de 2012 a 31 de abril de 2018) y las siguientes bases de datos de la biblioteca Cochrane: Cochrane Database of Systematic Reviews, Cochrane Central Register of Controlled Trials (CENTRAL), Database of Abstracts of Reviews of Effects, National Health Service Economic Evaluation Database a través de The Cochrane Library y la base de datos Literatura Latinoamericana y del Caribe en Ciencias de la Salud (LILACS).
El grupo de trabajo se acogió a la propuesta del Grading of Recommendations Assessment, Development and Evaluation (GRADE) Working Group5 para evaluar la calidad de la evidencia y emitir el grado de recomendación. Así mismo, se utilizó la herramienta GRADE PRO para calificar la evidencia, resumir y presentar la información de manera concisa, disminuyendo la subjetividad en la recomendación y facilitando la toma de decisiones. Para finalizarlas, todas las recomendaciones que superaron el 80% de la votación fueron incluidas por consenso, y retiradas aquellas recomendaciones que no superaron el 80% de la votación.
Finalmente, las preguntas, recomendaciones, y justificaciones se agruparon en 6 diferentes secciones, de acuerdo con las condiciones específicas que caracterizan al grupo de enfermos a los que van dirigidas:
- 1.
Beneficios de la sedoanalgesia.
- 2.
Sedación.
- a.
Estrategias de sedación consciente.
- b.
Bundle ABCDEF.
- c.
Recomendaciones para el uso y duración de agentes sedantes.
- d.
Indicaciones y estrategias para la sedación profunda.
- e.
Impacto de la amnesia vs. la conservación de la memoria.
- f.
Sedación en pacientes con SDRA y ECMO.
- g.
Sedación en paciente con compromiso cardiovascular.
- h.
Sedación en paciente neurocrítico.
- 3.
Analgesia.
- a.
Beneficios y estrategias del adecuado manejo del dolor del paciente en UCI.
- b.
Analgesia en paciente con compromiso cardiovascular.
- c.
Analgesia en pacientes con sepsis y shock séptico.
- d.
Analgesia en paciente con SDRA y ECMO.
- e.
Analgesia en paciente oncológico.
- 4.
Delirium.
- a.
Identificación, prevención y manejo del delirium.
- b.
Predicción del delirium.
- c.
Déficit cognitivo persistente.
- 5.
Poblaciones especiales.
- d.
Paciente con insuficiencia renal o hepática.
- e.
Analgesia del paciente en postoperatorio de trasplante cardiaco, pulmonar, hepático y renal.
- 6.
Varios.
- a
Pacientes traumatizados, embarazadas, quemados y ancianos.
- b
Síndrome de abstinencia por alcohol y otras sustancias.
La búsqueda por alto nivel de evidencia incluyendo revisiones sistemáticas, metaanálisis, estudios aleatorios y guías en relación a analgesia, sedación, y delirium en pacientes críticos con una búsqueda combinada generó un total de 4.192 artículos en las diferentes bases de datos mencionadas. Basados en esta búsqueda, las recomendaciones fueron graduadas según el nivel de evidencia y grado de recomendación (GRADE) (tabla 1). En total se hicieron 136 recomendaciones finales. Las preguntas con sus respectivas recomendaciones, fuerza y nivel de la evidencia han sido resumidas en la tabla 2 adjunta.
Nivel de evidencia y grado de recomendación
| Nivel de evidencia | Descripción e implicaciones |
|---|---|
| Nivel de evidencia alto | Es seguro que el efecto real de la intervención se encuentra cerca al efecto estimado |
| Nivel de evidencia moderado | Es casi seguro que el efecto real se encuentre cerca del efecto estimado del estudio, pero existe la posibilidad de que el efecto sea diferente |
| Nivel de evidencia bajo | La certeza del efecto estimado es limitada. El efecto real probablemente es sustancialmente diferente al efecto estimado del estudio |
| Nivel de evidencia muy bajo | Existe poca certeza sobre el efecto estimado. El efecto real es sustancialmente diferente al efecto estimado |
| Grado de recomendación | Descripción |
|---|---|
| Recomendación fuerte | El escrito presenta certeza de los efectos deseados. La intervención a favor debería ser ofrecida a todos los pacientes, o si es en contra debería no usarse |
| Recomendación condicional | El escrito concluye que no tiene completa certeza del efecto deseado. La adherencia a esta recomendación probablemente tiene mayor peso en los efectos no deseados, pero no existe certeza suficiente al respecto |
Recomendación de la Guía sedoanalgesia y delirium en el paciente adulto críticamente enfermo
| Pregunta | Recomendación | Fuerza | Nivel de evidencia |
|---|---|---|---|
| Beneficios de la sedoanalgesia | |||
| ¿Cuáles son los beneficios a corto y largo plazo del adecuado manejo del dolor y la sedación en el paciente adulto críticamente enfermo? | A1. Se sugiere la adaptación de estrategias que promuevan primero la prevención del dolor, seguido del manejo analgésico en etapas tempranas de su aparición y en caso de requerirse la adición de agentes sedantes, usar la menor dosis efectiva. | Condicional | Bajo |
| A2. Se recomienda la creación o adaptación de protocolos para el adecuado manejo del dolor y de la sedación promoviendo el uso de la analgosedación, sedación ligera o no sedación en una atención centrada en las necesidades del paciente, evitando el uso de benzodiacepinas | Fuerte | Moderado | |
| A3. Se recomienda el uso de estrategias que permitan la apropiada evaluación y adherencia a protocolos de manejo del dolor y la sedación en todos los pacientes críticos | Fuerte | Bajo | |
| ¿Cuál es el beneficio de usar protocolos de sedación, delirium y analgesia? | A4. Se sugiere el uso de protocolos de evaluación y manejo de la analgesia, agitación y delirium para mejorar los desenlaces tales como el adecuado control del dolor, diminución de los episodios de agitación y delirium, menor exposición a medicamentos, menor tiempo en ventilación mecánica y estancia en la UCI y hospitalización. | Condicional | Moderada |
| Sedación | |||
| ¿Cuál es el manejo de la sedación recomendado en pacientes adultos con sepsis y shock séptico? | A1. Se sugiere utilizar sedación ligera siempre que sea posible en pacientes que necesiten ser acoplados a ventilación mecánica, evaluación periódica del estado neurológico y usar escalas de sedación según objetivos individualizados. No usar sedación profunda de manera rutinaria | Condicional | Bajo |
| ¿En los pacientes adultos críticamente enfermos que no tienen soporte ventilatorio, cuál es el manejo de la sedación más adecuado? | A2. Se sugiere en los pacientes sin intubación orotraqueal y sin soporte ventilatorio usar fármacos como la dexmedetomidina a bajas dosis, que tienen bajo riesgo de producir depresión respiratoria y efectos adversos hemodinámicos graves. Se debe monitorizar el nivel de sedación. | Condicional | Bajo |
| ¿Qué impacto tiene la aplicación del protocolo ABCDEF en el paciente críticamente enfermo? | B1. Se recomienda la aplicación del protocolo ABCDEF en el paciente crítico para aumentar los días libres de delirium y días libres de estado de coma, disminuir el tiempo de soporte ventilatorio, la estancia en cuidados intensivos y mortalidad. | Fuerte | Bajo |
| ¿Cuál es el beneficio de la presencia de los familiares en el desenlace del paciente adulto crítico? | B2. Se sugiere la presencia, participación y preparación de la familia en el plan de cuidados del paciente crítico como una medida para el soporte psicosocial. | Condicional | Bajo |
| ¿Cuál es el beneficio de la movilización temprana en los pacientes adultos críticos? | B3. Se recomienda que a todo paciente en cuidado intensivo se le realice movilización pasiva y una vez su estado clínico lo permita será candidato a movilización activa | Fuerte | Moderado |
| B4. Se recomienda la movilización temprana en todo paciente quirúrgico que esté en ventilación mecánica por lo menos 48 horas. Esta debe ser basada en un protocolo institucional que involucre a médicos, enfermeras y terapeutas | Fuerte | Moderado | |
| B5. Se recomienda la movilización temprana en todo paciente en POP de cirugía cardiaca de revascularización coronaria o cambio valvular hemodinámicamente estable | Fuerte | Moderado | |
| ¿Existe relación entre la dosis y el tiempo de uso de las benzodiacepinas y sus efectos adversos en pacientes críticamente enfermos? | C1. Se sugiere evitar el aumento de dosis nocturnas de midazolam, prefiriendo el uso de no benzodiacepinas. | Condicional | Bajo |
| C2. Si se utiliza sedación con midazolam, se sugiere utilizar sedación ligera en vez de sedación profunda, para evitar recuerdos delirantes y no afectar la memoria implícita | Condicional | Bajo | |
| C3. Cuando se utilice midazolam durante el manejo de la sedación en el paciente crítico, se sugiere evitar su uso en infusión continua y preferir los bolos intermitentes | Condicional | Bajo | |
| C4. Se sugiere evitar la sedación profunda con el uso de midazolam | Condicional | Moderado | |
| C5. Se recomienda evitar la administración de benzodiacepinas en pacientes con alto riesgo de delirium | Fuerte | Alto | |
| ¿Cuándo utilizar las benzodiacepinas en el paciente críticamente enfermo sin abstinencia a alcohol? | C6. Se sugiere el uso de midazolam, antes que tiopental como parte del manejo del estatus convulsivo refractario | Condicional | Bajo |
| C7. Se sugiere adicionar midazolam al uso de haloperidol para mejorar el control de la agitación en el paciente paliativo. | Condicional | Bajo | |
| ¿Cuáles son los pacientes críticamente enfermos que más se benefician del uso de remifentanil? | C8. Se recomienda el uso de remifentanil en postoperatorio de cirugía cardiaca para disminuir el tiempo en ventilación mecánica. | Fuerte | Moderado |
| C9. Se sugiere el uso de remifentanil junto a propofol para sedación durante hipotermia terapéutica después de paro cardíaco. | Condicional | Bajo | |
| C10. Se sugiere el uso de remifentanil en pacientes con insuficiencia renal para disminuir el tiempo en ventilación mecánica y estancia en UCI | Condicional | Bajo | |
| C11. Se sugiere el uso de remifentanil en pacientes neurocríticos para disminuir el tiempo de despertar y permitir su evaluación neurológica | Condicional | Bajo | |
| C12. Se sugiere titular el uso de remifentanil a la mínima dosis efectiva posible, para disminuir la hiperalgesia asociada a su uso y posterior suspensión | Condicional | Bajo | |
| ¿Cuál es la asociación entre dosis y duración de uso de la dexmedetomidina y efectos adversos? | C13. Se recomienda evitar el uso generalizado de dosis de carga de dexmedetomidina en el paciente crítico. | Fuerte | Alto |
| C14. Cuando se requiera utilizar dosis de carga, se sugiere utilizar dosis<1mcg/kg y durante>20 min | Condicional | Bajo | |
| C15. Se sugiere utilizar sedantes diferentes a dexmedetomidina cuando se requiera profundizar el paciente en vez de dosis de carga de esta. | Condicional | Bajo | |
| C16. Se recomienda evitar dosis de mantenimiento>1,4 mcg/kg/h y niveles de sedación profunda basadas en dexmedetomidina para evitar el riesgo de bradicardia severa. | Fuerte | Moderado | |
| C17. Se sugiere utilizar dosis mínimas de dexmedetomidina para sedación ligera durante mantenimiento, usualmente<0,7 mcg/kg/h. | Condicional | Moderado | |
| C18. Se sugiere titular con sedantes diferentes a dexmedetomidina cuando se requiera sedación profunda y evitar dosis superiores a 1,4 mcg/kg/h | Condicional | Bajo | |
| C19. Se recomienda en pacientes con bradicardia y repercusión hemodinámica disminuir la dosis de mantenimiento o interrumpirla temporalmente. | Fuerte | Bajo | |
| C20. Se sugiere evaluar periódicamente la necesidad de continuar por tiempo prolongado (hasta por 7 días) la infusión de dexmedetomidina | Condicional | Moderado | |
| C21. Si se requiere continuar sedación con el uso de dexmedetomidina en mantenimiento>7 días, dado que no hay evidencia suficiente para recomendar cuánto es el tiempo máximo. Se sugiere alternar con periodos de interrupción y vigilar la aparición de efectos adversos | Condicional | Bajo | |
| C22. Se sugiere suspender transitoriamente la infusión de dexmedetomidina cuando se sospeche hipertermia asociada a su uso, especialmente en obesos y en postoperatorio de cirugía cardiovascular. | Condicional | Bajo | |
| ¿Cuál es la estrategia farmacológica recomendada para mantener RASS -4 o -5 en pacientes que requieren sedación por más de 72 horas? | D1. Se recomienda la asociación de un hipnótico a un analgésico (preferentemente un opiáceo) para alcanzar una sedación profunda, siempre que esta esté clínicamente justificada. | Fuerte | Moderado |
| D2. Se sugiere evitar el uso de midazolam en sedación profunda prolongada y/o asociarlo a un opiáceo, propofol y/o dexmedetomidina | Condicional | Moderado | |
| D3. Se sugiere considerar el uso de la sedación inhalada como alternativa a la sedación intravenosa profunda en casos de estatus asmático, estatus epiléptico o dificultad respiratoria | Condicional | Bajo | |
| ¿Cuál es el impacto que tiene actualmente la amnesia versus la conservación de la memoria en los pacientes adultos críticos? | E1. Se recomienda promover el recuerdo de eventos positivos y evitar amnesia completa para disminuir el síndrome pos-Cuidados Intensivos (PICS) y mejorar el desenlace funcional del paciente posterior al alta de UCI. | Fuerte | Bajo |
| E2. Se recomienda la sedación ligera en el paciente crítico para disminuir el desarrollo de recuerdos asociados a trastorno de la sensopercepción (ilusiones o alucinaciones). | Fuerte | Moderado | |
| E3. Se sugiere realizar un diario de la estancia en UCI del paciente crítico dentro de un plan integral a la rehabilitación neurocognitiva pos-UCI. | Condicional | Bajo | |
| ¿Cuál es el manejo de sedación recomendado en pacientes adultos con síndrome de dificultad respiratoria aguda (SDRA)? | F1. En pacientes que presentan SDRA con PaO2/FiO2 mayor o igual a 150 se recomienda seguir los lineamientos dados por la guía, sedación consciente o cooperativa siempre que sea posible, usando las recomendaciones para pacientes en ventilación mecánica, evaluando los niveles de sedación periódicamente con escalas y usar los protocolos de sedación guiados por enfermería. En pacientes que presentan trastornos de oxigenación moderado PaO2/FiO2<150 y que requieren relajación muscular se sugiere sedación profunda | Fuerte | Moderado |
| ¿Cuáles son las mejores estrategias de sedación en pacientes con soporte extracorpóreo (ECMO)? | F2 Se sugiere ajustar las dosis de los sedativos (propofol, midazolam o dexmedetominida) debido a que su farmacocinética se ve alterada por los componentes del circuito. A la vez se sugiere usar ketamina para reducir las dosis de sedoanalgesia y vasopresores | Condicional | Bajo |
| ¿Cuál es el manejo de la sedación recomendado en pacientes adultos con inestabilidad hemodinámica? | G1. Se sugiere la ketamina como coadyuvante a la estrategia de sedación en el paciente hemodinámicamente inestable. | Condicional | Bajo |
| G2. Se recomienda usar con precaución agentes sedantes en pacientes con inestabilidad hemodinámica. | Fuerte | Moderado | |
| ¿En pacientes con enfermedad coronaria, Cuál es el manejo de la sedación más adecuado? | G3. En pacientes con síndrome coronario agudo, se sugiere el uso de dexmedetomidina para sedación. | Condicional | Bajo |
| G4. En pacientes en postoperatorio de revascularización miocárdica, se sugiere el uso de dexmedetomidina como fármaco de elección para la sedación | Fuerte | Alto | |
| G5. Se sugiere tener precaución con el uso de la dexmedetomidina y los alfa-2 agonistas, ya que tienen riesgo de producir hipotensión arterial y bradicardia | Condicional | Moderado | |
| ¿Cuáles son las estrategias recomendadas para la analgesia y sedación durante la cardioversión eléctrica? | G6. Se recomienda el propofol y el midazolam como medicamentos de elección para la realización de cardioversión eléctrica. | Fuerte | Moderado |
| G7. La dosis de propofol sugerida va desde 0,5 mg/kg hasta 1 mg/kg para pasar en 30 a 60 segundos, la adición de un opiáceo (alfentanil 5 mcg/kg, fentanil 0,5 mcg/kg, remifentanil 0,25 mcg/kg) a dosis baja es una alternativa segura y no se asocia a mayores complicaciones. | Condicional | Moderado | |
| G8. El etomidato parece ser similar al propofol durante la cardioversión eléctrica, sin embargo, se asocia a mayor tasa de eventos adversos por lo cual se considera de segunda línea. El midazolam es efectivo durante la cardioversión eléctrica, sin embargo, requiere vigilancia durante mayor tiempo poscardioversión y debe estar disponible el flumazenil como antídoto. | Condicional | Bajo | |
| G9. El agente farmacológico elegido puede ser administrado por un médico con adecuado equipo y entrenamiento en el manejo de la vía aérea. En este escenario el midazolam es el medicamento de elección. | Condicional | Moderado | |
| G10. Se sugiere la administración de dexmedetomidina a dosis de 1 mcg/kg 10 minutos antes de la administración de un agente sedante para disminuir la recidiva de arritmias en las primeras 24 horas. | Condicional | Bajo | |
| ¿Cuál es el manejo de sedación recomendado en pacientes adultos con hipertensión endocraneana? | H1. Se recomienda aplicar una estrategia de sedación a todos los pacientes con hipertensión endocraneana enfocada en metas de protección cerebral | Fuerte | Moderado |
| H2. Se sugiere reservar el uso de barbitúricos como el tiopental sódico o el pentobarbital solo a los casos de hipertensión endocraneana refractaria a otras medidas terapéuticas | Condicional | Bajo | |
| H3. No se recomienda la interrupción diaria de la sedación en los pacientes con hipertensión endocraneana. | Condicional | Bajo | |
| ¿Cuál es el manejo de sedación recomendado en pacientes adultos con trauma craneoencefálico severo? | H4. Se sugiere utilizar medicamentos de vida media corta y de poca acumulación (propofol, dexmedetomidina y remifentanil) que permitan evaluaciones neurológicas frecuentes. | Condicional | Bajo |
| ¿En qué pacientes que requieran sedación está indicado el uso de dispositivos de monitorización de la actividad cerebral? | H5. Se recomienda usar monitorización electrónica de actividad cerebral frontal en pacientes bajo efectos de relajación neuromuscular para evitar infra- y sobresedación. | Fuerte | Moderado |
| H6. Se sugiere el uso de monitorización electrónica de actividad cerebral frontal para reducir la dosis de agente sedante en pacientes con sedación profunda | Condicional | Bajo | |
| H7. Se sugiere el uso de escalas clínicas validadas para valorar el nivel de sedación/ agitación en el paciente crítico en sedación ligera y sin bloqueo neuromuscular. | Condicional | Muy Bajo | |
| Analgesia | |||
| ¿Cuál es el beneficio de usar protocolos de analgesia? | A1. Se recomienda el uso de protocolos de analgesia y sedación basada en analgesia para el adecuado control del dolor de todos los pacientes críticos que ingresan a la UCI. | Fuerte | Moderado |
| A2. Se recomienda la educación y capacitación continua del personal al cuidado del paciente (enfermeras, intensivistas, terapeutas) acerca del protocolo y las opciones de tratamiento disponibles en la institución. | Fuerte | Moderado | |
| ¿Cuáles son las estrategias de analgesia en el paciente crítico? | A3. Se recomienda siempre la evaluación del dolor mediante escalas según las condiciones del paciente. | Fuerte | Moderado |
| A4. Se recomienda brindar educación clara acerca de la evaluación, la intervención, las metas y los efectos secundarios de la terapia que se va a instaurar | Fuerte | Bajo | |
| A5. Se sugiere el uso de analgésicos opioides como parte de unas de las primeras líneas de tratamiento analgésico en dolor de origen no neuropático | Condicional | Moderado | |
| A6. En caso de requerir opioides, se sugiere usar la menor dosis posible para mantener el paciente confortable | Condicional | Bajo | |
| A7. Se recomienda la evaluación periódica de la presencia de dolor para el ajuste adecuado de las dosis. | Fuerte | Moderado | |
| A8. Se recomienda la administración de analgésicos antes de realizar procedimientos que exacerben el dolor | Fuerte | Moderado | |
| A9. Se sugiere el uso de medidas no farmacológicas como musicoterapia, mindfulness, electroestimulación y masajes como terapia coadyuvante | Fuerte | Moderado | |
| A10. Se sugiere la adopción de estrategia multimodal y/o bundle ABCDEF para la promoción de la activación temprana del paciente crítico en la UCI | Fuerte | Moderado | |
| ¿Cuáles son los beneficios de optimizar el uso de opioides en pacientes críticos y quiénes son los que más se benefician? | A11. Recomendamos que se usen las menores dosis de opioides para conseguir el objetivo terapéutico y solo por el menor tiempo necesario. | Fuerte | Moderado |
| ¿Cuál es la estrategia para el manejo del dolor del paciente críticamente enfermo que no tiene soporte ventilatorio? | A12. Se recomienda la monitorización rutinaria del dolor en la UCI, evaluado por una herramienta validada, con los objetivos de mejorar el manejo del dolor y el uso más eficiente de los analgésicos. | Fuerte | Moderado |
| A13. Se recomienda estratificar a los pacientes según su tipo de dolor (p. ej., agudo, subagudo, crónico, neuropático o no neuropático) e intensidad (p. ej. leve 0-3, moderada a grave>4/10) de su dolor, así como su exposición previa a los opiáceos (p. ej., primera ocasión versus tolerante) para elegir la opción terapéutica más adecuada. | Fuerte | Moderado | |
| A14. Se recomienda el uso de analgesia multimodal con el propósito de controlar el dolor en el paciente crítico sin ventilación mecánica y reducir el uso de opiáceos en esta población | Fuerte | Moderado | |
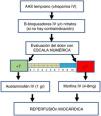
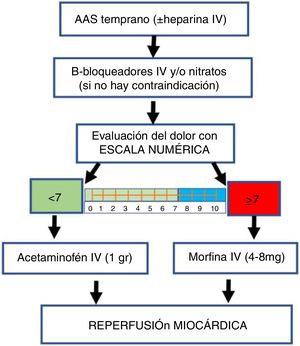
| ¿Cuál es el manejo del dolor en pacientes con enfermedad coronaria? | B1. Se recomienda evitar el uso de morfina de forma rutinaria en pacientes con infarto agudo de miocardio. | Fuerte | Moderado |
| B2. Se recomienda hacer uso de estrategias para el control del dolor alternativas a la morfina en pacientes con infarto de miocardio, incluyendo el uso de los nitratos y beta bloqueadores. | Fuerte | Moderado | |
| B3. Se sugiere restringir el uso de morfina en pacientes con infarto agudo de miocardio con elevación del ST en casos de persistencia de dolor severo (VAS≥7), a pesar del inicio de terapias antiisquémicas y antitrombóticas. | Condicional | Bajo | |
| B4. Se sugiere el uso de acetaminofén como estrategia analgésica en los pacientes hipertensos con riesgo cardiovascular. | Condicional | Bajo | |
| B5. Se sugiere evitar el uso de AINE como estrategia analgésica de uso prolongado en los pacientes hipertensos crónicos con enfermedad coronaria. | Condicional | Bajo | |
| B6. Se sugiere usar ketamina como parte de las estrategias analgésicas para el paciente con inestabilidad hemodinámica. | Condicional | Moderado | |
| B7. Se sugiere precaución con la aplicación de acetaminofén intravenoso en pacientes con inestabilidad hemodinámica. | Condicional | Bajo | |
| ¿Cuál es el manejo de la analgesia recomendado en pacientes adultos con sepsis y shock séptico? | C1. Se recomienda la monitorización rutinaria del dolor en la UCI, evaluado por una herramienta validada, con los objetivos de mejorar el manejo del dolor y el uso más eficiente de los analgésicos. | Fuerte | Moderado |
| C2. Se sugiere estratificar a los pacientes según su tipo de dolor (p. ej., agudo, subagudo, crónico, neuropático o no neuropático) e intensidad (leve 0-3, moderada a grave>4/10) de su dolor, así como su exposición previa a los opiáceos (p. ej., primera ocasión versus tolerante) para elegir la opción terapéutica más adecuada. | Condicional | Moderado | |
| C3. Se sugiere el uso de analgesia multimodal con el propósito de controlar el dolor en el paciente crítico sin ventilación mecánica y reducir el uso de opiáceos en esta población. | Condicional | Moderado | |
| ¿Cuál es la estrategia del manejo analgésico recomendada en pacientes adultos con SDRA? | D1. Se recomienda el uso de opioides (con especial consideración por remifentanil) para proporcionar analgesia en el dolor agudo. Realizando los ajustes de las dosis de acuerdo con la etapa del proceso patológico y las necesidades específicas de los pacientes con SDRA grave. | Fuerte | Moderado |
| D2. Se sugiere evitar dosis altas de remifentanil para prevenir la controvertida hiperalgesia asociada con su uso. | Condicional | Bajo | |
| ¿Cuál es la estrategia del manejo analgésico recomendada en pacientes en ECMO? | D3. Se sugiere evitar el uso de analgésicos lipofílicos (por ejemplo fentanil) debido al grado de atrapamiento por el circuito. | Condicional | Bajo |
| D4. Se sugiere el uso de analgésicos preferiblemente no lipofílicos (por ejemplo, morfina). | Condicional | Bajo | |
| D5. Se sugiere ajustar las dosis de analgésicos en función del tiempo en ECMO, si los circuitos son nuevos o viejos, y si el ECMO es veno-venoso o veno-arterial. | Condicional | Bajo | |
| ¿Debe evaluarse la presencia de dolor en los pacientes al final de la vida con limitación del esfuerzo terapéutico (LET)? | E1. Se sugiere evaluar la presencia de dolor, agitación y dificultad respiratoria de modo protocolizado en los pacientes al final de la vida. En los pacientes que presenten dificultades para comunicarse sugerimos evaluar signos objetivos de dolor y dificultad respiratorios. | Condicional | Bajo |
| ¿Cuál es el objetivo del tratamiento analgésico en los pacientes al final de la vida con limitación del esfuerzo terapéutico (LET)? | E2. Se sugiere que el objetivo del tratamiento farmacológico durante la LET busque prevenir y tratar el dolor y otros síntomas como la angustia o la dificultad respiratoria. Cuando se administre un tratamiento, se recomienda dejar registrada su justificación. | Condicional | Bajo |
| Delirium | |||
| ¿Cuál es el beneficio a corto y largo plazo en el manejo adecuado del delirium en el adulto críticamente enfermo? | A1. Se recomienda el manejo adecuado del delirium ya que a corto plazo disminuye el tiempo de ventilación mecánica, trastornos cognitivos, estancia en UCI y hospitalaria; además a largo plazo se asocia con disminución en la mortalidad y mejor calidad de vida. | Fuerte | Alto |
| A2. Se recomienda el uso de dexmedetomidina en infusión continua en pacientes con delirium hiperactivo en ventilación mecánica, ya que se asocia a mayor número de horas libre de ventilador en los primeros 7 días, extubaciones más tempranas y una resolución más rápida del delirium. | Fuerte | Moderado | |
| ¿Cuál es el beneficio de usar estrategias de detección y manejo de delirium? | A3. Se recomienda la valoración diaria con una escala validada como CAM-ICU (the confusion assessment method for the intensive care unit) y ICDSC (intensive care delirium screening checklist) para la detección de delirium en pacientes críticamente enfermos con o sin ventilación mecánica, ya que esto se asocia a disminución de la mortalidad y estancia hospitalaria. | Fuerte | Moderado |
| A4. Se recomienda intervenciones multicomponente (reducción de luz y ruido, cubrimiento de los ojos, orientación frecuente al paciente y provisión de música), en los pacientes críticamente enfermos con delirium para disminuir la duración en días e impactar en mejores desenlaces. | Fuerte | Moderado | |
| ¿Cuáles son las medidas farmacológicas y no farmacológicas más recomendadas para prevenir el delirium en el paciente crítico? | A5. Se recomienda realizar esfuerzos estructurales, organizacionales y de manejo médico para reducir la ansiedad, mejorar la adaptación, la comodidad del paciente, contribuir al adecuado control del dolor, la reorientación frecuente y la optimización del entorno con el fin de disminuir la aparición de delirium. | Fuerte | Moderado |
| A6. Se recomienda intervención multimodal (reducción de luz y ruido, cubrimiento de los ojos, orientación frecuente al paciente y provisión de música) y la estrategia ABCDEF en pacientes críticamente enfermos. | Fuerte | Moderado | |
| A7. Se sugiere la integración de la familia con visitas no restringidas en la prevención del delirium dentro de las terapias no farmacológicas. | Condicional | Bajo | |
| A8. Se recomienda la utilización de dexmedetomidina en infusión continua a bajas dosis para prevención de delirium en POP de cirugía no cardiaca con alto riesgo de delirium. | Fuerte | Alto | |
| A9. Se recomienda en pacientes con ventilación no invasiva la administración de dexmedetomidina, para prevenir el delirium y disminuir la necesidad de intubación. | Fuerte | Moderado | |
| A10. Se sugiere el uso de haloperidol en la prevención de delirium en pacientes mayores de 75 años en postoperatorio de cirugía abdominal y ortopédica. | Condicional | Moderado | |
| ¿Cuáles son las medidas farmacológicas y no farmacológicas más recomendadas para el tratamiento del delirium en el paciente crítico? | A11. Se recomienda las estrategias ABCDEF y multimodales en el manejo de delirium en los pacientes críticamente enfermos. | Fuerte | Moderado |
| A12. Se recomienda la dexmedetomidina para el manejo de pacientes con ventilación mecánica en delirium hiperactivo. | Fuerte | Moderado | |
| A13. Se sugiere la utilización de quetiapina en pacientes con delirium hipoactivo. | Condicional | Bajo | |
| A14. Se recomienda la utilización de dexmedetomidina en el paciente críticamente enfermo con delirium | Fuerte | Moderado | |
| ¿ Es posible predecir la aparición de delirium en el paciente crítico? | B1. Se recomienda el uso de los modelos E-PRE-DELIRIC y PRE-DELIRIC al ingreso y a las 24 horas de admisión respectivamente, para predecir el riesgo de aparición de delirium. | Fuerte | Moderado |
| B2. Se recomienda el uso de las reglas de predicción NICE, el APREDEL-ICU, la herramienta AWOL y otros modelos basados en factores de riesgo, para predecir la aparición de delirium. | Fuerte | Bajo | |
| ¿Cuáles son los factores de riesgo asociados con déficit cognitivo persistente? | C1. Se recomienda realizar una valoración de los factores de riesgo asociados a la aparición de déficit cognitivo persistente en los pacientes admitidos a la UCI.Los principales factores de riesgo asociados a déficit cognitivo persistente son la presencia de delirium en la UCI y síntomas de estrés postraumático durante los primeros 30 días del egreso. | Fuerte | Bajo |
| ¿Cuáles son las estrategias para la prevención del déficit cognitivo persistente? | C2. Se recomienda la prevención y manejo del delirium como principal estrategia para disminuir la incidencia del déficit cognitivo persistente. | Fuerte | Bajo |
| C3. Se sugiere promover movilización temprana, disminución de sedantes, optimización del sueño y un adecuado soporte emocional y psicológico como estrategias asociadas a la disminución del déficit cognitivo persistente. | Condicional | Bajo | |
| Poblaciones especiales | |||
| ¿Qué medicamentos analgésicos y sedantes están indicados y contraindicados en pacientes con insuficiencia hepática? | D1. Se sugiere el uso de analgesia multimodal para el tratamiento del dolor postoperatorio en pacientes adultos con disfunción hepática o renal. | Condicional | Bajo |
| D2. No se sugiere el uso de AINE en pacientes con disfunción hepática. | Condicional | Bajo | |
| D3. Se sugiere el uso de acetaminofén en el primer escalón para manejo de dolor agudo en pacientes cirróticos no alcohólicos en dosis 2-3 g/día. | Condicional | Bajo | |
| D4. Se sugiere evitar el uso de dipirona en pacientes cirróticos. | Condicional | Bajo | |
| D5. Se sugiere el uso de tramadol a dosis de 25 mg cada 8 horas como segunda línea de tratamiento después del acetaminofén. | Condicional | Bajo | |
| ¿Qué medicamentos analgésicos y sedantes están indicados y contraindicados en pacientes con insuficiencia renal? | D6. Se sugiere el uso de fentanil y la metadona como medicamentos seguros en pacientes con insuficiencia renal. | Condicional | Bajo |
| D7. Se sugiere utilizar con precaución la hidromorfona y oxicodona reduciendo la dosis en pacientes con insuficiencia renal. | Condicional | Bajo | |
| D8. Se sugiere evitar el uso de codeína, hidrocodona, meperidina y morfina en pacientes con insuficiencia renal. | Condicional | Bajo | |
| D9. Se sugiere el uso de acetaminofén aumentando el intervalo de medicación a cada 8 horas, con dosis no mayores a un gramo cuando la tasa de filtración glomerular (TFG) es menor a 10 ml por minuto. | Condicional | Bajo | |
| D10. Se sugiere la administración de tramadol para el manejo de dolor en dosis de 100 mg cada 12 h en pacientes con TFG estimada de 30 ml/min y a 50 mg cada 12 h cuando la TFG estimada sea menor a 10 ml/min. | Condicional | Bajo | |
| D11. Se sugiere evitar el uso de AINE en pacientes con insuficiencia renal. | Condicional | Bajo | |
| ¿Cuáles son los medicamentos recomendados para la analgesia postoperatoria en pacientes trasplantados cardiacos, pulmón, hígado o riñón? | E1. Se sugiere el uso de analgesia en el postoperatorio de trasplante pulmonar con bloqueo paravertebral o con analgesia epidural torácica continua. | Condicional | Bajo |
| E2. Se sugiere tener precaución al usar dexmedetomidina, como sedante en pacientes en postoperatorio de trasplante pulmonar, por el riesgo de asistolia. | Condicional | Bajo | |
| E3. Se sugiere el control y administración intraoperatorio de magnesio cuando se use tramadol como analgésico postoperatorio. | Condicional | Bajo | |
| E4. Se sugiere el uso de STAP (subcostal transversus abdominis plane block), guiado por ultrasonido, en el manejo del dolor postoperatorio de trasplante hepático. | Condicional | Bajo | |
| E5. Se sugiere evitar el uso de AINE en el postoperatorio de trasplante renal. | Condicional | Bajo | |
| E6. Se sugiere el uso de acetaminofén en el primer escalón de manejo de dolor postrasplante renal. | Condicional | Bajo | |
| E7. Se sugiere no utilizar el bloqueo de un plano transverso del abdomen (TAP) para el manejo de dolor postrasplante renal, pues no afecta el uso de morfina postoperatorio. | Condicional | Bajo | |
| E8. Se sugiere el uso de tramadol en paciente posoperatorio de trasplante renal. | Condicional | Bajo | |
| E9. Se sugiere el uso de hidromorfona en el postoperatorio inmediato de trasplante renal. | Condicional | Bajo | |
| Varios | |||
| ¿Qué consideraciones especiales y cuáles son las recomendaciones farmacológicas para el manejo de la sedación y analgesia en pacientes con situaciones especiales (traumatizados, ancianos, quemados y embarazadas)? | A1. Se sugiere que la dexmedetomidina puede ser una alternativa al haloperidol en el manejo de delirium en pacientes traumatizados sin trauma craneoencefálico (TCE) | Condicional | Moderado |
| A2. Pacientes sin lesión cerebral aguda: se recomienda el uso de ketamina como analgésico adicional en pacientes con trauma de tórax y fracturas costales en quienes no se logre control de dolor con PCA ni técnicas regionales | Condicional | Moderado | |
| A3. Se recomienda la monitorización con BIS en el manejo de pacientes con trauma múltiple | Fuerte | Moderado | |
| A4. Se sugiere el inicio de metadona en los primeros 4 días de inicio de la ventilación mecánica para reducir los tiempos de ventilación en pacientes que posiblemente estén ventilados por lo menos una semana | Condicional | Bajo | |
| A5. Se recomienda el uso de dexmedetomidina para la prevención de delirium en ancianos después de cirugía no cardiaca | Fuerte | Alto | |
| A6. Se recomienda el uso de dexmedetomidina como sedación en el manejo perioperatorio de cirugía cardiaca en pacientes mayores de 60 años para prevención de delirium. | Fuerte | Moderado | |
| A7. Se recomienda el uso de dexmedetomidina como agente sedante de elección en pacientes eclámpticas posparto que requieran ventilación mecánica, esto en relación a disminución de la presión arterial, frecuencia cardiaca, disminución de la necesidad de antihipertensivos, opiáceos y menor estancia en UCI. | Fuerte | Bajo | |
| A8. Se recomienda el uso de la dexmedetomidina como coadyuvante para la sedación en pacientes quemados ventilados. | Condicional | Bajo | |
Para la elaboración de esta nueva versión de las guías se plantearon preguntas sobre temas que no se habían abordado en las guías anteriores, otras fueron preguntas sobre temas que ya se habían revisado pero sobre los que se quiso hacer una actualización. El grupo revisó la mejor evidencia disponible para responderlas, encontrando que solo seis preguntas tenían un alto nivel de evidencia, mientras que el nivel fue moderado y bajo para la gran mayoría. La fuerza de las recomendaciones dependió no solo de la calidad de la evidencia disponible (siendo este el criterio más importante) sino también de la relevancia que el consenso de expertos le dio a cada intervención. De esta manera se hicieron algunas recomendaciones fuertes y muchas más recomendaciones condicionales.
Las recomendaciones fuertes se basaron en siete puntos:
- 1.
Evaluación del dolor: se hace énfasis en la importancia de una adecuada evaluación del dolor mediante escalas para cada escenario y tipo de paciente y así ofrecer un manejo y seguimiento óptimo.
- 2.
Educación: educación al paciente y a la familia acerca de la intervención que se va a realizar, así como sus indicaciones, alcances, ventajas, limitaciones y riesgo.
- 3.
Opioides y analgesia multimodal: en el manejo del dolor moderado a severo, los opioides siguen estando en la primera línea de manejo. Sin embargo, cada vez se reconocen más los efectos adversos del uso y abuso de los opioides, por lo cual se deben buscar diferentes alternativas analgésicas dentro de una estrategia multimodal con el fin de disminuir la exposición a estos.
- 4.
Sedación ligera: evaluar la necesidad de sedación o no de cada paciente con el fin de ofrecer comodidad, manteniendo un nivel de sedación lo más superficial posible y usando la sedación profunda solo cuando está indicada y cuando la evidencia ha demostrado beneficios.
- 5.
Delirium: abordar el delirium del paciente crítico desde el momento del ingreso, haciendo predicción del riesgo, prevención, detección, y manejo. En prevención y manejo hay medidas farmacológicas y no farmacológicas que han mostrado beneficios con nivel de evidencia desde alto hasta bajo.
- 6.
Movilización temprana: reducir el desacondicionamiento en UCI mediante la movilización temprana, pasiva y activa cuando su condición clínica lo permita, mediante protocolos, disminuyendo estancias y mejorando la independencia funcional y la calidad de vida de los pacientes al egreso.
- 7.
Menor disrupción del sueño: promover un sueño de calidad con menor fragmentación. Las medidas no farmacológicas como la reducción del ruido y la iluminación nocturna, entre otras, tienen mejor evidencia que las medidas farmacológicas.
Otras recomendaciones fueron presentadas en este documento como condicionales, lo cual no quiere decir que estas intervenciones no sean importantes, pues aunque la evidencia disponible que las soporta tiene un nivel inferior, el grupo ha considerado proponerlas en beneficio del paciente crítico. El juicio clínico al lado del paciente con el conocimiento de las mejores estrategias, ayudarán a tomar mejores decisiones. (fig. 1)
ExoneraciónEs importante recordar que las guías son solo una herramienta útil para mejorar las decisiones médicas, y que deben ser utilizadas teniendo en cuenta el criterio médico, circunstancias clínicas, preferencias de los pacientes, y la disponibilidad de los medios locales. También conviene recordar que nuevos resultados de la investigación clínica pueden proporcionar nuevas evidencias que hagan necesario cambiar la práctica usual, aun antes de que estas guías sean actualizadas.
FinanciaciónEl desarrollo de las guías fue posible con el apoyo incondicional de la Federación Panamericana e Ibérica de Sociedades de Medicina Crítica y Terapia Intensiva (FEPIMCTI), el Hospital Universitario Fundación Santa Fe de Bogotá (FSFB), la Asociación Colombiana de Medicina Crítica y Cuidado Intensivo (AMCI), y un Grant Educacional Irestricto de Pfizer.
Conflicto de interesesLos miembros del grupo Consenso declaran los siguientes conflictos de intereses: J.C. Díaz, investigador principal o secundario en estudios patrocinados por Abbot, Aspen, Amarey, Glaxo, conferencista para Aspen, Baxter, B.Braun, Dräger, Hamilton, Hospira y Glaxo; G. Castorena, conferencista de MSD para Sugamadex; G. Castillo Abrego conferencista de Medtronic y Zoll medical; J.M. Pardo, apoyo para asistir a congresos por MSD y Sanofi Aventis. Los demás autores no declaran ningún conflicto de intereses.
A la Asociación Colombiana de Medicina Crítica y Cuidado Intensivo por su soporte en la elaboración de la guía.
Al Hospital Universitario Fundación Santa Fe de Bogotá por su soporte académico y administrativo en la elaboración de la guía. Especialmente a Alexandra Suárez por su ayuda en la organización de la logística y trabajo de secretaría en la elaboración del escrito de la guía.