INTRODUCCIÓN
La cetoacidosis diabética (CAD) es una complicación aguda grave de la diabetes mellitus (DM) que afecta a más de 100.000 personas/año en EE.UU. A menudo, puede cursar con temperatura corporal baja, pero se asocia raramente a hipotermia grave. Esta complicación conlleva una elevada morbimortalidad1. Se estima que es responsable del 9 al 28% de todos los ingresos hospitalarios relacionados con la enfermedad y su incidencia varía según la edad y el sexo en un rango que va desde 4,6 a 13,4 casos por 1.000 pacientes diabéticos/año. Es más frecuente en mujeres y adultos jóvenes pese a la creencia popular de que lo es en niños2.
A pesar de los avances logrados en el tratamiento de la CAD, las tasas de mortalidad se cifran en torno al 2-5%, aunque en países en vías de desarrollo se registran cifras que varían entre el 6 y el 24%3. En estos pacientes el fallecimiento rara vez es el resultado de las complicaciones metabólicas por la hiperglucemia o de la acidosis metabólica, sino más bien se relaciona con la enfermedad que precipitó la CAD; y se consideró a aquélla el factor predictor que se asocia con una estancia hospitalaria más prolongada en pacientes con CAD4.
Se ha descrito que la hipotermia puede aparecer como complicación de una hipoglucemia y de la acidosis láctica. Asimismo es conocido que la CAD puede afectar a la regulación de la temperatura corporal al causar una alteración en la producción de calor. La hipotermia resultante agravaría la emergencia que en sí constituye esta complicación grave de la DM5.
CASO CLÍNICO
Se trata de un varón de 40 años, fumador activo y ex bebedor, diagnosticado de DM tipo 1 (DM1) a raíz de un ingreso hospitalario por CAD. Seguía tratamiento con insulina Actrapid Novolet® en el desayuno y la comida e Insulina Mixtard Novolet® en la cena, pero con un mal control metabólico crónico. Vivía con sus padres en una casa mal acondicionada para las bajas temperaturas invernales. La mañana de su ingreso, y tras ser visto consciente por última vez la noche anterior, la familia lo encontró en la cama inconsciente, sin respuesta a estímulos vigorosos, motivo por el que avisó al médico del servicio especial de urgencias, que constató la situación de coma, test de Glasgow de 7 puntos, con respiración superficial e intensa rigidez de las extremidades. Ante los antecedentes clínicos y la sospecha de coma cetoacidótico, se le administró insulina rápida intravenosa (i.v.) e inició sueroterapia i.v. El paciente fue trasladado al servicio de urgencias de nuestro hospital. La exploración clínica inicial mostró a un paciente en coma, con escala de Glasgow de 7 puntos (O1-M5-V1), hipotenso, con presión arterial
media de 55 mmHg y una temperatura timpánica central de 27,6 °C. Se avisó inmediatamente al intensivista de guardia y se decidió su ingreso en la unidad de cuidados intensivos (UCI).
A su ingreso en la UCI presentaba un Glasgow de 8 puntos (O1-M5-V2), frialdad y sequedad intensa de piel y las mucosas, presión arterial de 80/40 mmHg y una taquipnea a 30 respiraciones por min (rpm). Se confirmó mediante termómetro timpánico que la temperatura central era de 27,6 °C, por lo que se iniciaron inmediatamente medidas de recalentamiento externo con manta térmica automática para alcanzar una temperatura de 36 °C, focos de infrarrojos, así como la administración de fluidos intravenosos a 37 °C calentados por un calentador de fluidos Hotline®. Se tomaron muestras analíticas de sangre (bioquímica completa, hemograma y coagulación), anormales, y sedimentos en orina, así como 3 hemocultivos seriados y un urocultivo, y se inició posteriormente tratamiento con un antibiótico de amplio espectro por vía intravenosa.
En la analítica a su ingreso destacaba: glucemia de 963 mg/dl, creatinina de 2,1 mg/dl, leucocitos 27 x 109/l con 90% de segmentados y creatinfosfocinasa total de 84 UI/l. La gasometría venosa mostraba un pH de 6,82, PaCO2 de 13 mmHg con un bicarbonato de 3 mmol/l. En la analítica simple de orina se objetivó la presencia de metilcetona, 8 mmol/l; glucosa; > 56 mmol/l; bacterias positivas y nitritos negativos. La radiografía de tórax no mostraba alteraciones. El resto de la exploración física fue normal. Se inició tratamiento con fluidoterapia i.v. con control de la presión venosa central e insulina rápida i.v. en perfusión continua, precisando dosis que alcanzaron las 18 U/h. El paciente evolucionó favorablemente con normalización lenta y progresiva de los parámetros clínicos y analíticos antes mencionados a las 12 h desde su ingreso en la unidad y fue dado de alta a planta en situación clínica estable 2 días más tarde.
DISCUSIÓN
La CAD ha sido descrita como una complicación aguda de la DM, que aparece en los pacientes diagnosticados de DM1, con una incidencia que varía entre el 8 y el 6% al año. Puede ser la primera manifestación de una diabetes aún no diagnosticada o presentarse en un paciente ya diagnosticado y con mal control metabólico crónico; esta última es la causa más frecuente, sobre todo si los episodios son recurrentes. Se sabe que también puede estar presente en pacientes con DM tipo 2, aunque es menos frecuente y su aparición suele estar asociada con situaciones que supongan un estrés grave, como sepsis, traumatismo o cirugía mayor3.
La fisiopatología de la CAD es el resultado de un déficit agudo de insulina y un aumento de las hormonas contrarreguladoras (glucagón, catecolaminas, corticoides y hormona del crecimiento) en respuesta a una determinada situación clínica. El déficit agudo de insulina es, a su vez, el factor regulador más importante de la cetogénesis. En ausencia de insulina se reduce la utilización de la glucosa y de los cuerpos cetónicos, con lo que ambas sustancias se acumulan en la sangre. La hiperglucemia resultante provoca un aumento de la diuresis, depleción del volumen intravascular e hiperosmolaridad que se correlaciona estrechamente con la depresión del sistema nervioso central y el coma. La acumulación de cuerpos cetónicos provoca acidosis metabólica, que se ve agravada por una defectuosa excreción renal de hidrogeniones que puede deteriorar el sistema cardiovascular.
El cuadro clínico se caracteriza por síntomas abdominales, polidipsia y poliuria, y en casos graves puede llegar a depresión respiratoria y del sistema nervioso central6. El diagnóstico se basa, además de la sintomatología antes descrita, en la constatación de glucemias elevadas por encima de 250 mg/dl, en la presencia de cuerpos cetónicos en la orina y en la sangre, un pH ≤ 7,30 y/o bicarbonato sérico ≤ 15 mmol/l.
La asociación de CAD con hipotermia fue descrita por varios autores en la bibliografía5,9,10. Es conocido que los pacientes con CAD a veces tienen una temperatura corporal baja, incluso cuando la infección no está presente, aunque una hipotermia grave definida por temperatura corporal central por debajo de 32 °C es un hallazgo muy infrecuente9.
Se han descrito7 varias razones de la coexistencia de ambas situaciones clínicas, entre las que destacan una vasodilatación periférica como consecuencia de la acidosis, las alteraciones de la osmolaridad que provocan interferencia en el centro termorregulador y la incapacidad de mantener la temperatura corporal en condiciones de bajas temperaturas ambientales.
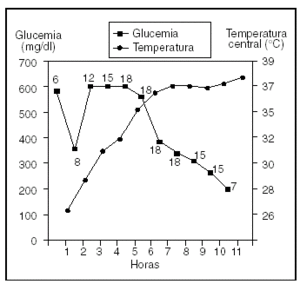
La hipotermia provoca un aumento de los valores de esteroides y catecolaminas, con lo que se inhibe la liberación de insulina, se aumenta su resistencia periférica tisular, aumentan los ácidos grasos libres y se induce la glucogenólisis y la gluconeogénesis; todo ello contribuye a un aumento de los valores de glucemia en la sangre. Por otra parte, la insulina exógena tiene un escaso efecto cuando el paciente está hipotérmico y es preciso administrarla en dosis altas para conseguir un efecto beneficioso8. En nuestro caso, se infundieron dosis de hasta 18 U/h de insulina rápida i.v., durante 4 h para un control adecuado de la glucemia, tal y como se refleja en la figura 1.
Figura 1. Evolución horaria desde el ingreso en la unidad de cuidados intensivos de los valores de temperatura corporal central y de glucemia y la dosis administrada de insulina intravenosa en perfusión continua.
En el tratamiento de la CAD asociado a hipotermia grave, junto a la administración de fluidoterapia intensa, la corrección de las alteraciones hidroelectrolíticas y la administración de insulina por vía intravenosa, se deben iniciar medidas de recalentamiento externo e interno de forma cuidadosa. En nuestro caso se realizó el calentamiento de fluidos i.v. mediante un sistema HOTLINE®, y se utilizaron una manta eléctrica y una lámpara de infrarrojos hasta alcanzar un estado de normotermia.
Sin embargo, se debe realizar un adecuado diagnóstico y tratamiento de la enfermedad de base que ha originado la descompensación diabética. Guerin et al9 describen una prevalencia del 14% y una mortalidad del 60% en los pacientes con hipotermia grave y CAD. Estos mismos autores10 encuentran que en pacientes con CAD que presentan infección, la prevalencia de la hipotermia es 4 veces más alta que en los pacientes sin enfermedad infecciosa subyacente, y la mortalidad, 3 veces mayor respecto al grupo de pacientes con CAD sin infección como causa de descompensación. También se han descrito hallazgos similares en la bibliografía5.
Se recomienda sistemáticamente emplear tratamiento antibiótico en todo paciente con CAD e hipotermia. En nuestro caso, tras la toma de cultivos se inició el tratamiento con antibiótico de amplio espectro. Los resultados de los cultivos fueron negativos y no se detectó foco infeccioso alguno.
En resumen, aunque la asociación de CAD con hipotermia grave es rara, para el manejo de estos pacientes debemos tener en consideración una monitorización estricta en una UCI, que permita la estabilización cardiorrespiratoria y hemodináica del paciente y la normalización de las alteraciones hidroelectrolíticas, el tratamiento de la enfermedad precipitante de forma temprana y efectiva, así como la aplicación de unas adecuadas medidas de recalentamiento corporales internas y externas.