Analizar la relación y concordancia entre el esfuerzo respiratorio calculado con las señales del respirador (Pmus) y el medido con presión esofágica (Pes), en ventilación mecánica con diferentes niveles de asistencia respiratoria.
DiseñoEstudio prospectivo de una cohorte.
ÁmbitoUnidad de cuidados intensivos polivalente en 2 hospitales terciarios.
PacientesPacientes en fase de retirada de la ventilación mecánica.
IntervencionesLa presión en la vía aérea, esofágica y flujo respiratorio se registraron en CPAP, ventilación asistida controlada por volumen (ACV) y presión soporte (PS) con asistencia respiratoria completa (ACV1, PS1) y parcial (ACV5, PS5). Variables medidas en Pes y Pmus: amplitud respiratoria (Δ: cmH2O) y el producto presión tiempo por minuto (PTPm: cmH2O·s/m).
ResultadosEn 10 pacientes se estudiaron 41 registros. La asistencia en CPAP fue de 5cmH2O, PS1 15±5 y PS59±4cmH2O. En ACV1 el flujo inspiratorio fue 1±0,2l/s, reducido a 0,49±0,1l/s para ACV5. El esfuerzo respiratorio disminuyó con el aumento de la asistencia respiratoria: ΔPes (CPAP, ACV5, ACV1, PS5, PS1): 11±3, 6±3, 5±3, 9±6, 7±7 y en ΔPmus 16±5, 10±6, 5±3, 10±6, 5±4cmH2O (p<0,001). PTPm Pes: 213±87, 96±91, 23±24, 206±121, 108±100 (p=0,001) y en Pmus: 293±117, 156±84, 24±32, 233±121, 79±90cmH2O·s/m (p<0,001). Las medidas en Pes y Pmus mostraron una correlación Δ:0,72 y PTPm: 0,87. El análisis de Bland-Altman demostró que la diferencia ΔPes-Pmus puede ser de 16cmH2O y el PTPm de 264 y el error sistemático en Δ: −0,98±4,4 y PTPm −23,69±66,3cmH2O·s/m.
ConclusionesLos parámetros calculados de esfuerzo respiratorio y los medidos directamente presentan diferencias que no son aceptables en la práctica clínica.
Study the relationship and concordance between calculated respiratory effort using the signals of the ventilator (Pmus) and that measured in esophageal pressure (Pes) on mechanical ventilation with different levels of respiratory assistance.
DesignProspective cohort study.
AmbitIntensive Care Unit of 2 universitary hospitals.
Patients Patients on weaning time.
ProcedureAirway, esophageal and respiratory flow were recorded on CPAP, assist volume control (ACV) and pressure support (PS), with complete (ACV1,PS1) and partial assistance (ACV5,PS5). Measurement: respiratory variations of Pes and Pmus (Δ: cmH2O) and pressure time product (PTPm: cmH2O·s/m).
ResultsFourty one records were studied, the assistance was in CPAP of 5cmH2O, PS1 of 15±5 reduced to 9±4cmH2O. In ACV1 the inspiratory flow was 1±0.2l/s, reduced to 0.49±0.1l/s for ACV5. The increase in respiratory assistance decreases respiratory effort, measured in Delta Pes (CPAP, ACV5, ACV1, PS5, PS1): 11±3, 6±3, 5±3, 9±6, 7±7 and in Pmus 16±5, 10±6, 5±3, 10±6, 5±4cmH2O (P<.001). The PTP per minute measured in Pes: 213±87, 96±91, 23±24, 206±121, 108±100 (P=.001) and in Pmus: 293±117, 156±84, 24±32, 233±121, 79±90 (P<.001). The measurements in Pes and Pmus showed the following correlation, in Delta: 0.72 and PTPm, 0.87. The Bland-Altman analysis indicates that the difference between Delta Pes-Pmus can be 16 and the PTPm of 264 and the systematic error in Delta: −0.98±4.4 and PTPm −23.69±66.3cmH2O·s/m.
ConclusionsCalculated and measured parameters of respiratory effort showed unacceptable differences in clinical practice.
En la práctica diaria programar los parámetros del respirador en ventilación asistida suponen un reto, una excesiva asistencia produce disfunción diafragmática por reposo muscular y facilita el fallo de trigger. Por otro lado, un excesivo esfuerzo produce disnea1, asincronía e incluso fatiga y lesión muscular2, con el riesgo de prolongar la duración de la ventilación mecánica3. Por tanto, parece aconsejable objetivar el esfuerzo muscular y recientes revisiones recuerdan este tema, así como la dificultad en la incorporación a las prácticas de monitorización en UCI4. «A pie de cama» valoramos el trabajo respiratorio mediante el examen clínico y por la monitorización de las señales respiratorias ofrecidas por el respirador. La valoración clínica de la dificultad respiratoria está basada en un conjunto de signos clínicos, pero la observación y cuantificación muestra una amplia variabilidad interobservador5. En nuestro conocimiento no hay estudios clínicos que comparen la exploración clínica con medidas objetivas del esfuerzo muscular respiratorio. La interpretación de las curvas de la pantalla del respirador depende de la experiencia del médico, pero incluso facultativos experimentados tienen dificultades en su interpretación6. Los cambios que el esfuerzo muscular respiratorio produce en la curva de presión en vía aérea, en ventilación asistida controlada por volumen y en el flujo inspiratorio en ventilación con presión soporte, permiten inferir la intensidad del esfuerzo respiratorio7,8. En estos casos estamos asumiendo que el esfuerzo que realiza el paciente modifica la presión en ventilación controlada por volumen (ACV) o el flujo en presión soporte (PS) y por tanto la diferente morfología respecto a la ventilación controlada o pasiva representa la presión muscular (Pmus) respiratoria calculada9,10. La incorporación de esta señal a la monitorización del paciente con ventilación mecánica permite mejorar la interacción con el respirador8,11, pero hay poca información sobre la capacidad de estimar la amplitud de la presión pleural en modos de ventilación asistida12. En este sentido, ha sido utilizada en ventilación con PS para optimizar el nivel de asistencia, mostrando una buena correlación con la presión esofágica (Pes)8, pero no se ha establecido la concordancia entre ambas señales y por tanto si son equivalentes para medir el trabajo respiratorio13.
El objetivo de este estudio es evaluar la concordancia entre la medida invasiva del esfuerzo respiratorio con sonda de Pes y la no invasiva con las curvas que muestra el respirador.
Material y métodosPacientesEstudiamos a un grupo de pacientes que precisaron ventilación mecánica por diferentes causas, ingresados en UCI medicoquirúrgica de 2 centros hospitalarios de tercer nivel, con criterios para iniciar la retirada de la ventilación mecánica y que aceptan la participación en el estudio. Excluimos a pacientes con fuga pleural activa, cirugía o sangrado digestivo reciente y deformidades de la caja torácica.
Monitorizados con electrocardiograma, pulsioximetría y presión arterial no invasiva. El protocolo fue aprobado por el comité de investigación del hospital y el consentimiento para participar fue obtenido del paciente o familiar.
Señales registradas. El flujo respiratorio (V‘) es medido con un neumotacógrafo (Fleisch n.o 2) interpuesto entre el tubo endotraqueal y la conexión en Y del circuito del respirador. El volumen (V) es obtenido por integración de la señal de flujo. La presión de la vía aérea (Pva) es registrada de una conexión entre el tubo endotraqueal y el circuito del respirador. La Pes fue medida con un catéter balón tras insuflar 0,5ml de aire, la posición fue confirmada con un test de oclusión. Las presiones son medidas con un transductor de presión diferencial, procesadas y almacenadas en un ordenador para un posterior análisis utilizando el software Anadat.
La mecánica respiratoria fue calculada en ventilación asistida controlada por volumen con alta asistencia (ACV1), sin maniobras adicionales. Por regresión lineal múltiple, con el método de los mínimos cuadrados, ajustando los valores de presión, volumen y flujo, durante todo el ciclo respiratorio, a un modelo mecánico de un compartimento con un valor de elastancia y resistencias. Básicamente con la señales de volumen y flujo buscamos 2 constantes (Esr, Rsr) que permitan reproducir la presión medida en la vía aérea, considerando que esta es la suma de una presión elástica y otra resistiva. La variable dependiente es la Pva y las independientes el flujo y volumen [Pva(t)=Esr V(t)+Rsr (V́)+Pesp]. Esr, es la elastancia dinámica y Rsr, son las resistencias totales del sistema respiratorio respectivamente. Pesp representa la PEEP dinámica o punto de la curva de presión en el que comienza la integración del flujo14. Utilizamos el valor medio de los ciclos respiratorios incluidos en el tiempo de registro (40s), si el coeficiente de determinación del ajuste es superior a 0,95. En casos con altos niveles de PEEPi utilizamos el método de oclusión inspiratoria y espiratoria.
Pmus calculada. Utilizamos el mismo modelo de análisis de la mecánica respiratoria, asumiendo que la presión en el sistema es el resultado de la presión ejercida por el respirador y la musculatura respiratoria [Rsr·V’+Esr·V+Pesp=Pva−Pmus]. Conociendo las anteriores variables calculamos Pmus [Pmus=Rsr·V́+Esr·V+Pesp−Pva]7,15. El valor de Pmus durante la fase espiratoria está relacionado con la PEEP, pero no representa el verdadero valor que no puede ser calculado.
ProcedimientoEl paciente en posición reclinada, previo al registro de las señales retiramos el humidificador y se aspiran secreciones bronquiales. Al comienzo del estudio realizamos una prueba de CPAP y a los 30min tras el registro, iniciamos ventilación asistida controlada por volumen con asistencia respiratoria alta (ACV1). Para esto el trigger inspiratorio es programado al máximo de sensibilidad, sin autotrigger, la PEEP según la PEEPi y la frecuencia respiratoria que permita que el disparo del respirador sea realizado por el paciente. El volumen corriente de 6-8ml/kg de peso ideal y aumentamos el flujo inspiratorio (cuadrado) para que el esfuerzo respiratorio sea mínimo, valorado en la curva de Pes. Si es necesario el volumen corriente fue aumentado transitoriamente para reducir el esfuerzo. Después de registrar las señales, el flujo inspiratorio fue reducido según el nivel de esfuerzo hasta un 50% y repetimos el registro (ACV5). En ventilación en soporte de presión, la sensibilidad del trigger inspiratorio, espiratorio y PEEP no fue modificada. El nivel de asistencia fue aumentado en pasos de 2-5cmH2O hasta que el esfuerzo fue mínimo (PS1); tras el registro, la asistencia fue reducida en un 50% (PS5).
Índices fisiológicos medidos en la presión esofágica y muscularAmplitud respiratoria de Pes y Pmus (delta Pes, delta Pmus) medidas como la diferencia entre el inicio del descenso inspiratorio de Pes y Pmus hasta el máximo descenso o nadir de cada señal.
Producto presión tiempo inspiratorio (PTP)16,17 cuantificado como el área entre la presión de retroceso elástica de la pared torácica (Pre.pt) y la Pes o Pmus inspiratoria. Consideramos el final del esfuerzo inspiratorio el punto de presión equivalente al flujo igual a cero. Pre.pt medida a partir de la elastancia de la pared torácica durante la ventilación pasiva y el volumen corriente durante la ventilación asistida. Esta presión es extrapolada al inicio del esfuerzo inspiratorio en Pes y Pmus [Pre.pt=(Ept·v)+Pes.esp], donde Pes.esp es la Pes o Pmus al final de la espiración, Ept es la elastancia de la pared torácica medida en ACV1, relación entre la variación respiratoria de la Pes y el volumen corriente. El área fue medida por integración de la presión (Pes, Pmus) en función del tiempo; medimos 3 ciclos representativos del patrón respiratorio del paciente en cada modo de ventilación y obtenemos el valor medio, este es expresado por minuto, considerando la frecuencia respiratoria medida en la señal de flujo. Estas medidas son realizadas en cada modo de ventilación y CPAP.
Análisis estadísticoUtilizamos el test de Kolmogorov-Smirnov para analizar si las variables estudiadas siguen una distribución normal. Los datos se expresan como medias con desviación estándar (DE) y medianas con cuartiles 25-75%. Se comparan con t-test, o no paramétricos de sumas de rangos Mann-Whitney, según proceda. Para medias repetidas se realizó test ANOVA. La relación entre variables se evaluó mediante regresión lineal simple y el ajuste entre los 2 métodos de medida aplicando análisis de concordancia de Bland-Altman. El porcentaje de error fue calculado como los límites de ajustes (2DE) de las diferencias de medias dividido por la media de los 2 métodos18. Se consideró el nivel de significación estadística valor de p<0,05.
ResultadosEstudiamos a 10 pacientes; sus características son resumidas en la tabla 1. Se realizaron 50 registros, de estos, 41 fueron adecuados para el análisis, el resto se descartaron por artefactos en la señal de Pes. El nivel de CPAP aplicada fue de 5cmH2O, excepto en un caso que precisó 18cmH2O por PEEPi de 20cmH2O. En este modo el pico de flujo inspiratorio (V‘máx) fue de 0,7±0,1l/s y el volumen minuto (VE) de 9±2l/m. En ACV1 el volumen corriente 0,42±0,04 l, VE de 9±2l/m y V́I de 1±0,2l/s. El flujo inspiratorio fue disminuido a 0,49±0,1l/s para ACV5, con VE de 9±3. En PS la asistencia para reposo muscular máximo (PS1) fue de 15±5cmH2O y disminuida a 9±4cmH2O en PS5, sin cambios significativos en V́I 0,8±0,1 vs. 0,8±0,04l/s, VE fue más alto que con los otro modos 10±3l/m (fig. 1).
Características de los pacientes, mecánica respiratoria y pronóstico
| N.o | Sexo | Edad (años) | Apache IIal ingreso | Días VM | Diagnóstico | EsrcmH2O/l | RsrcmH2O/l/s | EptcmH2O/l | RptcmH2O/l/s | PEEPicmH2O | Evolución |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | 74 | 29 | 40 | PostQco abd-SDRA | 30 | 8 | 10 | 0,4 | 1 | Alta |
| 2 | M | 48 | 17 | 35 | Peritonitis 3.a-SDRA | 21 | 10 | 9 | 0,9 | 7 | Exitus |
| 3 | M | 55 | 16 | 25 | Pancreatitis-SDRA | 36 | 9 | 11 | 0,6 | 0 | Alta |
| 4 | M | 70 | 22 | 1 | IRCA | 12 | 7 | 4 | 0,6 | 4 | Alta |
| 5 | M | 65 | 23 | 25 | IRCA | 28 | 22 | 15 | 1 | 20 | Alta |
| 6 | M | 20 | 16 | 1 | Asma | 20 | 13 | 2 | 0,5 | 2 | Alta |
| 7 | M | 55 | 22 | 7 | PostQco neurocirugía | 16 | 10 | 4 | 0,6 | 0 | Alta |
| 8 | M | 62 | 20 | 7 | Sepsis abd. SDRA | 31 | 11 | 7 | 3,5 | 0 | Alta |
| 9 | H | 40 | 15 | 70 | Neumonía SDRA | 40 | 31 | 14 | 3,2 | 14 | Alta |
| 10 | M | 55 | 6 | 10 | Neumonía SDRA | 19 | 21 | 5 | 2,1 | 0 | Alta |
abd: abdominal; Ept: elastancia de la pared torácica cmH2O/l; Esr: elastancia del sistema respiratorio (cmH2O/l); IRCA: insuficiencia respiratoria crónica agudizada; PEEPi: autoPEEP dinámica (cmH2O); PostQco: posquirúrgico; Rpt: resistencias de la pared torácica (cmH2O/l/s); Rsr: resistencias totales del sistema respiratorio (cmH2O/l/s); SDRA: síndrome de dificultad respiratoria aguda del adulto; VM: ventilación mecánica.
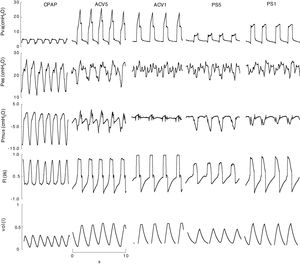
Ejemplo representativo, señales registradas (Pva,Pes,Fl) y calculadas (Pmus, vol) en CPAP, ACV y PS. Con baja asistencia la variación respiratoria de la presión esofágica y muscular calculada son evidentes y de mayor amplitud que con alta asistencia. Pero la amplitud de ambas es diferente. En este caso la medida es difícil, en la presión esofágica por la oscilación producida por el latido cardiaco y en la presión muscular calculada por oscilaciones o «espigas» producidas por cambios en el flujo inspiratorio. ACV1: asistida controlada por volumen con flujo 0,95l/s; ACV5: asistida controlada por volumen con flujo 0,75l/s; CPAP: presión positiva continua de 5cmH2O; F: flujo (l/s); Pes: presión esofágica; Pmus: presión muscular calculada (cmH2O); PS5: presión soporte de 8; PS1: 16cmH2O con PEEP 4cmH2O; Pva: presión en la vía aérea; Vol: volumen (l).
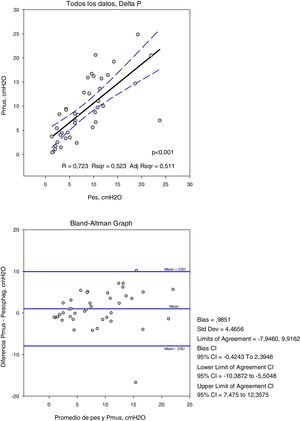
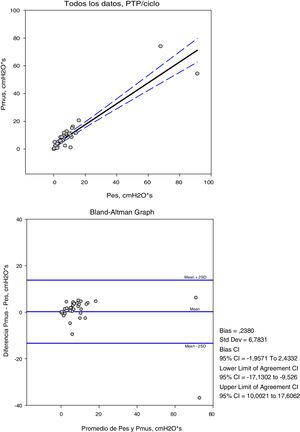
Las variables medidas en Pes y Pmus se muestran en la tabla 2; el aumento de la asistencia respiratoria disminuye el esfuerzo medido y el calculado de forma significativa (p<0,001). Comparando estas medidas en cada modo de ventilación, la diferencia media no es significativa, pero el análisis de concordancia muestra una amplia dispersión (tabla 3). Así la variación que podemos encontrar entre la medida y el cálculo del esfuerzo puede ser de 16cmH2O para la variación respiratoria y de 264cmH2O·s/m en el PTPm (figs. 2 y 3). Estas diferencias no están influidas por la amplitud del esfuerzo, pero el porcentaje de error entre la medida y el cálculo es menor con bajos niveles de asistencia (CPAP, ACV5, PS5).
Variables de esfuerzo medidas en todos los datos, asistencia 100% (ACV1 y PS1) y asistencia<50% (CPAP, PS5, ACV5)
| CPAP | ACV5 | ACV1 | PS5 | PS1 | |
|---|---|---|---|---|---|
| ΔPes | 11±3 | 6±3 | 5±3 | 9±6 | 7±7 |
| ΔPmus | 16±5 | 10±6 | 5±3 | 10±6 | 5±4 |
| PTPes.es | 213±87 | 96±91 | 23±24 | 206±121 | 108±100 |
| PTPmus. m | 293±117 | 156±84 | 24±32 | 233±121 | 79±90 |
Delta: variación respiratoria; Pes: presión esofágica; Pmus: presión muscular calculada (cmH2O); PTP, producto presión tiempo por ciclo (cmH2O/s); PTPm: producto presión tiempo por minuto (cmH2O·s/m).
Estadística descriptiva y concordancia
| PTP | PTPm | Delta | |
|---|---|---|---|
| Todos los datos | |||
| Pes, media±DECuartil 25-75 | 9±1(1-9) | 130±110*(22-223) | 8±5(3-10) |
| Pmus, media±DECuartil 25-75 | 9±14(1-11) | 155±133(23-256) | 9±6(3-14) |
| R | 0,92 | 0,87 | 0,72 |
| Bias (media de las diferencias±DE) | 0,23±6,7 | −23,69±66,3 | −0,98±4,4 |
| 2DE (95% límites de concordancia) | 13,17−13,63 | 108,91−156,29 | 7,82−9,78 |
| Asistencia 100% | |||
| Pes, media±DECuartil 25-75 | 11±24(0,8-7) | 66±83(22-223) | 6±5(3-10) |
| Pmus (media±DE)Cuartil 25-75 | 9±19(0,5-8) | 51±71(23-256) | 5±3(3-14) |
| Bias (media de las diferencias±DE) | −2,14±9,00 | −14,25±62,59 | −1,08±4,62 |
| 2DE (95% límites de concordancia) | 15,86−20,14 | 110,93−139,44 | 8,16−10,32 |
| Asistencia<50% | |||
| Pes (media±DE)Cuartil (25-75) | 7±4*(4-10) | 176±108*(74-268) | 9±4*(6-11) |
| Pmus (media±DE)Cuartil 25-75 | 9±4(6-11) | 234±119(119-344) | 12±6(8-16) |
| Bias (media de las diferencias) | 2,50±2,03 | 57,85±49,62 | −2,95±3,33 |
| 2DE (95% límites de concordancia) | −1,566,56 | −41,39157,09 | −3,719,61 |
Bias o error sistemático; DE: desviación estándar; Delta: variación respiratoria; Pes: presión esofágica; Pmus: presión muscular calculada (cmH2O); PTP, producto presión tiempo por ciclo (cmH2O/s); PTPm: producto presión tiempo por minuto (cmH2O·s/m); R: coeficiente de correlación. Límites de concordancia o error aleatorio.
Los resultados del estudio indican que el esfuerzo respiratorio calculado no permite inferir el valor medido en la Pes. Estas diferencias se pueden deber a varios factores, especialmente los parámetros que intervienen en el cálculo de la Pmus, la exactitud de las medidas de mecánica respiratoria y su validez cuando hay esfuerzo muscular. También puede influir la medida de la Pes y la transmisión del esfuerzo a la vía aérea.
La señal de Pmus calculada depende de los parámetros de mecánica respiratoria (E y R) que intervienen en la ecuación de movimiento19,20. Cualquier método de medida tiene limitaciones, ya que estos parámetros pueden cambiar de unos ciclos respiratorios a otros, incluso con sedación profunda21. En la práctica el método más utilizado es la oclusión inspiratoria y espiratoria, basado en un modelo matemático que asume la ausencia de esfuerzo22. Nosotros utilizamos un método previamente validado en respiración espontánea23, ventilación asistida13,24 y controlada25. Las diferencias que encontramos entre la medida y el cálculo del esfuerzo son similares a las previamente publicadas utilizando este método basado en un modelo mecánico simple26. Con métodos más complicados no han mejorado los resultados. En ventilación con PS27,28, el trabajo respiratorio calculado con Pmus y otras variables de ventilación puede diferir respecto al medido hasta 7j/m (normal 5-10j/m). Estudios experimentales utilizando complejos algoritmos matemáticos refieren diferencias de 0,3j/l29. En pacientes con ventilación asistida proporcional, las diferencias en el esfuerzo respiratorio medido y calculado pueden ser de 5cmH2O/s11, valor elevado si consideramos el límite aceptable en ventilación mecánica (4cmH2O/s17). En este modo de ventilación era de esperar una mayor semejanza entre ambas señales. Por definición en ventilación asistida proporcional, la presión y el flujo son proporcionales al esfuerzo respiratorio calculado30 y las medidas de mecánica respiratoria son periódicas18.
Las condiciones de medida de la mecánica respiratoria pueden influir. Estos parámetros son estimados en ventilación pasiva y pueden cambiar en respiración espontánea31, limitando su utilidad para calcular el esfuerzo muscular32,33. Así después de una desconexión fallida del respirador, se ha demostrado un descenso de compliancia, aumento de resistencias y PEEPi34,35. Pero estos resultados no han sido confirmados en otros estudios de pacientes que precisaron ventilación mecánica por EPOC y SDRA36. Diferencias en el patrón respiratorio pueden cambiar la mecánica respiratoria en ventilación asistida, por la dependencia de la elastancia y resistencias del volumen y flujo respectivamente37. El alto flujo inspiratorio utilizado para una ventilación pasiva puede sobreestimar el valor de resistencias inspiratorias y por tanto la Pmus calculada será mayor que la Pes.
Otros factores pueden influir en las diferencias entre el cálculo y la medida del esfuerzo muscular respiratorio. Que la Pes no represente adecuadamente la presión pleural y/o el esfuerzo respiratorio no modifique la Pva. La Pes es un valor de presión puntual y puede no reflejar la globalidad de la superficie pulmonar. Así en presencia de zonas del pulmón con diferentes características mecánicas, la presión pleural tendrá una distribución no solamente gravitacional y será más heterogénea, como se ha demostrado en pacientes con EPOC38 y recientemente en SDRA39. En estos casos, el esfuerzo respiratorio produce una redistribución del aire al inicio de la inspiración, sin cambios de volumen y la Pes no representa la presión pleural, especialmente en zonas dependientes. Por otro lado, el esfuerzo respiratorio puede no generar un cambio de presión proporcional en la vía aérea y por tanto la Pmus calculada no representa el cambio de presión pleural o esofágica. En sujetos sanos el cambio de presión alveolar durante la inspiración es similar al cambio de Pva, si bien puede haber diferencias entre sujetos de hasta un 12%40. Pero cuando las resistencias de las vías aéreas están aumentadas (EPOC), el esfuerzo respiratorio no se transmite adecuadamente a la vía aérea, como se ha demostrado tras la estimulación eléctrica del nervio frénico41 e infraestima el esfuerzo respiratorio19,38. De igual modo en presencia de baja compliancia pulmonar, el esfuerzo respiratorio produce compresión del gas inspirado, con poco cambio de volumen pulmonar y desproporción entre la Pes y la vía aérea42. Nuestros resultados muestran que en presencia de alta asistencia y esfuerzo débil, la Pes medida es superior a la calculada. Esto es, con alta asistencia, un esfuerzo pequeño cambia poco la Pva en ACV o el flujo inspiratorio en PS. Por el contrario, en presencia de baja asistencia, con esfuerzo muscular elevado, la presión calculada es superior a la medida, por las causas referidas anteriormente.
La limitación principal del estudio es la heterogeneidad del grupo de pacientes estudiado. Si bien están en fase de retirada del respirador, la mecánica respiratoria y días de ventilación mecánica es muy variable. Un grupo más amplio y/o estratificado podría mejorar los resultados.
En conclusión, las curvas del respirador de presión y flujo permiten valorar los cambios de esfuerzo muscular respiratorio cuando modificamos los parámetros de ventilación, pero no cuantificar su amplitud.
Contribución de los autoresFrancisco Ruiz Ferrón: Preparación del protocolo, registro realizado en 5 pacientes, análisis de los datos y preparación del manuscrito.
Jose Manuel Serrano Simón: Preparación del protocolo, registro realizado en 5 pacientes, análisis de los datos y preparación del manuscrito.
FinanciaciónNinguna.
Conflicto de interesesNinguno.